基于乳腺癌化疗-光动力联合治疗的负载紫杉醇白蛋白纳米给药系统的制备及其体外评价
2022-02-23亓文霞王胜兰王云腾孙钰迪张加余
亓文霞,王胜兰,杨 桁,高 科,王云腾,孙钰迪,赵 峰,张加余,张 静
·药剂与工艺·
基于乳腺癌化疗-光动力联合治疗的负载紫杉醇白蛋白纳米给药系统的制备及其体外评价
亓文霞,王胜兰,杨 桁,高 科,王云腾,孙钰迪,赵 峰,张加余,张 静*
滨州医学院药学院 国家中医药管理局方剂效应与临床评价重点研究室,山东 烟台 264003
以光敏剂二氢卟吩e6(chlorin e6,Ce6)修饰人血清白蛋白(human serum albumin,HSA)为载体,负载抗肿瘤药物紫杉醇(paclitaxel,PTX)后构建纳米给药系统PTX@HSA-Ce6,以实现肿瘤“化疗-光动力”联合治疗,改善乳腺癌治疗效果。共价结合法制备HSA-Ce6,红外光谱、紫外-可见吸收光谱和荧光光谱进行表征;自组装法制备载药纳米粒PTX@HSA-Ce6,对其粒径分布、表面ζ电位、形貌及稳定性进行表征,研究其药物负载和释放行为;利用乳腺癌MCF-7细胞模型考察PTX@HSA-Ce6的活性氧产生、细胞摄取及体外抗肿瘤效果。当HSA与Ce6投料比为1∶10时,制备得到的PTX@HSA-Ce6呈规整的球形,平均粒径为(147.4±0.9)nm,ζ电位为(−15.2±0.6)mV,具有良好的稳定性。PTX@HSA-Ce6可有效负载紫杉醇,具有pH敏感性药物缓释效果。PTX@HSA-Ce6可被MCF-7细胞快速、持续摄取,激光照射下可在胞内产生活性氧,与紫杉醇发挥联合抗肿瘤作用。PTX@HSA-Ce6可实现对Ce6和紫杉醇的共载和胞内递送,发挥化疗-光动力治疗联合抗肿瘤作用,有利于改善乳腺癌的治疗效果。
紫杉醇;二氢卟吩e6;人血清白蛋白;纳米给药系统;化疗;光动力治疗;乳腺癌;共价结合法;自组装法
乳腺癌已超越肺癌,成为世界范围内发病率最高的恶性肿瘤,发病率和死亡率位列全球女性恶性肿瘤首位,在我国女性恶性肿瘤发病率中也位列首位[1-2]。化疗是乳腺癌临床治疗中的主要药物治疗手段,但化疗药物往往存在溶解性差、非特异性分布导致全身不良反应等缺陷,治疗效果不理想[3]。紫杉醇(paclitaxel,PTX)是从红豆杉中提取的一种二萜类天然次生代谢产物,可通过促进微管聚合和抑制解聚来保持微管蛋白稳定,从而抑制肿瘤细胞的有丝分裂并促进凋亡,广泛用于乳腺癌、卵巢癌、肺癌和胰腺癌等恶性肿瘤的治疗[4]。然而,紫杉醇存在水溶性差、非特异性体内分布、易产生耐药等缺陷,作为单一治疗手段往往效果不佳,且毒副作用大,限制了其临床应用。目前,大量纳米给药系统被开发并应用于紫杉醇的递送中,不仅可以改善紫杉醇的溶解度,提高其靶向性和生物利用度,而且为紫杉醇与其他治疗手段的联合应用提供了契机,在乳腺癌治疗中有望发挥重要作用[5-7]。
研究证实,联合治疗可显著提高单一化疗药物的治疗效果。将化疗与光动力治疗相结合的肿瘤诊疗一体化技术,是一种极有潜力的肿瘤联合治疗策略[8]。光动力治疗是肿瘤辅助治疗的重要手段,利用光敏剂在特定波长激光照射下产生大量活性氧(reactive oxygen species,ROS),通过激活细胞凋亡的死亡受体途径和线粒体途径、参与自噬性细胞死亡等方式发挥抗肿瘤作用,具有侵袭性小、靶向性好、成本低等优点[9]。然而,光动力治疗受到肿瘤缺氧微环境中氧含量不足的制约,且随着治疗的进行会造成肿瘤缺氧加剧,因此作为单一治疗手段不仅难以根除肿瘤,还可能增加肿瘤细胞的抗性[10]。研究表明,利用纳米给药系统对光敏剂和化疗药物进行共传递,有望发挥光动力治疗与化疗的联合抗肿瘤作用,从而弥补单一治疗方式的应用缺陷,还可以通过生物成像来辅助治疗,在肿瘤治疗领域展示出独特的优势[11]。
人血清白蛋白(human serum albumin,HSA)具有生物相容性好、免疫原性低、化学稳定性高、半衰期长等优点,是一种理想的天然大分子载体材料[12-13]。本研究以HSA为载体材料,与光敏剂二氢卟吩e6(chlorin e6,Ce6)共价结合后,通过自组装法负载紫杉醇,构建共载Ce6和紫杉醇的纳米给药系统PTX@HSA-Ce6,以期同时实现乳腺癌的化疗-光动力联合治疗,改善乳腺癌的治疗效果,如图1所示。

图1 PTX@HSA-Ce6的制备与“化疗-光动力治疗”联合抗肿瘤作用示意图
1 仪器与材料
1.1 仪器
Nano ZS90纳米激光粒度分析仪,英国Malvern公司;JEM-1400透射电子显微镜,日本电子株式会社;高效液相色谱,美国Thermo Fisher Scientific公司;TGA/DSC 3+热重及同步热分析仪,瑞士梅特勒-托利多仪器有限公司;F-7000荧光分光光度计,日本日立公司;PerkinElmer Frontier傅里叶变换红外光谱仪,美国PerkinElmer公司;Alpha 1-2 LD plus真空冷冻干燥机,德国Christ公司;Leica TCS SPE激光扫描共聚焦显微镜,德国Leica公司;Tecan Infinite Pro全波长多功能酶标仪,瑞士Tecan公司;BD FACS Canto II流式细胞仪,美国BD公司;Bugbox M微需氧培养箱,英国Ruskinn公司;660 nm光纤耦合激光器,长春镭仕光电科技有限公司。
1.2 试剂
HSA(质量分数>96%,批号SLCH5923),美国Sigma-Aldrich公司;紫杉醇(质量分数>99%,批号J2028191)、1-乙基-(3-二甲氨基丙基)碳二亚胺盐酸盐[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC]和-羟基琥珀酰亚胺(-hydroxysuccinimide,NHS),上海阿拉丁生化科技股份有限公司;Ce6(质量分数>90%,批号N1127A)和单线态氧绿色荧光探针(singlet oxygen sensor green,SOSG),大连美仑生物技术有限公司;胎牛血清(fetal bovine serum,FBS),美国Gibco公司;Hoechst 33342和胰蛋白酶,北京索莱宝科技有限公司;Dulbecco’s modified eagle medium(DMEM)培养基,美国Hyclone公司;2′,7′-二氯荧光黄双乙酸盐(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA)ROS检测试剂盒,上海碧云天生物技术有限公司;乙腈,色谱纯,天津福晨化学试剂有限公司;其他试剂均为分析纯,国药集团化学试剂公司。
1.3 细胞
人乳腺癌细胞株MCF-7细胞,购自中国科学院上海细胞库。
2 方法
2.1 HSA-Ce6的合成与表征
2.1.1 HSA-Ce6的合成 参照文献方法[14-15],称取20 mg HSA溶于9 mL pH 8.0的PBS(0.1 mol/L,NaCl 0.05 mol/L)中。称取一定量Ce6(HSA与Ce6物质的量比分别为1∶5、1∶10、1∶20)溶于1 mL DMSO中,加入NHS和EDC(Ce6、NHS、EDC的物质的量比为1∶4.5∶4.5),室温下避光搅拌活化24 h。将活化后的Ce6溶液滴加入HSA溶液中,搅拌反应24 h,于去离子水中透析(截留相对分子质量14 000)48 h。将透析液5000 r/min离心10 min(离心半径12.3 cm),取上清液冷冻干燥,分别制备得到不同比例载体材料HSA-Ce6(1∶5)、HSA-Ce6(1∶10)和HSA-Ce6(1∶20)。
2.1.2 HSA-Ce6的表征 利用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)对HSA-Ce6的结构进行表征,利用荧光分光光度计检测其荧光光谱。利用紫外分光光度法测定HSA-Ce6溶液中Ce6的质量浓度,利用BCA法测定其中HSA的质量浓度,根据以下公式计算Ce6的偶联度()[16]。
=Ce6/HSA
Ce6为溶液中Ce6的质量,HSA为溶液中HSA的质量
(1)HSA-Ce6的FT-IR表征:HSA、Ce6和HSA-Ce6的FT-IR谱图如图2所示。HSA的FT-IR光谱给出了蛋白质类的共有吸收峰,包括3289、1658、1546 cm−1处酰胺结构的特征吸收,2960、2915 cm−1处甲基的不对称伸缩振动吸收峰;Ce6的FT-IR光谱显示甲基(2964 cm−1)和羧基中C=O(1711 cm−1)的特征吸收,以及烯氢的弯曲振动峰(955、895 cm−1)[17]。不同投料比的HSA-Ce6样品的FT-IR光谱均给出蛋白质的特征吸收,且1711 cm−1处羰基吸收大大减弱,HSA-Ce6(1∶5)在951、860 cm−1处,HSA-Ce6(1∶10)在944、859 cm−1处,HSA-Ce6(1∶20)在945、858 cm−1处均出现烯氢的弯曲振动峰,证实Ce6与HSA成功偶联。
(2)HSA-Ce6的紫外-可见光谱与荧光光谱表征:HSA-Ce6的紫外-可见光谱与荧光光谱如图3所示。由图3-A可见,HSA在280 nm处有最大吸收波长,Ce6在404、660 nm处出现特征吸收峰。HSA-Ce6(1∶5)、HSA-Ce6(1∶10)和HSA-Ce6(1∶20)的谱图中均可明显看到Ce6和HSA的特征峰,与文献报道一致[18]。随着Ce6投料量的增加,引入HSA主链中的Ce6数目进一步增加,利用紫外分光光度法测得HSA-Ce6(1∶5)、HSA-Ce6(1∶10)和HSA-Ce6(1∶20)中Ce6的偶联度分别为34.6、59.3、72.7 μg/mg。由图3-B可见,HSA-Ce6和Ce6在660 nm处均有明显的荧光发射峰,表明HSA与Ce6的偶联不会改变Ce6的光吸收特性。HSA-Ce6的荧光强度随Ce6投料量的增加而降低,这可能是由于二者偶联使Ce6分子间的重叠增加,间距变小,同时局部浓度增加导致Ce6荧光淬灭[19]。

图2 HSA (A)、Ce6 (B)、HSA-Ce6 (1∶5, C)、HSA-Ce6 (1∶10, D)、HSA-Ce6 (1∶20, E)的FT-IR图
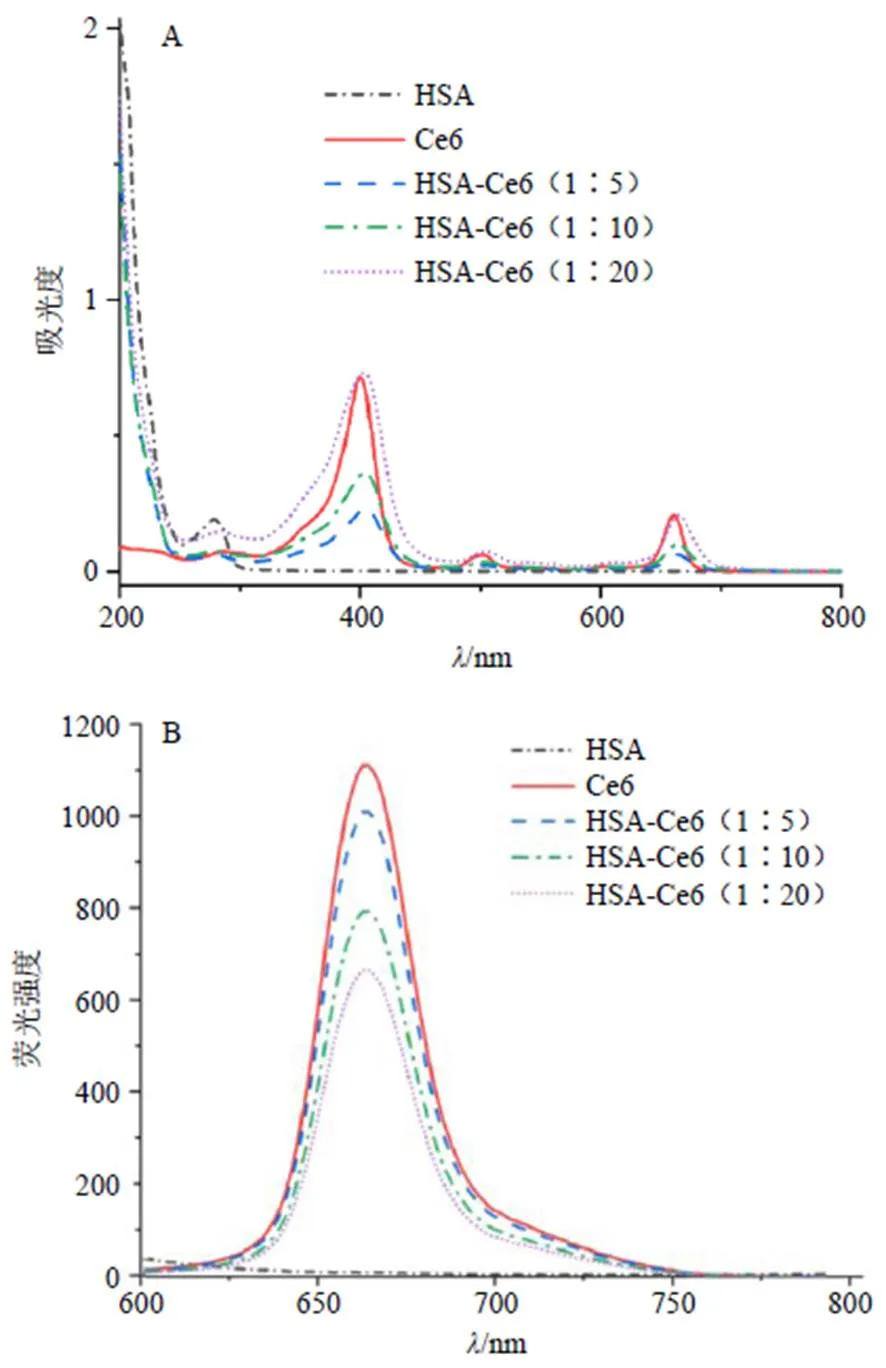
图3 HSA-Ce6的紫外-可见吸收光谱(A) 及荧光光谱(B)
2.2 载药纳米粒PTX@HSA-Ce6的制备与表征
2.2.1 PTX@HSA-Ce6的制备 利用紫杉醇与HSA疏水结构域之间的疏水相互作用诱导HSA-Ce6自组装形成载药纳米粒PTX@HSA-Ce6[20]。称取10 mg HSA-Ce6(1∶5、1∶10、1∶20)溶于10 mL pH 8.0的PBS(0.1 mol/L,NaCl 0.05 mol/L)中,称取2 mg紫杉醇溶于1 mL无水乙醇中。边搅拌边将紫杉醇的无水乙醇溶液滴加至HSA-Ce6溶液中,反应液于去离子水中透析(截留相对分子质量14 000)48 h,将透析液5000 r/min离心(离心半径12.3 cm)10 min,上清液即为PTX@HSA-Ce6悬液。
2.2.2 PTX@HSA-Ce6的表征 利用纳米激光粒度仪测定PTX@HSA-Ce6的粒径分布、表面ζ电位及多分散系数(polydispersity index,PDI),利用透射电镜(transmission electron microscope,TEM)观察其形貌。分别取紫杉醇、HSA-Ce6、PTX@HSA-Ce6以及紫杉醇与HSA-Ce6的混合物,在25~300 ℃进行差示热量扫描(differential scanning calorimetry,DSC)分析[21]。将PTX@HSA-Ce6分别于37 ℃、含10% FBS的DMEM完全培养基和4 ℃、pH 7.4 PBS中孵育7 d,检测其粒径分布与表面ζ电位变化情况,考察其体内稳定性和储存稳定性。
2.2.3 PTX@HSA-Ce6的包封率与载药量测定 取1 mL PTX@HSA-Ce6悬液,加入9 mL乙腈,超声提取纳米粒中的紫杉醇,12 000 r/min离心(离心半径12.3 cm)10 min,取上清液进样HPLC进行紫杉醇含量测定[22]。根据以下公式计算PTX@HSA-Ce6的包封率和载药量。
包封率=NPs/紫杉醇
载药量=NPs/总
NPs为PTX@HSA-Ce6中紫杉醇的质量,紫杉醇为紫杉醇的投药量,总为1 mL PTX@ HSA-Ce6悬液冷冻干燥后的总质量
载药纳米粒PTX@HSA-Ce6的粒径分布、多分散系数(polydispersity index,PDI)、表面ζ电位、包封率和载药量检测结果如表1和图4所示。随着Ce6投料量的增加,PTX@HSA-Ce6的平均粒径从(138.6±3.9)nm增加至(169.5±7.9)nm,均小于200 nm,有利于借助实体瘤的高通透性和滞留(enhanced permeability and retention,EPR)效应富集于肿瘤组织周围[23]。PTX@HSA-Ce6的包封率和载药量随Ce6的投料量的增加而增加,这可能与Ce6偶联度增加导致HSA疏水性增强有关。由于体系pH值高于HSA等电点,因此PTX@HSA-Ce6表面为负电性,有利于减少网状内皮系统的非选择性清除,且ζ电位绝对值随Ce6投料量的增加而增大,这可能与HSA表面氨基被Ce6取代有关。研究表明,Ce6易因诱导聚集而导致荧光猝灭,制剂中紫杉醇含量增加可能促进Ce6聚集,影响光动力治疗效果[19]。因此,为保证PTX@HSA-Ce6能够发挥化疗-光动力联合治疗作用,结合荧光光谱检测结果,选择HSA-Ce6(1∶10)用于后续载药纳米粒的制备和实验研究。
表1 PTX@HSA-Ce6的表征
Table 1 Characterization of PTX@HSA-Ce6
投料比(HSA∶Ce6)平均粒径/nmPDIζ电位/mV包封率/%载药量/% 1∶5138.6±3.90.206±0.030−13.9±0.736.77.8 1∶10147.4±0.90.229±0.040−15.2±0.646.49.5 1∶20169.5±7.90.258±0.030−19.1±1.153.810.2
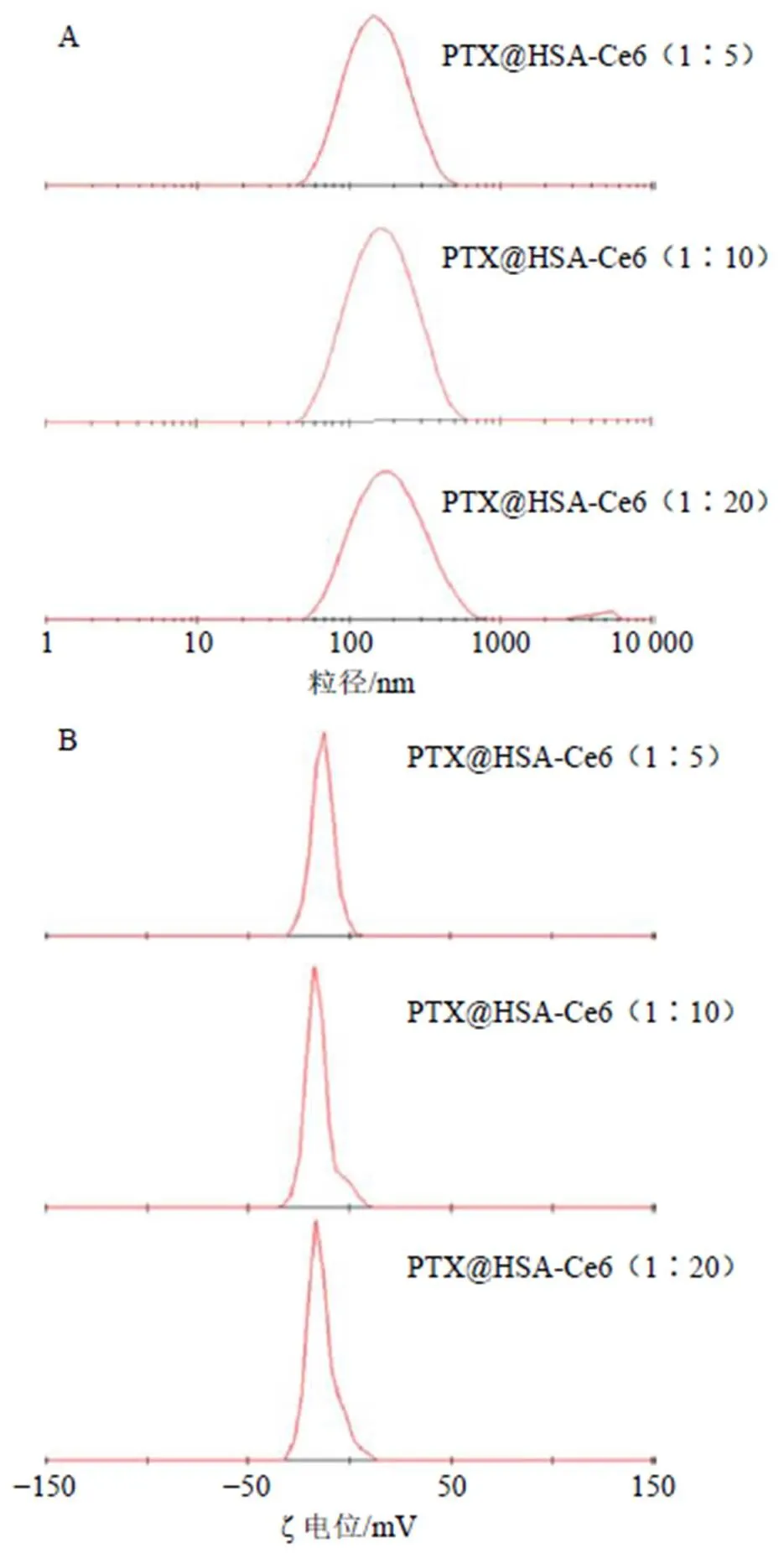
图4 PTX@HSA-Ce6的粒径分布(A) 和ζ电位(B)
TEM观察PTX@HSA-Ce6的形貌如图5-A所示。PTX@HSA-Ce6呈规整的球形,粒径为100~150 nm。HSA-Ce6和PTX@HSA-Ce6在水中均显示出良好的溶解性和分散性,而游离Ce6几乎不溶,表明HSA与Ce6偶联后显著改善了Ce6的溶解性(图5-B)。在不同条件下保存7 d,PTX@HSA-Ce6的粒径以及ζ电位略有改变,但波动范围较小(PBS中粒径为142.8~178.9 nm,ζ电位为−14.1~−19.2 mV;含10% FBS的DMEM中粒径为138.4~192.0 nm,ζ电位为−13.4~−18.1 mV),证实其具有较好的储存稳定性和体内稳定性(图5-C、D)。由图5-E可见,HSA-Ce6与紫杉醇物理混合后在220、237 ℃处出现紫杉醇的熔融吸收峰和分解放热峰,表明紫杉醇为结晶状态,而PTX@HSA-Ce6的DSC曲线与HSA-Ce6相似,未出现熔融吸收峰和分解放热峰,表明紫杉醇成功负载于PTX@HSA-Ce6中[24]。

2.3 PTX@HSA-Ce6的体外药物释放研究
分别配制含0.2%聚山梨酯80的不同pH的PBS缓冲液作为释放介质,考察PTX@HSA-Ce6的体外药物释放情况[25]。取3 mL PTX@HSA-Ce6悬液置于透析袋(截留相对分子质量14 000)中,转移至含30 mL不同释放介质的棕色瓶中,37 ℃恒温振荡,分别于0.5、1、2、4、8、12、24、48、72 h移出3 mL释放介质,并补加等体积空白释放介质。利用HPLC测定移出的释放介质中紫杉醇含量,根据以下公式计算PTX@HSA-Ce6的累积药物释放率(),绘制药物释放曲线。

0为PTX@HSA-Ce6中紫杉醇的总量,为释放介质的总体积,为取样次数,V为时移出释放介质的体积,C为时释放介质中紫杉醇的质量浓度
分别模拟正常生理环境(pH 7.4)、肿瘤细胞外环境(pH 6.5)和肿瘤细胞内溶酶体环境(pH 5.0)考察PTX@HSA-Ce6的体外药物释放情况。如图6所示,PTX@HSA-Ce6在不同pH条件下均为8 h内释放速率较快,而后趋于平缓。PTX@HSA-Ce6的释药量随体系pH的降低而增加,72 h时pH 5.0条件下的累积释放率(56.2%)显著高于pH 7.4(33.6%)和pH 6.5(46.7%)下的累积释放率,这可能与酸性条件下HSA质子化导致紫杉醇与HSA-Ce6间的静电和疏水相互作用减弱有关[26]。这一释放行为将有利于提高PTX@HSA-Ce6在递送过程中的稳定性,加快PTX@HSA-Ce6被肿瘤细胞摄取后的药物释放,有利于提高紫杉醇的治疗效果。

图6 PTX@HSA-Ce6的体外药物释放曲线
2.4 PTX@HSA-Ce6的光化学性质研究
利用SOSG探针考察PTX@HSA-Ce6在660 nm激光照射下的ROS生成情况[27]。向PTX@HSA-Ce6悬液中加入SOSG溶液(终浓度为1 µmol/L),660 nm激光照射后利用全波长多功能酶标仪(Ex=489 nm,Em=528 nm)测定各样品的荧光强度,考察不同激光照射时间、照射强度下ROS的产生情况。利用SOSG探针检测PTX@HSA-Ce6的ROS生成情况,结果如表2所示。可见,ROS的产量随着PTX@HSA-Ce6中Ce6浓度的提高而增加,具有一定的浓度相关性。随着照射时间和照射强度的增加,体系中的荧光强度逐渐增强,该结果表明PTX@ HSA-Ce6生成ROS具有一定的照射时间和强度相关性[27-28]。在实验设定的参数范围内,50 mW/cm2照射4 min时PTX@HSA-Ce6产生的ROS量最高,因此选择该照射条件进行后续实验研究。
2.5 溶血实验
利用红细胞溶血实验考察PTX@HSA-Ce6的体外血液相容性,初步评价其用于静脉给药的安全性。参照文献方法[29],取新鲜兔血用生理盐水处理后配成2%的红细胞悬液。分别取不同浓度的HSA-Ce6溶液或PTX@HSA-Ce6悬液与红细胞悬液等体积混合,以蒸馏水为阳性对照,生理盐水为阴性对照,37 ℃孵育2 h。2500 r/min离心(离心半径15.7 cm)10 min,取上清液于545 nm处测定其吸光度()值,根据以下公式计算溶血率。
表2 660 nm光照下PTX@HSA-Ce6的ROS产生
Table 2 ROS generation of PTX@HSA-Ce6 under 660 nm light irradiation
Ce6质量浓度/(μg∙mL−1)照射时间/min功率密度/(mW∙cm−2)平均荧光强度 0.0084501 932.3±537.0 0.0804505 990.7±249.3 0.80045029 025.0±845.2 0.80015015 641.0±3 393.7 0.80025023 237.0±2 477.8 0.8004513 391.3±317.1 0.80042024 215.3±805.3
溶血率=(样品-nc)/(pc-nc)
样品为样品组值,nc为阴性对照值,pc为阳性对照值
通过体外红细胞溶血实验考察载体材料HSA-Ce6和PTX@HSA-Ce6的溶血率,结果如图7所示。在实验设定的质量浓度范围内,HSA-Ce6和PTX@HSA-Ce6的溶血率随质量浓度增加略有上升,但均低于5%,表明其用于静脉给药具有良好的生物安全性。

图7 HSA-Ce6和PTX@HSA-Ce6的溶血率
2.6 细胞内ROS检测
将MCF-7细胞以2×104个/皿接种于激光共聚焦培养皿中,分别置于20% O2常氧培养箱或2% O2微需氧培养箱中培养过夜。将各皿中培养液更换为不同浓度的PTX@HSA-Ce6悬液,原培养条件下继续孵育4 h。弃去皿中溶液,PBS漂洗后加入1 mL DCFH-DA溶液(终浓度为10 µmol/L),继续孵育30 min。660 nm、50 mW/cm2激光照射4 min后,PBS漂洗,置于激光共聚焦显微镜(confocal laser scanning microscope,CLSM)下观察,考察细胞内ROS生成情况。
细胞内ROS的产生是决定光动力治疗效果的重要指标,PTX@HSA-Ce6在660 nm激光照射下的胞内ROS产生情况如图8所示。未经任何处理组Control(L−)和仅经激光照射组Control(L+)细胞内均未观察到荧光产生,未经激光照射的PTX@ HSA-Ce6暗处理组PTX@HSA-Ce6(L−)细胞内仅见微弱的点状荧光。激光照射后,PTX@HSA-Ce6(L+)胞内荧光强度明显增加,且荧光强度随PTX@ HSA-Ce6浓度的增加而增加。常氧条件下激光照射后胞内的荧光强度高于低氧条件下的荧光强度,但低氧条件下PTX@HSA-Ce6仍能产生一定量ROS,表明在肿瘤内部缺氧微环境中PTX@HSA-Ce6仍有望通过光动力治疗与化疗发挥联合抗肿瘤作用[30]。
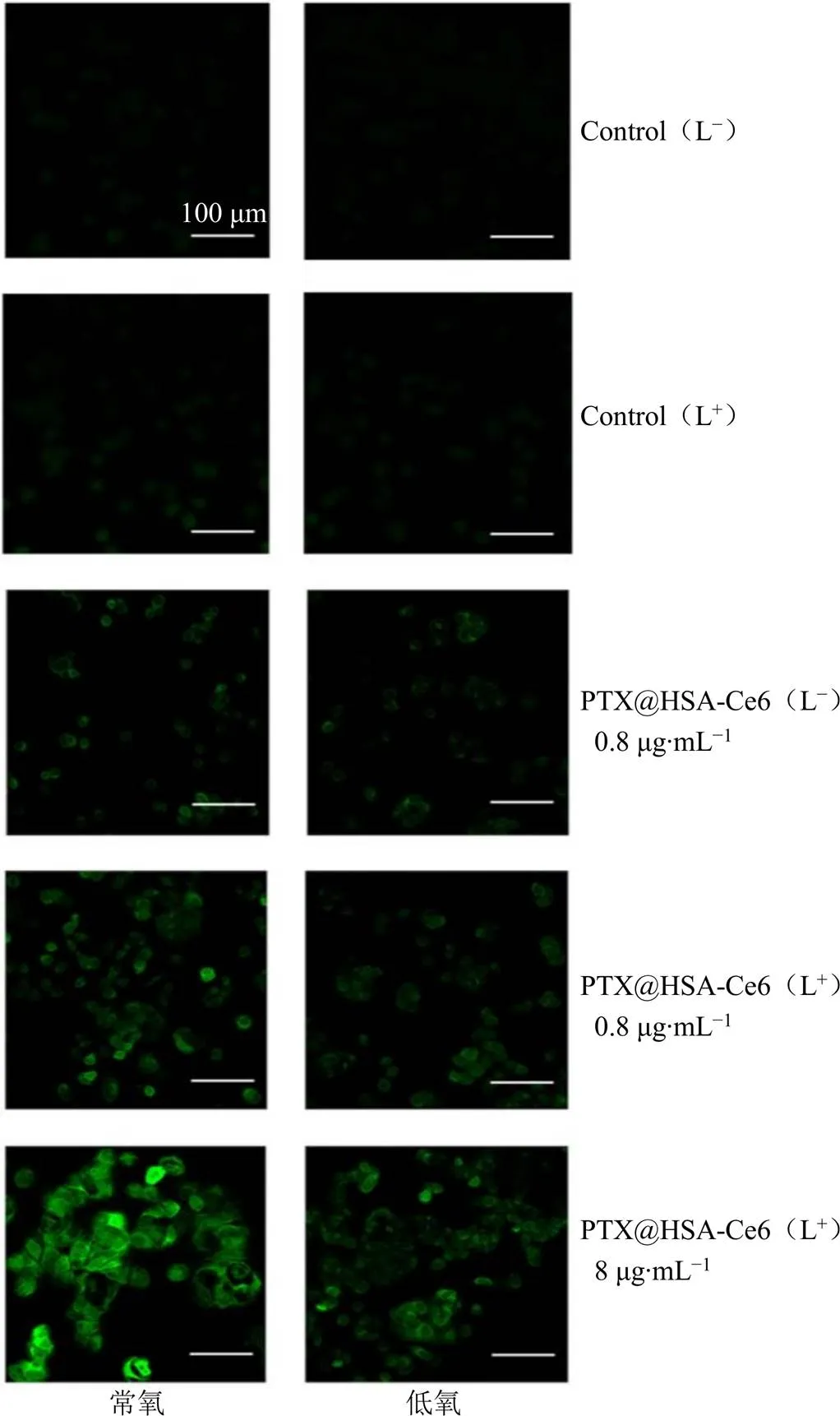
图8 MCF-7细胞在光照(L+) 和暗处理(L−) 下ROS生成的CLSM图像
2.7 体外细胞摄取研究
分别利用CLSM和流式细胞仪(flow cytometry,FCM)研究MCF-7细胞对PTX@HSA-Ce6的体外摄取情况。
2.7.1 CLSM观察 将MCF-7细胞以2×104个/皿接种于激光共聚焦培养皿中,CO2培养箱中孵育过夜。将各皿中培养液更换为不同浓度的PTX@HSA- Ce6悬液,继续培养一定时间。弃去皿中溶液,PBS漂洗,加入4%多聚甲醛溶液固定,Hoechst 33342溶液染色15 min,PBS漂洗后置于CLSM下观察。
2.7.2 FCM检测 将MCF-7细胞以5×105个/孔接种于6孔板中,CO2培养箱中孵育过夜。将各孔中培养液更换为不同浓度的PTX@HSA-Ce6悬液,继续培养一定时间。弃去各孔中溶液。PBS漂洗后胰酶消化,1000 r/min离心(离心半径15.7 cm)5 min后将细胞重悬于0.5 mL PBS中,进样FCM检测。Ce6的二氢卟吩环结构可产生强荧光信号,可实现PTX@HSA-Ce6的近红外荧光成像。利用CLSM和FCM研究了MCF-7细胞对PTX@HSA- Ce6的体外细胞摄取情况,如图9所示。CLSM观察可见,MCF-7细胞对PTX@HSA-Ce6的摄取具有明显的浓度相关性(图9-A)。孵育1 h后,在细胞质中即可观察到微弱的荧光,细胞质中荧光强度随孵育时间的延长而增加,表现出一定的时间相关性(图9-B)。FCM检测结果与CLSM观察结果一致(图9-C、D),证实PTX@HSA-Ce6可被MCF-7细胞快速、持续摄取,并在细胞质中大量聚集,有助于促进药物和光敏剂的跨膜转运,为发挥化疗和光动力治疗的联合抗肿瘤作用提供了基础。
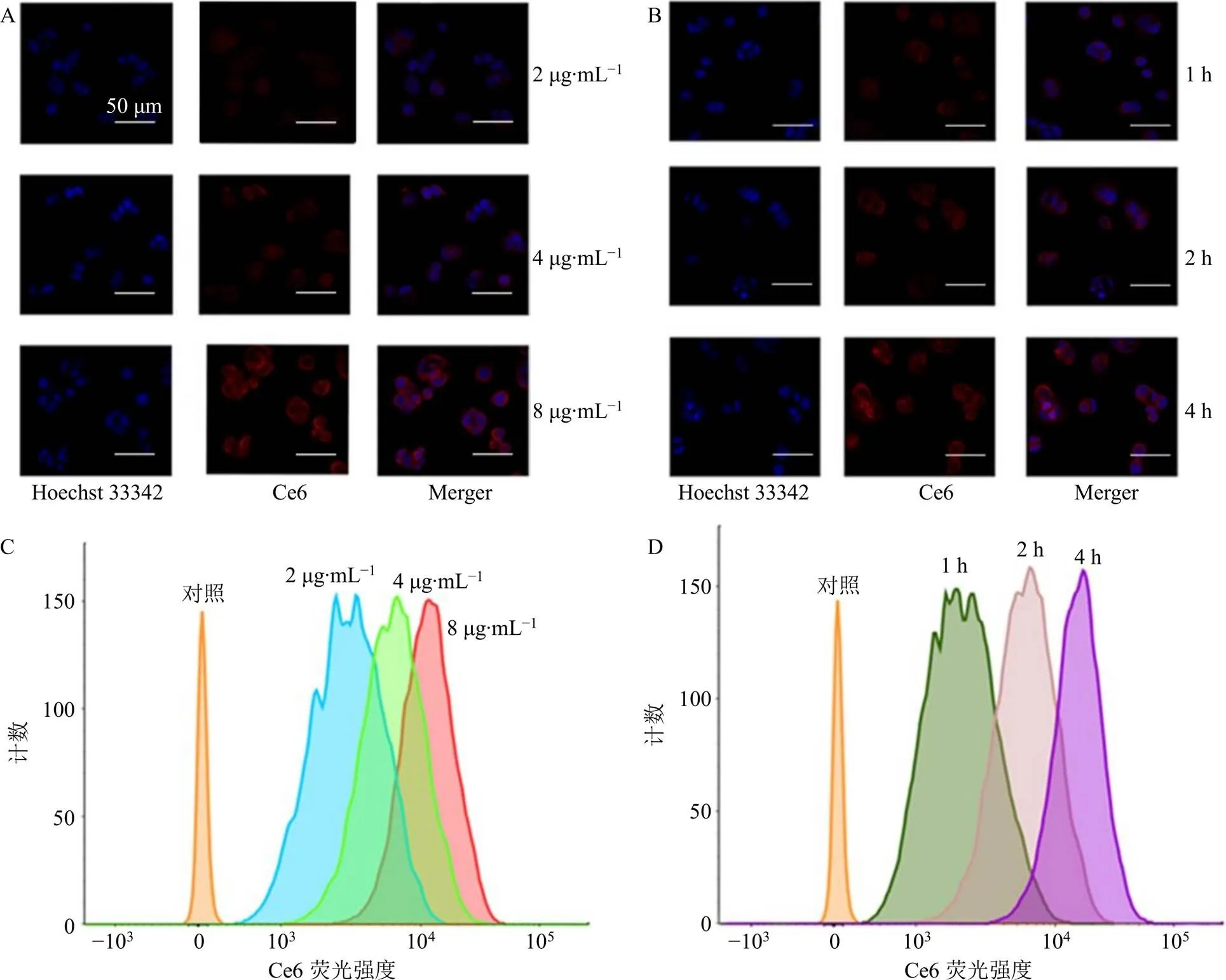
A-不同质量浓度PTX@HSA-Ce6与MCF-7细胞作用2 h的CLSM照片 B-PTX@HSA-Ce6(Ce6质量浓度4 μg∙mL−1)与MCF-7细胞作用不同时间的CLSM照片 C-不同质量浓度PTX@HSA-Ce6与MCF-7细胞作用2 h的FCM检测结果 D-PTX@HSA-Ce6(Ce6质量浓度4 μg∙mL−1)与MCF-7细胞作用不同时间的FCM检测结果
2.8 体外细胞毒性实验
利用MTT法研究常氧和低氧条件下PTX@ HSA-Ce6对MCF-7的体外细胞毒性。将MCF-7细胞以1×104个/孔接种于96孔板中,分别置于20% O2的常氧培养箱或2% O2的微需氧培养箱中培养过夜。将各孔中的培养液更换为不同质量浓度的HSA-Ce6溶液、PTX@HSA-Ce6悬液或游离紫杉醇,以培养液为阴性对照,原培养条件下继续培养4 h。激光照射组用660 nm、50 mW/cm2激光照射4 min,其他组不做处理,继续培养24 h。各孔中加入MTT继续培养4 h后,弃去各孔中溶液,加入DMSO 150 μL充分溶解甲臜,于酶标仪490 nm处测定各孔的值,根据公式计算MCF-7细胞的存活率。
细胞存活率=样品/nc
样品为样品组值,nc为阴性对照值
利用MTT法对PTX@HSA-Ce6对MCF-7细胞的体外细胞毒性进行研究,结果如图10所示。可见,暗处理时,不同条件下各质量浓度HSA-Ce6(L−)作用于MCF-7细胞后细胞的存活率均高于90%,表明HSA-Ce6具有良好的生物相容性。游离紫杉醇在常氧和低氧条件下对MCF-7细胞的体外细胞毒性随质量浓度的增加而增加。当Ce6质量浓度低于0.08 μg/mL时,激光照射后HSA-Ce6(L+)和PTX@HSA-Ce6(L+)的细胞毒性与暗处理组未见显著差异,低氧、常氧2种条件下HSA-Ce6(L+)的细胞毒性之间也未见显著差异,这可能与低质量浓度下激光照射后,Ce6产生的ROS含量不足有关[19]。当Ce6质量浓度为0.80 μg/mL时,HSA-Ce6(L+)和PTX@HSA-Ce6(L+)的细胞毒性较暗处理组显著增加,且常氧下HSA-Ce6(L+)的细胞毒性显著高于低氧下HSA-Ce6(L+)的细胞毒性(<0.01),表明当Ce6质量浓度足够高时,产生的ROS可通过PDT发挥抗肿瘤作用[31]。
同时,无论低氧还是常氧条件下,PTX@HSA-Ce6(L+)的细胞毒性均显著高于紫杉醇和HSA-Ce6(L+)的细胞毒性(<0.01),表明激光照射下PTX@HSA-Ce6表现出较单一使用紫杉醇和单一使用HSA-Ce6光动力治疗更为显著的MCF-7细胞增殖抑制效果,有望通过化疗-光动力联合治疗改善乳腺癌的治疗效果。
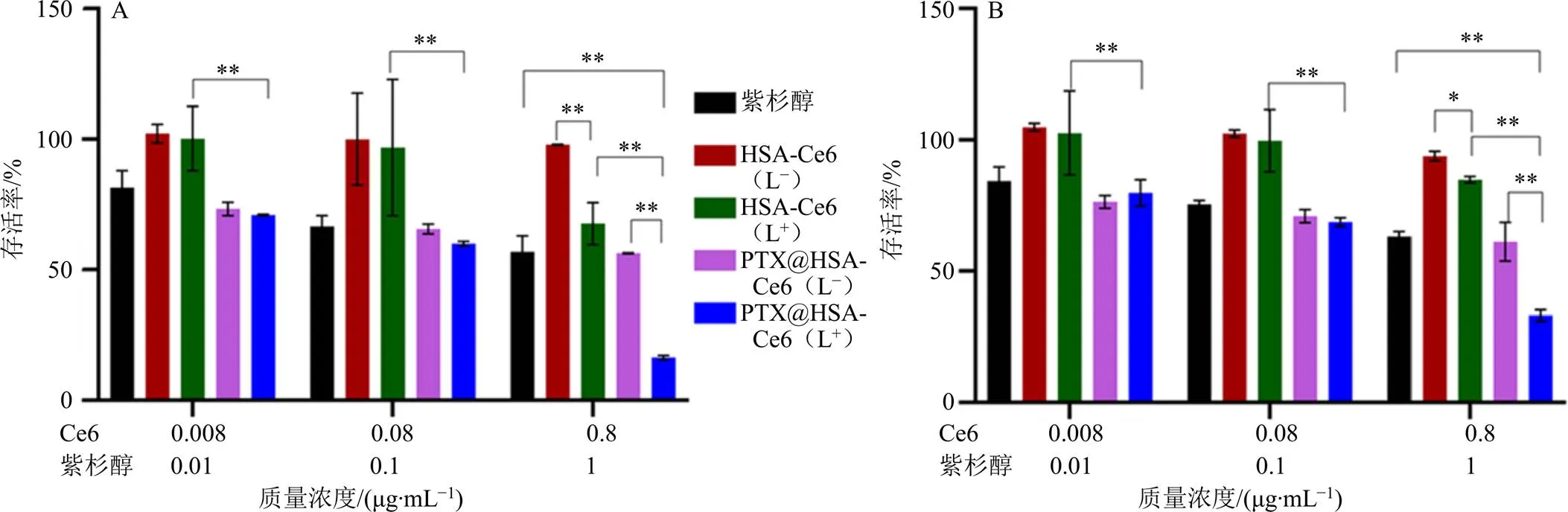
*P<0.05 **P<0.01
3 讨论
化疗是乳腺癌临床治疗中的主要药物治疗手段,光动力治疗是肿瘤辅助治疗的重要手段,但二者作为单一治疗方式应用于乳腺癌治疗效果均不理想。由于化疗药物产生细胞毒作用的机制与光动力治疗产生ROS导致细胞死亡的机制有很大差异,因此通过构建纳米给药系统将光敏剂和化疗药物共传递到肿瘤组织,有望通过化疗与光动力治疗二者互补来实现高效、低毒的肿瘤联合治疗,具有重要的研究和应用价值[32]。
本研究发现,当Ce6与HSA物质的量比为10∶1时制备得到的PTX@HSA-Ce6具有较高的包封率和载药量,且平均粒径为(147.4±0.9)nm,易于通过EPR效应富集于肿瘤组织周围,适合于作为Ce6和紫杉醇的共传递体系,有利于实现肿瘤的化疗-光动力联合治疗,进而改善乳腺癌的治疗效果[26]。
PTX@HSA-Ce6可以被MCF-7细胞快速、持续摄取,能够实现Ce6和紫杉醇的胞内递送。研究表明肿瘤细胞由于代谢异常及对特定蛋白的自身调节而形成了独特的乏氧、高还原的弱酸性微环境[33]。PTX@HSA-Ce6在模拟肿瘤细胞内溶酶体环境的酸性条件下紫杉醇释放率显著高于模拟正常生理环境的中性条件下的释放率,表明PTX@HSA-Ce6携带药物进入肿瘤细胞内部后可以促进药物的释放,同时降低药物在递送过程中的渗漏,减少对正常组织的损伤。
激光照射下,Ce6通过产生大量ROS不仅可以直接杀伤肿瘤细胞,促进肿瘤细胞凋亡,还可能破坏溶酶体膜结构,从而实现药物的溶酶体逃逸,改善肿瘤治疗效果[33-34]。肿瘤乏氧微环境往往导致光敏剂利用率低,激光照射后低氧条件下PTX@HSA-Ce6产生的胞内ROS明显低于常氧下产生的胞内ROS水平,作为单一治疗方式效果不理想。与单一使用游离紫杉醇进行化疗和单一使用HSA-Ce6进行光动力治疗相比,激光照射后PTX@HSA-Ce6在体外细胞毒性实验中表现出了更为显著的MCF-7细胞增殖抑制效果,初步证实PTX@HSA-Ce6用于乳腺癌化疗-光动力治疗的可行性和应用潜力,为乳腺癌的靶向联合治疗提供了一种新的思路。
利益冲突 所有作者均声明不存在利益冲突
[1] Sung H, Ferlay J, Siegel R L,. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2021, 71(3): 209-249.
[2] 郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析 [J]. 中华肿瘤杂志, 2019, 41(1): 19-28.
[3] Xiong K, Zhang Y, Wen Q,. Co-delivery of paclitaxel and curcumin by biodegradable polymeric nanoparticles for breast cancer chemotherapy [J]., 2020, 589: 119875.
[4] 赖梦琴, 张鹏, 杨明, 等. 吉西他滨单磷酸盐/紫杉醇联用靶向纳米粒的制备及其大鼠体内药动学研究 [J]. 中草药, 2021, 52(3): 669-676.
[5] Ansari M A, Thiruvengadam M, Farooqui Z,. Nanotechnology, in silico and endocrine-based strategy for delivering paclitaxel and miRNA: Prospects for the therapeutic management of breast cancer [J]., 2021, 69: 109-128.
[6] Chen Q, Chen J W, Liang C,. Drug-induced co-assembly of albumin/catalase as smart nano- theranostics for deep intra-tumoral penetration, hypoxia relieve, and synergistic combination therapy [J]., 2017, 263: 79-89.
[7] Namgung R, Lee Y M, Kim J,. Poly-cyclodextrin and poly-paclitaxel nano-assembly for anticancer therapy [J]., 2014, 5: 3702.
[8] Opoku-Damoah Y, Wang R N, Zhou J P,. Versatile nanosystem-based cancer theranostics: Design inspiration and predetermined routing [J]., 2016, 6(7): 986-1003.
[9] 刘朝莲, 吴宏磊, 徐可. 光动力疗法与抗肿瘤免疫治疗在肿瘤治疗中的应用 [J]. 中国肿瘤临床, 2021, 48(1): 35-39.
[10] Zhang Q Y, Li L B. Photodynamic combinational therapy in cancer treatment [J]., 2018, 23(3): 561-567.
[11] Denkova A G, de Kruijff R M, Serra-Crespo P. Nanocarrier-mediated photochemotherapy and photoradiotherapy [J]., 2018, 7(8): e1701211.
[12] 徐欢, 周美玲, 葛琳, 等. 人血清白蛋白在蛋白多肽类药物长效化中的应用 [J]. 中国生物工程杂志, 2019, 39(1): 82-89.
[13] 高彩芳, 梁剑铭, 秦晶, 等. 共载紫杉醇和纳米银的叶酸-白蛋白纳米粒的制备和体外评价 [J]. 中草药, 2018, 49(12): 2786-2792.
[14] Jeong H, Huh M, Lee S J,. Photosensitizer- conjugated human serum albumin nanoparticles for effective photodynamic therapy [J]., 2011, 1: 230-239.
[15] Liu L S, Bi Y K, Zhou M R,. Biomimetic human serum albumin nanoparticle for efficiently targeting therapy to metastatic breast cancers [J]., 2017, 9(8): 7424-7435.
[16] 张良珂, 侯世祥, 毛声俊, 等. 叶酸偶联白蛋白纳米粒的制备工艺研究 [J]. 生物医学工程学杂志, 2004, 21(2): 225-228.
[17] Girma W M, Dehvari K, Ling Y C,. Albumin- functionalized CuFeS2/photosensitizer nanohybrid for single-laser-induced folate receptor-targeted photothermal and photodynamic therapy [J]., 2019, 101: 179-189.
[18] Chen Q, Wang X, Wang C,. Drug-induced self- assembly of modified albumins as nano-theranostics for tumor-targeted combination therapy [J]., 2015, 9(5): 5223-5233.
[19] Yang G B, Phua S Z F, Lim W Q,. A hypoxia-responsive albumin-based nanosystem for deep tumor penetration and excellent therapeutic efficacy [J]., 2019, 31(25): e1901513.
[20] Yang Z J, Chen Q, Chen J W,. Tumor-pH-responsive dissociable albumin-tamoxifen nanocomplexes enabling efficient tumor penetration and hypoxia relief for enhanced cancer photodynamic therapy [J]., 2018, 14(49): e1803262.
[21] Qu N, Sun Y T, Li Y J,. Docetaxel-loaded human serum albumin (HSA) nanoparticles: Synthesis, characterization, and evaluation [J]., 2019, 18(1): 11.
[22] Ruan C H, Liu L S, Lu Y F,. Substance P-modified human serum albumin nanoparticles loaded with paclitaxel for targeted therapy of glioma [J]., 2018, 8(1): 85-96.
[23] Witt S, Scheper T, Walter J G. Production of polycaprolactone nanoparticles with hydrodynamic diameters below 100 nm [J]., 2019, 19(10): 658-665.
[24] Pham L M, Poudel K, Ou W Q,. Combination chemotherapeutic and immune-therapeutic anticancer approach via anti-PD-L1 antibody conjugated albumin nanoparticles [J]., 2021, 605: 120816.
[25] Kumari P, Paul M, Bobde Y,. Albumin-based lipoprotein nanoparticles for improved delivery and anticancer activity of curcumin for cancer treatment [J].(), 2020, 15(29): 2851-2869.
[26] Lee H, Kim S, Oh C,. Folic acid-modified bovine serum albumin nanoparticles with doxorubicin and chlorin e6 for effective combinational chemo- photodynamic therapy [J]., 2020, 117: 111343.
[27] Song X J, Feng L Z, Liang C,. Liposomes co-loaded with metformin and chlorin e6 modulate tumor hypoxia during enhanced photodynamic therapy [J]., 2017, 10(4): 1200-1212.
[28] Ji C W, Yuan A H, Xu L,. Activatable photodynamic therapy for prostate cancer by NIR dye/photosensitizer loaded albumin nanoparticles [J]., 2019, 15(2): 311-318.
[29] Luo T T, Han J T, Zhao F,. Redox-sensitive micelles based on retinoic acid modified chitosan conjugate for intracellular drug delivery and smart drug release in cancer therapy [J]., 2019, 215: 8-19.
[30] Wang Y, Luo S, Wu Y,. Highly penetrable and on-demand oxygen release with tumor activity composite nanosystem for photothermal/photodynamic synergetic therapy [J]., 2020, 14 (12): 17046-17062.
[31] Sun X K, Sun J, Lv J K,. Ce6-C6-TPZ co-loaded albumin nanoparticles for synergistic combined PDT-chemotherapy of cancer [J]., 2019, 7(38): 5797-5807.
[32] 宋鹏宇, 邓永岩, 韩海杰, 等. 活性氧可激活的聚合物纳米载体用于光动力-化疗联合治疗的研究 [J]. 材料导报, 2020, 34(10): 10166-10170.
[33] Yang X Y, Shi X Q, Zhang Y N,. Photo-triggered self-destructive ROS-responsive nanoparticles of high paclitaxel/chlorin e6 co-loading capacity for synergetic chemo-photodynamic therapy [J]., 2020, 323: 333-349.
[34] Wang R, Yang H, Khan AR, et al. Redox-responsive hyaluronic acid-based nanoparticles for targeted photodynamic therapy/chemotherapy against breast cancer [J]., 2021, 598: 213-228.
Preparation andevaluation of human serum albumin nano-drug delivery system loaded with paclitaxel for chemo-photodynamic combined therapy of breast cancer
QI Wen-xia, WANG Sheng-lan, YANG Heng, GAO Ke, WANG Yun-teng, SUN Yu-di, ZHAO Feng, ZHANG Jia-yu, ZHANG Jing
Key Laboratory of Prescription Effect and Clinical Evaluation of State Administration of Traditional Chinese Medicine of China, School of Pharmacy, Binzhou Medical University, Yantai 264003, China
A paclitaxel (PTX)-loaded nano-drug delivery system based on chlorin e6 (Ce6)-conjugated human serum albumin (HSA) was prepared for chemo-photodynamic combined therapy of breast cancer to improve therapeutic efficacy.HSA-Ce6 conjugates were prepared by covalent coupling method, and their FT-IR spectra, UV-vis absorption spectra and fluorescence spectra were analyzed. Paclitaxel-loaded HSA-Ce6 nanoparticles (PTX@HSA-Ce6) were prepared by self-assembling and their particle distribution, ζ potential, morphology and stability were characterized. The drug loading and release profiles of PTX@HSA-Ce6 were examined. Theintracellular reactive oxygen species (ROS) generation, cellular uptake and cytotoxicity of PTX@HSA-Ce6 were evaluated on human breast cancer MCF-7 cells.PTX@HSA-Ce6 prepared with a HSA/Ce6 molar ratio of 1∶10 displayed uniformly spherical shape and good stability with a mean particle size of (147.4 ± 0.9) nm and ζ potential of (−15.2 ± 0.6) mV. PTX@HSA-Ce6 could efficiently load paclitaxel and showed sustained drug release behaviors with pH-sensitivity. PTX@HSA-Ce6 could be rapidly and continuously taken up by MCF-7 cells, and generated intracellular ROS after laser irradiation. MTT assay indicated that PTX@HSA-Ce6 exhibited significantly higher inhibitory effect on theproliferation of MCF-7 cells compared with the single treatment of paclitaxel or HSA-Ce6.PTX@HSA-Ce6 could facilitate the co-loading and intracellular delivery of Ce6 and paclitaxel, therefore enhance the therapeutic efficacy of breast cancer by chemo-photodynamic combined therapy.
paclitaxel; chlorin e6; human serum albumin; nano-drug delivery system; chemotherapy; photodynamic therapy; breast cancer; covalent coupling; self-assembling
R283.6
A
0253 - 2670(2022)04 - 0993 - 11
10.7501/j.issn.0253-2670.2022.04.005
2021-09-08
国家自然科学基金资助项目(81703391);山东省自然科学基金重点项目(ZR2020KB015);山东省自然科学基金项目(ZR2021MC091);山东省青创人才引育团队—中药复杂体系作用模式解析创新研究团队项目(10073004);山东省大学生创新创业训练计划(S202010440063);山东省大学生创新创业训练计划(S202110440055)
亓文霞(1995—),女,硕士研究生,从事药物新剂型研究。E-mail: 18766572383@163.com
张 静,副教授,从事纳米给药系统的构建与应用研究。E-mail: jing0126@163.com
[责任编辑 郑礼胜]
