基于网络药理学和分子对接探讨泽泻三萜抗肝纤维化的作用机制
2022-02-23刘钰偲梁继超
江 雯,叶 晨,胡 熳,刘钰偲,张 艳,梁继超,陈 勇
基于网络药理学和分子对接探讨泽泻三萜抗肝纤维化的作用机制
江 雯,叶 晨,胡 熳,刘钰偲,张 艳,梁继超*,陈 勇*
湖北大学 药物高通量筛选技术国家地方联合工程研究中心 中药生物技术湖北省重点实验室,省部共建生物催化与酶工程国家重点实验室,湖北 武汉 430062
基于网络药理学和分子对接方法探究泽泻三萜成分抗肝纤维化的潜在作用机制。根据数据库筛选及文献调研选取以泽泻三萜中8种活性成分为研究对象,利用Swiss Target Prediction网络平台预测其作用靶点;通过GeneCards、OMIM数据库获取与肝纤维化有关的靶点,借助Cytoscape 3.7.2软件构建“活性成分-抗肝纤维化靶点”网络图,并通过度值筛选核心成分;使用String平台进行蛋白相互作用(protein-protein interaction,PPI)分析,结合Cytoscape 3.7.2软件构建PPI网络图,通过度值、节点紧密度、节点介度筛选关键靶点;采用DAVID数据库对泽泻三萜抗肝纤维化的作用靶点进行基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析;使用AutoDock软件对核心成分与关键靶点进行分子对接;考察乙酰泽泻醇C对油酸和棕榈酸诱导的小鼠正常肝细胞(NCTC-1469)上清液一氧化氮(nitric oxide,NO)水平的影响。筛选出泽泻三萜中8种活性成分包括24-乙酰泽泻醇A、泽泻醇B、乙酰泽泻醇B、16β-甲氧基乙酰泽泻醇B、泽泻醇C、乙酰泽泻醇C、泽泻内酯D、25-甲氧基泽泻醇F,预测得到35个抗肝纤维化靶点,4个核心成分包括乙酰泽泻醇B、16β-甲氧基乙酰泽泻醇B、泽泻醇C、乙酰泽泻醇C,4个关键靶点包括蛋白激酶Cα(protein kinase Cα,PRKCA)、丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)、磷酯酰肌醇-3激酶催化亚基γ(phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit γ,PIK3CG)、MAPK8;基因富集分析得到GO功能条目142个、通路69条(<0.05);分子对接结果显示,核心成分与关键靶点均有较强的潜在结合能力;网络药理学分析显示,泽泻三萜成分主要通过作用于脂多糖反应、凋亡等生物过程及肿瘤坏死因子(tumor necrosis factor,TNF)、磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)、MAPK等信号通路发挥抗肝纤维化作用。体外细胞实验结果显示乙酰泽泻醇C显著降低肝损伤细胞模型NO水平(<0.05)。泽泻三萜中的活性成分乙酰泽泻醇B、16β-甲氧基乙酰泽泻醇B、泽泻醇C、乙酰泽泻醇C可能通过调节MAPK、PI3K/Akt等信号通路,从而发挥抗肝纤维化作用。
泽泻三萜;肝纤维化;网络药理学;乙酰泽泻醇B;16β-甲氧基乙酰泽泻醇B;泽泻醇C;乙酰泽泻醇C
肝纤维化的本质是慢性肝病过程中的一种可逆的肝组织损伤过度修复反应。肝纤维化的主要发病机制包括肝脂代谢及能量代谢紊乱、慢性肝炎病毒感染等各种慢性损伤因素[1],诱导静止型肝星状细胞(hepatic stellate cells,HSC)转变为肌成纤维细胞样细胞[2],诱导生成大量细胞外基质(extracellular matrix,ECM)[3],并逐渐沉积于肝实质形成纤维瘢痕,同时细胞产生大量炎性因子引发纤维结缔组织过度增生,最终可发展为肝硬化,甚至肝癌[4]。引起肝纤维化的常见疾病包括病毒性肝炎、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)、酒精性肝炎、遗传代谢性肝病及胆汁瘀积性肝病等。目前NASH的发病率在全球范围内迅速上升[5-6],约1/3以上的患者可能进展为纤维化[7]。
泽泻为泽泻科植物泽泻(Sam.) Juzep.的干燥块茎,具有利水渗湿、化浊调脂等功效[8]。作为泽泻的活性成分,泽泻三萜类化合物具有抗炎等多方面活性[9-10]。高慧等[11]发现活血清肝饮(含泽泻)可改善患者肝纤维化。韩晓颖等[12]发现泽泻汤能够显著降低纤维化指标。此外多种有改善肝纤维化作用的中药组方含有泽泻[13-15]。研究表明,泽泻三萜单体化合物24-乙酰泽泻醇A可降低NASH小鼠模型中炎症细胞因子的表达[16];23-乙酰泽泻醇B通过激活法尼醇X受体(farnesoid X receptor,FXR)降低胆碱蛋氨酸缺乏诱导的NASH小鼠肝脏炎症标志物细胞趋化蛋白-1(monocyte ehemoattractant protein-1,)及纤维化标志物α-平滑肌肌动蛋白(α-smooth muscle actin,)、转化生长因子-β1(transformed growth factor-β1,)和基质金属蛋白酶2(matrix metallopeptidase 2,)mRNA表达[17]。但泽泻抗肝纤维化的作用机制并不明确。本研究采用网络药理学[18]和分子对接的方法,以泽泻三萜类成分为研究对象,预测分析泽泻三萜主要活性成分及其抗肝纤维化的潜在靶点,并利用细胞实验对预测的结果进行验证,为揭示泽泻的抗纤维化机制提供参考。
1 材料
1.1 细胞
小鼠正常肝细胞NCTC-1469购买自杭州海晟生物科技有限公司。
1.2 药品与试剂
乙酰泽泻醇C(质量分数≥98%,批号B21764)购自上海源叶生物科技有限公司;DMEM高糖培养基购自美国Gibco公司;四季青胎牛血清购自杭州天杭生物科技有限公司;双抗(青霉素和链霉素)、胰酶、牛血清白蛋白(bovine serum albumin,BSA)购自杭州吉诺生物医药技术有限公司;油酸钠(批号A1529012)购自上海阿拉丁生物公司;棕榈酸、二甲基亚砜(dimethyl sulfoxide,DMSO)、MTT购自美国Sigma公司;NaCl、KCl、Na2HPO4·12H2O、KH2PO4、NaHCO3购自国药集团化学试剂有限公司;总一氧化氮(nitric oxide,NO)检测试剂盒(批号S0023)购自上海碧云天生物科技有限公司;BCA蛋白定量试剂盒(批号23225)购自美国Thermo Fisher Scientific公司。
1.3 仪器
细胞培养箱(德国Heraeus公司);液氮罐(成都金凤液氮容器有限公司);立式自动电热压力蒸汽灭菌器(合肥华泰医疗设备有限公司);超净工作台(苏州安泰空气技术有限公司);XDS-1B型倒置相差显微镜(北京佳源兴业科技有限公司);BP211D型电子天平(德国Startorius公司);JA3003型电子天平(上海精密科学仪器有限公司);台式低温高速离心机(德国Eppendorf公司);iMARKTM酶标仪(美国Bio-Rad公司)。
2 方法
2.1 分子网络构建
2.1.1 泽泻三萜类活性成分库的构建 泽泻三萜类成分是泽泻分离出的主要化学成分,也是主要的活性成分。利用中药系统药理学数据与分析平台TCMSP数据库[19](http://tcmspw.com/tcmsp.php)、中医药证候关联数据库SymMap平台[20](http:// www.symmap.org/)及文献检索查询泽泻的三萜类化学成分。在TCMSP数据库中设定口服生物利用度(oral bioavailability,OB)≥30%且类药性(drug- likeness,DL)≥0.18作为筛选条件[21];在SymMap数据库中设定OB≥30%作为筛选条件获取有效三萜类成分[21],同时查阅相关文献补充部分未收录但已经报道的活性三萜类成分以构成泽泻三萜类活性成分库。使用有机小分子生物活性数据库PubChem(https://pubchem.ncbi.nlm.nih.gov/)对检索到的各个成分结构进行比对确认,对于未收录的化学成分根据文献通过ChemDraw进行绘制,均保存为sdf格式文件。
2.1.2 泽泻三萜类活性成分靶点库的构建 利用Swiss Target Prediction靶点预测数据库[22](http:// www.swisstargetprediction.ch/)、药效团匹配与潜在识别靶标平台PharmMapper数据库[23](http://www. lilab-ecust.cn/pharmmapper/)预测泽泻三萜类活性成分的作用靶点蛋白。在Swiss Target Prediction平台中导入化合物结构,物种设置为“Homo sapiens”,筛选Probability>0,得到相关的靶点名称、Uniprot ID等结果;在PharmMapper数据库中基于药效团模型预测化合物的靶标蛋白,选择“Human Protein Targets Only”,设置最终产生300个蛋白构象,获得所选成分潜在靶点的预测结果。将所筛选的活性成分靶点导入至Uniprot数据库(https://www. uniprot.org/uploadlists/),限定物种为“human”,将检索得到的所有蛋白靶标校正为Uniprot ID,并得到靶标蛋白所对应的基因名。
2.1.3 肝纤维化疾病靶点库的构建 以“liver fibrosis”“hepatic fibrosis”为关键词,在GeneCards(https://www.genecards.org/)、OMIM(https://omim. org/)、CTD(http://ctdbase.org/)数据库检索肝纤维化疾病相关靶点,整合3个数据库的检索结果并删除重复的基因靶点,得到肝纤维化疾病相关的靶点以构建肝纤维化疾病靶点库。
2.1.4 泽泻三萜的“活性成分-抗肝纤维化潜在靶点”网络构建与分析 将泽泻三萜类活性成分靶点库与肝纤维化疾病靶点库取交集,获得泽泻三萜类活性成分治疗肝纤维化的潜在作用靶点。运用Cytoscape 3.7.2软件将活性成分与潜在作用靶点筛选结果导入,进行网络可视化分析,通过节点和边表示关键化合物和靶点及其之间的关系。利用Network Analyzer功能进行网络拓扑学分析,通过参考拓扑学参数对比化合物在网络中的重要性,参数包括节点介数中心性、节点紧密度和度值等,分析主要活性成分及核心靶点。
2.1.5 泽泻三萜类“活性成分-肝纤维化”潜在靶点的蛋白相互作用(protein-protein interaction,PPI)网络构建 使用String平台[24](https://www. string-db.org/),将潜在作用靶点导入后设置物种为“Homo sapiens”,将最低相互作用分值设为“medium confidence=0.4”,隐藏没有相互作用联系的节点,其他参数设置不变以获得PPI关系,导出数据文件,之后导入到Cytoscape 3.7.2软件中进行可视化分析,设置参数使节点大小和颜色深浅反映度值的大小,边的粗细反映结合率评分的高低,建立PPI网络图。
2.1.6 泽泻三萜类“活性成分-肝纤维化”潜在作用靶点的京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路和基因本体(gene ontology,GO)功能富集分析 使用生物学信息注释数据库DAVID 6.8生物信息学分析平台(https://david.ncifcrf.gov/summary.jsp),将潜在作用靶点的Symbol录入后,Identifier选择为“OFFICIAL_GENE_SYMBOL”,物种为“Homo sapiens”,列表类型为“Gene List”,进行GO功能和KEGG通路富集分析。对潜在靶点进行GO功能分析,以研究泽泻三萜类活性成分抗肝纤维化的主要生物功能包括可能存在的生物过程(biological process,BP)、分子功能(molecular function,MF)、细胞组分(cellular component,CC),并根据值使用GraphPad v8.3绘制柱状图;进行KEGG通路分析,以研究泽泻三萜类活性成分抗肝纤维化的主要信号通路,将结果通过生物信息分析平台(http://www.bioinformatics.com.cn/)绘制成气泡图进行可视化。
2.1.7 泽泻三萜的“活性成分-靶点-通路”网络构建 筛选泽泻三萜类活性成分靶点富集得到抗肝纤维化的主要信号通路以及各通路对应的相关靶点,导入至CytoScape 3.7.2软件[25]中构建“活性成分-靶点-通路”网络,利用Network Analyzer功能进行网络拓扑学分析,参数包括度值、介度等,分析主要活性成分及核心靶点。
2.1.8 泽泻三萜活性成分与潜在靶点分子对接 为更好地阐述泽泻三萜活性成分抗肝纤维化的潜在靶点与对应的活性成分之间的结合活性,将“活性成分-靶点-通路”网络中度值靠前的核心成分与关键潜在靶点进行分子对接。从PDB数据库[26](http://www.wwpdb.org/)中下载关键潜在靶点蛋白的3D结构并保存为pdb格式,运用PyMOL软件进行蛋白受体分子的前处理,运用Chemdraw 3D软件进行活性化合物配体的前处理。将前处理好的潜在靶点和活性化合物成分导入对接软件AutoDock[27]中进行分子对接,将结果保存为pdbqt格式。借助Open Babel 2.2软件将结果文件转化为pdb格式,使用PyMOL软件将对接得分较高且构象较稳定的化合物与靶点蛋白,进行分子对接可视化分析。依据结果参数文件中配体与受体的结合能来判断结合活性和可能性,一般认为配体与受体的结合能越低,其结合的构象越稳定,结合能<0 kJ/mol认为化合物和靶蛋白可以自发结合,≤−17.78 kJ/mol时认为具有一定的结合活性,≤−20.92 kJ/mol时认为具有较好的结合活性,≤−29.29 kJ/mol时认为结合活性比较强烈[28]。
2.2 细胞实验
2.2.1 细胞培养 NCTC-1469细胞用含100 U/mL青霉素、100 μg/mL链霉素和10%胎牛血清的高糖DMEM培养基,于5% CO2、37 ℃的培养箱中培养,每2~3天传代1次。
2.2.2 NO测定 将NCTC-1469细胞以1×105/孔接种于6孔板中,培养24 h,设置对照组、模型组和乙酰泽泻醇C(8、16、32 μmol/L)组,对照组加入不含药物的培养基,其余各组用含0.5 mmol/L油酸和0.25 mmol/L棕榈酸的高糖DMEM完全培养基诱导处理24 h使细胞脂肪变性[29];各给药组再加入药物处理24 h,收集细胞。加入裂解液裂解细胞,取上清,一部分用于检测NO含量,另一部分检测蛋白浓度。使用总NO检测试剂盒测定细胞内NO含量,用BCA蛋白定量试剂盒测定蛋白浓度。以对照组NO含量与蛋白浓度的比值为100%,计算各孔细胞内NO的相对含量。
3 结果
3.1 泽泻三萜活性化学成分的筛选
从TCMSP数据库中检索到泽泻中的活性成分共46个,SymMap数据库中检索得到75个活性成分,根据ADME和Lipinski类药五规则[30]标准筛选并结合相关文献[17,31-32]补充,分析选取8个泽泻三萜类活性成分为研究对象,分别为24-乙酰泽泻醇A、泽泻醇B、乙酰泽泻醇B、16β-甲氧基乙酰泽泻醇B、泽泻醇C、乙酰泽泻醇C、泽泻内酯D、25-甲氧基泽泻醇F,其化合物结构见图1。
3.2 泽泻三萜活性化学成分靶点的预测
将各个泽泻三萜类活性成分分别导入Swiss Target Prediction和PharmMapper预测活性成分的潜在靶点,Swiss Target Prediction预测结果选择各个化合物可能性最高的前15位预测靶点,PharmMapper数据库预测结果筛选“Norm Fit>0.9”的靶点,合并后删除重复值共获得111个基因靶点。
3.3 肝纤维化相关靶点获取结果
通过GeneCard数据库检索出7238个靶点,OMIM数据库检索出6161个靶点,CTD数据库中检索出93 367个靶点,根据相关性打分筛选,合并3个数据库筛选结果并去除重复项共选取1330个靶点,采用这些靶点组建了肝纤维化相关靶点数据库。
3.4 泽泻三萜“活性成分-抗肝纤维化潜在靶点”网络构建及网络拓扑学分析
利用VENNY2.1在线平台(https://bioinfogp cnb.csic.es/tools/venny/index.html)对泽泻三萜类活性成分靶点与肝纤维化相关靶点取交集,得到泽泻三萜类活性成分治疗肝纤维化可能的35个作用靶点基因,包括丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)、蛋白激酶Cα(protein kinase Cα,PRKCA)、过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARG)、磷酯酰肌醇-3激酶催化亚基γ(phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit γ,PIK3CG)、表皮生长因子受体(epidermal growth factor receptor,EGFR)等,交集靶点信息见表1。将筛选出的8个泽泻三萜活性成分和35个潜在作用靶点利用Cytoscape 3.7.2软件进行“活性成分-肝纤维化”网络构建,结果如图2所示,该网络包含43个节点,165条相互作用的边,外圈节点表示35个潜在作用靶点,内圈节点表示8个活性成分。进行网络拓朴学分析,得到节点介度、节点紧密度、度值等数据,其中度值代表与节点相关联的边的数量,度值越大,说明该节点在网络中越重要。由表2可以看出,乙酰泽泻醇B、16β-甲氧基乙酰泽泻醇B、泽泻醇C、乙酰泽泻醇C具有较好的拓扑学参数,在“活性成分-抗肝纤维化潜在靶点”网络中较其他化合物更重要。
图1 泽泻三萜成分化学结构
Fig. 1 Chemical structures of triterpenes from A. orientalis
表1 泽泻三萜活性成分靶点与肝纤维化靶点交集信息
Table 1 Intersection information between triterpene active components of A. orientalis and hepatic fibrosis targets
Uniprot ID靶点Uniprot ID靶点 P35228NOS2P42574CASP3 Q13133NR1H3P04035HMGCR P06276BCHEP35968KDR P37231PPARGP08254MMP3 Q05655PRKCDP02766TTR P09211GSTP1P25024CXCR1 Q14994NR1I3P28482MAPK1 P04150NR3C1P48736PIK3CG Q16539MAPK14Q00987MDM2 P02774GCP00533EGFR P55055NR1H2Q9HBA0TRPV4 P00734F2P45983MAPK8 P35354PTGS2P80188LCN2 P12643BMP2P02768ALB P03372ESR1O75469NR1I2 P04062GBAP10275AR P62937PPIAP17252PRKCA P49841GSK3B
3.5 泽泻三萜“活性成分-肝纤维化”潜在靶点PPI网络的构建
借助String平台输入35个潜在作用靶点,获得包含35节点的PPI网络,隐藏没有相互作用联系的节点,通过Cytoscape 3.7.2软件进行网络可视化,如图3所示,共34个节点,度值越大,节点越大;连接评分越高,边越粗。拓扑学参数表明,PPI网络中节点介度的中位数为0.005 862 64、节点紧密度的中位数为0.550 152 82、度值的中位数为8,经3个参数综合筛选关联度最高的3个靶点分别为白蛋白(albumin,ALB)、MAPK1和EGFR,提示它们可能是泽泻三萜活性成分抗肝纤维化的关键靶点。
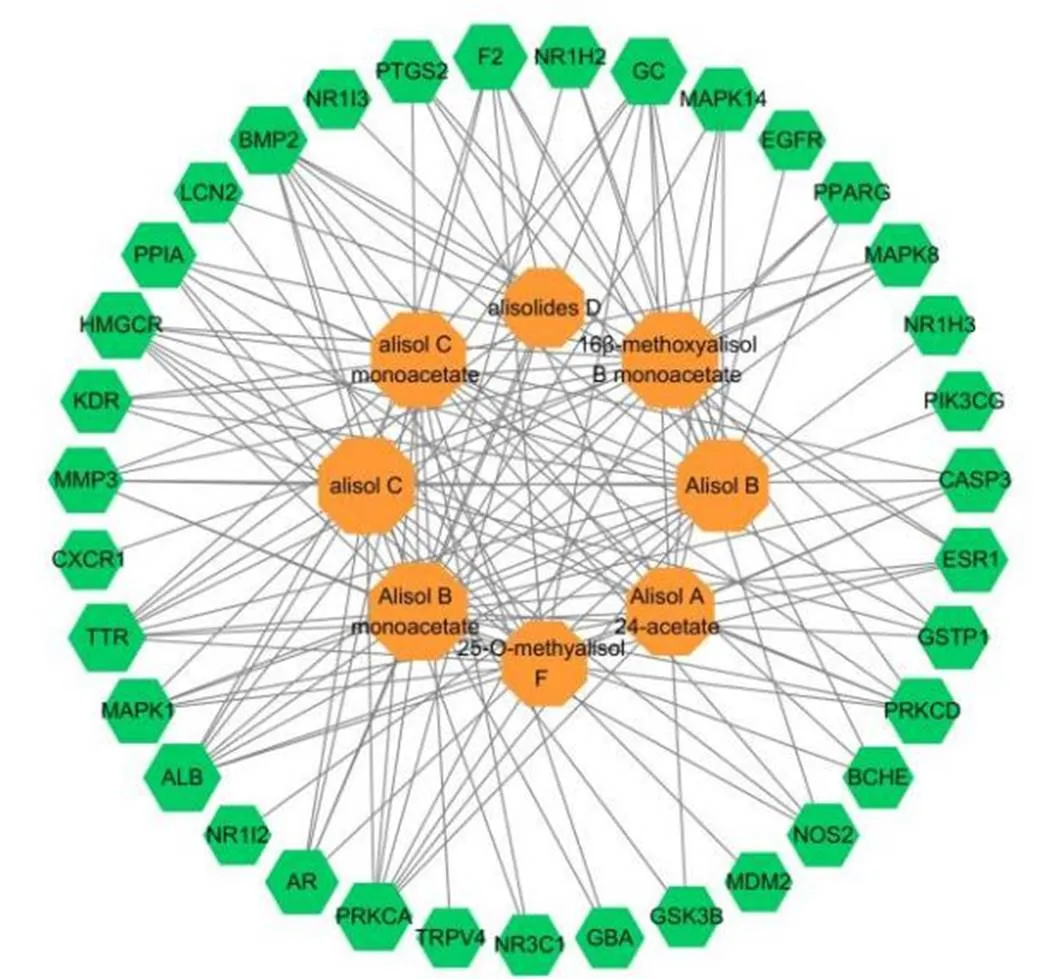
图2 泽泻三萜“活性成分-抗肝纤维化潜在靶点”相互作用网络
表2 泽泻三萜在“活性成分-抗肝纤维化潜在靶点”网络中的拓扑学分析
Table 2 Topological analysis of A. orientalis triterpenes in network of “active ingredients-potential targets against liver fibrosis”
成分介数中心性紧密度度值 乙酰泽泻醇B0.164 576 560.560 000 0022 16β-甲氧基乙酰泽泻醇B0.152 336 230.545 454 5521 泽泻醇C0.173 364 280.545 454 5521 乙酰泽泻醇C0.148 704 160.531 645 5720 泽泻醇B0.153 719 170.506 024 1018 24-乙酰泽泻醇A0.096 293 670.471 910 1115 25-甲氧基泽泻醇F0.052 383 620.451 612 9013 泽泻内酯D0.070 236 710.415 841 589
3.6 泽泻三萜“活性成分-肝纤维化”潜在靶点GO功能与KEGG通路富集分析
通过DAVID 6.8在线平台对35个潜在作用靶点进行GO功能富集分析,设定<0.05,总共富集到142条生物学过程或通路,其中96个与BP相关、15个与MF相关、31个与CC相关。根据值从小到大排列,各选取排名前10位结果绘制柱状图,由图4可以看出,泽泻三萜活性成分可能参与众多过程,BP主要涉及甾体激素介导的信号通路、脂多糖的反应、凋亡信号通路、γ干扰素(interferon-γ,IFN-γ)介导的信号通路、MAPK活性、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)活性等;MF主要涉及到类固醇激素受体活性、酶结合、蛋白结合、锌离子结合、蛋白丝氨酸/苏氨酸激酶活性、MAPK活性等;CC主要涉及蛋白质复合体、细胞核、胞质、核质等。
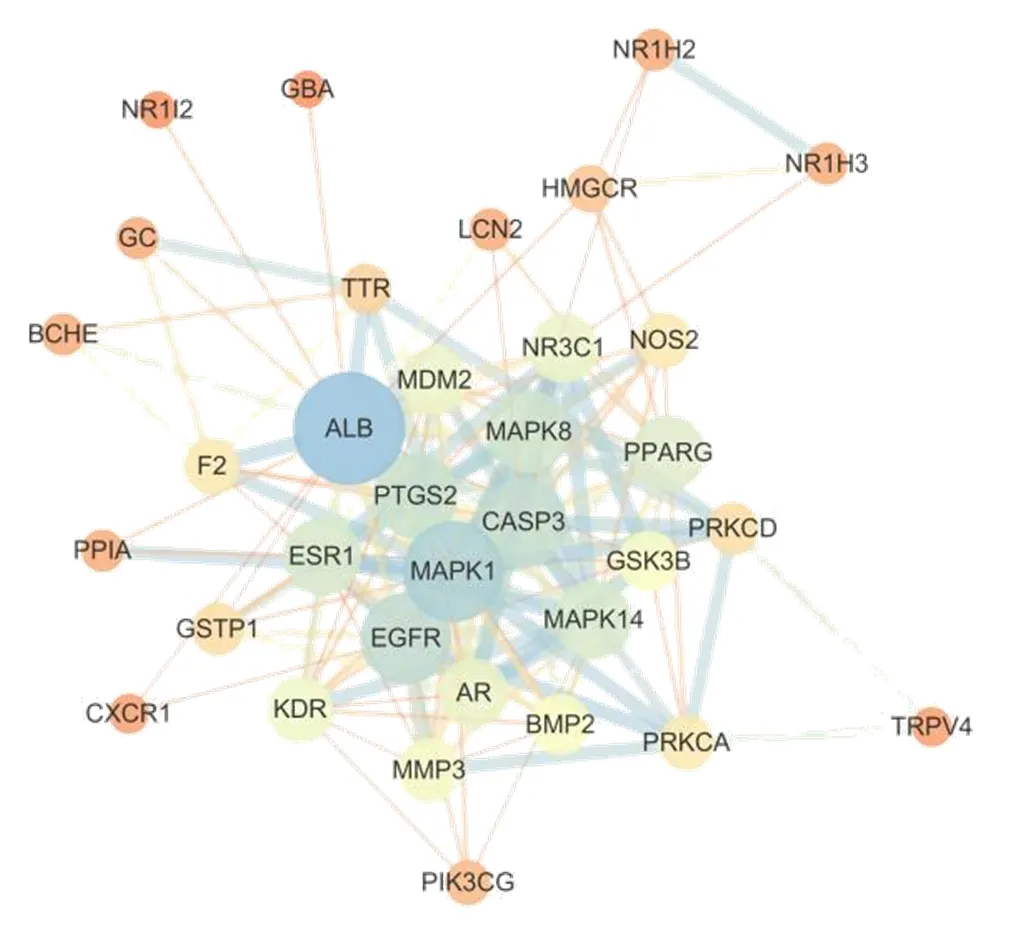
图3 泽泻三萜“活性成分-肝纤维化”潜在靶点PPI网络分析图
对35个潜在作用靶点进行KEGG通路富集分析,设定<0.05,共获得69条富集通路,按照值从小到大排列且筛选富集靶点数>5的通路,结合文献筛选出与肝纤维化相关的14条主要通路,14条通路的富集气泡图见图5,包括肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路、血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路、酪氨酸激酶受体2(tyrosine kinase receptor 2,ErbB)信号通路、炎症介质对瞬时感受器电位(transient receptor potential,TRP)通道的调节、胰岛素抵抗、甲状腺激素信号通路、FoxO信号通路、Rap1信号通路、Ras信号通路、MAPK信号通路、缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)信号通路、雌激素信号通路等。
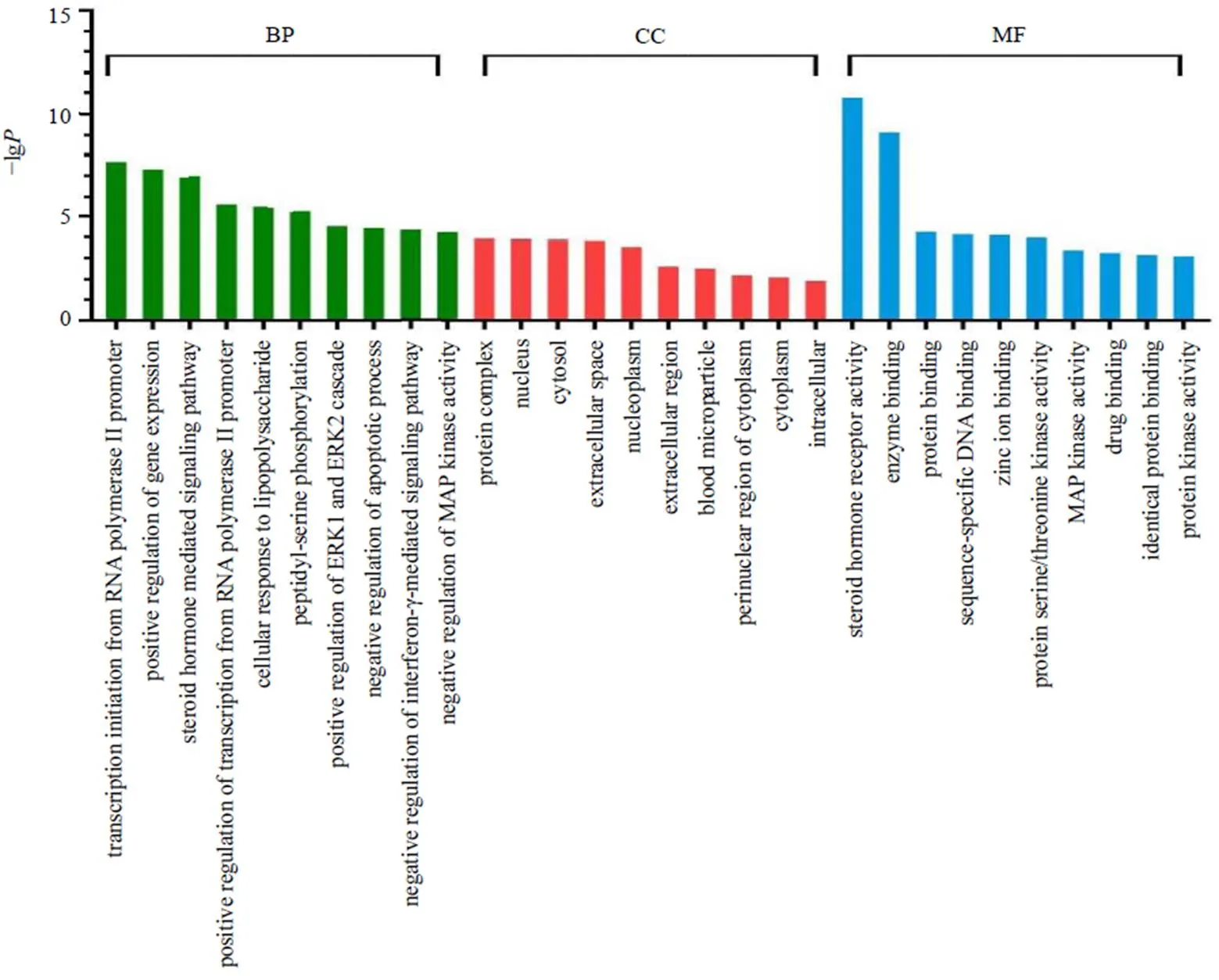
图4 GO功能富集分析(前10)

图5 KEGG通路富集分析
3.7 泽泻三萜“活性成分-抗肝纤维化潜在靶点-通路”网络的构建
根据KEGG通路富集分析结果选取的14条相关性高的信号通路,同时与这些相关通路的靶点建立相互作用联系,将活性成分、通路靶点、信号通路通过CytoScape 3.7.2软件进行可视化,如图6所示,包括58个节点和238条边,根据拓扑学数据表明,乙酰泽泻醇B、16β-甲氧基乙酰泽泻醇B、泽泻醇C、乙酰泽泻醇C可能是泽泻三萜治疗肝纤维化的主要活性成分;PRKCA、MAPK1、PIK3CG、MAPK8可能是泽泻三萜治疗肝纤维化的主要作用靶点。

图6 泽泻三萜“活性成分-潜在靶点-通路-疾病”网络
3.8 泽泻三萜主要活性成分与关键靶点的分子对接
根据GO功能及KEGG通路富集分析结果,初步选择“成分-靶点-通路”网络中度值较大的4个作用靶点PRKCA、MAPK1、PIK3CG、MAPK8,分别以4个度值较大的核心成分乙酰泽泻醇B、16β-甲氧基乙酰泽泻醇B、泽泻醇C、乙酰泽泻醇C为对象进行分子对接。选取该靶点所对应的配体作为参考来对比对接结果,所选取的靶点信息和对接打分情况如表3所示。所有核心成分与关键靶点的结合能均≤−20.92 kJ/mol,其中乙酰泽泻醇B与MAPK1、PIK3CG、MAPK8结合能≤−29.29 kJ/mol且强于PIK3CG特异性配体;16β-甲氧基乙酰泽泻醇B与MAPK8结合能≤−29.29 kJ/mol;泽泻醇C与MAPK1、MAPK8结合能≤−29.29 kJ/mol且强于MAPK1特异性配体;乙酰泽泻醇C与MAPK1、MAPK8结合能≤−29.29 kJ/mol且强于MAPK1特异性配体,以上结果表明活性成分与关键靶点具有较强的结合活性,它们之间的相互作用见图7。
表3 分子对接验证结果
Table 3 Verification results of molecular docking
靶点PDB ID活性成分结合能/(kJ·mol−1)抑制剂常数/(μmol·L−1) PRKCA3IW4乙酰泽泻醇B−25.1539.55 16β-甲氧基乙酰泽泻醇B−22.72105.37 泽泻醇C−23.0193.11 乙酰泽泻醇C−26.2824.81 LW4(unique ligands)−43.430.024 67 MAPK16SLG乙酰泽泻醇B−31.133.53 16β-甲氧基乙酰泽泻醇B−25.8629.54 泽泻醇C−30.794.05 乙酰泽泻醇C−38.160.206 59 LHZ(unique ligands)−29.336.91 PIK3CG2A4Z乙酰泽泻醇B−30.254.99 16β-甲氧基乙酰泽泻醇B−24.3554.3 泽泻醇C−23.8566.54 乙酰泽泻醇C−22.30123.28 BYM(unique ligands)−27.0717.97 MAPK84QTD乙酰泽泻醇B−32.551.99 16β-甲氧基乙酰泽泻醇B−31.712.78 泽泻醇C−33.051.62 乙酰泽泻醇C−30.175.18 38Z(unique ligands)−43.810.021 25
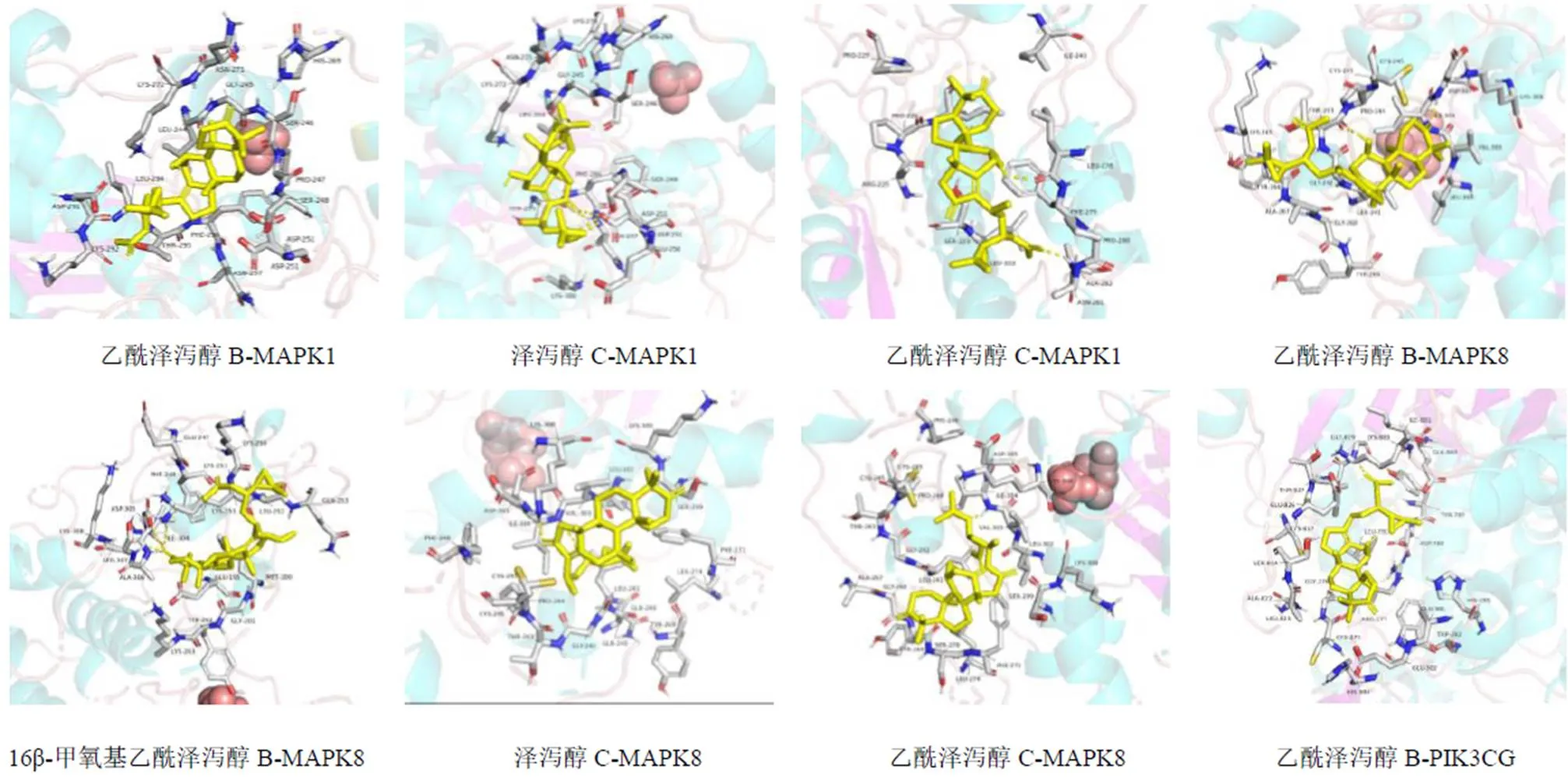
图7 泽泻三萜主要活性成分与关键靶点的分子对接
3.9 乙酰泽泻醇C对NCTC-1469细胞上清液NO水平的影响
为了研究乙酰泽泻醇C对炎症相关指标的影响,检测乙酰泽泻醇C对油酸和棕榈酸诱导的NCTC-1469细胞上清液NO水平,结果如图8所示,NCTC-1469细胞经油酸和棕榈酸处理后,细胞上清液NO水平显著高于对照组(<0.01);经乙酰泽泻醇C(32 μmol/L)处理24 h后,细胞上清液NO水平显著降低(<0.05)。

与对照组比较:**P<0.01;与模型组比较:#P<0.05
4 讨论
泽泻具有调血脂和降血糖等多种药理作用,常被用于治疗脂肪肝、高脂血症等。近年来,有大量研究发现泽泻三萜成分具有良好的肝保护作用,尤其是对非酒精性脂肪性肝脏损伤具有较好的保护作用,而肝纤维化则是这类慢性肝损伤所导致的肝脏细胞外基质过度沉积产生的综合效应,其作用机制仍未明确。因此本研究基于网络药理学和分子对接技术[33]筛选了泽泻三萜成分抗肝纤维化的主要活性成分及潜在作用靶点,探讨其抗肝纤维化可能的作用机制。
本研究共筛选出8个泽泻三萜类活性化学成分,包括24-乙酰泽泻醇A、泽泻醇B、乙酰泽泻醇B、16β-甲氧基乙酰泽泻醇B、泽泻醇C、乙酰泽泻醇C、泽泻内酯D、25-甲氧基泽泻醇F。据文献报道,泽泻三萜单体化合物24-乙酰泽泻醇A可降低NASH小鼠模型中的活性氧(reactive oxygen species,ROS)水平,抑制炎症细胞因子的表达[17]。23-乙酰泽泻醇B可通过激活FXR信号通路,降低蛋氨酸及胆碱缺乏饲料诱导的NASH小鼠肝脏炎症标志物及纤维化标志物的mRNA水平,从而降低肝脏脂质积聚、肝小叶炎症和细胞外纤维化水平[18],Huo等[34]研究表明23-乙酰泽泻醇B能激活FXR保护对α-萘异硫氰酸盐或雌激素所致肝损伤,对III型炎症反应有一定的抑制活性,还能改善炎细胞浸润及肝纤维化。李小艳等[35]发现泽泻醇C、23-乙酰泽泻醇C表现出一定的促进小鼠胚胎成纤维3T3-L1细胞葡萄糖摄取作用,有一定的降血糖功效。此外,Jin等[32]从泽泻中分离得到的6个四环三萜类新化合物alisolides A~F均能不同程度地抑制脂多糖诱导的人结肠癌Caco2细胞NO生成,缓解炎症反应。因此,本研究利用网络药理学对泽泻三萜主要成分进行了相关活性预测,以期筛选到具有一定抗NASH肝纤维化活性的泽泻单体化合物。其中乙酰泽泻醇B、16β-甲氧基乙酰泽泻醇B、泽泻醇C、乙酰泽泻醇C在网络中度值较大,可能为主要的活性成分。根据GO功能和KEGG通路富集分析,进一步表明泽泻三萜成分抗肝纤维化作用可能与TNF信号通路、PI3K/Akt信号通路、VEGF信号通路、ErbB信号通路、炎症介质对TRP通道的调节、胰岛素抵抗、FoxO信号通路等有关。其中显著性最高的TNF信号通路,被报道可诱导激活下游核转录因子-κB(nuclear factor-κB,NF-κB),抑制基因的表达,刺激HSC增殖和胶原合成,加重肝纤维化的病理进程[36];也有研究认为TNF是炎症反应和肝纤维化的调节分子,可激活NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)阻止肝脏损伤和纤维化进展[37]。此外成功构建了“活性成分-潜在靶点-通路-疾病”网络,潜在作用靶点中RRKCA、MAPK1、PIK3CG、MAPK8显示出较高的关联度,是该网络中的关键节点。提示泽泻三萜活性成分治疗肝纤维化与RRKCA、MAPK1、PIK3CG、MAPK8靶点密切相关。
分子对接结果显示,泽泻三萜成分中度值较高的4种核心成分乙酰泽泻醇B、16β-甲氧基乙酰泽泻醇B、泽泻醇C、乙酰泽泻醇C与关键作用靶点蛋白RRKCA、MAPK1、PIK3CG、MAPK8结合能均≤−17.78 kJ/mol,并且这4种核心成分与MAPK8的结合能均≤−20.92 kJ/mol,表明泽泻活性成分与潜在靶点分子生物亲和力高,具有较高的药效活性,其中乙酰泽泻醇C与MAPK1靶点结合能力最好。PRKCA是一种蛋白质编码基因,其相关通路包括MAPK通路,Pan等[38]通过转录组学研究发现PRKCA可作为促性腺激素释放激素(gonadotropin releasing hormone,GnRH)、MAPK/ERK等信号通路的负调控因子,调节miR-16从而抑制HSC活化,降低肝纤维化的程度。MAPK1称为ERK2,在细胞的增殖分化中起着重要的调控作用[39]。Jeng等[40]发现ERK2信号通路通过FOXM1、MMP9、CD133等多种肝细胞癌相关生物标志物调控肝纤维化进程,同时在肝纤维化小鼠模型中,ERK2−/−通过调节ERK信号通路使肝纤维化细胞增殖减少、α-SMA蛋白水平降低、肝纤维化程度降低、炎症反应减少。PIK3CG又被称为PI3K,是肌醇磷脂的磷酸化产物,其相关通路有MAPK通路和2型糖尿病,Lei等[41]发现miR-101可通过靶向雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)调节PI3K/Akt/mTOR信号通路来减少ECM积累,逆转肝纤维化。MAPK8被称为c-Jun氨基末端激酶1(c-Jun-terminal kinase 1,JNK1),参与炎症等病理过程中的调控[42]。有文献报道TGF-β和血小板衍生生长因子(platelet derived growth factor,PDGF)均可通过JNKs激活Smad2和Smad3,导致HSC迁移,其中JNK1−/−小鼠中α-SMA蛋白水平降低,对肝纤维化有保护作用[43]。上述文献研究结果表明,PRKCA、MAPK1、PIK3CG、MAPK8均与MAPK信号通路存在一定相关性。MAPK信号传导通路是经典的有丝分裂通路,是信号从细胞表面传导到细胞核内的重要传递者。近期的研究表明,MAPK信号通路与人体多种脏器纤维化的发生、发展密切相关[44]。MAPK信号通路可以通过对HSC活化、增殖、凋亡的调控参与肝纤维化的形成[45]。NO水平随肝纤维化程度加深而逐渐升高,可能成为反映肝纤维化及其活动性的指标之一[46-47]。体外实验结果显示,乙酰泽泻醇C处理后能降低脂变性细胞的NO含量。结合网络药理学、分子对接及体外细胞实验结果,推测乙酰泽泻醇C可能通过调节MAPK信号通路,减少肝细胞NO的生成,从而发挥抗肝纤维化作用。
综上所述,本研究系统揭示了泽泻三萜成分能通过多靶点-多途径共同调控肝纤维化的物质基础和作用机制,为泽泻的临床应用提供理论基础和科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Lee U E, Friedman S L. Mechanisms of hepatic fibrogenesis [J]., 2011, 25(2): 195-206.
[2] Friedman S L. Hepatic stellate cells: Protean, multifunctional, and enigmatic cells of the liver [J]., 2008, 88(1): 125-172.
[3] Friedman S L, Sheppard D, Duffield J S,. Therapy for fibrotic diseases: Nearing the starting line [J]., 2013, 5(167): 167sr1.
[4] Ying H Z, Chen Q, Zhang W Y,. PDGF signaling pathway in hepatic fibrosis pathogenesis and therapeutics (Review) [J]., 2017, 16(6): 7879-7889.
[5] 范慧宁, 陈尼维. 肝纤维化的流行病学研究进展 [J]. 国际消化病杂志, 2014, 34(1): 29-31.
[6] Xiao J, Wang F, Wong N K,. Global liver disease burdens and research trends: Analysis from a Chinese perspective [J]., 2019, 71(1): 212-221.
[7] Huang D Q, El-Serag H B, Loomba R. Global epidemiology of NAFLD-related HCC: Trends, predictions, risk factors and prevention [J]., 2021, 18(4): 223-238.
[8] 中国药典 [S]. 一部. 2020: 239.
[9] 罗奋熔. 泽泻降糖降脂及抗炎作用研究 [D]. 福州: 福建中医药大学, 2015.
[10] 钱丽萍, 江月萍, 阙慧卿, 等. 泽泻及复方制剂的化学成分及药理活性的研究进展 [J]. 海峡药学, 2010, 22(12): 8-11.
[11] 高慧, 张晓梅. 活血清肝饮治疗非酒精性脂肪性肝病疗效观察 [J]. 中医学报, 2018, 33(8): 1533-1536.
[12] 韩晓颖, 王劲松, 李小芬, 等. 泽泻汤对肝硬化门静脉高压PCIII、LN表达水平及血流动力学变化分析 [J]. 中医药信息, 2017, 34(4): 71-74.
[13] 王洪斌, 卫丽, 金宏伟, 等. 中西医结合治疗非酒精性脂肪性肝炎与纤维化的临床观察 [J]. 医药导报, 2007, 26(9): 1035-1036.
[14] 王彦刚, 杜士卜, 李佃贵, 等. 调肝方对肝炎肝硬化患者血小板参数和肝纤维化指标的影响 [J]. 时珍国医国药, 2007, 18(11): 2829-2830.
[15] 吴文霞, 杨洁文, 李勇斌, 等. 白金尚应用对药治疗2型糖尿病合并非酒精性脂肪肝的经验 [J]. 环球中医药, 2020, 13(10): 1779-1782.
[16] Wu C Q, Jing M H, Yang L J,. Alisol A 24-acetate ameliorates nonalcoholic steatohepatitis by inhibiting oxidative stress and stimulating autophagy through the AMPK/mTOR pathway [J]., 2018, 291: 111-119.
[17] Meng Q, Duan X P, Wang C Y,. Alisol B23-acetate protects against non-alcoholic steatohepatitis in mice via farnesoid X receptor activation [J]., 2017, 38(1): 69-79.
[18] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[19] 汝锦龙. 中药系统药理学数据库和分析平台的构建和应用 [D]. 杨凌: 西北农林科技大学, 2015.
[20] Wu Y, Zhang F, Yang K,. SymMap: An integrative database of traditional Chinese medicine enhanced by symptom mapping [J]., 2019, 47(D1): D1110-D1117.
[21] 陈与丰, 陈建新, 王雅蕾, 等. 泽泻汤治疗梅尼埃病作用机制的网络药理学探讨 [J]. 世界中医药, 2021, 16(7): 1060-1066.
[22] Gfeller D, Grosdidier A, Wirth M,. SwissTargetPrediction: A web server for target prediction of bioactive small molecules [J]., 2014, 42: W32-W38.
[23] Liu X, Ouyang S, Yu B,. PharmMapper server: A web server for potential drug target identification using pharmacophore mapping approach [J]., 2010, 38: W609-W614.
[24] von Mering C, Jensen L J, Snel B,. STRING: Known and predicted protein-protein associations, integrated and transferred across organisms [J]., 2005, 33: D433-D437.
[25] Kohl M, Wiese S, Warscheid B. Cytoscape: Software for visualization and analysis of biological networks [J]., 2011, 696: 291-303.
[26] Berman H, Henrick K, Nakamura H,. The worldwide Protein Data Bank (wwPDB): Ensuring a single, uniform archive of PDB data [J]., 2007, 35: D301-D303.
[27] Seeliger D, de Groot B L. Ligand docking and binding site analysis with PyMOL and Autodock/Vina [J]., 2010, 24(5): 417-422.
[28] 单丽芳, 康国娇, 张超, 等. 基于网络药理学和分子对接探讨四物汤抗乳腺癌的作用机制 [J]. 中草药, 2021, 52(13): 3943-3953.
[29] 刘亚云. 水飞蓟宾通过调节CFLAR-JNK通路改善非酒精性脂肪性肝炎 [D]. 武汉: 湖北大学, 2019.
[30] Rédei G P.[M]. Dordrecht: Springer, 2008: 1113.
[31] 陈华. 泽泻抗肾纤维化的物质基础及其作用机制研究 [D]. 西安: 西北大学, 2019.
[32] Jin Q, Zhang J, Hou J,. Novel C-17 spirost protostane-type triterpenoids from-with anti-inflammatory activity in Caco-2 cells [J]., 2019, 9(4): 809-818.
[33] 朱俊霞, 史佩玉, 綦向军, 等. 基于网络药理学和分子对接的半夏泻心汤治疗慢性萎缩性胃炎作用机制探讨[J]. 药物评价研究, 2021, 44(1): 98-110.
[34] Huo X K, Liu J, Yu Z L,.extract exerts the reversing cholestasis effect by activation of farnesoid X receptor [J]., 2018, 42: 34-42.
[35] 李小艳, 李雪君, 刘灿坤, 等. 泽泻三萜单体对3T3-L1脂肪细胞葡萄糖摄取活性的影响 [J]. 福建中医药大学学报, 2014, 24(5): 31-33.
[36] Gallois C, Habib A, Tao J,. Role of NF-kappaB in the antiproliferative effect of endothelin-1 and tumor necrosis factor-alpha in human hepatic stellate cells. Involvement of cyclooxygenase-2 [J]., 1998, 273(36): 23183-23190.
[37] Wree A, McGeough M D, Inzaugarat M E,. NLRP3 inflammasome driven liver injury and fibrosis: Roles of IL-17 and TNF in mice [J]., 2018, 67(2): 736-749.
[38] Pan Q, Guo C, Sun C,. Integrative analysis of the transcriptome and targetome identifies the regulatory network of miR-16: An inhibitory role against the activation of hepatic stellate cells [J]., 2014, 24(6): 3863-3871.
[39] Mebratu Y, Tesfaigzi Y. How ERK1/2 activation controls cell proliferation and cell death: Is subcellular localization the answer? [J]., 2009, 8(8): 1168-1175.
[40] Jeng K S, Lu S J, Wang C H,. Liver fibrosis and inflammation under the control of ERK2 [J]., 2020, 21(11): 3796.
[41] Lei Y, Wang Q L, Shen L,. MicroRNA-101 suppresses liver fibrosis by downregulating PI3K/Akt/ mTOR signaling pathway [J]., 2019, 43(5): 575-584.
[42] Kumar A, Singh U K, Kini S G,. JNK pathway signaling: A novel and smarter therapeutic targets for various biological diseases [J]., 2015, 7(15): 2065-2086.
[43] Kluwe J, Pradere J P, Gwak G Y,. Modulation of hepatic fibrosis by c-Jun--terminal kinase inhibition [J]., 2010, 138(1): 347-359.
[44] Dérijard B, Raingeaud J, Barrett T,. Independent human MAP-kinase signal transduction pathways defined by MEK and MKK isoforms [J]., 1995, 267(5198): 682-685.
[45] Janknecht R, Hunter T. Convergence of MAP kinase pathways on the ternary complex factor Sap-1a [J]., 1997, 16(7): 1620-1627.
[46] 边城, 李定国, 蒋祖明, 等. 大鼠肝纤维化过程中NO及NOS水平的动态变化 [J]. 上海第二医科大学学报, 2003, 23(2): 143-145.
[47] 孙自勤, 王要军, 权启镇, 等. 肝纤维化大鼠血清NO水平动态变化 [J]. 滨州医学院学报, 1998, 21(6): 560.
Mechanism oftriterpenes on anti-liver fibrosis effect based on network pharmacology and molecular docking
JIANG Wen, YE Chen, HU Man, LIU Yu-cai, ZHANG Yan, LIANG Ji-chao, CHEN Yong
National & Local Joint Engineering Resarch Center of High-throughput Drug Screening Technology, Hubei Key Laboratory of Biotechnology of Chinese Traditional Medicine, State Key Laboratory of Biocatalysis and Enzyme Engineering, School of Life Sciences, Hubei University, Wuhan 430062, China
To explore the potential mechanism of triterpenoids fromagainst liver fibrosis based on network pharmacology and molecular docking method.According to database screening and literature investigation, eight active components fromtriterpenes were selected as research objects, and their action targets were predicted by Swiss Target Prediction network platform, targets related to liver fibrosis were obtained through GeneCards and OMIM databases, and “active ingredients-anti-liver fibrosis targets” network was constructed by Cytoscape 3.7.2 software; Protein-protein interaction (PPI) analysis was carried out by String platform, PPI network diagram was constructed by Cytoscape 3.7.2 software, key targets were screened by degree value, node tightness and node degree. Gene ontology (GO) function and Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis on anti-liver fibrosis targets oftriterpenes were carried out by DAVID database; AutoDock software was used for molecular docking between core components and key targets; Effect of acetyl alisol C on nitric oxide (NO) levels in supernatant of NCTC-1469 cells induced by oleic acid and palmitic acid was investigated.Eight active components oftriterpenes including alisol A 24-acetate, alisol B, alisol B monoacetate, 16β-methoxyalisol B monoacetate, alisol C, alisol C monoacetate, alisolides D and 25--methyalisol F were obtained. Thirty-five anti-liver fibrosis targets were predicted, four core components including alisol B monoacetate, 16β-methoxy alisol B monoacetate, alisol C and alisol C monoacetate and four key targets including protein kinase Cα (PRKCA), mitogen-activated protein kinase 1 (MAPK1), phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit γ (PIK3CG) and MAPK8 were selected. GO enrichment analysis revealed 142 GO functional entries and 69 pathways (< 0.05). Results of molecular docking showed that core components displayed strong binding abilities with key targets respectively. Network pharmacological analysis showed thattriterpenoids played an anti-hepatic fibrosis role through lipopolysaccharide reaction, apoptosis and other biological processes, as well as tumor necrosis factor (TNF), phosphatidylinositol 3-kinase (PI3K)/protein kinase B (Akt), MAPK and other signal pathways. Results of cell experimentsshowed that NO content in liver injury cell model was decreased after treatment with alisol C monoacetate (< 0.05).Active components oftriterpenes such as alisol B monoacetate, 16β-methoxy alisol B monoacetate, alisol C and alisol C monoacetate may play an anti-liver fibrosis effect by regulating MAPK, PI3K/Akt and other signaling pathways.
triterpenes; liver fibrosis; network pharmacology; alisol B monoacetate; 16β-methoxy alisol B monoacetate; alisol C; alisol C monoacetate
R285.5
A
0253 - 2670(2022)04 - 1100 - 12
10.7501/j.issn.0253-2670.2022.04.017
2021-10-20
大学生创新创业训练计划项目(X202010512076,X202010512072)
江 雯,女,博士研究生,研究方向为微生物与生化药学。Tel: 15972013245 E-mail: jiangwenhubu@gmail.com
梁继超,男,硕士生导师,副教授,主要从事分子药理学研究。Tel: (027)88663882 E-mail: liang529114@163.com
陈 勇,男,博士生导师,教授,主要从事分子药理学和药动学研究。Tel: (027)88663590 E-mail: cy101610@qq.com
[责任编辑 李亚楠]
