丛生盔形珊瑚共生体及骨骼的形态研究
2022-02-22林镇跃陈建明
林镇跃,陈建明*
(1.闽江学院海洋研究院, 福建 福州 350108; 2.闽江学院福州市海洋生态养殖行业技术创新中心, 福建 福州 350108)
“共生”和“钙化”一直是珊瑚生物生态学研究中两个最核心的问题。珊瑚组织由内胚层和外胚层组成:虫黄藻共生于内胚层,而外胚层主要涉及与外部环境的化合物交换和珊瑚骨架的形成[1]。虫黄藻是由珊瑚胃真皮细胞通过吞噬作用获得的,从而形成一个称为“共生体”,由细胞内膜及囊泡封闭的结构,宿主的共生体膜与藻类的细胞膜逐渐成熟并融合形成了一个共生体膜复合体[2]。目前我们认为,共生体膜主要起源于宿主质膜,既可以防止宿主溶酶体对内共生虫黄藻的消化,又可以通过它与虫黄藻相互作用。国内尚缺少关于共生珊瑚细胞微结构和功能的研究工作,但了解珊瑚细胞生物学方面的知识对于预测珊瑚应对环境变化的反应至关重要。
石珊瑚如何以文石的形式沉积碳酸钙骨架,近一个世纪以来一直被广泛讨论,但没有形成明确的共识。有两种普遍的假说:地球化学家通常主张一个以物理化学为主的机制,是基于珊瑚钙化部位内部的化学控制;而生物学家则主张另一种由生物控制的机制,认为珊瑚通过分泌骨骼有机基质(Skeletal Organic Matrix, SOM)调节或者控制矿物质的沉积过程。支持第一种假说的依据有:提高钙化位点的海水pH,或者提高钙离子和无机碳浓度,可以产生适合矿化晶体形成的稳态条件[3]。支撑第二种假说的依据认为:SOM特别是富酸蛋白诱导粒子附着和晶体生长,并聚集形成有序的文石结构,即使在pH较低、不利于文石沉积的条件下,石珊瑚仍可以维持钙化。本研究通过扫描电镜研究丛生盔形珊瑚(Galaxeafascicularis)骨骼的微观结构,并利用电感耦合等离子体质谱(Inductively Coupled Plasma Mass Spectrometry, ICP-MS)分析珊瑚骨骼的微量元素形态,这些数据加深了对珊瑚骨架的空间结构和成分组成的了解,有助于阐明珊瑚的矿化机制。
1 材料和方法
1.1 材料
丛生盔形珊瑚样品于2015年6—8月采集自海南文昌海域,部分采集的珊瑚养殖于实验室的循环海水水族箱条件下(25 ℃,平均pH 8.15,盐度35)。珊瑚养殖使用hqi-10000 K金属卤化物灯提供有效光辐射强度(PAR)为180 μmol/(m2·s-1),光周期是L∶D=12 h∶12 h。
1.2 方法
1.2.1 珊瑚共生体的观察 用剪刀取新鲜的珊瑚触手组织,经DAPI染色后置于TCS SP5 II型激光共聚焦显微镜(Leica,德国)观察珊瑚与共生虫黄藻。珊瑚触手组织经聚合树脂包埋切片,利用JEM-1230型透射电镜(JEOL,日本)观察珊瑚与共生虫黄藻的亚细胞结构。将组织块切成小于1 mm3,用2.5%(质量分数)的戊二醛和1.0%(质量分数)的锷酸固定。后用10%~90%(体积分数)的乙醇逐级脱水,每级30 min,最后用无水乙醇脱水3次,样品放置于干燥器中脱水。再先用树脂∶酒精=1∶3 (体积比,下同)渗透6 h,后用树脂∶酒精=3∶1渗透过夜,最后纯树脂包埋3 h并置于60 ℃烘箱中1~2 d。超薄切片后镜检。
1.2.2 珊瑚骨骼形态的观察 珊瑚触手组织和骨骼[图1(a)、(b)]先用蒸馏水涮洗去除残余有机质,去除表面吸附物。将切好的珊瑚触手组织和骨骼样品经E-1010型离子溅射仪(Hitachi,日本)在高真空模式下喷金90 s后于30 kV高压进行FEI Quanta 450型扫描电镜(FEG,美国)观察珊瑚骨骼样品表面和内部微结构。
1.2.3 珊瑚骨骼元素成分分析 取部分珊瑚骨骼进行粉碎,过100 目筛后。称取约0.3 g样品,将样品置于消解管中,分别加入5 cm365%(体积分数)的浓硝酸和2 cm330%(体积分数)的H2O2,然后置于微波消解仪中进行消解。消解后,放入电加热器中于160 ℃进行赶酸,再转移至10 cm3容量瓶中,并用2%(体积分数)的硝酸溶液定容。之后放入ICP-MS (Thermo Fisher,美国)中测定元素含量,并选用相关内标元素做标准曲线和定量计算。以上实验均在自然资源部第三海洋研究所科学仪器共享平台完成。
2 结果与讨论
2.1 丛生盔形珊瑚共生体的显微结构
通过激光共聚焦显微镜观察珊瑚触手息肉组织,共生虫黄藻主要分布于珊瑚的内、外表皮细胞,有利于充分利用光源,估算细胞密度约为1×104~3×104虫黄藻细胞/mm2(图1)。通过透射电镜观察珊瑚触手息肉组织,外胚层上皮细胞含有大量横纹肌细胞及刺细胞。刺细胞大小约为2 μm×3 μm,内含有不同长度、细长盘卷的刺丝。此外,还有分泌细胞(腺细胞)及间细胞。分泌细胞暗色不透明、密度均匀,含细胞核并有细小的微纤结构。胞内含有大量的分泌颗粒,有的分泌出囊泡,容易识别。间细胞是一些小型、圆形的细胞,单独或成堆分布,并有较大的细胞核,主要分布于分泌细胞中间,或者间细胞经过分化形成分泌细胞(图2)。

图1 丛生盔形珊瑚共生体与骨骼的形态结构Fig. 1 Morphological structures of coral symbiot and skeletons of G. fascicularis(a)为丛生盔形珊瑚单体及触手照片;(b)为骨骼形态照片;(c)为显微镜观察的珊瑚组织;(d)为激光共聚焦显微镜观察的珊瑚组织,蓝色为DAPI染色,红色为虫黄藻自发荧光。
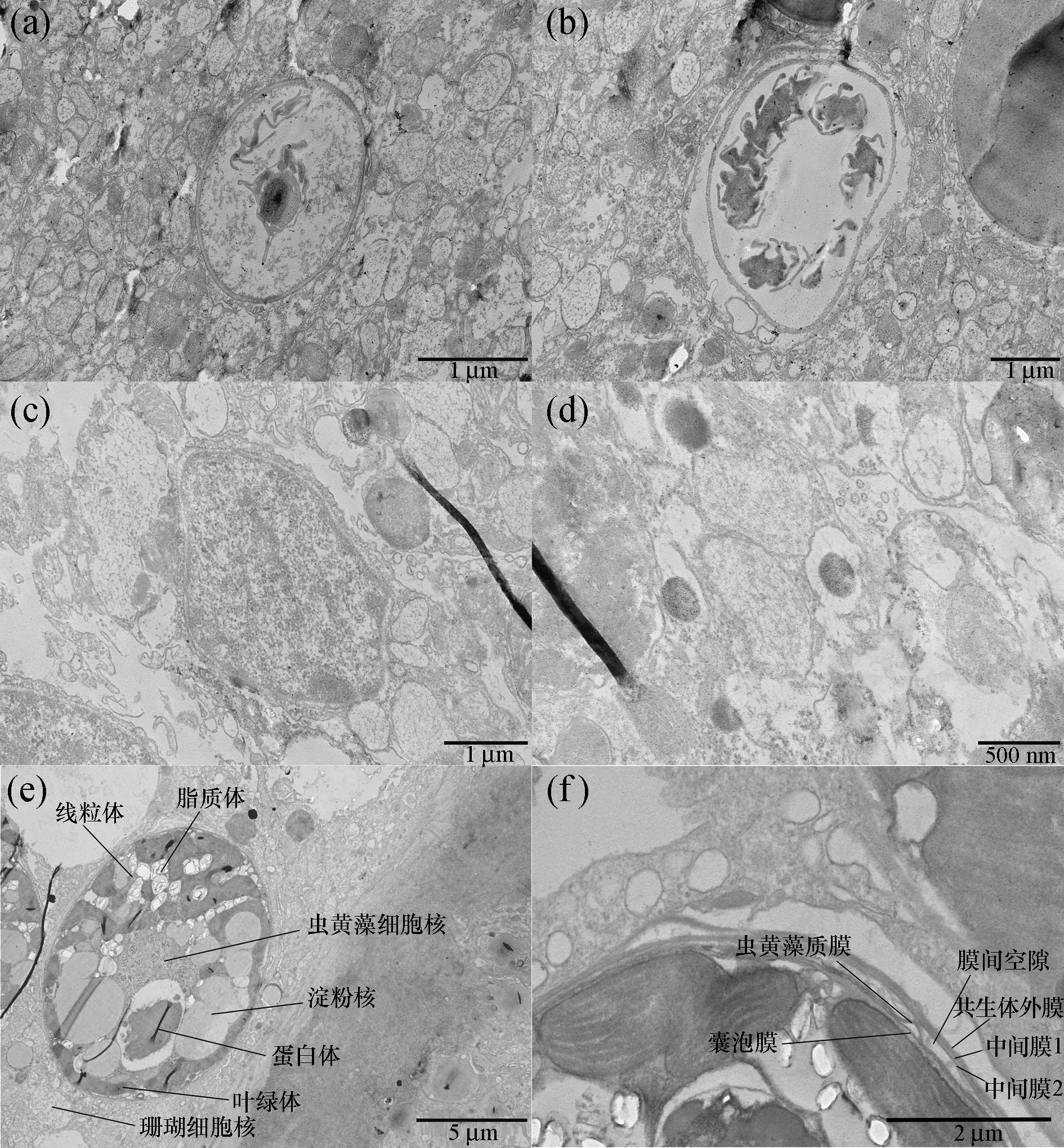
图2 透射电镜观察的珊瑚组织及细胞结构Fig. 2 Coral tissue and cell structures under TEM(a)、(b)为外皮肌细胞及刺丝囊细胞,(c)、(d)为黏液分泌细胞及单核的黏液变细胞,(e)、(f)为内共生虫黄藻细胞的亚显微结构。
一般情况下,不在分裂状态的虫黄藻呈球状被珊瑚宿主的表皮细胞单独包裹,能明显观察到珊瑚及虫黄藻的几种细胞质成分。虫黄藻的细胞核形态不规则,多位于藻细胞中心,由几条黑色浓缩染色体组成。淀粉核呈椭圆形,一般连接叶绿体,或者淀粉核被叶绿体所覆盖。蛋白体较大而呈泡状,在每个藻细胞中数量为一到两个。线粒体呈梭形或细长棒状结构,具有褶皱状的嵴,嵴分布于双层膜隔膜内。脂质体呈囊泡状,并非所有细胞都含有脂质体。叶绿体主要分布在细胞周围,呈分叶状结构,含有片状结构类囊体,通常呈平行排列。用透射电镜可以清楚地观察到珊瑚共生体膜的完整结构。虫黄藻的细胞质由藻的质膜和细胞壁所包围,又被多层宿主衍生的膜复合体所包围[图2(f)]。在靠近虫黄藻叶绿体的是一层不连续、扁平的囊泡膜,其厚度约为19~80 nm,长度可达1 400 nm或更长。虫黄藻质膜约6~7 nm厚,是包含细胞质的最内层膜,呈弯曲的形状。膜间空隙具有均匀厚度,与膜间空隙边界紧邻的是两层宿主衍生的中间膜结构,分别为中间膜1和中间膜2,这两层膜有时分界不明显。在整个共生体膜系统的最外层是由宿主衍生的、较厚的共生体外膜,呈波浪状结构。通过显微观察,我们确定珊瑚共生体的外膜层和内膜层分别起源于宿主细胞和虫黄藻细胞,共生体之间的所有营养物质的转运必须通过共生体外膜层和内膜层,这对于虫黄藻和宿主之间的代谢相互作用至关重要。虽然我们对珊瑚共生体膜结构有了进一步的了解,但是共生体膜的分子组成及代谢物是如何通过共生体膜进行交换运输,这些细节我们还不得而知。
一些虫黄藻的典型细胞结构特征,例如染色体呈高度浓缩的细胞核、叶状环绕细胞的叶绿体、巨大的淀粉核及蛋白体等在游离的虫黄藻中也可以观察到,但是游离的虫黄藻缺乏共生体结构。内共生虫黄藻位于宿主内胚层细胞内的共生体中,因此,共生体也被定义为宿主和虫黄藻细胞衍生的多层膜复合体,介于共生体内、外膜之间的膜间空隙,被认为是宿主和虫黄藻的边界。有时能够观察到共生体膜内陷或者卷曲的现象,这可能与共生虫黄藻的分裂有关[2]。与游离的虫黄藻不同,内共生的虫黄藻生活于高渗透压的珊瑚细胞环境中,而这种共生体的空间结构可以支持二氧化碳、碳酸氢盐离子和营养物质在宿主和藻细胞的扩散和迁移,同时共生体膜也可以防止珊瑚细胞的内消化作用。然而,应该指出的是共生体膜具有分子识别的机制,不能阻断光合作用产物和宿主释放因子的输送。最近有研究表明珊瑚共生体腔的pH范围接近4.0,远远低于宿主细胞和藻细胞的pH(7.1~7.4),其低pH环境创造了共生体膜与珊瑚细胞或藻细胞质膜之间强烈的质子梯度,可以促进宿主和虫黄藻之间的代谢物交换[1]。在胁迫条件下,共生体的形态发生变化,包括细胞的收缩、液泡化的增加,类囊体的无序和松散等。例如高温(34 ℃)下,将导致藻细胞变小,细胞质与细胞器融合,形成较大的细胞器体,最后共生体膜破裂,虫黄藻细胞进入凋亡[5]。虽然对珊瑚共生体的细胞结构有了进一步的认识,但对共生体确切的细胞功能和响应机制还知之甚少,这对理解珊瑚宿主与虫黄藻的共生关系及其生物相互作用至关重要,将有助于揭开珊瑚生长和功能障碍(白化)背后的生化过程。
2.2 丛生盔形珊瑚的表皮组织结构
利用扫描电镜观察珊瑚触手息肉组织的表面及外皮层结构(图3)。珊瑚的体壁由一层厚厚的表皮细胞(由黏液细胞和表皮支持细胞组成)和一层由中胚层分化的胃真皮细胞组成。扩张触手组织表面最突出的特征是表皮细胞的绒毛突出,黏液细胞分泌的大量黏液遮住或者包裹表面的微绒毛。正面观察表皮细胞,黏液紧密覆盖于外表面,形成质密呈网状结构的薄层,表皮层上还分布一些类似于弹孔的形状,孔隙直径达0~3 μm,推测这些孔隙是由表皮细胞附着的虫黄藻或者微生物脱落而留下的。通过扫描电镜图片观察,体壁表面具有一定的流动性,大量微生物和虫黄藻贴附在珊瑚黏液细胞层的外表面。从上表皮层断裂的样品中,可清楚观察外皮层的表面形态,其厚度接近50 μm。内皮层细胞间边界明显可见,但这些细胞内没有纤毛和微绒毛,内皮层细胞排列紧密,镶嵌大量虫黄藻细胞。共生虫黄藻除了主要被包裹于珊瑚内表皮细胞,在珊瑚外表皮黏液细胞同样也附着大量虫黄藻,本研究推测珊瑚外表皮具有分泌黏液及流动性的特征,可能与虫黄藻和微生物的穿梭有直接关系。

图3 珊瑚组织的扫描电镜观察Fig. 3 Coral tissue under SEM(a)、(b)为珊瑚外表皮的形态特征,(c)、(d)为附着于珊瑚外表皮的虫黄藻,(e)、(f)为内共生虫黄藻的空间结构。
黏液细胞是珊瑚表皮的一种优势细胞类型,这有利于附着微生物(包括虫黄藻),促进微生物群落在珊瑚的表皮上繁殖,增加珊瑚皮层厚度,丰富微生物种群。珊瑚表皮黏液除了通过招募海水中活动的微生物,还将促进微生物的原位生长来补充珊瑚的微生物群体,而体表微生物所需的养分来源于表皮下面的珊瑚组织。珊瑚的外表皮作为阻隔海水的物理屏障,然而扫描电镜下观察到珊瑚表皮存在孔隙,这可能更有利于营养物质的横向运输。研究表明,黏液细胞一般有两种类型,一类细胞是呈大而多角形的海绵包裹体;另一类细胞较小,并伴有较浓泡沫状分泌物的颗粒,这类细胞最容易被识别。黏液在挤压或胞吐过程中,囊泡与细胞膜融合,在不进行膜分离的情况下释放其内容物。另外还有以全细胞方式进行分泌,即整个细胞分解,再释放出细胞质和分泌物。甲苯胺蓝的组织化学反应表明,黏液细胞成分主要包括酸性或中性碳水化合物,例如多种黏多糖、蛋白质、碳水化合物和脂类等,其中多糖组分是黏液中的主要成分[4]。虽然对分泌黏液的成分和生化性质有了一定的了解,但其功能尚不十分清楚。在珊瑚中黏液除了与捕食有关外,还可能参与体外消化,清除沉积物,防止体表的干燥和紫外线辐射损伤,提高珊瑚对盐度和温度变化的抵抗力。
2.3 丛生盔形珊瑚骨骼显微结构及金属元素形态特征
珊瑚骨骼连接反口的外胚层,又称为钙基外胚层,其生长的钙基细胞表面与骨骼完全相互融合。钙基细胞分泌SOM,并控制钙离子流通最终形成纤维状的文石骨架[11]。从扫描电镜观察(图4)来看,丛生盔形珊瑚单体骨骼呈杯状结构,杯直径约1.0~6.0 mm,深度在0.5~8.0 mm之间。单体骨架发育有两轮不完全的隔壁和裂片,隔壁和裂片从底板向上隆起呈放射状垂直排列,并微凸于体壁之外,轴柱不明显。横截面观察裂片呈不均匀分布;隔壁呈锯齿状,表面不平滑附有类似疙瘩状的凸起。纵剖面观察,能看到横向鳞板,与隔壁垂直交错排列构成独立的隔间腔,鳞板厚度和隔间腔大小不一,隔间腔内分布有呈三角钉状的水镁石晶体。扫描电镜观察了珊瑚骨骼早期矿化中心(Early Mineralized Center, EMC)和隔壁辐射出的文石结构,文石骨架由连续的文石质结晶纤维和晶粒有规则的堆积叠加形成。在有些样品中的鳞板上发现有少量方解石矿物晶体和文石晶簇存在,方解石矿物晶体形状为立方体状,文石针晶主要呈簇状排布。总体来说,碳酸钙与SOM的结晶度在珊瑚骨架中的分布并不均匀,相比隔壁,EMC具有较高的SOM含量,结构更加密实[图4(f)]。这些观察表明,珊瑚通过分泌合成SOM诱导粒子附着,随着碳酸盐晶体生长进一步堆积形成骨架,因此,SOM对于珊瑚钙化过程是至关重要的,支持珊瑚矿化过程的生物调控观点。

图4 丛生盔型珊瑚骨骼内部结构特征Fig. 4 Internal structure features of the coral G. fascicularis(a)为珊瑚单体,(b)为珊瑚单体横截面,(c)为隔壁的显微结构,(d)为珊瑚单体纵截面,(e)为针状水镁石晶体,(f)、(g)为矿化晶粒的形态及大小,(h)、(i)为文石质骨骼纤维,(j)至(l)为方解石和文石碳酸盐晶体。
在珊瑚骨架的微观结构上,发现EMC的骨骼更加结实,说明其具有较高钙化速率[6]。目前还不清楚珊瑚骨骼最初的矿化是由细胞内的囊泡直接分泌形成,还是由外胚层钙基细胞在胞外钙化形成。然而,骨骼的扫描电镜分析揭示碳酸钙前体纳米粒子沉积时富集大量珊瑚分泌的SOM,有研究表明SOM前体蛋白在初级结构上极其多样,既有酸性蛋白质也有碱性蛋白质,其中酸性蛋白质富含天冬氨酸,从数量上看,富含天冬氨酸蛋白在骨骼基质中占主导地位,这类富含酸性的蛋白质可直接从海水中沉淀碳酸钙,并以纤维化形式构成文石晶体[7]。此外,阿拉伯糖在SOM中也有相当大的富集,这与珊瑚表皮细胞黏液组分一致。SOM在不同石珊瑚种中所占质量的比重介于0.1%~0.3%之间,例如在鹿角珊瑚(A.digitifera)中,SOM的浓度约为0.2%[8]。SOM对碳酸钙体外结晶也有很大的影响,在高浓度SOM(10~20 mg/mm3)下,晶体的形貌发生了很大的变化[9]。本研究支持珊瑚矿化过程的生物调控观点,生物矿化的过程是相对稳态的[7],不限于各种理化参数(例如碳酸盐离子饱和状态或海水的pH等)的控制,珊瑚自身也能够加大钙化代谢的潜力以应对未来的海洋气候变化,如热胁迫、富营养化和海洋pH降低等威胁[10-11]。
2.4 丛生盔形珊瑚骨骼的金属元素形态特征
丛生盔形珊瑚骨骼的各金属元素形态数据如图5所示。从图5可以看出,各种元素在丛生盔形珊瑚骨骼中的含量具有较大的差别。含量最高的是44Ca和43Ca,分别为3 038.90、1 914.62 ng/g,其次为23Na(776.43 ng/g)、88Sr(229.73 ng/g)、27Al(118.70 ng/g),含量均高于100.00 ng/g。含量较高的金属元素还有39K、66Zn、56Fe、11B、137Ba,含量均高于10.00 ng/g,其他的金属元素含量均低于10.00 ng/g。目前,对珊瑚文石中钙离子的矿化过程有较为深入的认识[12-13],而其他金属元素的矿化吸收过程还尚不清楚[14]。有研究认为,珊瑚生长速率等生物因素可能影响骨骼中的微量元素吸收[15],例如通过温度和光照处理提高钙化速率时,骨骼中的Mg/Ca比值相应升高;骨骼中的Sr/Ca比值却对光照不敏感,而水温才是控制Sr/Ca比值的主要因素[16]。珊瑚骨骼中某些金属元素含量的比值与海水环境参数具有相关性,记录了珊瑚生长的历史环境[17]。古温标参数(Sr/Ca、Mg/Ca、U/Ca)经常用于推测历史时期的珊瑚生长率与钙化率,这可能是由于钙泵对钙离子以外的金属亲和力不高,而且钙泵的活力对温度较为敏感,因此新生骨骼中的Sr/Ca比值容易受温度影响[18]。此外,河流排放物、海洋上升流、河流的注入量及近岸降雨量等因素也会影响珊瑚对海水中微量金属(如Ba、Zn等)的吸收[19];珊瑚骨骼中的重金属元素如Cd、Pb、Mn也可用于示踪海洋的污染状况[20]。未来开展珊瑚骨骼微量元素与海洋环境参数的相互作用研究,将有助于进一步探讨珊瑚生物钙化的环境效应。
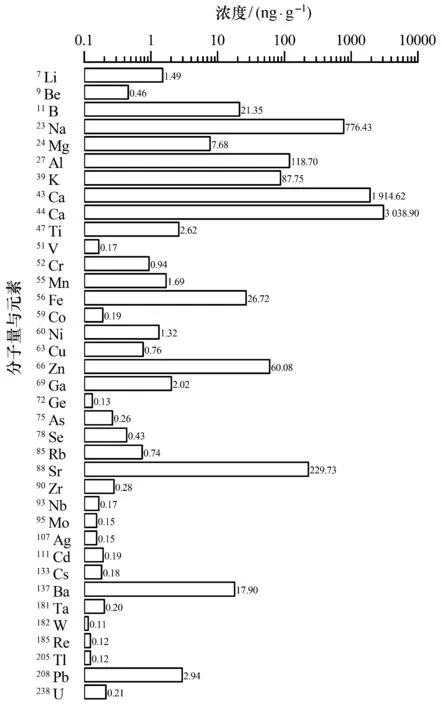
图5 珊瑚骨骼中金属元素形态分析测定结果Fig. 5 Results of speciation analysis of metal elements in skeleton of G. fascicularis
3 结论
丛生盔形珊瑚广泛分布于我国南海海域,并对环境变化和压力胁迫具有一定的抗逆性,可作为研究珊瑚“生物钙化”和“共生互作”等方面的一个重要模式生物。为加深对其认识,本研究通过透射电镜和扫描电镜研究了丛生盔形珊瑚共生体的细胞显微结构及骨骼的形态特征,获得了如下结论:
珊瑚共生体的外膜层和内膜层分别起源于宿主细胞和虫黄藻细胞,珊瑚共生体膜的复杂结构对“珊瑚-虫黄藻”的代谢物交换和生物相互作用具有重要意义。珊瑚外皮细胞可分泌大量的黏液而且体壁表面具有一定的流动性,可能与共生虫黄藻和微生物的穿梭有直接的关系。另外,珊瑚的骨骼显微结构表明,SOM的分泌对于钙化晶体和骨架纤维的形成至关重要,支持了珊瑚矿化的生物调控观点。
