不同接种密度条件下海洋酸化对坛紫菜叶状体的生理生态影响
2022-02-22田莹莹王文磊纪德华陈昌生谢潮添
田莹莹,许 凯,王文磊,徐 燕,纪德华,陈昌生,谢潮添
(集美大学水产学院,福建 厦门361021)
海洋占地球表面积的71%,是全球地表系统中最大的碳库,能大量吸收人类活动释放的CO2[1]。由于工业的快速发展,预计从当前到本世纪末,大气中CO2的浓度将从400×10-6升高到800×10-6~1 000×10-6,从而导致表层海水平均pH值将下降0.3~0.4,这种现象被称为海洋酸化[2-4]。近岸海洋酸化明显与外海不同,近岸海区生物量一般较高,光合作用和呼吸作用导致海水pH和CO2浓度出现明显的昼夜波动;而外海一般生物量较低,海水pH和CO2浓度基本维持稳定[5-8]。野生和栽培大型海藻广泛分布于近海潮间带及潮下带区域,是近海生态系统的重要组分。随着大气CO2浓度的不断提升,海洋酸化对大型海藻的生理生态效应得到了越来越多的关注。
坛紫菜(Pyropiahaitanensis)是一种生长在潮间带的大型红藻,在我国东南沿海均有分布,因其营养价值和化工医药价值,已成为我国主要的栽培海藻[9]。在福建沿海潮间带,坛紫菜主要附着生长在岩礁上,在平潭岛、东山岛等保护良好的区域形成天然藻场。野生坛紫菜完成一个生活史需要1 a,其单位生物量随生活史而周期性变化。而栽培坛紫菜的单位生物量主要受栽培密度和采收的影响,一般内湾区域栽培密度高,而开放海域则密度较低;采收前生物量高,采收后生物量低。研究表明,大型海藻密度受光条件、营养盐浓度、pH等物理化学因素的显著影响,进而会影响大型海藻的生理生态表现[10-12]。而且,随藻类生物量的提高,光合作用和呼吸作用导致的海水pH和CO2浓度的昼夜波动幅度也将加大[5-8]。
在以往的坛紫菜应答海洋酸化的研究中,一般通过维持较低的生物量以确保pH恒定,即模拟稳定的海洋酸化对坛紫菜的影响[13-14],这显然与真实养殖情况不符。本研究中,通过接种长约1 cm的坛紫菜幼苗培养15 d,模拟随生物量增长出现pH昼夜波动,进而更真实地反映海洋酸化对坛紫菜的生理生态影响,旨在探究海洋酸化对栽培坛紫菜的生长和碳收支的影响。
1 材料与方法
1.1 实验材料
本研究的实验材料为由集美大学选育的坛紫菜品系W-28的叶状体。
1.2 实验设计
选取健康的坛紫菜幼嫩叶状体(长度约1 cm),将藻体置于1 dm3的培养基中,连续充气培养15 d,模拟坛紫菜在自然海区中从幼苗长大为成菜的养殖过程。用过滤灭菌后的天然海水配制的PES(Provasoli’s Enriched Seawater)培养基[15]培养叶状体。坛紫菜的接种密度分为两种:低接种密度(1株/dm3)和高接种密度(3株/dm3)。所充空气的CO2浓度有两种:自然空气和CO2浓度为1 000×10-6的空气。共设计4个处理组,每个处理组设置4个重复:①LD-LC:低接种密度培养-充自然空气;②HD-LC:高接种密度培养-充自然空气;③LD-HC:低接种密度培养-充高CO2浓度空气;④HD-HC:高接种密度培养-充高CO2浓度空气。自然空气采自室外,高CO2浓度为1 000×10-6的空气购自弘华工业气体有限公司,由纯CO2与自然空气混合而成。以上各处理组的通气流量均设定为300 mL/min,培养基更换前都预先充气24 h,使培养基中的CO2浓度达到预设处理浓度。
实验在温度为(21.0±0.5)℃的环境中进行,光照周期为L∶D=12∶12,光照时间为7:00—19:00,光照强度为2 778 lx。
培养过程中对培养基pH的昼夜变化和海水碳酸盐系统的变化进行监测。在第2、5、8、11、13和14天的7:00和19:00测定pH,监测培养过程中培养基pH的昼夜变化。培养过程中为防止坛紫菜的生长受养分的限制,在每隔3 d的15:00更换新鲜培养基,并用自动电位滴定仪(Mettler-Toledo G20,Switzerland)测定更换下来的培养基的pH与总碱度(TA)。根据培养基的pH和TA,利用CO2SYS软件计算海水碳酸盐化学参数[16]。
1.3 实验方法
1.3.1 比生长速率的测定 比生长速率是通过测定干重的变化来获得的。计算公式如下:
μ=ln(DW15/DW0)/15
(1)
式(1)中:μ表示比生长速率(d-1),DW0和DW15分别表示藻体的初始干重(mg)和最终干重(mg)。
1.3.2 最大光化学量子产量的测定 测定前将坛紫菜样品暗处理15~20 min,然后用DIVING-PAM(Walz,德国)测定光系统II的最大光化学量子产量(Fv/Fm)。
1.3.3 色素的测定 叶绿素a(Chl-a)参照Jensen(1978)的测定方法[17]。4 ℃下将约0.01 g的新鲜藻体在体积分数为90%的丙酮中充分研磨。将研磨液4 ℃避光放置24 h后,离心(7 296 r/min,4 ℃)20 min,取上清液测定提取物在666 nm和730 nm波长下的吸光度。计算公式如下:
CChl-a=(A666-A730)×10/890
(2)
式(2)中:CChl-a表示叶绿素a含量(mg/g),A666、A730分别表示在666、730 nm波长下的吸光度。
藻胆蛋白的取样和测定方法参照文献[18-19],4 ℃下将约0.01 g的新鲜藻体在磷酸缓冲液(pH 6.8)中充分研磨。将研磨液放入冰箱冷冻(-20 ℃),然后室温避光解冻,至少冻融6次后,于4 ℃下避光放置12 h。4 ℃下7 296 r/min离心15 min后,取上清液测定提取物在565、615、650、730 nm波长下的吸光度。计算公式如下。
CPE=0.123(A565-A730)-0.068(A615-A730)
+0.015(A650-A730)
(3)
CPC=0.162(A615-A730)-0.001(A565-A730)
-0.098(A650-A730)
(4)
CAPC=0.171(A650-A730)-0.006(A565-A730)
-0.004(A615-A730)
(5)
式(3)至(5)中:CPE、CPC和CAPC分别表示藻红蛋白含量(mg/g)、藻蓝蛋白含量(mg/g)和别藻蓝蛋白含量(mg/g),A565、A615、A650、A730分别表示在565、615、650、730 nm波长下的吸光度。
1.3.4 总蛋白的测定 将干燥的坛紫菜样品用液氮研磨粉碎,置于冰上,加入包含蛋白酶抑制剂和磷酸酶抑制剂的NP40裂解液(北京索莱宝)对组织细胞进行充分裂解。然后转移至离心管中于4 ℃下11 303 r/min离心15 min。取上清液,得到蛋白质样品,再使用BCA试剂盒(北京索莱宝)测定蛋白浓度。
1.3.5 坛紫菜组织中碳、氮和磷的测定 培养15 d后,将坛紫菜用纱布吸干表面水分,称量鲜重,然后在55 ℃下烘48 h至恒重,计算含水率。干燥的藻体粉碎后置于恒温干燥器内备用。用元素分析仪(Costech,美国)测定组织碳(C)和氮(N)含量,参考Solórzano等(1980)提出的方法[20]测定组织磷(P)含量。
1.3.6 溶解有机碳和颗粒有机碳的测定 每隔3 d更换培养基时,将培养液用孔径0.7 μm、直径25 mm的GF/F玻璃纤维膜(450 ℃灼烧4 h)过滤,收集颗粒有机碳(POC)和溶解有机碳(DOC)样品。过滤后的水样用于检测DOC,GF/F膜用于检测POC。将GF/F膜放于55 ℃烘箱中烘干,再置于恒温干燥箱内备用。用元素分析仪测定POC。使用总有机碳分析仪(TOC5000A,日本岛津)测定DOC。根据藻体释放的DOC和POC以及藻体组织中碳质量计算藻体固定的总碳(TC)。计算公式如下:
MTC=Mtissue+MDOC+MPOC
(6)
式(6)中:MTC表示藻体固定的总碳质量(mg),Mtissue表示藻体组织中的碳质量(mg),MDOC表示溶解有机碳释放量(mg),MPOC表示颗粒有机碳释放量(mg)。
1.4 数据分析
使用Excel 2016进行数据处理,并使用SPSS 17.0软件中的单因素方差分析(One-Way ANOVA)进行数据分析。所有的实验数据均以平均值±标准差表示。显著和极显著差异水平分别设为p<0.05和p<0.01。
2 结果与讨论
2.1 海水碳酸盐系统
培养过程中,海水碳酸盐化学参数如表1所示,pH的昼夜变化如图1所示。在培养初期,LD-LC、HD-LC、LD-HC、HD-HC培养液的第3、第6和第9天的CO2浓度平均值分别为:(403.8±40.5)×10-6、(416.6±15.3)×10-6、(803.1±44.3)×10-6和(770.8±39.2)×10-6。充高CO2浓度空气导致培养基的pH显著降低,而CO2浓度则显著升高,但达不到1 000×10-6。在培养过程中,酸化处理组的pH总是小于充自然空气组的pH。培养过程的前12天,pH的昼夜变化不显著。第13、14天,LD-LC组的pH昼夜变化显著(p<0.05),HD-LC和HD-HC组的pH昼夜变化极显著(p<0.01),而LD-HC组的pH昼夜变化不显著(p>0.05)。培养后期,所有处理的CO2浓度均达不到预期值。
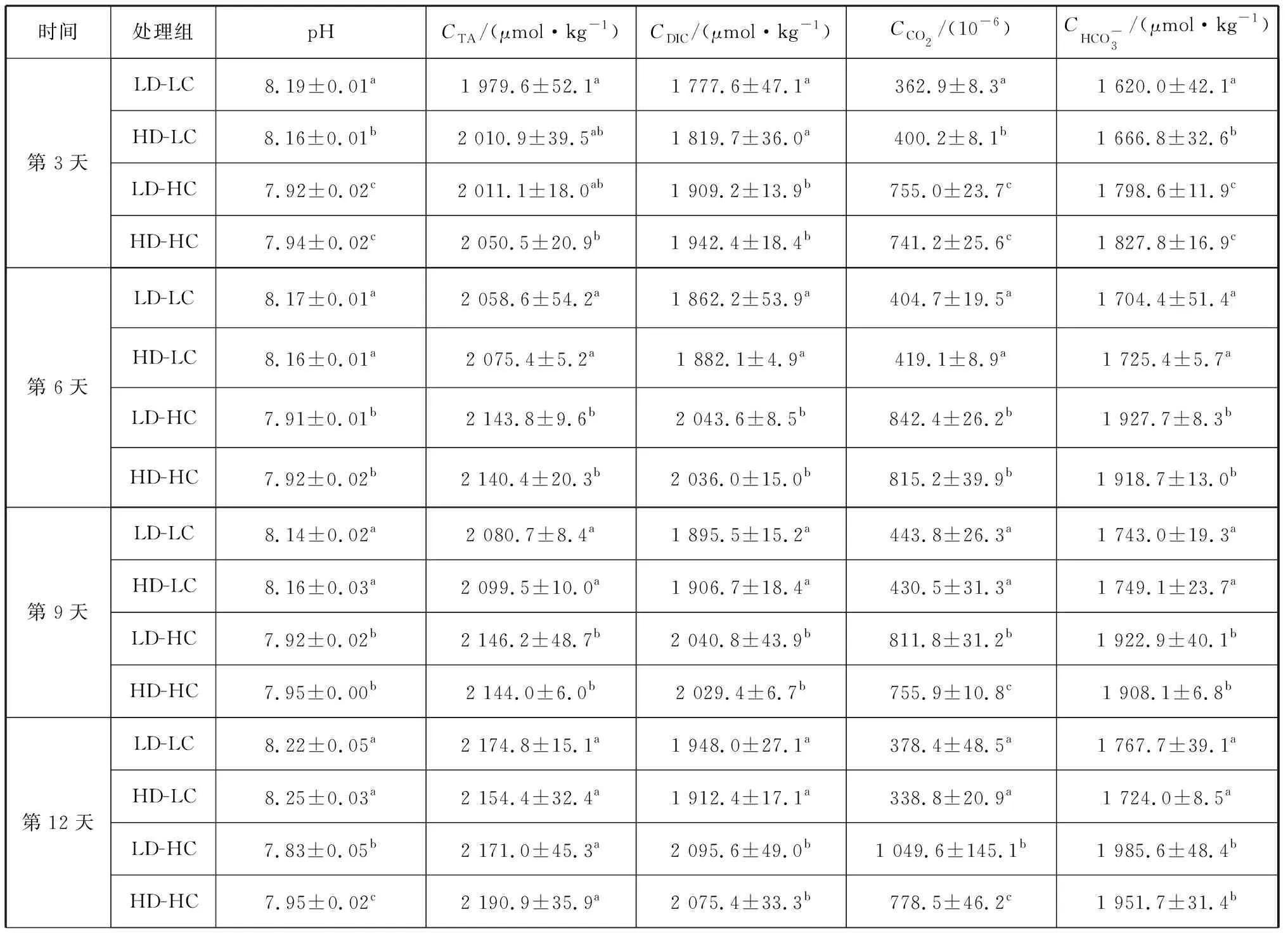
表1 培养期间的海水碳酸盐化学参数 Tab.1 Carbonate chemical parameters of seawater during incubation

续表

图1 坛紫菜培养基的pH昼夜变化Fig. 1 Diurnal changes in pH of the media for P. haitanensis culture图中灰色条带代表暗期,LC-LD表示充自然空气-低接种密度培养,LC-HD表示充自然空气-高接种密度培养,HC-LD表示充高CO2浓度空气-低接种密度培养,HC-HD表示充高CO2浓度空气-高接种密度培养。
2.2 坛紫菜的生长特性
低接种密度培养条件下,酸化处理对坛紫菜的生长有明显的抑制作用,使坛紫菜干重显著下降了33.3%[p<0.05,图2(a)]。高接种密度条件下,酸化处理极显著地促进了坛紫菜的生长,使坛紫菜干重增加了34.6%[p<0.01,图2(a)]。LD-HC组的比生长速率比LD-LC组低6.7%,而HD-HC组的比生长速率比HD-LC组高6.7%[p<0.01,图2(b)]。正常CO2条件下提高接种密度显著降低比生长速率达14.8%,而酸化处理下提高接种密度对坛紫菜的比生长速率无显著影响[图2(b)]。

图2 不同生长条件下坛紫菜的干重、比生长速率Fig. 2 Total dry weights and specific growth rates of P. haitanensis growing at different cultivation conditions图中上标无相同字母表示显著差异,下同。
2.3 叶绿素荧光参数
在两种CO2处理条件下坛紫菜的Fv/Fm值不随接种密度变化而发生变化。在两种接种密度条件下,酸化处理对Fv/Fm值没有显著影响(p>0.05,图3)。
2.4 色素含量
改变培养基内的CO2浓度和接种密度对坛紫菜的叶绿素a、藻红蛋白、藻蓝蛋白和别藻蓝蛋白的含量没有显著影响(p>0.05,图4)。
2.5 总蛋白含量
培养15 d后,用BCA蛋白检测试剂盒测定不同处理条件下坛紫菜的总蛋白含量。经显著性分析发现,酸化处理和接种密度对总蛋白含量无显著影响(p>0.05,图5)。
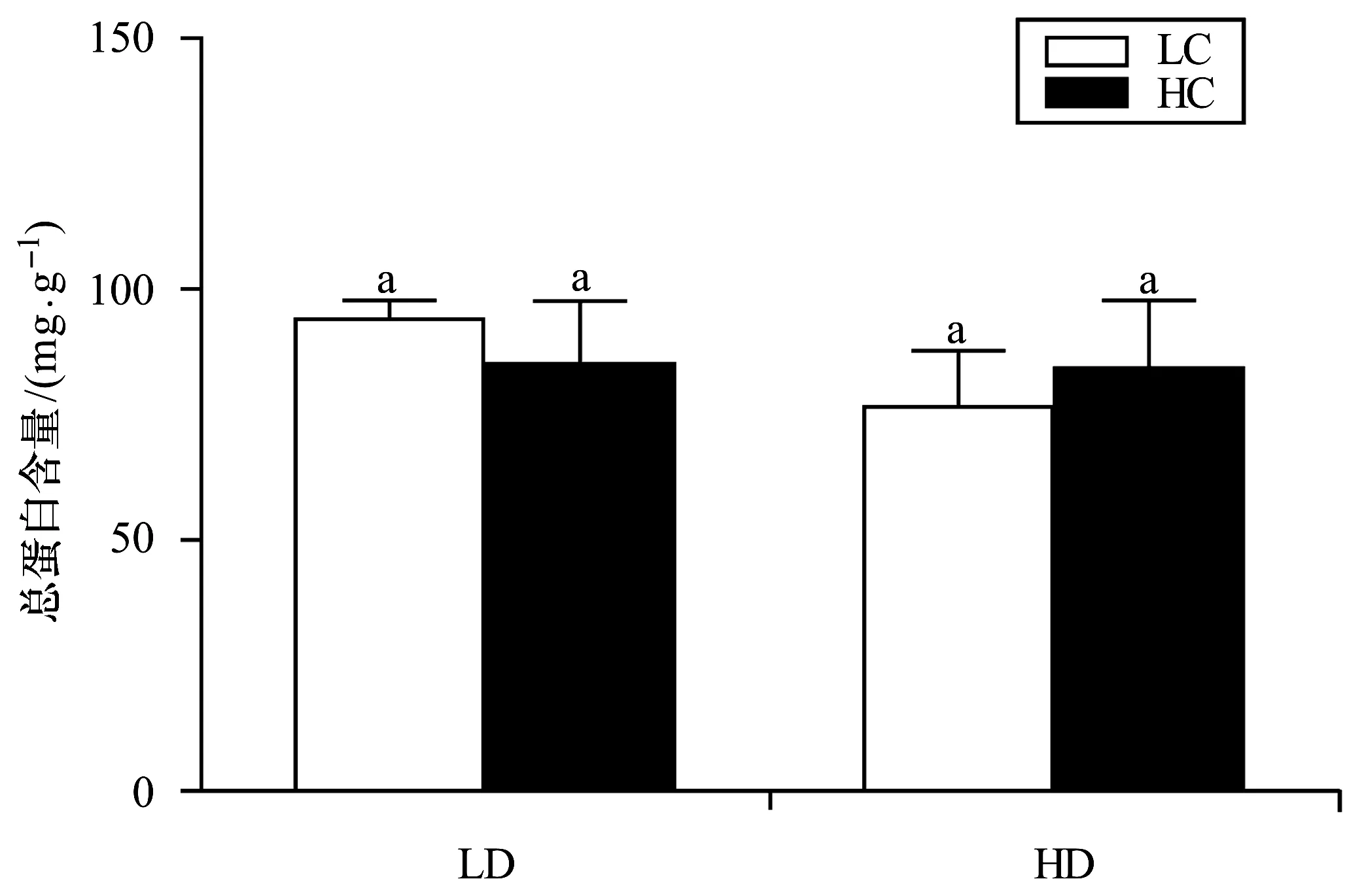
图5 不同生长条件下坛紫菜的总蛋白含量Fig.5 Total protein contents of P. haitanensis growing at different cultivation conditions
2.6 元素含量及其比例
从图6(a)至(c)可以看出,在两种接种密度条件下,酸化处理对坛紫菜组织中C、N、P的含量无显著影响(p>0.05)。从图6(d)至(f)可以看出,各处理条件下组织C/N比和C/P比略高于Redfield 比例,而组织N/P比接近Redfield N/P比(16∶1)。在低接种密度条件下,酸化处理对组织C/N比没有显著影响(p>0.05)。然而,在高密度条件下,酸化处理能显著提高组织C/N比[p<0.05,图6(d)]。
2.7 溶解性有机碳和颗粒有机碳
坛紫菜在培养过程中释放的DOC占固定TC的比例(MDOC/MTC)极显著地高于POC的所占比例(MPOC/MTC)(p<0.01,图7)。低接种密度条件下,酸化处理显著增加MDOC/MTC[p<0.05,图7(a)];对高接种密度培养的坛紫菜的MDOC/MTC没有显著影响(p>0.05)。在相同接种密度条件下,酸化处理使坛紫菜的MPOC/MTC显著降低[p<0.05,图7(b)]。
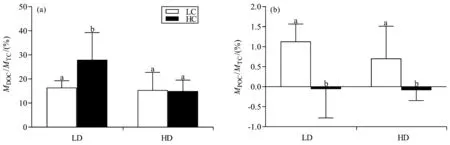
图7 不同生长条件下坛紫菜释放DOC和POC占藻体TC的比例Fig.7 Proportions of DOC and POC in the TC of P. haitanensis growing at different cultivation conditions
2.8 讨论
Fv/Fm是反映植物光合作用状态的敏感指标,当植物遭受逆境胁迫时会显著下降[21]。在本研究中,酸化处理和接种密度均对Fv/Fm没有显著影响,这表明坛紫菜叶状体的光合作用系统没有受到胁迫(图3)。此外,酸化处理和接种密度均对坛紫菜叶状体的色素和蛋白含量没有显著影响。生长是藻类各种生理活动的一个综合体现。本研究是从1 cm左右的小苗开始培养实验,这能更准确模拟海洋酸化对坛紫菜栽培的影响。本研究发现海洋酸化的效应取决于接种密度:低密度下抑制生长,而高密度下则促进生长[图2(b)]。此外,在充自然空气下提高密度对生长有抑制作用,而酸化处理下提高密度则没有显著影响。这表明海洋酸化和提高密度具有交互效应,但具体原因有待进一步研究。以往的研究也发现海洋酸化对坛紫菜生长速度的影响取决于生长密度、温度和营养盐等其他环境因素[14,22-24]。
坛紫菜是近海生态系统的重要组成部分,可通过光合作用吸收利用海水中的无机碳,具有缓解大气CO2浓度升高的作用。有研究表明,在生长过程中,海藻可吸收海水中的N、P等营养元素,可降低水体的富营养化程度,从而有效防止赤潮等自然灾害的发生[27]。因此,坛紫菜组织的C、N、P含量是反应大型海藻生态修复潜力的重要指标之一[28-29]。在本研究中,接种密度和酸化处理对坛紫菜叶状体的C、N、P含量都没有显著影响(图6),且数值与之前报道接近[30-31]。综合生长数据,说明低接种密度下酸化处理将显著降低坛紫菜叶状体去除C、N和P的能力。
大型海藻是海洋碳汇重要的组成部分。大型海藻固定的碳一部分被固定在藻体内,另一部分以POC和 DOC等形式释放到海洋中,共同构成了海洋碳循环系统[32-33]。DOC和POC的释放也是藻类主要的碳损失,被认为是一种能够对环境做出响应的调节机制,这种机制可以维持细胞的代谢完整性,并防止光系统受不能用于生长和生化组分存储的过量产物的影响,有研究表明海洋酸化会改变刺酸藻(Desmarestiaaculeata)DOC的释放[34-36]。陈思旺(2020)通过研究福建省11种常见大型海藻释放有机物的特点,发现DOC的释放量远高于POC的释放量[37],这与本研究结果一致。本研究还发现,低接种密度条件下酸化处理能显著增加DOC的释放量,而高接种密度条件下酸化处理对DOC的释放量没有显著影响(图7),这可以解释不同密度条件下海洋酸化对比生长速率的相反作用[图2(b)]。此外,在两种接种密度条件下酸化处理使POC的释放量显著降低(图7)。
3 结论
本研究从生理生化水平研究了海洋酸化对坛紫菜叶状体的生长、生化组分以及释放DOC和POC的影响,获得了如下结论:
(1)低接种密度条件下,海洋酸化导致坛紫菜叶状体的比生长速率降低6.7%。高接种密度条件下,海洋酸化使坛紫菜叶状体的比生长速率增加6.7%。
(2)低接种密度条件下,海洋酸化导致DOC的释放量显著增加了70.2%。而高接种密度条件下,海洋酸化对DOC的释放量没有显著的影响。两种接种密度条件下,海洋酸化均显著降低了POC的释放量。
(3)两种接种密度条件下,海洋酸化对Fv/Fm、总蛋白含量和色素蛋白含量以及藻体组织中C、N和P含量均无显著影响。
综上所述,坛紫菜叶状体的生理生态表现对海洋酸化的应答受接种密度的影响。
