银鲳应对高温胁迫的生理响应及其相关基因表达研究
2022-02-22史琛榆赵淳朴胡艺潇沙桃平王亚军王丹丽徐善良
史琛榆,赵淳朴,胡艺潇,沙桃平,王亚军,王丹丽,徐善良*
(1.宁波大学海洋学院,浙江 宁波 315211; 2.宁波大学应用海洋生物技术教育部重点实验室,浙江 宁波 315211)
银鲳(Pampusargenteus),属鲈形目(Pereiformes),鲳科(Stromateidae),鲳属(Pampus),主要分布于我国黄海南部和东海北部,为暖水性中上层集群性鱼类,有结群和洄游习性。
近年来,由于全球气候变暖,以及极端高温、严寒天气出现的频率和强度增加,浙江沿海夏季表层海水温度上升明显,内湾甚至最高可达到33 ℃以上,静水池塘水温更是能够达到35 ℃的高水温。一般研究认为,银鲳生长最适水温为22~26 ℃,当其长期处于30 ℃及以上水温时,在高温胁迫下会出现显著的热应激反应,如生长停滞、免疫力下降、感染疾病,从而导致机体内酶系统瘫痪且代谢途径受阻,最终爆发性死亡。
近年有关银鲳的研究多集中在其分布与分类[1-2]、资源评估[3-4]、营养成分分析[5]、繁殖特性与生理[6-7]、人工繁殖与营养需求[8-9]等诸多方面。但有关银鲳应对高温胁迫的响应机制的研究尚未见报道。在养殖实践中,每年7—8月银鲳都会面临极端的高温胁迫,因而必须增开制冷机降温,但耗能与养殖成本的增加又是不容忽视的问题。因此解开银鲳面临高温胁迫的生理及其体内相关基因的应答机制,有利于找到银鲳内在的不可逆临界高温值,从而指导并实际应用于银鲳产业化养殖。
目前,有关高温对海洋生物影响的研究主要通过急性热刺激比较酶活性或热休克蛋白家族基因表达的变化。徐冬冬等(2010)在高温胁迫对褐牙鲆(Paralichthysolivaceus)生长及肝脏抗氧化酶活性影响的研究中发现,肝脏组织中超氧化物歧化酶(Superoxide Dismutase, SOD)和过氧化氢酶(Catalase,CAT)二者的活性随着胁迫温度的升高呈负相关[10]。田照辉等(2012)通过实时荧光定量技术发现,在高温胁迫下,西伯利亚鲟(Acipenserbaerii)各组织中,hsp70基因在脾脏的表达量最高,鳃次之,肝最低(p<0.05)[11]。李林春等(2012)通过转录组研究发现,斑马鱼在高温胁迫下抑制基因表达从而影响DNA复制、神经系统过程和类固醇激素生物合成等生命活动[12]。但是多数研究并没有结合生命活动的综合调控机制,对不同温度水平下海洋鱼类的高温应激能力做探讨。综上所述,本研究拟从组织学、酶活性及基因表达等多个方面,研究银鲳在高温胁迫下的生理和基因应答机制,初步阐明高温对银鲳生理机能及其相关基因表达的影响。
1 材料与方法
1.1 实验材料
实验用银鲳为人工培育获得,选取大小规格相近、健康的银鲳作为实验对象, 平均体重为105.31±6.76 g,平均体长15.33±0.95 cm。水温用冷热水机(广东日生CW-2500A)进行调控。实验期间海水盐度为24~26,DO含量>7 mg/L,pH为8.1~8.2。
1.2 实验设计和取样
实验设置4个温度组: 对照组A(26 ℃)、B组(28 ℃)、C组(30 ℃)、D组(32 ℃),每组设3个重复。每个重复均养殖于PP圆形实验桶(1 t)内,每桶12尾。将各组银鲳成鱼在26 ℃下暂养适应4 d,3个实验组(B、C、D)按照设定温度分别在24 h内升温至28、30、32 ℃。
在实验开始后的第0、0.5、1、3、7天这5个时间点分别进行取样,每次从每桶中取2尾,为避免取样惊扰,先在同温水中适应2 h,在取样前经MS-222麻醉后,称体质量(精确至0.01 g),然后将鱼体置于冰盘上解剖取样,包括肝、肾、鳃,用生理盐水冲洗。组织样品切取5 mm大小用波恩氏液固定,分子样品置于RNA保存液中,然后与营养分析的样品一起置于-80 ℃保存。
1.3 组织的石蜡切片
用于切片的肝、鳃、肾组织,在波恩氏液中固定24 h后置于70%乙醇保存,后经逐级脱水、透明、透蜡后,用石蜡包埋。将包埋后的组织切片(厚度5 μm)、展片、晾干后,HE染色,最后用中性树胶封片。晾干后的切片在显微镜下观察并对典型的结构拍照。
1.4 组织氧化应激生化指标测定
将银鲳肝组织按质量(g)体积(mL)比1∶9加入9倍的1×PBS于匀浆器中充分匀浆,将10%的组织匀浆液于冷冻离心机4 ℃、4 000 r/min 离心10 min。取上清液,采用 Bicinchoninic acid (BCA)法测定组织中的蛋白质浓度。对三种常规的组织氧化应激生化指标进行测定:超氧化物歧化酶、过氧化氢酶以及丙二醛。实验用试剂盒均购自南京建成生物工程研究所,具体实验方法参见说明书。。
1.5 引物的设计
通过银鲳转录组获得银鲳hsp70家族基因序列,用Primer Premier 5.0设计特异性引物,PCR获得基因核心片段。根据获得的银鲳hsp70基因的核心片段设计实时定量PCR引物,基于银鲳内参基因18S cDNA序列设计内参基因序列引物18S-F/R,引物序列见表1。

表1 hsp70基因引物Tab. 1 Primers used for hsp70
1.6 总RNA提取和hsp70基因核心片段克隆
本研究采用AxyPrep总RNA小量制备试剂盒进行RNA提取,并通过1%的琼脂糖凝胶电泳实验验证所提取的RNA的完整性。对提取获得的银鲳肝脏组织总RNA通过反转录获得cDNA。选择银鲳肝脏组织cDNA为模板,使用特异性引物进行PCR扩增。PCR产物于1%琼脂糖凝胶电泳检测确认目的条带大小后,送华大基因公司测序,在NCBI数据库中进行Blast对比分析正确后获得目的基因的核心片段序列。
1.7 实时荧光定量PCR检测
以18S cDNA为内参基因,进行预实验确定最佳稀释浓度:样品cDNA做3个10倍梯度稀释,各设3个平行,进行RT-qPCR,而后建立标准曲线,确定最佳实验稀释的倍数为100倍。PCR反应体系(共20 μL):SYBR Premix ExTaq 10 μL,ddH2O 7.2 μL,上、下游引物各0.4 μL,cDNA模板2 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s,对应退火温度30 s,72 ℃ 40 s,40个循环;95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s。荧光定量数据分析采用△△Ct方法,使用2-△△Ct值表示目的基因的相对表达量。实验数据采用SPSS 13.0软件统计,采用One-way ANOVA 法进行显著性检验,并用Duncan法检验法进行多重比较,实验结果表示为平均值±标准误差(M±SD),p<0.05的实验结果为差异显著。
2 结果与讨论
2.1 银鲳不同组织的组织学变化
与26 ℃对照组相比,不同高温组短期胁迫后的银鲳肝、肾、鳃组织均出现了不同程度的改变(图1)。在26 ℃下,肝、肾和鳃组织结构清晰。28 ℃时,银鲳的肝脏淤血,肝脏组织结构仍较清晰;鳃组织出现轻微的上皮位移现象;肾组织受温度胁迫的影响不明显,肾小管及肾小球的结构并没有出现明显的变化。
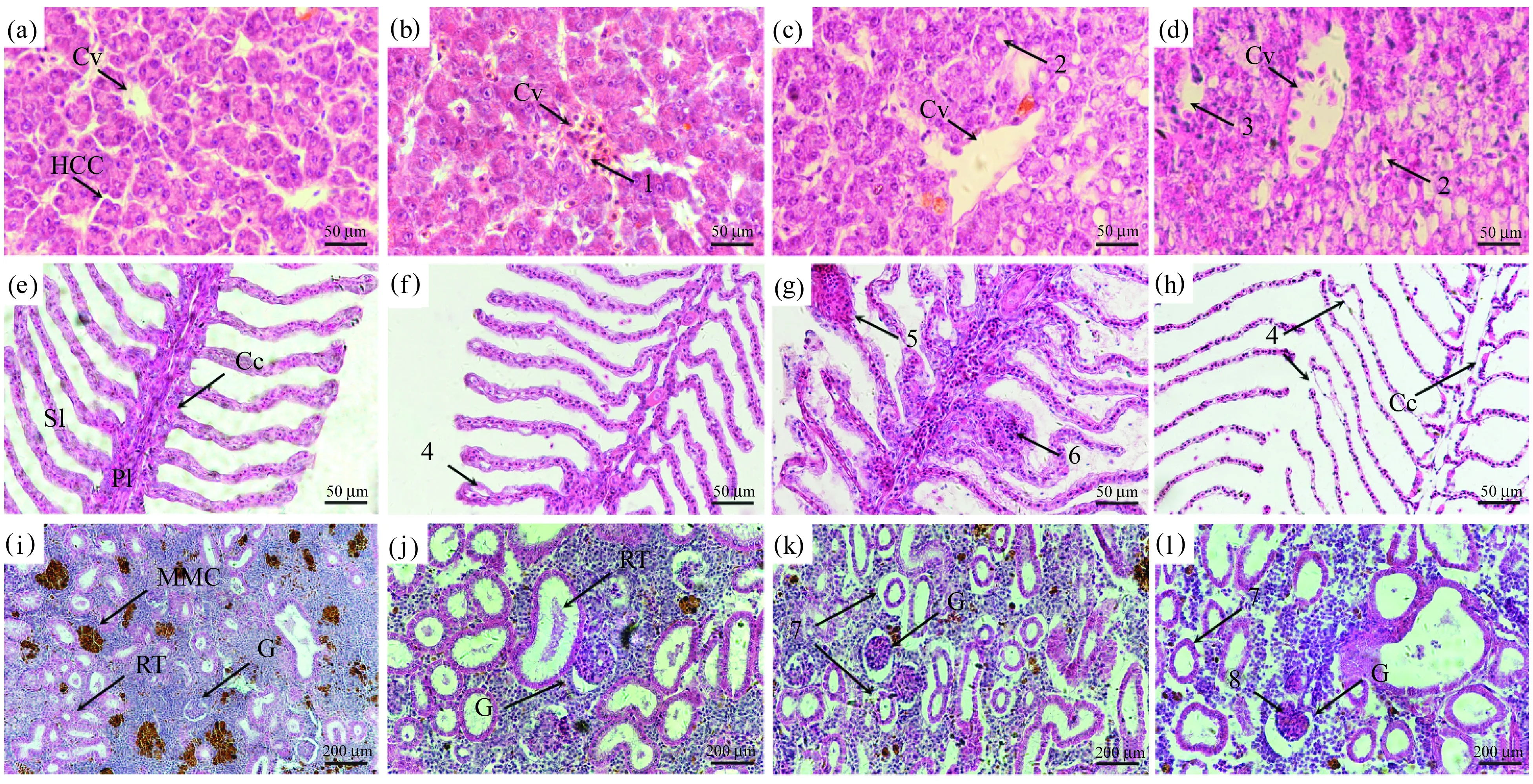
图1 不同温度下银鲳肝、肾和鳃组织显微结构变化Fig. 1 Microstructure changes in the tissues of liver, kidney and gill of Pampus argenteus at different temperatures(a)至(d)为26、28、30、32 ℃下银鲳肝组织(×400),(e)至(h)为26、28、30、32 ℃下银鲳鳃组织(×400),(i)至(l)为26、28、30、32 ℃下银鲳肾组织(×200)。 Cv为中央静脉,HCC为肝细胞索,1为淤血,2为脂质空泡,3为细胞坏死产生的空洞,Cc为泌氯细胞,Pl为鳃丝,Sl为鳃小片,4为上皮位移,5为鳃丝末端充血和卷曲,6为动脉栓塞或充血,MMC为黑色素-巨噬细胞中心,RT为肾小管,G为肾小球,7为肾小管上皮位移,8为肾小球萎缩。
30 ℃时,银鲳的肝细胞结构不规则,存在脂质空泡,且中央静脉出现明显的损伤;肾组织中的肾小管出现明显的上皮位移的现象;此时可以观察到鳃组织上皮位移的现象,鳃丝动脉栓塞或充血,鳃丝末端也出现充血和卷曲的现象。
32 ℃时,银鲳肝脏原有结构基本遭到破坏,可以观察到脂质空泡以及肝细胞坏死产生的空洞,肝细胞出现广泛变性坏死;在鳃组织中可观察到更明显的上皮位移现象,且出现了大量的细胞破碎和坏死现象。肾组织中可以观察到肾小球萎缩,肾小管出现上皮位移的现象严重,且部分肾小管的结构遭到破坏,出现细胞坏死的现象。
2.2 银鲳肝组织中氧化应激生化指标变化
2.2.1 超氧化物歧化酶 高温胁迫下,银鲳肝脏SOD的活性变化见图2(a)。各温度组的SOD相对活性均于第0.5天显著升高(p<0.05),之后随胁迫时间的增长,28 ℃组的SOD活性先下降后升高,最后在第7天下降至正常水平,变化过程类似“M”型趋势;30 ℃组SOD的升高持续至第1天后开始下降,在第7天又显著升高,变化过程类似于“N”型趋势,且SOD相对活性在胁迫发生后的各时间点均显著高于其他两个温度组(p<0.05);32 ℃组SOD活性于1 d后显著下降,至第7天显著低于正常水平(p<0.05)。
2.2.2 过氧化氢酶 在不同温度下,银鲳肝脏CAT的活性变化见图2(b)。28 ℃组的CAT活性在各时间点之间均无显著性差异(p>0.05)。30 ℃和32 ℃组肝脏中的CAT活性均呈先上升后下降的趋势,30 ℃组于0.5天时达到最大值20.96 U/mg prot,32 ℃组于第1天达到最大值21.95 U/mg prot,在第7天,30 ℃和32 ℃组CAT显著低于正常水平(p<0.05)。
2.2.3 丙二醛 在不同温度下,银鲳肝脏MDA含量的变化见图2(c)。肝脏中的MDA含量在28、30、32 ℃时变化趋势基本一致,均在0.5天时显著上升,后于第3天显著下降,且均于第1天达到最大值。在第7天,30 ℃和32 ℃组MDA含量显著低于正常水平(p<0.05)。
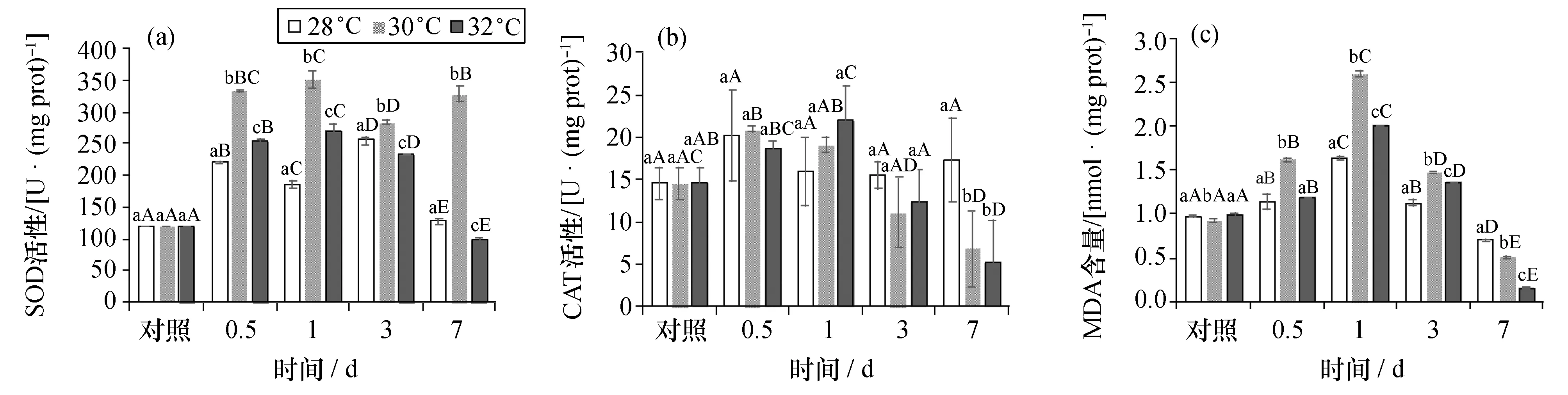
图2 高温胁迫对银鲳肝脏中SOD活性、CAT活性和MDA含量的影响Fig. 2 Effect of high temperature stress on the hepatic SOD and CAT activities and MDA content of Pampus argenteus(a)为高温胁迫对SOD活性的影响;(b)为高温胁迫对CAT活性的影响;(c)为高温胁迫对MDA含量的影响。不同小写字母表示不同温度组在同一时间点差异显著(p<0.05);不同大写字母表示同一温度组在不同时间点差异显著(p<0.05)。
2.3 银鲳hsp70基因核心片段的克隆及相对表达量的变化
对不同温度下各时间点,银鲳肝组织中hsp70基因的表达情况进行比较分析。结果显示(图3),各温度组hsp70基因的表达量变化趋势均呈显著上升后下降的趋势。各温度组在0.5天时显著升高并达到峰值,之后迅速回落,且32 ℃组银鲳的hsp70基因表达量显著高于其他两个温度组(p<0.05)。与各组起始水平相比,0.5天时,32 ℃组hsp70基因表达量升高约260倍,30 ℃组为104.6倍,28 ℃组为36.4倍。

图3 不同温度下银鲳肝脏hsp70基因的mRNA表达差异Fig. 3 Expression leves of hepatic hsp70 mRNAof Pampus argenteus at different temperatures
2.4 讨论
2.4.1 高温胁迫对银鲳肝、鳃、肾三组织造成的损伤 研究表明,28、30、32 ℃高温胁迫对银鲳成鱼的鳃、肾、肝组织的组织结构均造成了不同程度的损伤。柳意樊等(2014)研究发现褐牙鲆(Paralichthysolivaceus)不同组织对高温的响应程度不同[13];Rojas等(2013)对大盖巨脂鲤(Colossomamacropomum)在高温胁迫下各组织的变化研究后提出鳃和肝组织是研究热胁迫对组织影响的理想组织[14],这与我们的研究结果一致。银鲳肝、鳃组织结构对高温的响应程度大于肾组织,且产生的组织结构改变更为明显和复杂。此外,在28 ℃下,银鲳鱼各组织的结构虽然产生了变化,但症状均表现为较轻微的上皮位移等。这表明28 ℃短时间的高温胁迫对银鲳鱼的组织器官并不会造成较严重的影响,这也与实际养殖过程中的情况相吻合,28 ℃水温下银鲳只表现为摄食率有所下降,并不影响成活率。
2.4.2 银鲳肝组织中抗氧化酶系统对高温胁迫的响应 诸多研究表明,高温胁迫对鱼类抗氧化酶系统活性有显著的影响。SOD和CAT是存在于生物体内的非常重要的抗氧化防御性功能酶[15],SOD可将代谢或外界刺激产生的有毒物质氧自由基分解成过氧化氢,再通过 CAT将过氧化氢还原成氧分子和水,进而维持机体的正常生理活动。MDA 是细胞膜脂过氧化作用的产物之一,主要在肝脏进行分解,通过MDA含量多少可间接判断机体受到自由基损伤的程度[16]。
在28 ℃下,SOD活性变化趋势类似“M”型趋势,这与柳毅樊等[13]研究褐牙鲆的结果相类似,说明此温度下银鲳尚能够通过机体调节机能,做出动态调节,逐渐适应环境温度。同时CAT活性,MDA含量也在经过0.5~1 d的短时间升高后,逐步下降到正常水平,说明银鲳在28 ℃短期热胁迫中能基本适应。
30 ℃胁迫下,CAT活性和MDA含量出现显著上调后,均于第7天下降,且显著低于正常水平。这与刘玲等(2018)研究驼背鲈(Cromileptesaltivelis)与鞍带石斑鱼(Epinepheluslanceolatus)杂交子代短期热刺激后,肝组织受到一定损伤,使细胞通透性下降,肝脏中CAT活性显著下降的研究结果[17]相吻合。而SOD活性保持在较高的水平,这与徐冬冬等针对褐牙鲆的研究[10]不同,可能这与鱼类的物种及胁迫温度、时间等条件不同相关。因此,可推断在30 ℃下,短期的高温胁迫已经对银鲳机体产生了严重的损伤,养殖中表现为食欲显著下降,鱼体易受到惊吓。
32 ℃高温胁迫下,肝脏 MDA 含量随应激时间的延长呈先上调后下降的趋势。SOD与CAT活性在短时间内也都呈上升的趋势。强俊等(2012)研究发现,尼罗罗非鱼(Oreochromisniloticus)在35 ℃高温下,随应激时间的延长,SOD和CAT二者活性均呈先上升后下降的变化[18],这与本实验的结果相一致。此外,在32 ℃胁迫7 d后,SOD、CAT二者活性和MDA含量均显著低于正常水平和该时间点下其他2个温度组。这说明,在32 ℃的短期高温胁迫对银鲳机体已产生致命性的损伤。事实上也可观察到,当水温高达32 ℃时,银鲳处于高度紧迫状态,狂游且极少进食,死亡率显著上升,此时必须采用人工降温手段调节水温。
2.4.3 银鲳肝组织hsp70基因表达对高温胁迫的响应 大量研究结果显示,在鼠尾藻(Sargassumthunbergii)[19]、栉孔扇贝(Chlamysfarreri)[20]、克氏原螯虾(Procambarusclarkii)[21]、团头鲂(Megalobramaamblycephala)[22]等众多物种的研究中均发现热刺激会引起hsp70基因的大量表达,且其表达水平的高低可以作为评价机体应激程度和应激能力的重要指标[23]。强俊等研究发现,温度应激对罗非鱼肝脏hsp70基因的表达水平有显著影响,且随应激时间的延长,hsp70基因的表达量在24 h内基本呈先上升后下降的变化[18],我们的实验结果也是如此。此外,各温度组下hsp70基因表达量在0.5天时有显著差异,这也进一步说明银鲳在不同的高温胁迫下的应激响应存在显著差异。
3 结论
通过研究不同高温胁迫对银鲳肝、鳃、肾的组织结构、肝组织中氧化应激生化指标(SOD活性、CAT活性和MDA含量)和hsp70基因相对表达量的影响,结果显示银鲳在高温胁迫初期即会迅速响应,且响应程度与胁迫强度存在正相关关系。在28 ℃下,银鲳受到的高温损伤较轻,且能逐步适应该温度下的胁迫压力;在30 ℃下,高温胁迫对银鲳严重损伤;而在32 ℃高温胁迫下,银鲳表现出强烈的应激响应,胁迫可对其造成致命损伤。
