miR-22通过靶向UCP2保护心肌细胞免受硫酸吲哚酚诱导的凋亡和过度自噬
2022-02-22王学忠
郭 影,梁 婷,王学忠
研究[1]表明,硫酸吲哚酚(indoxyl sulfate,IS)在慢性肾病患者中观察到的心血管疾病进程中起促进作用。体外实验证实了IS通过增强氧化应激上调心肌细胞的自噬水平[2]。但是,尚不清楚IS诱导的心肌细胞自噬水平的更深层机制。解偶联蛋白2(uncoupling protein 2,UCP2)位于线粒体内膜,在心肌组织中广泛表达[3]。研究[4]表明UCP2可以通过抑制活氧性生成来保护心肌细胞免受氧化应激引起的凋亡和过度自噬。据报道[5],miRNA-22(miR-22)在心脏中高度表达,并作为心脏重塑的重要调节剂。然而,miR-22是否通过UCP2保护心肌细胞免受IS诱导的凋亡和过度自噬尚不清楚。该研究探讨miR-22在调节IS诱导的心肌细胞自噬作用及其可能机制。
1 材料与方法
1.1 材料
1.1.1试剂 10%胎牛血清购自美国HyClone公司;Dulbecco改良Eagle培养基购自美国Thermo Scientific公司;3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2H-溴化四唑(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、脂质体2000转染试剂、硫酸吲哚酚均购自美国Sigma-Aldrich公司;乳酸脱氢酶(lactic dehydrogenase,LDH)测量试剂盒购自美国Promega公司;miR-22模拟物(mimic-miR-22)、miR-22抑制剂(anti-miR-22)和UCP2过表达物(LeUCP2)均购自上海吉玛制药技术有限公司;TRIzol试剂、MicroRNA qRT-PCR Sybr Green检测试剂盒、SYBR RT-PCR试剂盒均购自日本Takara Biochemical公司;裂解缓冲液购自美国Roche Applied Science公司;PVDF膜购自美国Merck Millipore公司;p-62抗体、LC3Ⅰ/Ⅱ抗体、UCP2抗体、Bcl-2抗体、Bax抗体、caspase-3抗体和β-actin抗体均购自美国Cell Signaling Technology公司;辣根过氧化物酶结合的第二抗体购自美国Abcam公司;膜联蛋白V-FITC和碘化丙啶(PI)检测试剂盒购自美国BD Biosciences公司;Quik突变株试剂盒购自德国Stratagene公司;pmiRGLO载体购自美国Promega公司。
1.1.2仪器 FL-600酶标仪购自美国BioTek公司;实时PCR系统购自美国Applied Biosystems公司;利用化学发光检测系统购自上海Tanon公司;BD FACSDiva Software v7.0购自美国Becton-Dickinson公司;双荧光素酶报告系统购自美国Promega公司。
1.2 细胞培养人心肌母细胞H9c2购自美国ATCC公司,将其培养在含有10%胎牛血清的Dulbecco改良Eagle培养基。
1.3 细胞增殖测定使用MTT来检测细胞的活力。将H9c2接种在96孔板中,然后暴露于连续浓度的IS(100、250、500、1 000 μmol/L)中48 h。在另一个实验中,将H9c2与500 μmol/L IS孵育24、48、72 h。用IS处理后,将20 μl MTT工作溶液(5 mg MTT/ml溶于磷酸盐缓冲液,PBS)添加到每个孔中,并在37 ℃下孵育5 h。弃上清液,将沉淀用150 μl二甲基亚砜(DMSO)溶解10 min。使用FL-600酶标仪在570 nm波长处检测吸光度。为了验证数据,每个测定进行了3次。
1.4 细胞毒性的测定为了分析IS对H9c2的细胞毒性作用,使用LDH测量试剂盒测定细胞释放的LDH。具体操作为:将H9c2接种在96孔板中,然后暴露于连续浓度的IS(100、250、500、1 000 μmol/L)中48 h。吸取50 μl上清液转移至96孔酶法测定板,向每个孔加入50 μl重组底物混合物。盖住平板,在室温下避光孵育30 min。最后,加入停止液,并用FL-600酶标仪在490 nm处记录吸光度。实验进行了3次以验证结果。
1.5 细胞转染取对数生长期的H9c2细胞,以5×104个/孔接种于24孔板,用脂质体2000转染试剂,分别将mimic-miR-22(50 nmol/L)、anti-miR-22(100 nmol/L)和LeUCP2(50 nmol/L)转染入细胞。加入乱码miR-22或空慢病毒载体作为对照。转染48 h后,收集细胞并进行以下测定。
1.6 逆转录酶反应和实时定量PCR使用TRIzol试剂从培养的细胞中分离了总RNA。为了量化miR-22 miRNA的表达,使用针对特定miRNA的特殊茎环引物合成cDNA,然后使用MicroRNA qRT-PCR Sybr Green检测试剂盒和7500序列检测实时PCR系统确定miRNA表达水平。比较Ct(阈值周期)值用于量化miRNA表达水平。为了量化UCP2 mRNA的表达,使用SYBR RT-PCR试剂盒合成cDNA并进行RT-PCR分析。U6和β-actin分别作为miRNA和mRNA的内部对照。miRNA和mRNA表达水平以相对于对应对照样品表达水平的倍数变化表示,并使用2-ΔΔCt方法计算。实验使用引物如下:miR-22引物,正向5′-GCCTGAAGCTGCCAGTTGA-3′和反向5′-GTGCAGGGTCCGAGGT-3′;大鼠U6引物,正向5′-CTCGCTTCGGCAGCACA-3′和反向5′-AACGCTTCACGAATTTGCGT-3′;β-actin引物,正向5′-CGACCACACACAGAGGGAGAT-3′和反向5′-GCCGATTCACACCGAGTA-3′;UCP2引物,正向5′-TGC TGAGCTGGTGACCTATG-3′和反向5′-CCAGGGCAG AGTTCATGTAT-3′。
1.7 Western blot分析用PBS清洗细胞,并在含有蛋白酶抑制剂和磷酸酶抑制剂的冰冷裂解缓冲液中裂解细胞。然后在12 000 r/min下4 ℃离心10 min。在10% SDS-PAGE凝胶上分离等量的细胞裂解物(20 μg),并转移到PVDF膜上。这些膜在TBST中用5%吐温-20在室温下阻断2 h,然后将p-62抗体(1 ∶1 000)、LC3Ⅰ/Ⅱ抗体(1 ∶800)、UCP2抗体(1 ∶800)、Bcl-2抗体(1 ∶2 000)、Bax抗体(1 ∶1 000)、caspase-3抗体(1 ∶1 000)和β-actin(1 ∶1 000)第一抗体与膜在4 ℃孵育过夜。次日,在室温下用辣根过氧化物酶结合的第二抗体孵育1 h。利用化学发光检测系统对抗体复合物进行了可视化和定量分析。用相对密度法测定靶蛋白表达水平,并将其标准化为β-actin对应的条带。
1.8 流式细胞仪分析使用膜联蛋白V-FITC和碘化丙啶(PI)检测试剂盒对细胞进行了染色,并通过流式细胞仪分析细胞存活情况。首先,使用胰蛋白酶消化细胞(6×105个),然后将细胞在室温下于黑暗中重悬于100 μl含5 μl Annexin V-FITC和5 μl PI的结合缓冲液中10 min,然后将400 μl结合缓冲液添加至混合物中。在停止反应后1 h内通过流式细胞术分析细胞。使用BD FACSDiva Software v7.0评估流式细胞仪数据。每组共计数10 000个细胞进行统计分析,每次评估重复3次。
1.9 双荧光素酶报告分析使用引物5′-AAACGGACTCGCAGCGAGCTCCAG-3′和5′-CGACTCTAGA CTAGATACATGACTCTAACATTTGCC-3′通过PCR扩增含有推定的miR-22靶位点的UCP2的野生型(WT)3′非翻译区(3′UTR-WT)的片段。同时通过使用Quik突变株试剂盒对pGL3-UCP2-3′ UTR载体上带有的miR-22靶点序列中的seed sequence序列进行点突变。随后,将包含UCP2的3′UTR-WT或3′UTR-MUT(突变型)片段插入紧邻荧光素酶基因序列下游的pmiRGLO载体中。在报告分析中,该研究用荧光素酶报告构建物和mimic-miR-22、anti-miR-22或阴性对照miRNAs共转染了H9c2细胞。转染后48 h,裂解细胞,用双荧光素酶报告系统测定荧光素酶活性。荧光素酶活性水平被标准化为肾素荧光素酶活性水平。
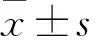
2 结果
2.1 IS对H9c2细胞增殖、毒性和自噬的影响MTT分析结果显示,IS可以剂量依赖性地抑制H9c2的增殖(图1A),并且随着暴露的时间的延长,由500 μmol/L IS诱导的H9c2增殖的抑制作用增加(图1B)。同时,用500 μmol/L或1 000 μmol/L IS处理48 h可增加H9c2中LDH的释放(图1C)。此外,Western blot分析显示,IS可以剂量依赖性地降低H9c2细胞中p62的表达(F=16.137,P<0.001),并促进LC3-Ⅰ向LC3-Ⅱ转化(F=28.424,P<0.001,图1D、E)。
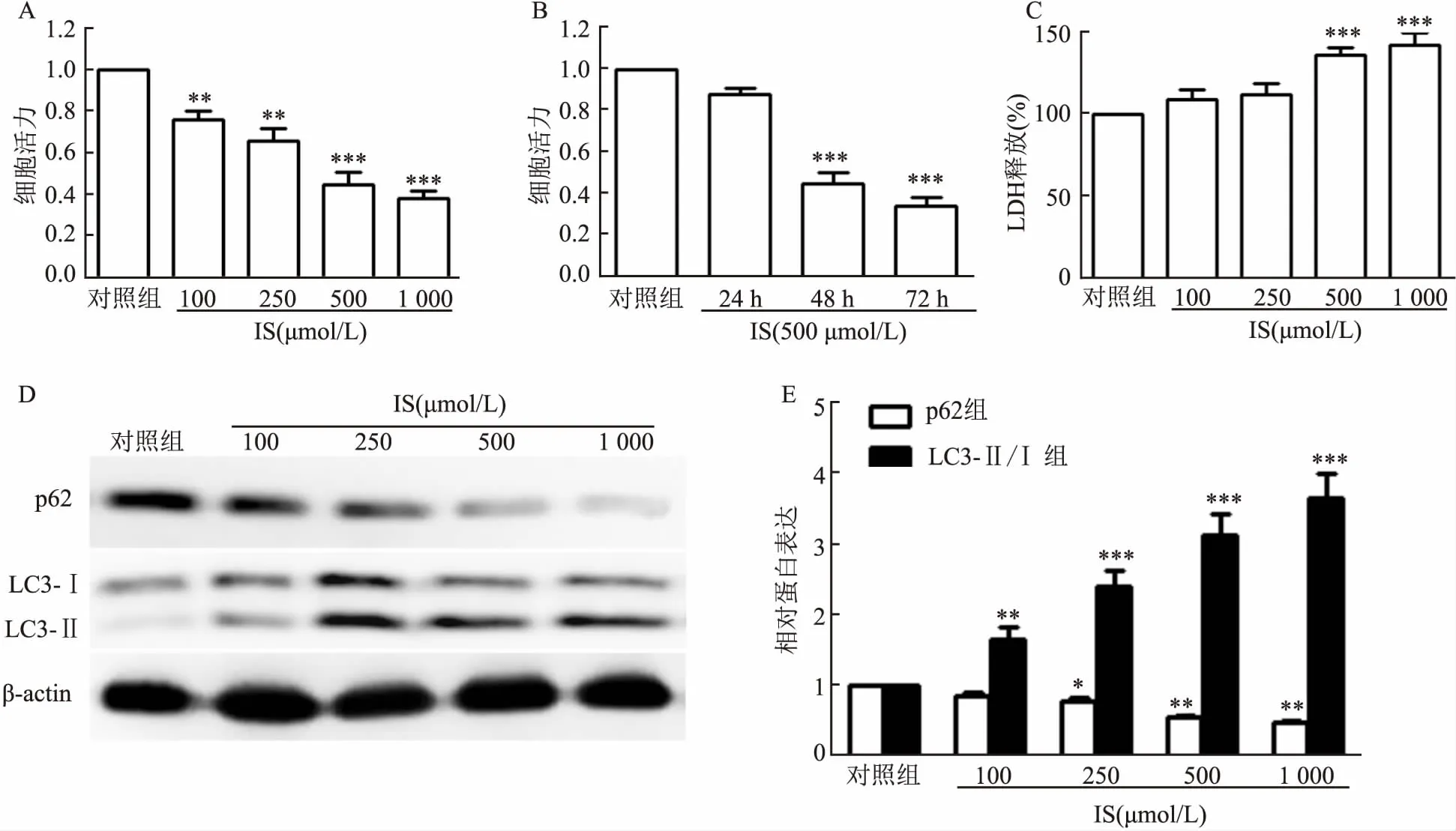
图1 IS对H9c2细胞增殖、毒性和自噬的影响A:MTT法检测不同浓度IS对H9c2细胞增殖的影响;B:MTT法检测IS不同处理时间对H9c2细胞增殖的影响;C:不同浓度IS对H9c2细胞毒性的影响;D、E:不同浓度IS对H9c2细胞p62蛋白表达及LC3-Ⅱ/Ⅰ比值的Western blot结果和定量数据;与对照组比较:△P<0.05,△△P<0.01,△△△P<0.001
2.2 miR-22对IS诱导的H9c2细胞凋亡的影响为了检查miR-22对IS处理过的心肌细胞的作用,研究通过用miR-22模拟物或抑制剂转染H9c2细胞来诱导miR-22过表达和敲低。转染效率如图2A、B所示,与对照组相比,miR-22模拟组中的miR-22水平升高(P<0.001),而miR-22抑制剂组中的miR-22水平降低(P<0.001)。在暴露于IS条件下,与接受对照处理的H9c2细胞相比,IS组的存活H9c2细胞数量减少(t=4.614,P=0.006),而凋亡和坏死细胞的数量却增加了(t=4.526、4.638,P=0.007、0.006)。用miR-22模拟物治疗可减少坏死和凋亡细胞的百分比(t=3.142、3.315,P=0.037、0.034),而用miR-22抑制剂治疗可进一步增加凋亡和坏死细胞的百分比(t=6.753、6.841,P<0.001)(图2 C、D)。
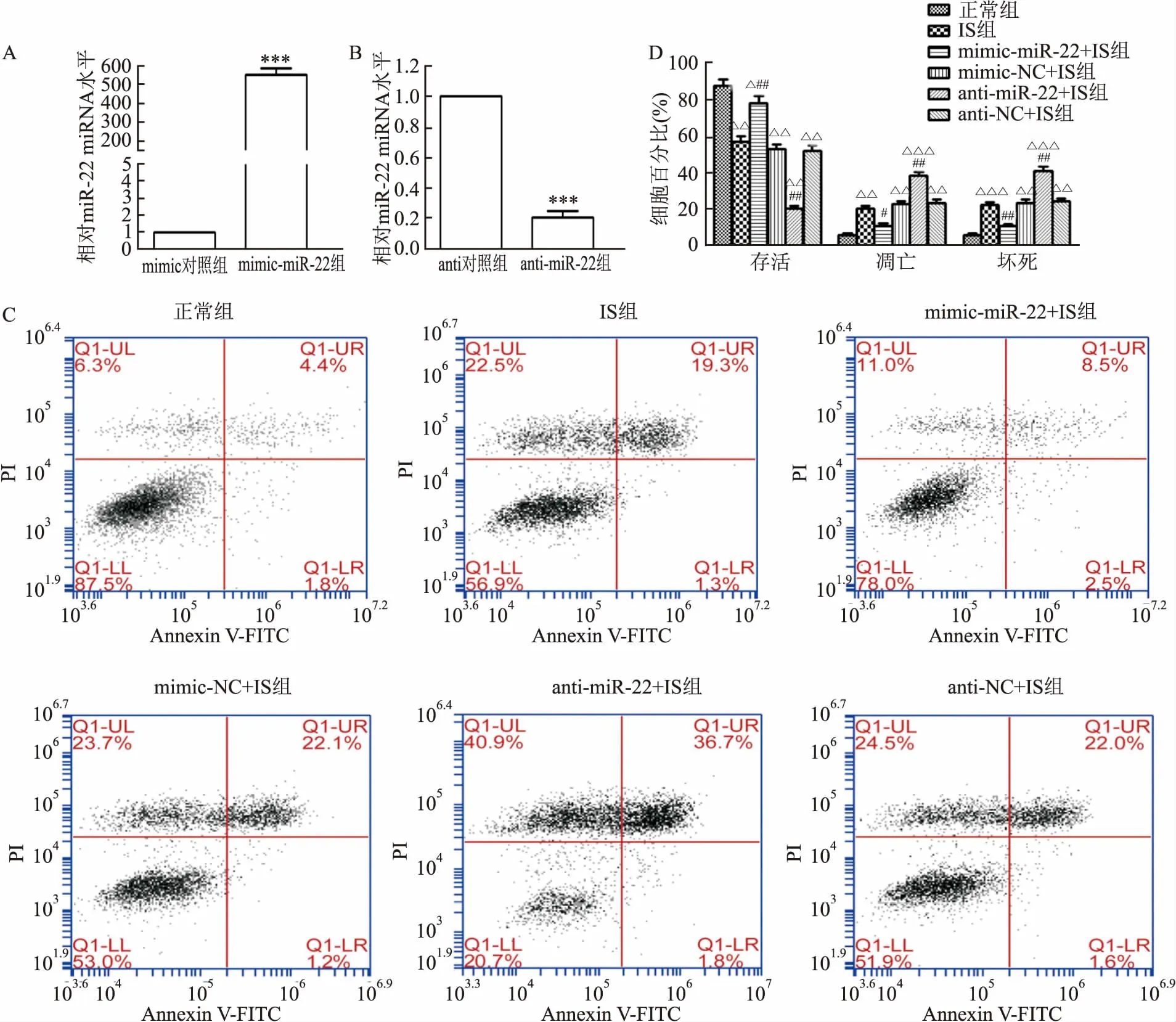
图2 miR-22对IS处理过的心肌细胞的作用A、 B:qRT-PCR分析miR-22模拟物、miR-22抑制剂或相应的阴性对照(n=3)转染的H9c2细胞中miR-22表达;与对照组比较:***P<0.001;C、D:流式细胞术分析显示miR-22对H9c2细胞坏死、凋亡和存活的影响(n=3);与正常组比较:*P<0.05,**P<0.01,***P<0.001;与IS组比较:#P<0.05,##P<0.01
2.3 miR-22对IS诱导的自噬的影响Western blot分析显示,在暴露于IS条件下,miR-22模拟物转染的H9c2细胞与相应的阴性对照miRNA转染的细胞相比具有更低的LC3-Ⅱ/Ⅰ比值(t=8.259,P<0.001),p62蛋白表达提高(t=2.716,P=0.043)(图3A、B);而miR-22抑制剂则产生了相反的结果(t=4.329,P=0.005;p62:t=4.473,P=0.004)(图3C、D)。
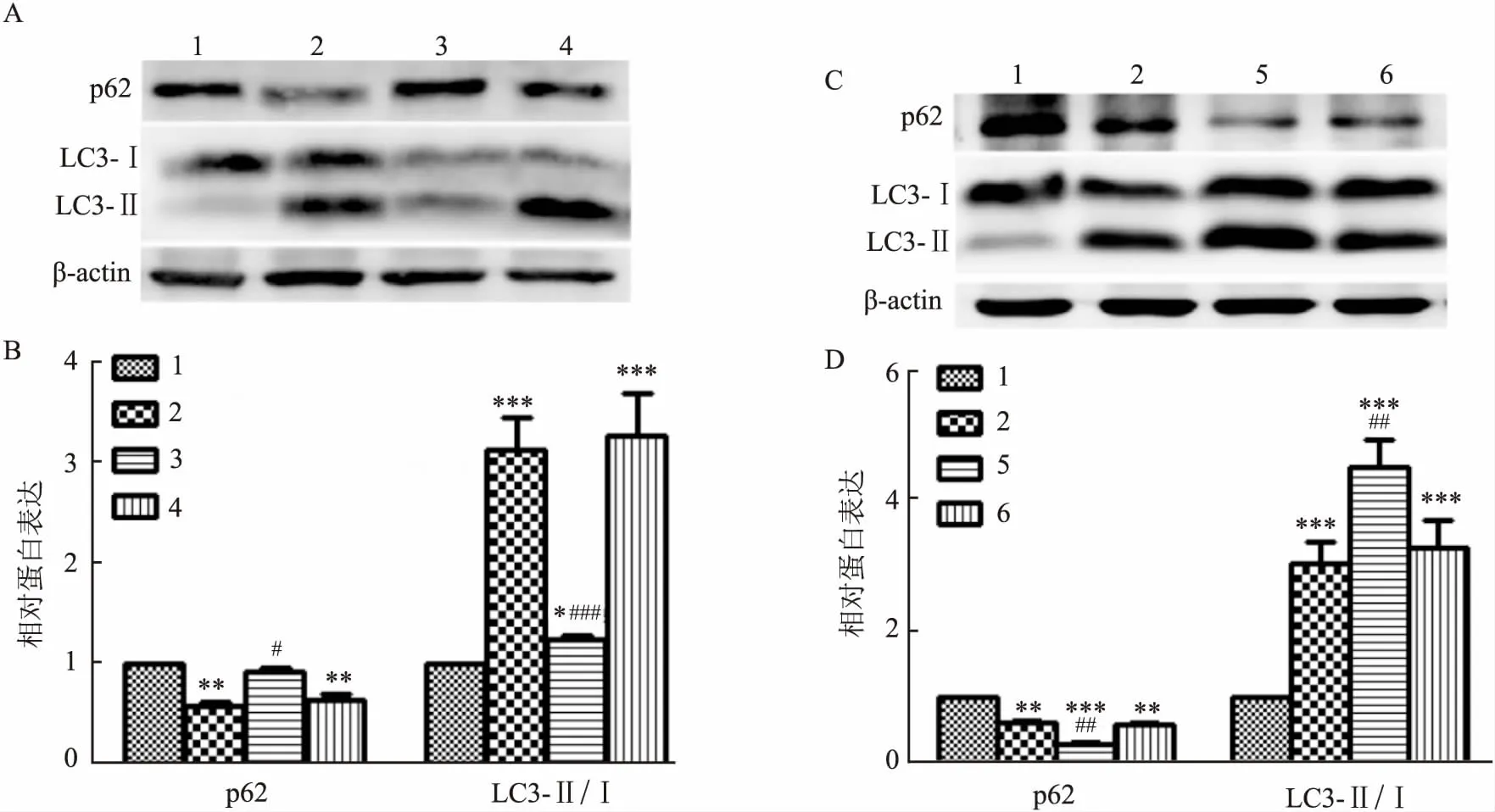
图3 miR-22对IS诱导自噬的影响 A、 B:miR-22模拟物对H9c2细胞p62蛋白表达及LC3-Ⅱ/Ⅰ比值的Western blot结果和定量数据;C、D:miR-22抑制物对H9c2细胞p62蛋白表达及LC3-Ⅱ/Ⅰ比值的Western blot结果和定量数据;1:正常组;2:IS组;3:mimic-miR-22-IS组;4:mimic-NC+IS组;5:anti-miR-22-IS组;6:anti-NC+IS组;与正常组比较:*P<0.05,**P<0.01,***P<0.001;与mimic-NC+IS或anti-NC+IS组比较:#P<0.05,##P<0.01,###P<0.001
2.4 miR-22靶向UCP2qRT-PCR和Western blot分析表明,在暴露于IS条件下,miR-22模拟物转染的H9c2细胞与相应的阴性对照miRNA转染的细胞相比具有更高的UCP2 mRNA和蛋白表达(t=4.437、4.614,P=0.007、0.005);而miR-22抑制剂则产生了相反的结果(t=3.572、4.533,P=0.025、0.005)。为了证实miR-22与UCP2之间的关系,研究进行了双重荧光素酶报告基因检测。结果显示,在UCP2 3′UTR WT组中,与阴性对照转染细胞相比,miR-22模拟转染的细胞中标准化萤光素酶活性水平增加(t=7.843,P<0.001),而在抑制剂转染的细胞中则降低(t=4.823,P=0.003)。但是在UCP2 3′UTR MUT组中,用miR-22模拟物或抑制剂转染后的荧光素酶构建体的活性水平较阴性对照未发生变化。见图4。
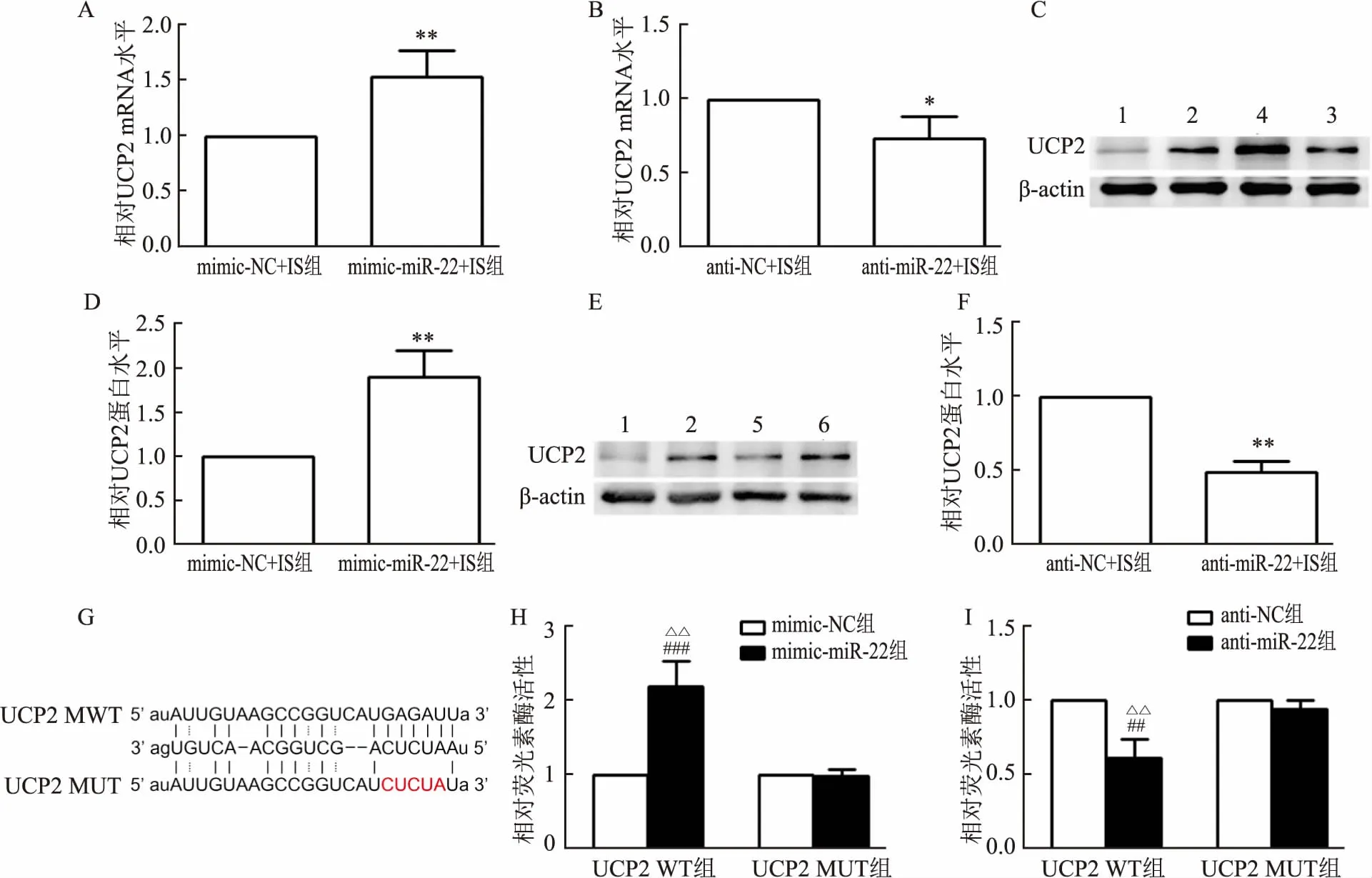
图4 miR-22靶向UCP2A、 B:qRT-PCR分析转染miR-22模拟物、miR-22抑制剂或相应阴性对照后48 h的H9c2细胞中UCP2 mRNA表达水平;C~F:miR-22模拟物、miR-22抑制剂对H9c2细胞中UCP2蛋白表达的Western blot结果和定量数据;与mimic-NC+IS或anti-NC+IS组比较:*P<0.05,**P<0.01;G:miR-22在UCP2的WT 3′UTR和MUT 3′UTR中的预测结合位点;H、I:双荧光素酶报告基因测定miR-22模拟物和miR-22抑制剂转染的H9c2细胞中的荧光素酶活性水平;1:正常组;2:IS组;3:mimic-miR-22-IS组;4:mimic-NC+IS组;5:anti-miR-22-IS组;6:anti-NC+IS组;与mimic-NC或anti-NC组比较:△△P<0.01;与mimic-miR-22+UCP2 3′UTR或anti-miR-22+UCP2 3′UTR组比较:##P<0.01,###P<0.001
2.5 UCP2介导miR-22在IS刺激H9c2细胞中的保护作用Western blot分析结果见图5所示,LeUCP2转染的H9c2细胞中UCP2表达水平明显升高,表明LeUCP2转染的效率很高。与空慢病毒载体对照相比,LeUCP2转染导致暴露于IS的H9c2细胞或miR-22抑制剂转染的H9c2细胞中Bcl-2/Bax比率和p62表达增加(tLeUCP2=7.162、4.673,P<0.001、0.005;tanti-miR-22=7.514、3.614,P<0.001、0.019)以及cleaved-caspase3和LC3-Ⅱ/Ⅰ比值降低(tLeUCP2=3.044、2.836,P=0.024、0.030;tanti-miR-22=3.173、4.388,P=0.024、0.009)。
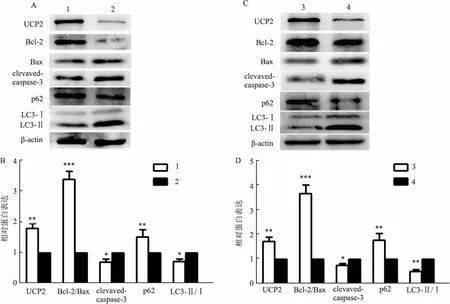
图5 UCP2介导miR-22在IS刺激H9c2细胞中的作用A、 B:Western blot分析LeUCP2对暴露于IS的H9c2细胞中UCP2、Bcl-2、Bax、cleaved-caspase3、p62、LC3-Ⅰ和LC3-Ⅱ蛋白表达;C、D:Western blot分析LeUCP2对暴露于IS且接受miR-22抑制剂转染的H9c2细胞中UCP2、Bcl-2、Bax、cleaved-caspase3、p62、LC3-Ⅰ和LC3-Ⅱ蛋白表达;1:LeUCP2+IS组;2:Le-NC+IS组;3:LeUCP2+IS+ anti-miR-22组;4:Le-NC+IS+anti-miR-22组;与Le-NC+IS或Le-NC+IS+anti-miR-22组比较:*P<0.05,**P<0.01,***P<0.001
3 讨论
尿毒症性心肌病是慢性肾病最常见的并发症,其病死率较高。MicroRNA是目前有关心血管疾病的研究重点。该研究表明,miR-22上调可通过抑制细胞凋亡和过度自噬来保护心肌细胞免受IS诱导的损伤。机理研究[5]表明,miR-22直接靶向UCP2,UCP2过表达保护心肌细胞免受凋亡和过度自噬。该研究揭示了诱导性心肌病的潜在机制。
据报道[6-7],miR-22在几种癌症中异常表达,并且其在这些癌症中的作用已得到广泛研究。研究[8]表明miR-22与多种心肌疾病有关,miR-22通过直接靶向TNNI3K抑制心肌肥大。Li et al[9]研究表明,miR-22通过靶向p38α调节饥饿诱导的心肌细胞自噬和凋亡。在其他研究中,Yang et al[10]揭示了miR-22抑制了缺血/再灌注诱导的心肌坏死和炎症,因此,有利于损伤后的心肌修复。该研究旨在通过模拟体内尿毒症微环境,阐明在IS刺激下miR-22对心肌细胞凋亡和自噬的影响。有研究[11]显示,尿毒症患者的血清IS水平升高了约50倍,而慢性肾病患者的血清IS最高浓度可超过500 μmol/L。通常将100~1 000 μmol/L范围内的IS浓度用于体外研究[12]。因此,该研究也选择此IS浓度范围来进行体外实验。结果显示,在IS刺激下,miR-22通过抑制细胞凋亡和自噬促进细胞存活。
研究[13]表明,位于线粒体内膜中的UCP2通过抑制活氧性生成和抑制氧化应激而对心血管系统具有保护作用。此外,UCP2抑制会降低细胞内NAD+和ATP的水平,最终导致细胞功能障碍和死亡[14]。虽然UCP2在心血管疾病中的作用已得到广泛研究,但是,UCP2是否会影响尿毒症性心肌病发病过程中的自噬过程尚不清楚。以往在线数据库进行的MicroRNA靶基因预测研究[15]已表明miR-22可以靶向UCP2。因此,该研究选择UCP2作为miR-22调控IS诱导的H9c2心肌细胞凋亡和过度自噬中的靶标,结果显示,上调miR-22可以在mRNA和蛋白质水平上提高UCP2表达,而下调miR-22可以降低UCP2表达。双荧光素酶报告基因检测结果证实miR-22与UCP2相互作用。此外,该研究表明通过用慢病毒预处理H9c2心肌细胞来上调UCP2可以减轻IS诱导的细胞凋亡和过度自噬。结果表明,LeUCP2对H9c2心肌细胞存活具有有利影响。研究还表明LeUCP2消除了miR-22抑制剂对IS诱导的H9c2心肌细胞的促凋亡和自噬作用。因此,UCP2可能是miR-22的下游效应物,并可能介导miR-22对IS诱导的心肌细胞损伤的作用。
