广藿香醇对脂肪酸诱导原代小鼠肝细胞脂质积蓄的作用及机制研究
2022-02-22唐东晖钟映芹林重韩亮钟艳花
唐东晖,钟映芹,林重,韩亮,钟艳花
(1.广州市荔湾区中医医院针康科,广东 广州 510140;2.广东药科大学健康学院,广东 广州 510006)
非酒精性脂肪性肝病(NAFLD)是一种无过量饮酒史,由各种原因引起的肝细胞内脂肪堆积,以肝细胞脂肪变性和脂质蓄积为主要特征的临床病理综合征。其病理变化随病程的进展表现有单纯性脂肪肝、高脂血症、高血压,并被认为是代谢综合征在肝脏的一种病理表现。NAFLD疾病谱包括单纯性脂肪肝(NAFL)、脂肪性肝炎(NASH)及其相关肝硬化和肝细胞癌。我国NAFLD患病率约30%,由于其发病机制复杂,机制不清,临床缺乏有效药物,严重危害人民健康。
藿朴夏苓汤出自《医原》,组方由11味中药组成,能“理气和中、燥湿利水”。方中君药广藿香配伍臣药白蔻仁、厚朴、半夏,起“芳香化湿、燥湿运脾”之功效,使脾能运化水湿,不为湿邪所困。再配伍用茯苓、猪苓、泽泻、薏苡仁、杏仁、淡豆豉和通草等佐使药,起“开泄肺气于上、渗利湿于下”之功效,使肺气宣降、水道畅通,则水道自调,湿有去路。该方主治湿热病邪在气分而湿偏重者,中医临床上广泛用于脾胃湿热证等症治疗[1‑2]。前期研究显示,该方具有抗炎、降脂、保肝等药理作用[3‑8]。然而,关于其降脂机制及物质基础尚不明确。本研究旨在小鼠原代肝细胞水平上观察藿朴夏苓汤主要成分广藿香醇对FXR信号的影响,探讨藿朴夏苓汤降脂、抗NAFLD的作用机制及其物质基础。
1 材料与仪器
1.1 实验动物
雄性SPF级6~8周C57BL/6J小鼠,体质量18~20 g,购于广东省医学实验动物中心,生产许可证号:SCXK(粤)2018‑0002。雄性SPF级C57BL/6J背景FXR基因敲除小鼠,6~8周,购于南模生物(批号:NM‑KO‑190328)。
1.2 药品与试剂
广藿香醇(批号:HY‑N0207)、厚朴酚(批号:HY‑N0163)、和厚朴酚(批号:HY‑N 0003)、乙酰泽泻醇A(批号:HY‑N 0853A)、乙酰泽泻醇B(批号:HY‑N 0805)、茯苓酸(批号:HY‑N0371)、苦杏仁苷(批号:HY‑N0190)、琥珀酸(批号:HY‑N0420)、甘油三油酸酯(批号:HY‑N1981)、油酸(OA,批号:HY‑N1446)、棕榈酸(PA,批号:HY‑N0830)、奥贝胆酸(OCA,FXR阳性激动剂,批号:HY‑12222)等对照品,均来源于美国MedChemExpress科研化学品和生物活性化合物供应商;HEK293T细胞株(批号:bio‑72947),中国微生物菌种与细胞库中心;pCD‐NA3.1‑hFXR和pCDNA3.1‑BSEP‑luc质粒由中山大学黄民教授馈赠;FuGENE6转染试剂(批号:E2691)、pCDNA3.1(批 号:E1751)和pGL3‑CMV Renilla(批号:E2231),美国Promega公司;三酰甘油(TG)测定试剂盒(批号:A110‑1‑1),中国南京建成生物工程研究所;荧光探针DCFH‑DA活性氧(ROS)检测试剂盒(批号:A110‑1‑1),碧云天生物技术有限公司;PureLink™FFPE总RNA提取试剂盒(批号:K156002)、SuperScript™双链cDNA合成试剂盒(批号:11917010),TaqMan®Gene Expression Mas‐ter Mix的real‑time PCR反应液(批号:20200411)、小鼠TaqMan PCR探针、FXR探针(批号Mm004845 23_m1)、SHP探针(批号:Mm00442278_m1)、BSEP探针(Mm00445168_m1)、FASN探针(Mm00662319_m1)、CD36探针(Mm00432403_m1)、FABP1探针(Mm00444340_m1)和GAPDH探针(批号:Mm 99999915_g1),均购于美国Thermal‑Fisher公司;FXR抗体(批号:ab129089),英国Abcam公司。
1.3 仪器与设备
Enspire plus多功能酶标仪(美国PerkinElmer公司);BT3000全自动生化分析仪(意大利爱康公司);BDU‑700核酸蛋白分析仪(美国Beckman公司);StepOne Plus Real‑time荧光实时定量PCR仪(美国ABⅠ公司);BX53奥林巴斯荧光显微镜(日本奥林巴斯公司)。
2 方法
2.1 小鼠原代肝细胞分离
按照LⅠU等[9]报道的方法,采用胶原酶消化肝组织法分离C57BL/6J野生型小鼠和FXR敲除小鼠原代肝细胞(MPH)。具体操作步骤:小鼠采用戊巴比妥钠麻醉后,75%(φ)乙醇皮肤消毒,打开腹腔,分离下腔静脉,插管,立即注入1 mL肝素(100 U)。采用37℃的KrebsRinger灌流液Ⅰ(1 mmol/L NaHCO3、50 mmol/Lglucose、10 mmol/L NaCl、1 mol/L HEPES(p H7.45)、48 mmol/L KCl、12 mmol/L KH2PO4、12 mmol/L MgSO4和5 mmol/L EGTA)按20 mL/min流速进行肝脏灌注50 mL灌流液Ⅰ,灌入的同时剪开门静脉。随后采用含0.5 g/L胶原酶ⅠⅠ的灌流液Ⅱ(1 mmol/L NaHCO3、50 mmol/L glucose、10 mmol/L NaCl、1 mol/L HEPES(p H7.45)、48 mmol/L KCl、12 mmol/L KH2PO4、12 mmol/LMgSO4和1 mmol/L CaCl2)进行灌流约10 min至肝脏软塌出现皲裂。剪下肝脏放置培养皿中,加入20 mL培养基,撕裂肝脏,形成肝细胞混悬液,细胞液用70µm细胞网滤过,收集滤液,50 g,离心3 min,弃上清,然后加入新鲜细胞培养基混悬。台盼蓝计数活细胞数(>80%活细胞数用于后续实验)。接种细胞,4 h后换液培养,并进行相关实验。
2.2 细胞培养与处理
MPH和HEK293T细胞在37℃的5%(φ)CO2培养箱里,使用10%(φ)FBS、100µg/mL链霉素和100 U/mL青霉素的DMEM培养基进行培养。MPH细胞按1×106种于6孔板中,细胞贴壁后,分为对照组(DMSO)、模型组、广藿香醇低、中、高剂量组(5、10、20μmol/L)和OCA组(10μmol/L)。模型组采用OA+PA(体积比2∶1,1 mmol/L)诱导24 h模拟细胞内脂质积蓄模型,对照组给予相应的生理盐水。各组细胞预先给予相应药物作用24 h后,随后加入OA+PA诱导24 h。
2.3 双荧光素酶分析
HEK293T细胞按5×104种于24孔板中,贴壁后,细胞采用FuGENE6转染试剂瞬时转染pCD‐NA3.1(500 ng/孔,对 照 质 粒)、pCDNA3.1‑hFXR(500 ng/孔)、pCDNA3.1‑BSEP‑luc(1 000 ng/孔)和pGL3‑CMV Renilla荧光素酶质粒(100 ng/孔)12 h,然后加入10μmol/L相应药物(OCA、广藿香醇、和厚朴酚、厚朴酚、乙酰泽泻醇A/B、茯苓酸、苦杏仁苷、琥珀酸、甘油三油酸酯等)治疗24 h后,对照组给予DMSO作为溶剂对照,采用Enspire plus多功能酶标仪,按照Promega双荧光素酶报告检测的方法,测定各组药物对BSEP‑luc荧光素酶活性的影响。
2.4 免疫荧光分析
MPH按1×104种于24孔板中,广藿香醇低、中、高剂量和OCA治疗24 h后,PBS冲洗2次,10%(φ)多聚甲醛固定20 min,PBS冲洗3次,0.5%Triton X‑100/PBS通透10 min,PBS冲洗3次,5%BSA封闭30 min,FXRⅠ抗(1∶200)4℃孵育过夜。PBS冲洗3次,加入FⅠTC荧光2抗,37℃避光孵育30 min,PBS冲洗3次,0.5µg/mL DAPⅠ染核5 min,PBS冲洗3次后,镜检。
2.5 ROS测定
MPH按1×104种于24孔板中,依次加入广藿香醇、OA+PA分别治疗24 h后,更换新鲜培养基,加入DCFH‑DA荧光探针孵育4 h,按照ROS检测试剂盒说明书进行操作,置于BX53奥林巴斯荧光显微镜观察并拍照。
2.6 MPH细胞脂质蓄积及TG含量测定
MPH细胞采用PBS冲洗3次,4%多聚甲醛固定20 min,60%(φ)异丙醇分化3 min,加入新鲜配置的油红O染色液染色20 min,PBS冲洗3次,苏木素染核30 s,PBS冲洗5次,置于显微镜下观察并拍照。并将各组细胞消化后,收集细胞,按照TG检测试剂盒说明书测定细胞内TG含量。
2.7 Real‑time PCR测定细胞中FXR信号和脂质合成相关基因mRNA表达水平
MPH细胞采用PBS冲洗2次,经Trizol试剂提取、纯化总mRNA、cDNA逆转录等步骤后,采用StepOne Plus Real‑time荧光实时定量qPCR仪测定细胞中FXR、SHP、BSEP、FASN、CD36和FABP1的mRNA相对表达量。Real‑time PCR反应体系:cDNA模板5µL,TaqMan探针1µL,ddH2O 4µL,TaqMan Fast Advanced Master Mix 10µL,总体积20µL。扩增条件:95℃2 min;95℃5 s、60℃30 s测定,40个循环。记录各组样品Ct值,以GAPDH作为内参基因,采用2-△△Ct法计算目的基因的相对表达量。
2.8 统计学方法
各项指标测定结果以表示,用Stata11.0统计软件进行统计,组间比较采用单因素方差分析,两两比较采用LSD‑t检验,以P<0.05为差异有统计学意义。
3 结果
3.1 藿朴夏苓汤成分广藿香醇对FXR信号的影响
为筛选激动FXR的成分,本研究对藿朴夏苓汤中代表性化学成分进行了BSEP‑luc荧光素酶报告基因活性分析。如图1所示,与对照组比较,阳性对照药OCA、广藿香醇和乙酰泽泻醇A/B显著提高BSEP‑luc荧光素酶报告基因活性,结果提示广藿香醇和乙酰泽泻醇A/B可激动FXR信号。

图1 藿朴夏苓汤成分广藿香醇对FXR信号的作用Figure 1 Patchoulialcohol activated FXRsignaling in MPH cells(±s,n=3)
考虑到广藿香是藿朴夏苓汤方中的君药,随后的实验都采用广藿香醇作为研究对象。与荧光素酶活性测定结果一致,与对照组比较,免疫荧光分析显示广藿香醇和OCA可提高MPH细胞内FXR的蛋白水平,并促进FXR入核作用。此外,与对照组比较,广藿香醇中、高剂量组可显著提高FXR及其下游靶基因SHP和BSEP的mRNA表达水平,差异有统计学意义(P<0.05,P<0.01)。
以上结果提示广藿香醇可激动FXR信号,可能是藿朴夏苓汤发挥降脂、抗NAFLD作用的关键成分之一。
3.2 广藿香醇对OA+PA诱导MPH细胞脂质水平的影响
与对照组比较,油红O染色实验显示,模型组中MPH细胞内红色脂滴聚集和TG水平明显增加,表明OA+PA诱导的细胞内脂质堆积增加。与模型组比较,广藿香醇中、高剂量组均可明显降低细胞内红色脂滴聚集和细胞内TG水平,差异有统计学意义(P<0.05,P<0.01)。结果表明,广藿香醇可显著降低OA+PA诱导的MPH细胞内脂质沉积作用。结果见图2和图3。
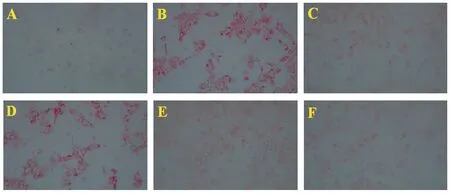
图2 广藿香醇对OA+PA诱导细胞内红色脂滴聚集的影响(油红O染色,200×)Figure 2 Patchoulialcohol decreased OA+PA‑induced lipid accumulation in MPH cells(200×)

图3 广藿香醇对OA+PA诱导细胞内TG含量的影响Figure 3 Patchouli alcohol reduced OA+PA‑induced TG level in MPH cells(±s,n=3)
3.3 广藿香醇对OA+PA诱导MPH细胞ROS形成的影响
结果见图4。与对照组比较,模型组中MPH细胞内DCFH‑DA荧光探针水平明显增加,表明OA+PA诱导的细胞内ROS形成。与模型组比较,广藿香醇中、高剂量组均可明显降低细胞内DCFH‑DA荧光探针水平。结果表明,广藿香醇可显著降低OA+PA诱导的MPH细胞内ROS形成作用。

图4 广藿香醇对OA+PA诱导细胞内红色脂滴聚集的影响Figure 4 Patchoulialcohol mitigated OA+PA‑induced ROSgeneration in MPH cells(200×)
3.4 广藿香醇对OA+PA诱导MPH细胞FXR信号和脂质合成相关基因mRNA表达的影响
结果见图5。与对照组比较,模型组细胞内FXR、SHP和BSEP的mRNA表达显著降低,而脂质合成基因FASN、CD36和FABP1的mRNA表达则明显升高,差异有统计学意义(P<0.01)。与模型组比较,广藿香醇中、高剂量组可显著提高OA+PA诱导MPH细胞内FXR信号(FXR、SHP和BSEP)的mRNA表达,而抑制脂质合成基因(FASN、CD36和FABP1)的mRNA表达,差异有统计学意义(P<0.05,P<0.01)。结果表明,广藿香醇可提高FXR信号,进而抑制OA+PA诱导的细胞内脂质合成作用。
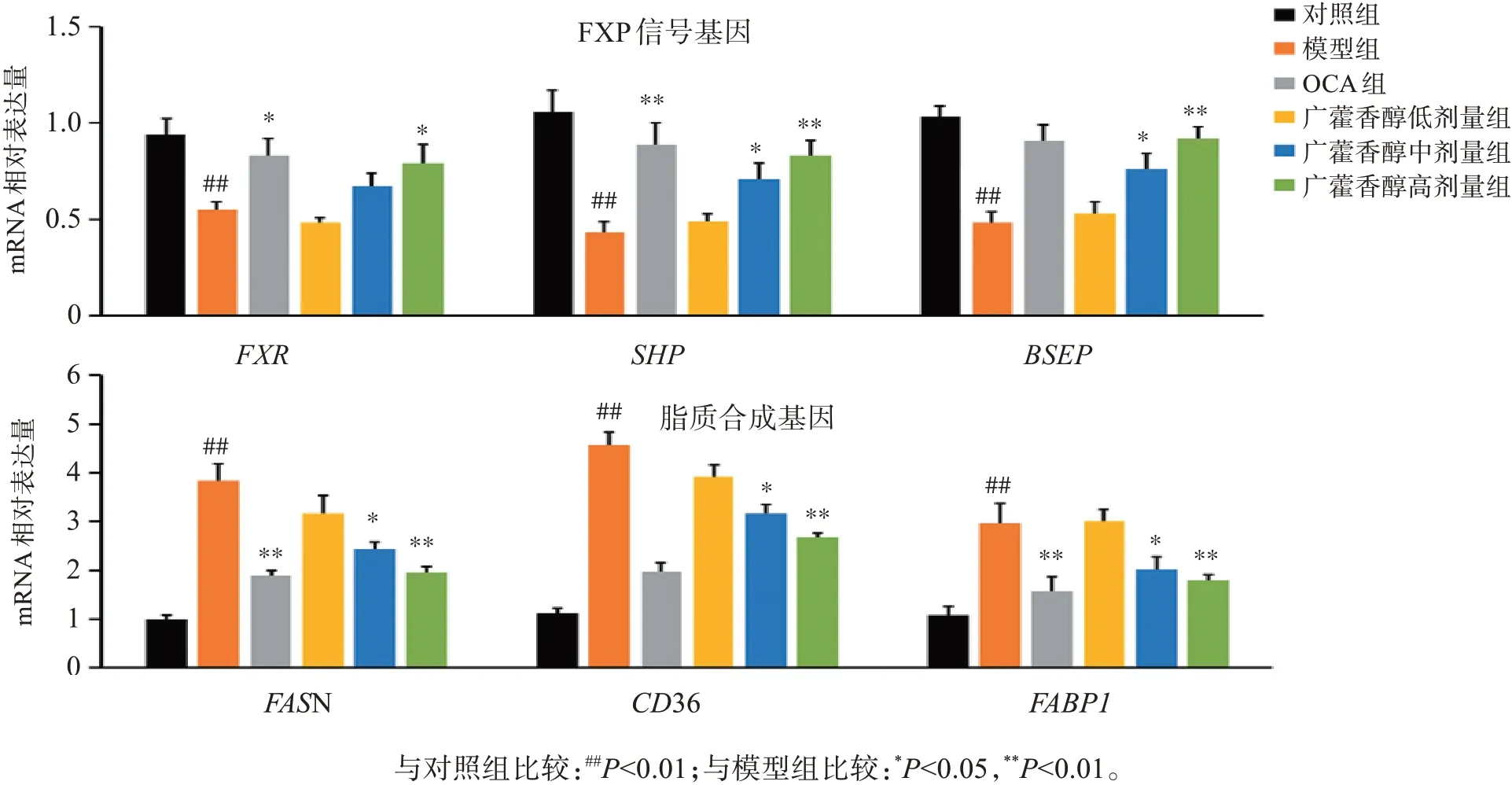
图5 广藿香醇对OA+PA诱导MPH细胞内FXR信号和脂质合成相关基因的mRNA表达水平的影响Figure 5 Effect of patchouli alcohol on the mRNA expression level of FXR signaling and lipid synthesis genes in MPH cells induced by OA+PA(±s,n=3)
3.5 FXR敲除后,广藿香醇对OA+PA诱导FXR敲除MPH细胞脂质水平积蓄作用的影响
为了进一步阐述广藿香醇激动FXR信号在降脂、抗NAFLD作用中的重要性,本研究进行分离FXR基因敲除小鼠的MPH细胞。在野生型MPH中,与模型组比较,广藿香醇高剂量组明显降低细胞内红色脂滴聚集和细胞内TG水平,差异有统计学意义(P<0.05,P<0.01);相反,在FXR敲除MPH中,与模型组比较,广藿香醇介导的细胞内脂滴积蓄和TG水平的降低作用则受到损害,差异无统计学意义(P>0.05)。结果表明,广藿香醇降低OA+PA诱导MPH细胞内脂质沉积作用依赖于FXR的激动作用。结果见图6和7。
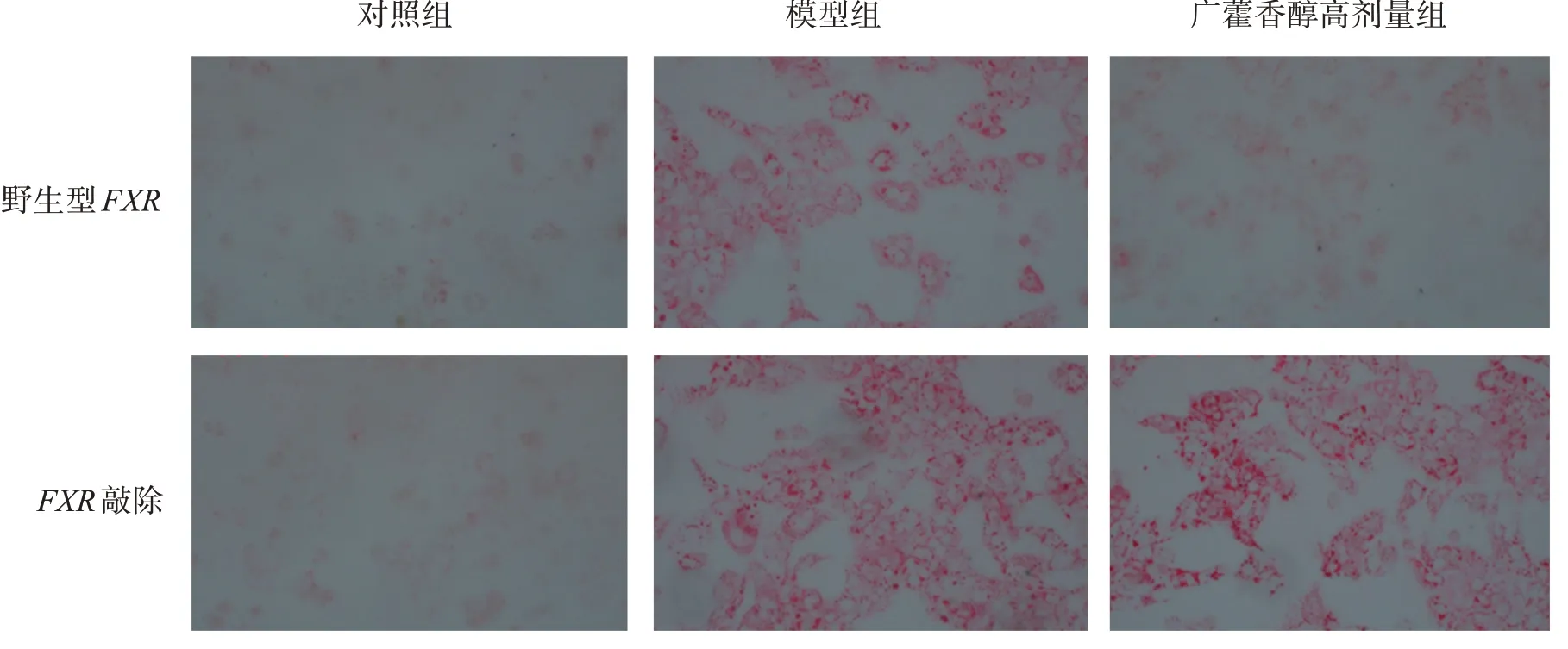
图6 FXR敲除后,广藿香醇对OA+PA诱导细胞内红色脂滴聚集的影响Figure 6 FXR deletion compromised patchouli alcohol‑mediated the decrease of lipid accumulation induced by OA+PA in MPH knockout cells(200×)
3.6 FXR敲除后,广藿香醇对OA+PA诱导FXR敲除MPH脂质合成相关基因的影响

图7 FXR敲除后,广藿香醇对OA+PA诱导FXR敲除MPH细胞内TG含量的影响Figure 7 Effect of patchouli alcohol on TG level in FXR‑deficient MPH cells induced by OA+PA(±s,n=3)
结果见图8。在野生型MPH中,与模型组比较,广藿香醇明显提高FXR信号FXR、SHP和BSEP的mRNA表达,而抑制OA+PA诱导的脂质合成基因FASN、CD36和FABP1的mRNA表达,差异有统计学意义(P<0.05,P<0.01);相反,在FXR敲除MPH中,与模型组比较,广藿香醇失去了脂质合成基因的抑制作用,差异无统计学意义(P>0.05)。结果表明,广藿香醇降低OA+PA诱导的MPH细胞内脂质合成基因的调控作用依赖于FXR的激动作用。

图8 FXR敲除后,广藿香醇对OA+PA诱导FXR敲除MPH细胞内脂质合成基因mRNA表达水平的影响Figure 8 The effect of patchouli alcohol on mRNA expression level of lipid synthesis genes in FXR‑knockout MPH cells induced by OA+PA(±s,n=3)
4 讨论
随着肥胖及相关代谢综合征全球化流行的趋势下,我国NAFLD发病率逐年升高,已成为最常见的肝脏疾病之一。NAFLD患者肝细胞内的脂质代谢障碍,致肝细胞脂质沉积,造成肝内脂肪变性、ROS形成,继而发生肝细胞炎症、胰岛素抵抗等,最终导致肝纤维化、肝硬化的发生、发展。到目前为止,NAFLD发病机制还未完全清楚,临床上也缺乏有效的治疗药物和措施。因此,该病严重威胁人们的健康,故开发研制针对NAFLD有效药物具有必要性及紧迫性。
NAFLD致脂质吸收增加,引起TG形成升高,而致肝脂肪变性,进而损害肝脏功能[10],因此,降低肝脏脂质含量的策略可能成为防治NAFLD的重要措施[10‑11]。脂质合成/吸收紊乱主要由于肝脏核受体(如FXR、PPARα、LXR等)的功能紊乱,从而失去对参与肝细胞脂质的合成/吸收等相关基因(合成基因FASN、SCD1、CD36、ACC、FATP1等)的作用调控[12‑14],导致肝脏脂质合成/吸收紊乱。FASN是脂肪酸合成的关键限速酶,其活性或基因表达的增加可促进脂质合成,抑制FASN的表达则显著降低肝脏脂质沉积,发挥改善NAFLD作用。研究显示NAFLD患者体内FXR和BSEP基因表达降低,且FXR敲除小鼠,引起脂质合成基因FASN、SCD1、ACC等表达升高,易于发生脂质紊乱,表明FXR是防治NAFLD一个重要靶点[15‑16]。相反,激动肝脏FXR,进而抑制FASN表达,可逆转高脂饮食诱导肝脂滴聚集和大泡性脂肪变性特征,发挥抗NAFLD作用[17‑18],表明FXR激动剂在防治NAFLD中意义重大。然而,目前临床上涉及靶向FXR防治NAFLD的药物仅限于OCA[19]。因此,开发低毒、有效的FXR激动剂迫在眉睫。
藿朴夏苓汤组方源自《医原》,方由广藿香、厚朴(姜制)、半夏(制)、茯苓、杏仁、薏苡仁、白蔻仁、淡豆豉、泽泻和通草组成,具有“理气化湿、疏表和中”之功效,临床用于湿温初起,湿重于热者,是临床常用治湿之良剂,临床和实验研究显示良好的保肝、降脂、抗NAFLD作用[3‑8],但抗NAFLD药理机制和物质基础不明。
考虑到FXR信号在NAFLD发病的重要性,本实验首先通过对方中的代表性成分如广藿香醇(广藿香的主要成分)、厚朴酚、和厚朴酚(厚朴的主要成分)、乙酰泽泻醇A/B(泽泻的主要成分)、茯苓酸(茯苓的主要成分)、苦杏仁苷(杏仁的主要成分)、琥珀酸(半夏的主要成分)、甘油三油酸酯(薏苡仁的主要成分)等,进行荧光素酶报告基因活性分析,筛选FXR激动剂。与Meng和Lin等报道一致[20‑21],本研究结果显示,广藿香醇和乙酰泽泻醇A/B升高BSEP‑luc荧光素酶报告基因活性,提高FXR蛋白表达和促进FXR入核作用,加强FXR信号的mRNA表达,并抑制脂质合成基因的表达,最终导致降低了OA+PA诱导MPH细胞内脂质堆积和ROS形成。FXR敲除实验显示,FXR敲除后,广藿香醇失去了对FXR信号的诱导作用,导致了损害广藿香醇改善OA+PA诱导脂质合成基因的抑制作用和改善MPH细胞脂质沉积作用。本实验结果验证了广藿香醇降脂作用主要是依赖于FXR的激动作用。
综上所述,本实验在MPH细胞水平上显示藿朴夏苓汤成分广藿香醇通过激动FXR信号通路,抑制脂质合成基因的表达,进而改善OA+PA诱导的MPH细胞脂质堆积和ROS形成的作用。
