UV法测定奥美沙坦酯氨氯地平片含量均匀度
2022-02-22王少泽魏顺发张伟
王少泽,魏顺发,张伟
(1.昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500;2.云南龙津康佑生物医药有限公司,云南 昆明 650503;3.昆明龙津药业股份有限公司,云南 昆明 650503)
奥美沙坦酯氨氯地平片是日本一三共公司研制的作用于AGTR1(angiotensinⅡreceptor type‑1)和VGCCS(voltage‑gated calcium channel)靶点的抗高血压复方制剂[1‑2]。2007年9月,FDA批准并以商品名Azor®在美国上市,2009年1月欧盟上市,商品名为Sevikar®。2018年7月,上海一三共公司获得中国国家药品监督管理局(NMPA)批准上市,商品名为“思卫卡”。作为抗高血压的一线用药,该药不仅对收缩压的降压作用强,且能够改善患者血管活性物质水平,安全可靠,具有显著的临床应用价值[3‑5]。
目前,奥美沙坦酯氨氯地平片的主要规格有:每片含奥美沙坦酯40 mg、氨氯地平10 mg;每片含奥美沙坦酯20 mg、氨氯地平5 mg;国内在售的主要规格是每片含奥美沙坦酯20 mg、氨氯地平5 mg[6]。2020年版《中国药典》规定,片剂中每片标示量≤25 mg或主药含量占片重的百分比≤25%,应依照规定对其含量均匀度进行检测[7]。《美国药典》第43版采用HPLC法进行奥美沙坦酯氨氯地平片的含量和含量均匀度测定,测定时需将进样器温度设为5℃,对仪器性能要求高,且检测时间长[8]。另外,国外有学者采用超高效液相色谱仪使该复方制剂的含量测定时间缩短,但操作繁琐、检测成本高[9]。本研究拟采用UV法对奥美沙坦酯氨氯地平片的含量均匀度进行测定,以期开发出一种准确、快速、经济的检测方法[10]。
1 仪器与试药
Thermo Evolution 350紫外/可见分光光度计;Shimadazu UV‑2700紫外/可见分光光度计;Agilent 1260型高效液相色谱仪;Sartorius SQP型天平;SK8200GR型超声波清洗器。
奥美沙坦酯氨氯地平片(规格:每片含奥美沙 坦酯20 mg、氨氯地平5 mg,批号:20201028、20201128‑2、20201224)和空白辅料(规格:每片含空白辅料80 mg,批号:20200928)均由云南龙津康佑生物医药有限公司提供;奥美沙坦酯对照品(批号:100864‑201904)和苯磺酸氨氯地平对照品(批号:100374‑201605)均由中国药品生物制品检定研究院提供;聚四氟乙烯滤膜(天津市圣信唯科技有限公司,规格0.45μm);尼龙滤膜(规格0.45μm)和聚醚砜滤膜(规格0.45μm)均由天津市津腾实验设备有限公司提供;乙腈(AR级),水(自制)。
2 方法及结果
2.1 检测波长的选择
分别精密称取40 mg奥美沙坦酯对照品和28 mg苯磺酸氨氯地平对照品(以氨氯地平计为20 mg),加稀释剂(乙腈‑水,体积比为1∶1)适量,溶解并稀释制成奥美沙坦酯质量浓度为20μg/mL和氨氯地平为10μg/mL的溶液,作为对照品溶液。精密称取80 mg的空白辅料置50 mL量瓶中,用聚四氟乙烯膜过滤,精密量取续滤液5 mL置25 mL量瓶中,加稀释剂定容,摇匀,过滤,取用续滤液,即得空白辅料溶液。取上述溶液在190~500 nm波长处进行扫描,结果见图1。

图1 UV全波长扫描图Figure 1 UV full‑wavelength scan
可见,奥美沙坦酯和苯磺酸氨氯地平分别在260 nm和360 nm波长附近有最大吸收,空白辅料在260 nm波长附近对奥美沙坦酯吸光度略有干扰,而在波长285 nm处空白辅料和空白溶剂无明显干扰,故将奥美沙坦酯的测定波长定为285 nm,苯磺酸氨氯地平的测定波长定于无任何干扰的360 nm。
2.2 溶液的制备
2.2.1 对照品溶液 分别精密称定奥美沙坦酯和苯磺酸氨氯地平(以氨氯地平计)对照品适量,加稀释剂制成含80μg/mL奥美沙坦酯和20μg/mL氨氯地平的对照品溶液。
2.2.2 供试品溶液 取本品10片,分别放入50 mL量瓶中,加稀释剂35 mL,超声(500 W、35 kHz)25 min,放冷至室温,加稀释剂定容,摇匀,用聚四氟乙烯膜过滤,精密量取续滤液5 mL置25 mL量瓶中,加稀释剂定容,摇匀,即得供试品溶液。过滤,取用续滤液。
2.3 测定原理
由于本公司生产的奥美沙坦酯氨氯地平片处方中的2个原料药分别是奥美沙坦酯和苯磺酸氨氯地平。计算奥美沙坦酯和氨氯地平的含量时,需先测出奥美沙坦酯和苯磺酸氨氯地平的吸光度,再按照对照品比较法计算奥美沙坦酯和苯磺酸氨氯地平的浓度。其中,测得的苯磺酸氨氯地平的浓度需乘以氨氯地平与苯磺酸氨氯地平的相对分子质量比值才是氨氯地平的浓度。在分别测定奥美沙坦酯和苯磺酸氨氯平对照品溶液时发现:奥美沙坦酯在285 nm波长处的吸光度约为0.55,360 nm波长处的吸光度约为-0.002;苯磺酸氨氯地平在285 nm波长处的吸光度约为0.02,在360 nm波长处的吸光度约为0.33。由此推算,奥美沙坦酯在360 nm波长处含量占氨氯地平含量<2%,对测定氨氯地平含量结果影响可忽略不计。但氨氯地平在285 nm波长处占奥美沙坦酯含量已超过2%,对测定奥美沙坦酯含量结果的影响不可忽略。按以下推导公式计算苯磺酸氨氯地平和奥美沙坦酯的浓度:

将上述测得的苯磺酸氨氯地平和奥美沙坦酯的浓度分别代入下列公式1和公式2中,即可分别计算出氨氯地平和奥美沙坦酯的含量:
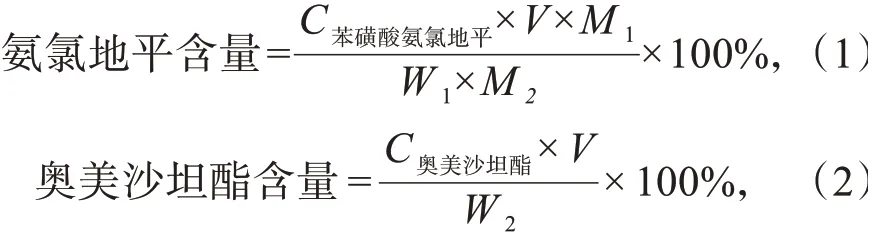
式中:V为稀释体积250 mL;M1为氨氯地平相对分子质量408.9;M2为苯磺酸氨氯地平相对分子质量567.1;W1为氨氯地平标示量5 mg;W2为奥美沙坦酯标示量20 mg。
2.4 标准曲线
2.4.1 氨氯地平标准曲线 精密称取苯磺酸氨氯地平对照品28.14 mg(以氨氯地平计为20.29 mg),用稀释剂溶解并定量稀释制成每1 mL含氨氯地平202.90μg的溶液作为对照品储备液。精密量取对照品储备液适量,用稀释剂稀释分别制成每1 mL含氨氯地平12.17、16.23、20.29、24.35、32.46μg的系列对照品溶液,在360 nm波长处测定吸光度值。以浓度(CAML)为横坐标、吸光度(AAML)为纵坐标进行线性回归,得回归方程AAML=0.016 2CAML+0.003 2,rAML=0.999 5,表明氨氯地平在12.17~32.46μg/mL浓度范围内与吸光度呈良好线性关系。
2.4.2 奥美沙坦酯标准曲线 精密称取奥美沙坦酯对照品40.19 mg,用稀释剂溶解并定量稀释制成每1 mL含奥美沙坦酯803.80μg的溶液作为对照品储备液。精密量取对照品储备液适量,用稀释剂稀释分别制成每1 mL含奥美沙坦酯48.23、64.30、80.38、96.46、128.61μg的系列对照品溶液,在285 nm波长处测定吸光度值。以浓度(COLM)为横坐标、吸光度(AOLM)为纵坐标进行线性回归,得线性回归方程为AOLM=0.006 7COLM+0.007,rOLM=0.999 9,表明奥美沙坦酯质量浓度在48.23~128.61μg/mL范围内与吸光度呈良好线性关系。
2.5 回收率试验
分别精密称取奥美沙坦酯对照品400 mg、苯磺酸氨氯地平对照品140 mg(以氨氯地平计约含100 mg)置100 mL量瓶中,加稀释剂超声溶解,并加稀释剂定容至刻度。即得每1 mL分别含奥美沙坦酯4 mg和氨氯地平1 mg的对照品储备液。
取9个50 mL量瓶,每份容量瓶中精密称取80 mg空白辅料。并按“2.2.1”项的对照品溶液浓度的70%、100%、130%分别移取上述储备液3.5、5、6.5 mL置含80 mg空白辅料的50 mL量瓶中,加稀释剂至容量瓶体积的70%,超声25 min,超声结束后稀释定容摇匀,过滤,精密量取续滤液5 mL置25 mL量瓶中加稀释剂定容,摇匀,过滤,弃去2~3 mL,取用续滤液,每个浓度平行制备3份,即得9份待测液[11]。将上述待测溶液于285 nm与360 nm波长处进行扫描测定。将测得的吸光度值代入“2.3”项推导公式中,可得到待测溶液中奥美沙坦酯与氨氯地平的浓度,从而分别求出奥美沙坦酯与氨氯地平的回收率。结果测得2种成分的回收率均在98%~102%范围内,RSD值<2%,表明空白辅料对2个主成分的检测几乎无干扰,见表1、表2。
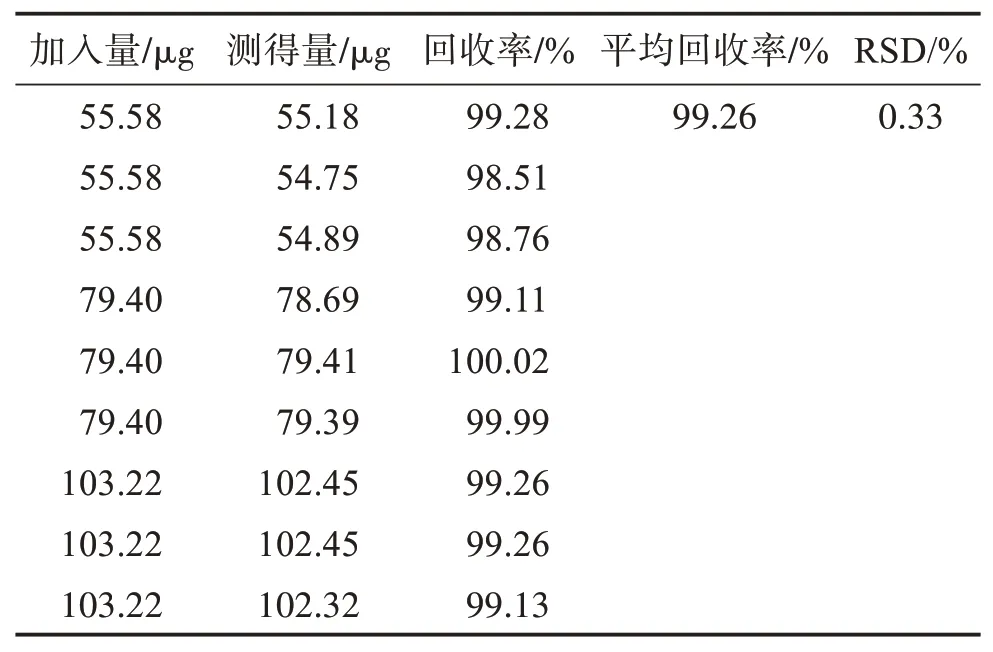
表1 奥美沙坦酯回收率试验结果Table 1 The results of olmesartan medoxomil recovery test
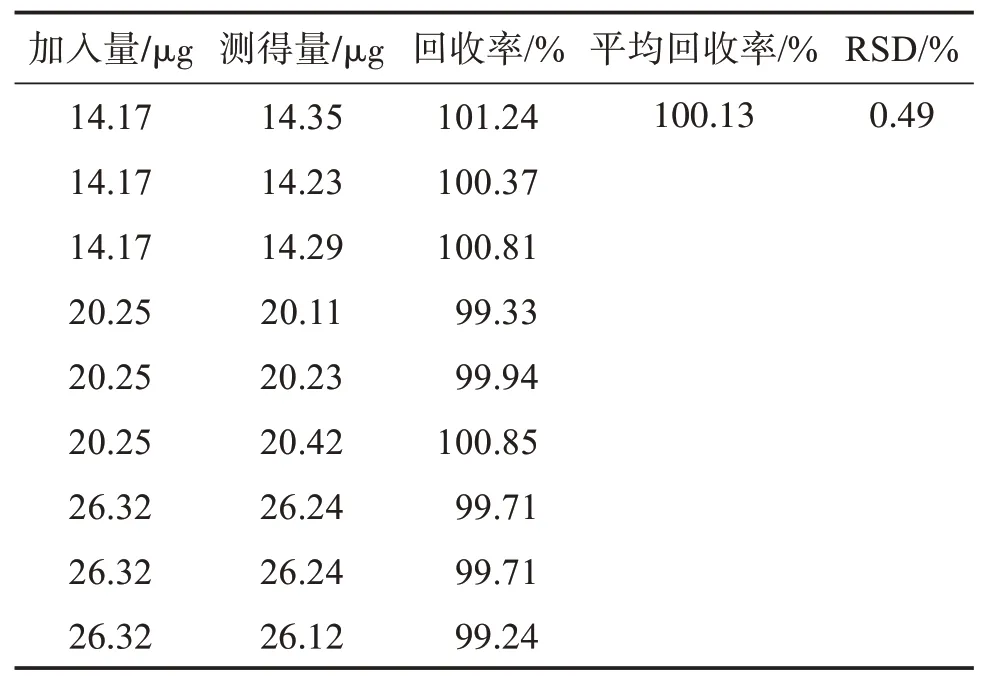
表2 氨氯地平回收率试验结果Table 2 Test results of amlodipine recovery rate
2.6 精密度试验
取1份供试品溶液分别在360 nm和285 nm波长处扫描6次,结果显示苯磺酸氨氯地平在360 nm波长处吸光度分别为0.330 2、0.330 2、0.330 3、0.330 3、0.330 5、0.330 7,RSD值为0.06%;奥美沙坦酯在285 nm波长处吸光度分别为0.566 3、0.566 7、0.567 8、0.568 3、0.568 6、0.568 4,RSD值为0.16%,表明仪器精密度符合要求。
2.7 重现性试验
取供试品(批号:20201224),分别在Thermo Evolution 350紫外/可见分光光度计、Shimadazu UV‑2700紫外/可见分光光度计上,使用不同的分析人员进行测试。其中Thermo Evolution350紫外/可见分光光度计上测得奥美沙坦酯平均质量分数为101.08%,A+2.2S为3.94,氨氯地平平均质量分数为99.70%,A+2.2S为0.86。Shimadazu UV‑2700紫外/可见分光光度计上测得奥美沙坦酯平均质量分数为99.40%,A+2.2S为7.13,氨氯地平平均质量分数为100.97%,A+2.2S为4.99,表明方法重现性良好。
2.8 稳定性试验
取1份供试品溶液,避光条件下室温放置0、2、4、6、8 h,于285 nm与360 nm波长处进行扫描测定,结果测得奥美沙坦酯在285 nm波长处吸光度为0.569 9、0.570 3、0.586 4、0.579 8、0.576 9,RSD值为1.07%;苯磺酸氨氯地平吸光度在360 nm波长处为0.320 5、0.322 6、0.333 8、0.326 0、0.326 7,RSD值为1.55%,表明供试品溶液在避光条件下室温放置8 h内稳定。
2.9 含量均匀度测定结果
按“2.2”项方法配制对照品溶液和供试品溶液,按“2.3”项方法进行样品含量均匀度测定,另参照《美国药典》第43版中奥美沙坦酯氨氯地平片质量标准中HPLC法含量均匀度测定相同3批奥美沙坦酯氨氯地平片的含量均匀度,结果见表3。可见,本文所建立的UV法与HPLC法测定的奥美沙坦酯氨氯地平片的含量均匀度结果基本一致。

表3 奥美沙坦酯氨氯地平片的含量均匀度测定结果Table 3 Determine result of the content uniformity of amlodipine and olmesartan medoxomil tablets
3 讨论
3.1 供试品浓度的选择
本研究选择的供试品测定浓度为含氨氯地平20μg/mL、奥美沙坦酯80μg/mL,结果显示苯磺酸氨氯地平在360 nm波长处的吸光度约为0.33,奥美沙坦酯在285 nm波长处的吸光度约为0.55,吸光度值均落在2020年版《中国药典》推荐的0.3~0.7范围内,且符合朗勃‑比尔定律[12]。
3.2 稀释剂的选择
有文献报道,在测定奥美沙坦酯氨氯地平片含量时,用乙腈与水混合进行溶解[13],故本研究尝试选用乙腈‑水(体积比1∶1)作为稀释剂,结果显示供试品溶解良好。
3.3 超声时间的考察
取同批样品30片,考察在不同超声(500 W、35 kHz)时间(5、25、45 min)下的含量均匀度,超声时应注意采用水循环或者加冰块的方式防止溶液温度过高从而导致主成分降解。分析结果发现3个超声时间点奥美沙坦酯的平均质量分数分别为97.45%、103.48%、99.61%,氨氯地平的平均质量分数分别为100.84%、105.01%、101.61%,测得结果均在93.0%~107.0%范围内,且A+2.2S≤15.0。根据质量标准,片剂的含量在(100.0±7.0)%范围是包含了检测误差的,本次测试复方制剂的各有效成分质量分数在此规定范围内,多次测定值之间的差值可以酌情放宽至5%。结合《美国药典》在测试该药含量时超声时间选择25 min,本研究选择超声时间为25 min也是可行的。
3.4 滤膜的筛选
分别用离心及聚四氟乙烯、尼龙、聚醚砜滤膜过滤的方式,对供试品溶液进行前处理,并于检测波长处进行吸光度测定,结果测得离心及3种滤膜在360 nm波长处苯磺酸氨氯地平的吸光度分别为0.336 5、0.331 8、0.335 4、0.338 3,在285 nm奥美沙坦酯波长处的吸光度分别为0.568 3、0.562 4、0.563 1、0.609 0。可见聚四氟乙烯、尼龙滤膜与离心几乎无差别,但聚醚砜滤膜与离心相差较大。考虑聚四氟乙烯滤膜所用材质稳定,本研究选用聚四氟乙烯滤膜。
本研究不足之处在于苯磺酸氨氯地平对照品溶液在285 nm波长处的吸光度过低(约为0.02),测定吸光度时受干扰因素较多。因此,平行制备的2份对照品溶液在此处响应因子(吸光度/浓度)比值很难达到98%~102%范围内,导致奥美沙坦酯的含量测定结果误差较大。本文选择将2份苯磺酸氨氯地平对照品溶液的285 nm波长处响应因子取平均值的方式代入“2.3”推导公式中来降低误差。
