对氯苯甲酸构筑的铜(Ⅱ)配合物的合成、HSA结合及细胞毒性
2022-02-22曾振芳黄秋萍庞华钰杨红兰黄秋婵
曾振芳,袁 芳,黄秋萍,庞华钰,杨红兰,黄秋婵
(广西民族师范学院化学与生物工程学院,崇左 532200)
0 引 言
铜是人体必要的微量元素,参与机体内许多生理过程,如细胞呼吸[1]、心血管健康[2]和代谢[3]。铜金属配合物的合成及性质研究受到了广大学者的关注,岳爱琴等[4]合成的两个铜(Ⅱ)配合物对体外HeLa、HepG2和SGC7901肿瘤细胞具有抑制增殖的能力。王大伟等[5]合成的2-羟基萘-1-甲醛Cu(Ⅱ)配合物对稻疫真菌具有抗菌活性。邓燕等[6]合成槲皮苷铜配合物具有P-糖蛋白抑制作用。HSA(人血清蛋白)是人体循环系统中含量最丰富的载体蛋白,它可以与许多内因性和外因性物质相结合,在储存和运输中起着重要的作用[7],因其易溶于水,且不易与其他物质反应,可以用作临床药物研究中的模型蛋白质,在临床医学和分子生物学中具有重要的应用价值[8]。抗肿瘤药物与蛋白质的相互作用关系及其引起的蛋白质的构象变化亦是其诱导肿瘤细胞凋亡作用机制研究的目标、内容和途径,故抗肿瘤药物与HSA间相互作用的研究在生命科学以及生物医药领域具有重要理论价值[9]。为了发现和发展新型金属配合物作为抗肿瘤药物,本文合成了一个新型对氯苯甲酸构筑的铜(Ⅱ)配合物 [Cu(pcba)2·(phen)(H2O)],通过红外、元素分析及 X-射线单晶衍射等方法对配合物进行表征及结构分析,并研究了配合物与HSA 的相互作用方式及配合物对胃癌细胞A549、宫颈癌细胞Hela和肝癌细胞HepG2的抗增殖能力。
1 实 验
1.1 主要仪器和试剂
实验仪器:XTL-220型显微镜(中国上海天省),Spectrum 65型傅里叶变换红外光谱仪(美国PerkinElmer),HERA cell CO2型细胞培养箱(美国Thermo),Smart ApexII CCD X 型X-射线单晶衍射仪(德国 Bruker),Multiskan Spectrum型酶标仪(美国Thermo),RF-5301 PC型荧光分光光度计(日本岛津),VarioEL Ⅲ元素分析仪(德国艾乐曼),常数毛细管黏度计(中国上海申谊),UV-8000型紫外可见分光光度计(中国上海元析仪器)。
实验试剂:对氯苯甲酸(上海阿拉丁生化科技),三水合硝酸铜(天津市光复科技),甲醇(成都市科龙化工试剂厂),三羟甲基氨基甲烷(Tris,武汉市恒沃科技),DMEM培养液(Hyclone),F12K培养液(Gibco),胎牛血清(Gibco),CCK-8试剂(Biosharp),0.25% 胰酶溶液(索来宝),人正常肝细胞LO2、胃癌细胞A549、宫颈癌细胞Hela和肝癌细胞HepG2(中国科学院细胞库),顺铂(上海麦克林生化科技),人血清蛋白(HSA,Sigma),三羟甲基氨基甲烷(Tris,武市恒沃科技)。缓冲溶液是pH值为7.2的Tris-HCl/NaCl溶液,缓冲溶液和人血清蛋白(HSA)溶液根据文献[10]配制。
1.2 配合物 [Cu(pcba)2·(phen)(H2O)] 的合成
称取对氯苯甲酸0.047 0 g (0.3 mmol)、1-10-菲罗啉0.018 1 g (0.1 mmol)和三水硝酸铜0.024 2 g (0.1 mmol),分别置于三个50.0 mL的烧杯中,各加5.0 mL甲醇将固体溶解,搅拌,将对氯苯甲酸溶液和1,10菲罗啉溶液分别滴至三水硝酸铜溶液中,滴加完毕,常温下搅拌30 min,保鲜膜封口,10 d后析出淡蓝色块状晶体,过滤后50 ℃下烘干。[Cu(pcba)2·(phen)(H2O)] 的分子式为C26H18Cl2CuN2O5,相对分子质量MW=572.86。元素分析理论值(%):C 54.51, H 3.17, N 4.89;实验值(%):C 54.38, H 3.12, N 4.78。IR(ν/cm-1): 3 414, 1 593, 1 388, 1 089, 1 017, 831, 776, 721, 533。
1.3 配合物的晶体结构测定
选择合适大小为0.26 mm×0.24 mm×0.18 mm的晶体置于CCD X 射线面探衍射仪上,衍射光源为石墨单色化的Mo-Kα(λ=0.071 073 nm),温度为300.75 K,数据收集角度范围为2.053°<θ<29.340°,衍射区为(-10≤h≤10,-12≤k≤14,-19≤l≤20),收集15 983个衍射点,其中独立衍射点有5 207个。结构分析工作采用OLEX2和SHEXTL-97软件完成。由理论加氢法确定氢原子的坐标,对氢原子和非氢原子分别采用各向同性和各向异性温度因子进行全矩阵最小二乘法修正。配合物的晶体学、主要键长与键角分别列于表1、表2。CCDC:2104589。R(int)=0.034 0,R1=0.035 9,wR2=0.089 1。

表1 配合物的晶体学数据Table 1 Crystallographic data of the complex
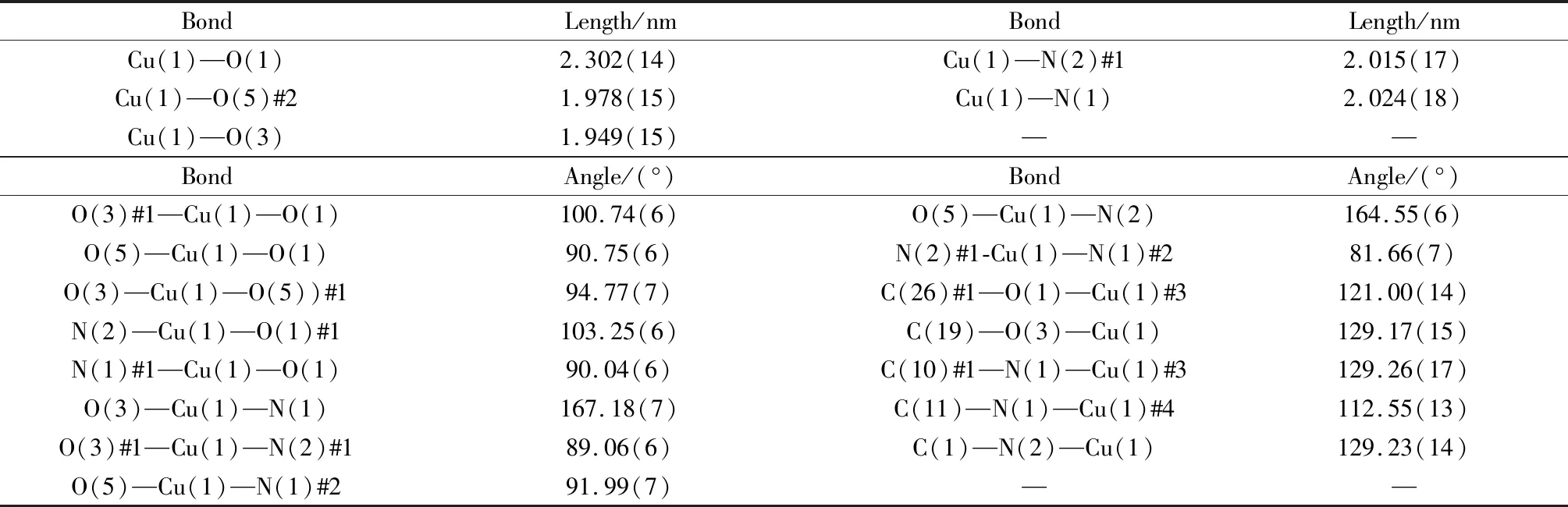
表2 配合物的主要键长和键角Table 2 Selected bond lengths and bond angles of the complex
1.4 配合物与HSA相互作用
1.4.1 紫外-可见吸收光谱
在样品池和空白池中分别加入2.5 mL 缓冲溶液校准基线,将样品池的缓冲溶液换成5 μmol·L-1的HSA溶液,并在250~300 nm的波长下扫描。用移液枪加入50 μL的配合物溶液(50 μmol·L-1),吹打混匀。室温下放置5 min后,在同样波长范围内扫描,共加7次配合物溶液。
1.4.2 荧光光谱
向样品池中加入2.5 mL的 5.0 μmol·L-1HSA溶液,最优激发波长为300 nm,在波长为320~365 nm下扫描。用移液枪加入30 μL的配合物溶液(50 μmol·L-1),吹打混匀,室温下放置5 min后,在同样波长范围内扫描,共加4次配合物溶液。
1.5 细胞毒性
将LO2、HepG2、HeLa和A549细胞消化,配制成浓度为5×104个/mL的细胞悬液,在96孔细胞培养板中每孔加入100 μL细胞悬液(每孔5×103个细胞),将细胞培养板在37 ℃、5%CO2条件下过夜培养,使用培养液(90%培养液+10%胎牛血清)配制不同浓度配合物溶液,每孔加入100 μL配合物溶液,每种浓度重复3次,细胞在37 ℃、5%CO2培养箱中培养48 h后弃上清液,培养液洗涤细胞1次,CCK-8染色,λ=450 nm下用酶标仪测定OD值。
2 结果与讨论
2.1 配合物晶体结构解析
配合物部分键长、键角列于表2,分子晶体结构如图1所示。
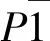
2.2 配合物与HSA的相互作用
2.2.1 紫外-可见吸收光谱
HSA与的配合物结合产生的紫外吸收光谱如图2所示。由于蛋白质结构α-螺旋化,HSA在273 nm处产生特征吸收峰。随着配合物浓度增大,273 nm处的吸收峰发生减色效应,表明配合物与HSA发生了相互作用[11]。
2.2.2 荧光光谱分析
HSA内部含有氨基酸残基,能吸收紫外线而发射内源性荧光。由图3可以看出,HSA强吸收峰在336 nm处,随配合物浓度增高,荧光强度由96.89%降低至78.49%,这是由于配合物对HAS发生荧光猝灭作用。蛋白质的荧光猝灭可分为两种,一是动态猝灭,为电子转移过程。二是静态猝灭,因结合而导致荧光猝灭[12]。判断荧光猝灭是动态猝灭还是静态猝灭,可以用Stern-Volmer方程:F0/F=1+Kqτ0[C]=1+Ksv[C][9],式中F和F0分别为加入和不加入配合物时EB-CT-DNA的荧光强度,Kq为分子猝灭过程的速率常数,Ksv为猝灭常数,τ0为猝灭剂不存在时荧光分子的平均寿命,[C]为猝灭剂的浓度。可求得Ksv=2.35×105L·mol-1,猝灭速率常数Kq=Ksv×108=2.35×1013L·mol-1·s-1,显然配合物对HSA的猝灭速率常数远大于药物小分子与生物大分子之间的最大扩散的碰撞猝灭常数2.0×1010L·mol-1·S-1[13],表明配合物对HSA的荧光猝灭是静态猝灭。对静态猝灭,以lg[(F0-F)/F]对lg[C]作图(见图4),计算得到配合物与HSA的结合常数Ka=2.14×1013L·mol-1,结合位点n=2.37,结合常数和结合位点比较大[14-16],说明所合成配合物和HSA的结合能力较强。
2.3 细胞毒性
配合物 [Cu(pcba)2·(phen)(H2O)] 对胃癌细胞A549、宫颈癌细胞Hela、肝癌细胞HepG2和肝细胞LO2作用48 h后细胞的IC50值见表3,由表3可知,配合物对四种细胞都具有抗增殖作用,相同条件下,配合物对三种癌细胞的抗增殖效果远远大于配体pcba,抗癌效果没有顺铂好,对四种细胞的毒性作用顺序为LO2>A549>HepG2>HeLa。本文合成的 [Cu(pcba)2·(phen)(H2O)] 细胞毒性不如文献[10]报道的配合物1细胞毒性效果好,[Cu(pcba)2·(phen)(H2O)] 的结构单元中含有两个对氯苯甲酸根,文献[10]报道的配合物1结构单元中含有四个4-氯3-硝基苯甲酸,可能是结构单元中氯原子和硝基的数量导致细胞毒性差异。

表3 配合物的对LO2、A549、HeLa和HepG2细胞的毒性Table 3 IC50 of the complex against LO2, A549, HeLa, and HepG2 cell
3 结 论

