干扰山羊KLF12促进皮下脂肪细胞分化
2022-02-22杜宇王永孟庆勇朱江江林亚秋
杜宇,王永,孟庆勇,朱江江,林亚秋
干扰山羊促进皮下脂肪细胞分化

1西南民族大学青藏高原动物遗传资源保护与利用教育部/四川省重点实验室,成都 610041;2西南民族大学畜牧兽医学院,成都 610041;3中国农业大学生物学院农业生物技术国家重点实验室,北京 100193
脂肪组织分为皮肤下的皮下脂肪组织(subcutaneous adipose tissue,SAT)和腹部内器官周围的内脏脂肪组织(visceral adipose tissue,VAT),皮下脂肪作为影响肉类美味与否的重要因素,探究皮下脂肪沉积分子调控机制对于育种改良和畜牧业的发展至关重要。Krüppel-like factors12 ()是一个进化保守的转录因子,可以在多种细胞类型中表达并控制着广泛的细胞过程。【】研究获得山羊的分子特征并进行生物信息学分析,同时明确在山羊组织和细胞中的表达模式以及干扰对山羊皮下脂肪细胞分化的调控作用,为进一步研究在脂肪沉积过程中的潜在作用提供理论依据。利用逆转录PCR(reverse transcription PCR,RT-PCR)方法克隆山羊完整编码序列(coding sequence,CDS)区,使用在线生物信息学分析软件对山羊核苷酸序列和氨基酸序列进行分析。利用实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)技术检测在山羊心脏、肝脏、腹部脂肪、皮下脂肪、臂三头肌、背最长肌等14个组织中的表达水平,以及诱导分化不同时间段在皮下前体脂肪细胞中的表达水平。随后,试验通过化学合成山羊小干扰RNA(si-),使用Lipofectamine RNAiMAX转染试剂将山羊si-序列转染到体外培养的山羊皮下前体脂肪细胞中。使用100 µmol·L-1油酸导液诱导脂肪细胞分化。利用油红O以及Bodipy染色方法和qRT-PCR技术分别从形态学以及分子生物学的角度阐明干扰对皮下前体脂肪细胞脂滴积聚和脂肪分化标志基因mRNA表达水平的影响。试验成功获得包含开放阅读框(open reading frame,ORF)(1 209 bp)的山羊(1 315 bp,编码402个氨基酸)。亚细胞定位结果显示KLF12主要位于细胞核,此外,KLF12无跨膜结构域和信号肽,且在317—341、347—371及377—399氨基酸处存在3个典型的锌指结构域(ZnF_C2H2)。组织表达谱结果显示在山羊心脏和脾脏的表达水平极显著高于其他组织(<0.01)。此外,在山羊皮下前体脂肪细胞分化过程中表达水平在诱导分化60 h时达到峰值。于山羊皮下前体脂肪细胞中转染si-后利用油红O以及Bodipy染色法从形态学观察发现脂肪细胞脂滴聚积明显增加,同时qRT-PCR结果显示,脂肪分化标志基因脂蛋白脂肪酶(lipoprteinlipase,)和过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,)的表达水平显著升高(<0.05)而前脂肪细胞生长因子(preadipocyte factor 1,)的表达水平极显著降低(<0.01)。结合形态学观察结果以及脂肪分化标志基因表达水平变化情况,推测在皮下脂肪细胞分化过程中起到负调控作用。通过对山羊的分子生物学特征、组织细胞间的表达规律以及对山羊皮下脂肪细胞分化过程的潜在调控作用的研究表明,是山羊皮下脂肪细胞分化过程中的负调控因子,并且这种作用可能是通过调控、和实现的,为进一步探究在调控脂肪细胞分化过程中的分子机制奠定了基础。
山羊;;分子特征;干扰;皮下脂肪细胞
0 引言
【研究意义】脂肪组织分为皮肤下的皮下脂肪组织和腹部内器官周围的内脏脂肪组织[1-2]。研究表明,皮下脂肪与调节胰岛素敏感性[3],保护葡萄糖耐量[4]和糖尿病[5]等密切相关。此外,皮下脂肪与肌肉和肌内脂肪一样,也是决定肉类美味与否的重要因素之一[6]。羊肉因其味道鲜美,口感独特从而越来越受广大消费者的青睐。因此,研究皮下脂肪沉积的分子调控机制对于育种改良和畜牧业的发展至关重要。【前人研究进展】Krüppel-like factors()是一个进化保守的转录因子簇,其C端区域包含3个可以与靶基因结合的Cys2-His2锌指DNA结合结构域,现有研究证实KLFs在多种细胞类型中表达并控制着广泛的细胞过程,包括细胞增殖、分化和胚胎的发育等[7–9]。近年来,已经确定哺乳动物KLFs家族的成员是调控前脂肪细胞形成、脂肪细胞分化和脂肪形成和肥胖的关键参与者[10-12]。例如,Banerjee等[13]研究发现在3T3-L1脂肪细胞中高度表达,并通过有效抑制脂肪生成标志基因过氧化物酶体增殖物激活的受体γ(PPARγ)的表达起到抑制脂肪细胞分化和脂肪生成的调控作用。郭红芳[14]研究表明,干扰和的表达均可抑制牛脂肪细胞中甘油三酯的积累。此外,牛脂肪细胞中可以促进启动子的转录活性,即对存在正向调节作用。是家族成员之一,最早被确定为激活蛋白2α(AP-2α)的阻遏物[15]。近年来关于的研究多集中于对卵巢癌[16]、胰腺癌[17]、胃癌[18]以及子宫内膜蜕化[19]等疾病的调控研究,而关于在调控脂代谢和脂肪沉积的相关报道较少。现有研究如Mei等[20]通过GWAS途径分析表明与糖尿病性状有显著关联。Shen等[21]研究指出tRNA衍生片段(tRF)在肥胖大鼠中可以直接靶标并促进3T3-L1前脂肪细胞增殖而抑制前脂肪细胞的分化。以上研究提示可能与脂代谢和脂肪细胞分化有关。【本研究切入点】本研究团队前期利用高通量测序发现是山羊皮下脂肪细胞分化前后的差异表达基因,推测其具有调控山羊皮下脂肪细胞分化的作用,所以明确山羊的分子特征、组织细胞表达模式以及在脂肪细胞分化过程中的转录调控机制对最终揭示的基因功能尤为重要。【拟解决的关键问题】拟克隆山羊序列并在此基础上利用在线软件对山羊进行生物信息学分析。利用实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)技术检测该基因在山羊各组织和皮下前体脂肪细胞分化过程中的表达模式。使用油红O染色和RNA干扰等方法从形态学及分子生物学角度检测抑制的表达对山羊皮下前体脂肪细胞分化的影响。进一步通过检测干扰后脂肪标志基因的表达情况,从而推测其在山羊皮下前体脂肪细胞分化过程中的潜在作用机制。为进一步研究在脂肪沉积过程中的潜在作用提供基础资料。
1 材料与方法
1.1 试验材料
I-5TM2×High-Fidelity Master Mix酶、TB GreenTMPremix Ex TaqTMⅡ、TRIzol和pMDTM19-T Vector Cloning载体购自宝生物工程(大连)有限公司; TreliefTM5α感受态细胞购于擎科新业生物技术有限公司(中国);胶回收试剂盒购于天根生化科技有限公司(中国);反转录试剂盒RevertAid First Strand cDNA Synthesis Kit和荧光染料Bodipy购自Thermo(美国);血清购自Gemini(美国);青链霉素、DME/F12培养基和0.25%胰酶购自Hyclone(美国);油酸购于Sigma(美国),转染试剂RNAi MAX Reagent购自Invitrogen(美国)。
1.2 试验方法
1.2.1 试验样品采集 试验所用组织样品在2018年12月于四川省简阳大哥大牧业有限公司完成采样。试验选用1周岁(公羊)健康大耳山羊(Jianzhou goat)(n=4),清晨空腹屠宰放血后立即取其各个内脏和肌肉等组织,用已灭菌的DEPC水处理组织后用锡箔纸包裹组织样品后置于冻存管中迅速放置液氮中储存。
1.2.2 山羊CDS序列克隆 以山羊脾脏cDNA为模板,根据GenBank中山羊预测序列(登录号:XM_005687692.3),利用Primer 5.0设计克隆引物(表1)。RT-PCR反应体系:I-5TM2×High- Fidelity Master Mix 12.5 μL,10 μmol·L-1上、下游引物各1 μL,模板cDNA 1 μL,ddH2O 9.5 μL。RT-PCR扩增程序:预变性98℃ 2 min;变性98℃ 10 s;退火58℃ 15 s;延伸72℃ 15 s;延伸72℃ 5 min;设定35个循环。1%琼脂糖凝胶电泳检测扩增片段,利用胶回收试剂盒收获预期片段,连接到pMDTM19-T Vector Cloning载体后转化于TreliefTM5α感受态细胞中培养,LB固体培养基培养10—12 h后挑取单菌落于干净的EP管中,加入含AMP的LB液体培养基培养4—6 h,进行菌液PCR鉴定,将符合预期片段的菌液送至成都擎科梓熙生物技术有限公司测序。

表1 引物信息
S.正义链引物;A.反义链引物;.广泛表达转录子基因(Ubiquitously-expressed transcript gene)
S. Sense primer;A. Antisense primer;Ubiquitously-expressed transcript gene
1.2.3 山羊生物信息学分析 利用NCBI对获得的序列进行开放阅读框预测,并翻译为氨基酸序列;利用NCBI中CD-search工具以及SMART在线软件进行蛋白结构域预测;使用MegAlign软件进行同源性分析。利用PSORT Ⅱ进行亚细胞定位;利用NPSA预测蛋白二级结构;利用TMHMM预测跨膜结构域,SignalIP4.1预测信号肽;使用Swiss-model预测蛋白三级结构;利用STRING进行蛋白构建蛋白互作网络;使用MEGA 7.0软件中邻接法(Neighbor-Joining,NJ)进行系统进化树分析。
1.2.4 构建山羊组织表达谱 根据克隆获得的山羊CDS区序列基因设计特异的qRT-PCR引物(表1),利用qRT-PCR技术检测该基因在山羊13种组织中的表达水平。qRT-PCR反应体系:10 μmol·L-1的上下游引物各1 μL、组织cDNA 1 μL、TB GreenTMPremix Ex TaqTMⅡ 10 μL、ddH2O 7 μL。qRT-PCR运行程序:预变性:95℃ 3 min,变性:95℃ 10 s,退火(:61℃,:60℃)10 s,延伸72℃ 15 s,38个循环。
1.2.5 山羊siRNA化学合成 根据克隆获得的山羊序列(KX247669.1)设计特异性siRNA,交由Invitrogen公司合成冻干粉,使用前12 000 r/min离心10 min后按照说明书加入1 mL RNase Free H2O溶解为终浓度20 µmol·L-1的溶液,于- 20℃保存。siRNA序列如下:siRNA 1: 5′-CAAACUGAGCCAG UGGACUUGUCCA-3′;siRNA 2: 5′-UGGACAAGUC CACUGGCUCAGUUUG-3′。阴性对照(Negative Control,NC)由Invitrogen公司提供。
1.2.6 山羊皮下前体脂肪的培养与si-RNA转染 37℃水浴锅复苏实验室储存的山羊皮下前体脂肪细胞,使用含10% FBS和0.1%青链霉素的完全培养基,F1代细胞接种于25 cm2细胞培养瓶中,F3代细胞接种于12孔板中,于37℃含5% CO2的细胞恒温培养箱培养。待F3代细胞铺板至80%时开始诱导分化并分别于诱导0、12、24、48、60和96 h后加TRIzol收细胞,提取细胞RNA。同时,F3代细铺板只80%左右开始转染(每组3个生物学重复),转染前4 h更换无血清培养基Opti饥饿细胞,转染6 h后更换100 μmol·L-1油酸导液。诱导分化48 h后收集细胞用于提取RNA。
1.2.7 油红O及Bodipy染色 用于染色的细胞接种于24孔板,处理方式同1.2.6。细胞用PBS缓冲液缓慢清洗2次,用10%甲醛固定细胞30 min,再用PBS缓冲液清洗2次之后加入油红O工作液染色30 min。用于Bodipy染色的细胞接种于24孔板,细胞转染及固定方法同上,PBS缓冲液清洗2次之后加入Bodipy染色工作液,避光染色15 min。染色结束后弃去油红/Bodipy工作液用并用PBS清洗数次直至显微镜下观察清晰,拍照记录结果。每个试验组3个重复。染色后的细胞按照每孔 1 mL 用量加入异丙醇以溶解细胞诱导分化产生的脂滴,混匀后等量加至 96 孔板中于 490 nm 波长测定OD 值。每组设置 5 个重复。
1.2.8 qRT-PCR检测 TRIzol法提取细胞总RNA后,使用Revert Aid First Strand cDNA Synthesis Kit反转录试剂盒反转录cDNA,qRT-PCR检测si-转染效率以及脂肪分化标志基因的表达变化。脂肪标志基因和si-引物信息见表2。
1.2.9 数据统计分析 qRT-PCR数据使用2-ΔΔCt法分析,利用SPSS 18软件单因素方差分析法进行差异显著性分析。利用GraphPad Prism 5软件绘图,数据表示为≧4个独立试验的均值±标准误即“Mean±SEM”。试验中所有数据均进行3次重复性检验。*:<0.05;**:<0.01。

表2 引物信息
S.正义链引物;A.反义链引物;.广泛表达转录子基因
S. Sense primer;A. Antisense primer;. Ubiquitously-expressed transcript gene
2 结果
2.1 山羊KLF12克隆
以山羊脾脏组织cDNA为模板,RT-PCR扩增获得基因序列1 315 bp(图1),其中包括5'UTR 序列52 bp、3'UTR序列54 bp和开放阅读框1 209 bp,基因编码402个氨基酸(图2-A)。提交GenBank获得登录号为:KX247669.1。使用NetPhos 3.1、CD-search及SMART在线软件预测山羊KLF12磷酸化位点以及结构域,结果发现在第9、15、33、38、42、48、77、91和92等处存在酪氨酸(Tyr)、丝氨酸(Ser)和苏氨酸(Thr)的磷酸化位点。此外,在第228—401氨基酸之间存在结构域,其中分别于317—341、347—371及377—399氨基酸之间存在3个典型的锌指结构域(ZnF_C2H2)(图2-B)。
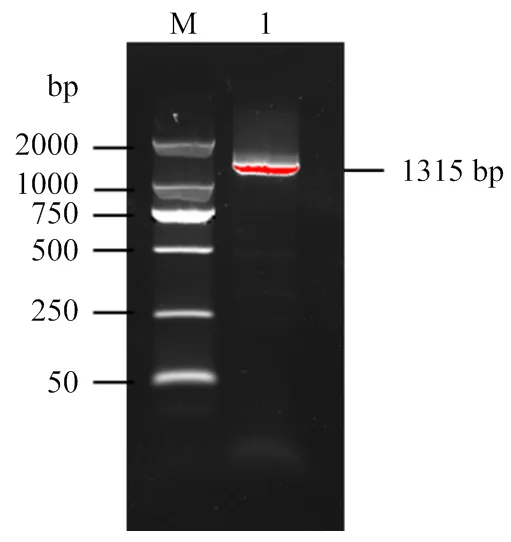
M:Marker D2000;1:KLF12基因扩增序列 The amplified sequence of KLF12
2.2 山羊KLF12生物信息学分析
使用PSORT Ⅱ进行亚细胞定位发现山羊KLF12有95.7%存在于细胞核,4.3%存在于线粒体,无信号肽剪切位点。使用TMHMM预测跨膜结构域发现山羊KLF12无跨膜结构域。比较物种间KLF12典型结构域发现,野牛、绵羊、马、人和猪等均存在与山羊KLF12相同结构域(图3-A)。NPSA二级结构预测结果显示山羊KLF12蛋白序列60个(14.93%)可能形成α螺旋,253个(62.94%)可能形成无规卷曲,89个(22.14%)可能形成延伸链(图3-B)。利用Swiss-model在线软件预测获得山羊KLF12蛋白三级结构如(图3-C)。进一步利用STRING构建山羊KLF12蛋白互作网络,结果显示KLF12可能与FSBP、SRBD1、MAGEB10、TYWS、TANC2、PARD3B和TFAP2A等蛋白发生相互作用(图3-D)。

A:核苷酸序列与氨基酸序列对比;黑色三角表示磷酸化位点;结构域用灰色底纹表示,方框表示ZnF_C2H2区域;起始密码子ATG和终止密码子TGA用方框表示;扩增引物用红色下划线标出;B:山羊KLF12结构域预测
2.3 KLF12同源性比对与系统进化树构建
利用NCBI及MegAlign软件对山羊核苷酸序列与野牛、绵羊、白鲸、马、猪、人、鼠、鸡、黑猩猩、狗和猫的核苷酸序列进行同源性分析如(图4-A),结果发现山羊与白鲸的同源性最高达到95.7%,此外与野牛、猫和马的同源性分别为92.2%、94.8%和95.3%。根据KLF12的氨基酸序列利用MEGA7.0构建了KLF12的氨基酸序列构建系统进化树,结果显示KLF12在哺乳动物之间属同一分支,山羊KLF12与绵羊和野牛亲缘关系较近(图4-B)。
2.4 山羊KLF12组织与细胞时序表达谱
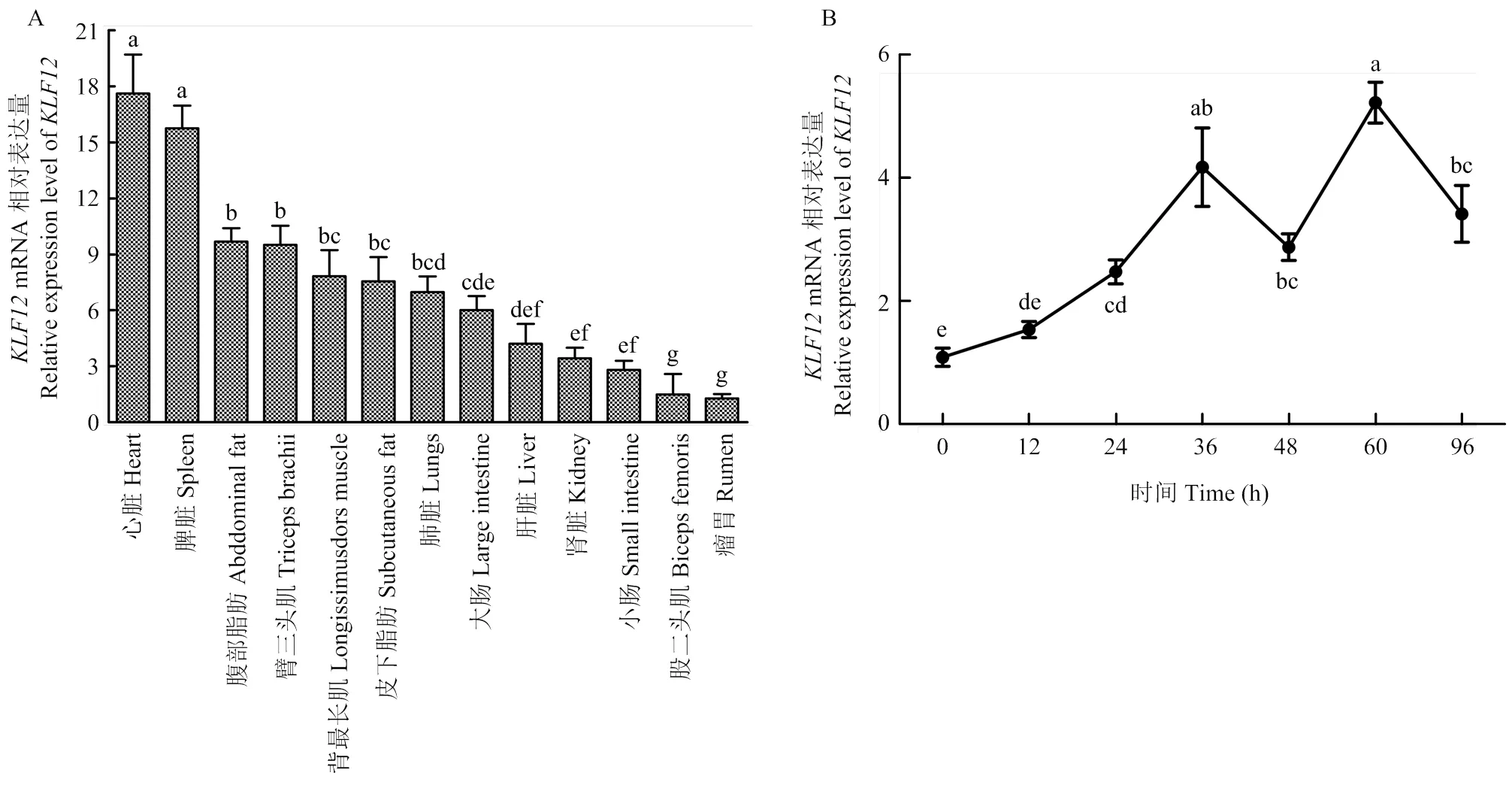
qRT-PCR检测山羊各组织中mRNA表达水平(图5-A)。选择UXT为内参基因[22-23],以瘤胃表达水平作对照。结果显示,广泛表达于山羊各个组织,其中心脏和脾脏的表达水平最高,极显著高于其他组织(<0.01),此外在皮下和腹部脂肪也有较高表达。检测mRNA在山羊皮下前体脂肪细胞诱导分化0—96 h的表达水平变化。结果显示,山羊在皮下前体脂肪细胞中的表达总体呈先上升后下降再上升的趋势,于诱导分化第60小时表达量达到峰值(图5-B)。

A:不同物种KLF12结构域比对;B:山羊KLF12二级结构预测;C:山羊KLF12蛋白三级结构预测;D:山羊KLF12蛋白相互作用预测
2.5 干扰KLF12促进山羊皮下前体脂肪细胞分化
为进一步探究在山羊皮下脂肪细胞中参与的分子机制,体外培养山羊皮下前体脂肪细胞,待F3代细胞铺板至80%时转染化学合成的- siRNA,转染完成后更换油酸诱导液诱导分化48 h后收集细胞。qRT-PCR检测siRNA干扰效率为50%,如图6-A。于490 nm处检测转染si-后OD值变化,结果显示,干扰后皮下脂肪细胞甘油三酯含量显著升高(<0.05),如图6-B,表明转染si-后脂质堆积能力显著增强。与此同时,油红O染色以及Bodipy染色从形态学上观察发现抑制的表达可促进山羊皮下前体脂肪细胞脂滴聚积(图6-C)。
2.6 干扰KLF12对脂肪分化标志基因的影响
收集转染si-后诱导分化48 h的细胞,qPCR检测脂肪标志基因表达水平变化(图7)。结果显示,与对照组相比,山羊皮下前体脂肪细胞中干扰显著上调LPL和(<0.05)的mRNA表达水平,而显著下调了(<0.01)的mRNA表达水平。
3 讨论
3.1 KLFs是脂肪细胞分化重要的转录调控因子
脂肪组织是一种高度动态的器官,可以介导系统体内的稳态。成人中,主要的脂肪组织库由白色脂肪组成,而白色细胞膨胀是肥胖症的标志[24-25]。研究表明,脂肪沉积是由脂肪细胞的数量和脂滴积累程度决定的,其中脂肪细胞的增殖和分化是高度协调的过程并受到大量转录因子以及多种细胞因子的调控[26-28]。KLFs家族是一类具有锌指结构的转录因子,大量研究已经证实KLFs在调控脂肪细胞分化过程中的重要作用。例如,猪前体脂肪细胞分化过程中干扰的表达,可显著抑制、CCATT/增强子结合蛋白α(CCATT/enhancer binding protein alpha,)和脂肪型脂肪酸结合蛋白(adipocyte fatty acid binding protein,)的表达进而抑制甘油三酯含量和脂滴聚积[29]。张娟娟[30]研究发现,miR- 20a-5p可直接靶标并通过靶向抑制3的表达促进小鼠原代骨髓间充质干细胞向脂肪细胞分化。

图4 不同物种KLF12同源性比对与系统进化树
用Duncan法表示差异显著性,不同字母表示P<0.01. n=6

A:siRNA干扰效率;B:甘油三酯含量;C:油红O和Bodipy染色;*:P<0.05;**:P<0.01

图7 皮下前体脂肪细胞中干扰KLF12对脂肪分化标志基因表达的影响
3.2 KLF12序列分析以及在山羊不同组织的相对表达量
本次试验基于NCBI上山羊预测序列设计引物克隆获得山羊序列1 315 bp,编码的402个氨基酸,预测发现山羊KLF12氨基酸序列具有9个磷酸化位点,并存在3个连续的典型锌指结构,与其他物种同源性较高。蛋白互作网络结果显示KLF12可能与FSBP、SRBD1、MAGEB10、TYWS、TANC2、PARD3B和TFAP2A等蛋白发生相互作用。其中Zheng等[31]使用全基因组关联分析(GWAS)研究表明,2是鲤鱼肌肉脂肪含量相关的潜在候选基因。Kim等[32]利用遗传力分析(GCTA)和GWAS等方法对猪和人肥胖性状研究表明是具有与2型糖尿病相关的证据的肥胖候选基因。此外,TFAP2A被证明与葡萄糖稳态平衡相关遗传变异转化为2型糖尿病有显著相关性[33]。物种之间同源性比较发现山羊与野牛、绵羊、马和白鲸等均有较高同源性,分别为92.2%、85%、95.3%和95.7%。与此同时,系统进化树结果显示与绵羊和野牛亲缘关系最近,这些结果提示在进化过程中有较高保守性。为阐明山羊功能,本论文利用qRT- PCR技术构建其在山羊各组织中的表达水平,结果显示,在心脏和脾脏的表达显著高于其他组织,并且在皮下脂肪和腹部脂肪也有较高的表达。研究发现,在腺病毒介导的人子宫内膜基质细胞(HESCs)中过表达可显著抑制胰岛素样生长因子结合蛋白-1(IGFBP-1)的表达和分泌[34]。如今,IGFBP家族已被确定为与一系列生理过程有关的推定信号分子,可以高亲和力结合胰岛素生长因子(IGF),并在肥胖、糖尿病和心血管疾病中起到重要作用[35-37]。
3.3 KLF12是山羊皮下前体脂肪细胞的负调控因子
以上研究提示在脂代谢和脂肪细胞分化过程中可能扮演重要角色,本次研究利用qRT-PCR方法检测在山羊皮下前体脂肪细胞诱导分化第60小时的表达量达到峰值。为进一步确认调控脂肪细胞分化的分子机制,将si-转染到体外培养的山羊皮下前体脂肪细胞中,形态学观察结果显示,干扰表达可显著促进脂肪细胞脂滴聚积,推测在成脂分化过程中起到负调控因子作用。此外,qRT-PCR检测脂肪分化标志基因表达变化情况,结果显示,山羊皮下脂肪细胞中干扰的表达可显著上调和的表达水平(<0.05),而极显著抑制的表达水平(<0.01)。研究表明,在脂肪组织中广泛分布,在棕色脂肪组织中与机体产热有关,在白色脂肪组织中的活性升高有助于脂质储存[38-40]。是葡萄糖和脂质体内稳态的核心核受体,是促进脂质摄取和脂滴形成的促脂肪生成因子[41-42]。是抑制脂肪生成的小鼠脂肪细胞祖细胞的既定标记,此外,也是成年女性皮下腹部脂肪基质细胞闲脂肪形成得到负调节剂[43-44]。本次试验中转染siRNA后表达水平极显著降低,结合形态学观察结果以及脂肪分化标志基因表达水平变化情况,推测在脂肪细胞分化过程中起到负调控作用。
4 结论
克隆获得具有典型锌指结构包含完整开放阅读框的山羊序列1 315 bp,编码402个氨基酸,无跨膜结构域和信号肽。山羊在心脏,皮下和腹部脂肪中存在较高水平表达,且在诱导分化60 h的山羊皮下前体脂肪细胞中存在高水平表达。干扰促进山羊皮下前体脂肪细胞脂滴聚积,并且这种作用是通过调节脂肪细胞分化标志基因、和的表达实现的。
[1] FUJISAWA T, KAGAWA K, HISATOMI K, KUBOTA K, SATO H, NAKAJIMA A, MATSUHASHI N. Obesity with abundant subcutaneous adipose tissue increases the risk of post-ERCP pancreatitis. Journal of Gastroenterology, 2016, 51(9): 931-938. doi: 10.1007/s00535-016-1160-x.
[2] LUO L, LIU M. Adipose tissue in control of metabolism. The Journal of Endocrinology, 2016, 231(3): R77-R99. doi: 10.1530/ JOE-16-0211.
[3] FOSTER M T, SOFTIC S, CALDWELL J, KOHLI R, DE KLOET A D, SEELEY R J. Subcutaneous adipose tissue transplantation in diet-induced obese mice attenuates metabolic dysregulation while removal exacerbates it. Physiological Reports, 2013, 1(2): e00015. doi: 10.1002/phy2.15.
[4] BOOTH A D, MAGNUSON A M, FOUTS J, WEI Y, WANG D, PAGLISSOTTI M J, FOSTER M T. Subcutaneous adipose tissue accumulation protects systemic glucose tolerance and muscle metabolism. Adipocyte, 2018, 7(4): 261-272. doi: 10.1080/21623945. 2018.1525252.
[5] CHEN P, HOU X, HU G, WEI L, JIAO L, WANG H, CHEN S, WU J, BAO Y, JIA W. Abdominal subcutaneous adipose tissue: A favorable adipose depot for diabetes?. Cardiovascular Diabetology, 2018, 17(1): 93. doi: 10.1186/s12933-018-0734-8.
[6] SONG B, DI S, CUI S, CHEN N, WANG H, WANG X, GAO Q, TONG G, WANG H, HUANG X, DING L, GAO Y, LIU J, WANG X. Distinct patterns of PPARγ promoter usage, lipid degradation activity, and gene expression in subcutaneous adipose tissue of lean and obese swine. International Journal of Molecular Sciences, 2018, 19(12): 3892. doi: 10.3390/ijms19123892.
[7] FERNANDEZ-ZAPICO M E, LOMBERK G A, TSUJI S, DEMARS C J, BARDSLEY M R, LIN Y H, ALMADA L L, HAN J J, MUKHOPADHYAYD, ORDOG T, BUTTAR N S, URRUTIA R. A functional family-wide screening of SP/KLF proteins identifies a subset of suppressors of KRAS-mediated cell growth. The Biochemical Journal, 2011, 435(2): 529-537. doi: 10.1042/ BJ20100773.
[8] GHALEB A M, NANDAN M O, CHANCHEVALAP S, DALTON W B, HISAMUDDIN I M, YANG V W. Krüppel-like factors 4 and 5: the yin and yang regulators of cellular proliferation. Cell Research, 2005, 15(2): 92-96. doi: 10.1038/sj.cr.7290271.
[9] RANE M J, ZHAO Y, CAI L. Krϋppel-like factors (KLFs) in renal physiology and disease. EBioMedicine, 2019, 40: 743-750. doi: 10.1016/j.ebiom.2019.01.021.
[10] HASHMI S, ZHANG J, SIDDIQUI S S, PARHAR R S, BAKHEET R, AL-MOHANNA F. Partner in fat metabolism: Role of KLFs in fat burning and reproductive behavior. 3 Biotech, 2011, 1(2): 59-72. doi: 10.1007/s13205-011-0016-6.
[11] GUO H, KHAN R, RAZA S H A, NING Y, WEI D, WU S, HOSSEINI S M, ULLAH I, GARCIA M D, ZAN L. KLF15 promotes transcription of KLF3 gene in bovine adipocytes. Gene, 2018, 659: 77-83. doi: 10.1016/j.gene.2018.03.049.
[12] MATSUBARA Y, AOKI M, ENDO T, SATO K. Characterization of the expression profiles of adipogenesis-related factors, ZNF423, KLFs and FGF10, during preadipocyte differentiation and abdominal adipose tissue development in chickens. Comparative Biochemistry and Physiology. Part B, Biochemistry & Molecular Biology, 2013, 165(3): 189-195. doi: 10.1016/j.cbpb.2013.04.002.
[13] BANERJEE S S, FEINBERG M W, WATANABE M, GRAY S, HASPEL R L, DENKINGER D J, KAWAHARA R, HAUNER H, JAIN M K. The Krüppel-like factor KLF2 inhibits peroxisome proliferator-activated receptor-gamma expression and adipogenesis. The Journal of Biological Chemistry, 2003, 278(4): 2581-2584. doi: 10.1074/jbc.M210859200.
[14] 郭红芳. KLF3和KLF15基因对牛前体脂肪细胞分化和脂质代谢调控研究[D]. 杨凌: 西北农林科技大学, 2018.
GUO H F. The function of KLF3 and KLF15 in Bovine preadipocyte differentiation and lipid metabolism[D]. Yangling: Northwest A&F University, 2018. (in Chinese)
[15] GODIN-HEYMANN N, BRABETZ S, MURILLO M M, SAPONARO M, SANTOS C R, LOBLEY A, EAST P, CHAKRAVARTY P, MATTHEWS N, KELLY G, JORDAN S, CASTELLANO E, DOWNWARD J. Tumour-suppression function of KLF12 through regulation of anoikis. Oncogene, 2016, 35(25): 3324-3334. doi: 10.1038/onc.2015.394.
[16] MAK C S L, YUNG M M H, HUI L M N, LEUNG L L, LIANG R, CHEN K, LIU S S, QIN Y, LEUNG T H Y, LEE K F, CHAN K K L, NGAN H Y S, CHAN D W. MicroRNA-141 enhances anoikis resistance in metastatic progression of ovarian cancer through targeting KLF12/Sp1/survivin axis. Molecular Cancer, 2017, 16(1): 11. doi: 10.1186/s12943-017-0582-2.
[17] HE Z, GUO X, TIAN S, ZHU C, CHEN S, YU C, JIANG J, SUN C. MicroRNA-137 reduces stemness features of pancreatic cancer cells by targeting KLF12. Journal of Experimental & Clinical Cancer Research: CR, 2019, 38(1): 126. doi: 10.1186/s13046-019- 1105-3.
[18] XUN J, WANG C, YAO J, GAO B, ZHANG L. Long non-coding RNA HOTAIR modulates KLF12 to regulate gastric cancer progression via PI3K/ATK signaling pathway by sponging miR-618. OncoTargets and Therapy, 2019, 12: 10323-10334. doi: 10.2147/OTT.S223957.
[19] HUANG C, JIANG Y, ZHOU J, YAN Q, JIANG R, CHENG X, XING J, DING L, SUN J, YAN G, SUN H. Increased Krüppel-like factor 12 in recurrent implantation failure impairs endometrial decidualization by repressing Nur77 expression. Reproductive Biology and Endocrinology: RB&E, 2017, 15(1): 25. doi: 10.1186/ s12958-017-0243-8.
[20] MEI H, LI L, GRISWOLD M, MOSLEY T. Gene expression meta-analysis of seven candidate gene sets for diabetes traits following a GWAS pathway study. Frontiers in Genetics, 2018, 9: 52. doi: 10.3389/fgene.2018.00052.
[21] SHEN L, TAN Z, GAN M, LI Q, CHEN L, NIU L, JIANG D, ZHAO Y, WANG J, LI X, ZHANG S, ZHU L. tRNA-derived small non-coding RNAs as novel epigenetic molecules regulating adipogenesis. Biomolecules, 2019, 9(7). doi: 10.3390/biom9070274.
[22] HE C, WANG Y, XU Q, XIONG Y, ZHU J, LIN Y. Overexpression of Krueppel like factor 3 promotes subcutaneous adipocytes differentiation in goat. Animal Science Journal, 2021, 92(1): e13514. doi: 10.1111/asj.13514.
[23] 池永东, 王永, 胡萌, 何小芳, 朱江江, 赵越, 林亚秋. 山羊不同组织器官的内参基因筛选. 基因组学与应用生物学, 2020, 39(2): 561-567. doi: 10.13417/j.gab.039.000561.
CHI Y D, WANG Y, GU M, HE X F, ZHU J J, ZHAO Y, LIN Y Q. Screening of internal reference genes in different tissues and organs of goats. Genomics and Applied Biology, 2020, 39(2): 561-567. doi: 10.13417/ j.gab.039.000561. (in Chinese)
[24] ORCI L, COOK W S, RAVAZZOLA M, WANG M Y, PARK B H, MONTESANO R, UNGER R H. Rapid transformation of white adipocytes into fat-oxidizing machines. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(7): 2058-2063. doi: 10.1073/pnas.0308258100.
[25] GAO Z, DAQUINAG A C, SU F, SNYDER B, KOLONIN M G. PDGFRα/PDGFRβ signaling balance modulates progenitor cell differentiation into white and beige adipocytes. Development (Cambridge, England), 2018, 145(1). doi: 10.1242/dev.155861.
[26] 苑洪霞, 骆金红, 冯文武, 陈祥. 猪LYRM1基因对脂肪沉积的影响研究. 畜牧兽医学报, 2019, 50(4): 677-687. doi: 10.11843/j.issn. 0366-6964.2019.04.001.
YUAN H X, LUO J H, FENG W W, CHEN X. Study on the effect of LYRM1 gene on the fat deposition of pig. Acta Veterinaria et Zootechnica Sinica, 2019, 50(4): 677-687. doi: 10.11843/j.issn.0366- 6964.2019.04.001. (in Chinese)
[27] 王香明. DNMT3A对猪肌内前体脂肪细胞增殖与分化的作用机制研究[D]. 杨凌: 西北农林科技大学, 2018.
WANG X M. The mechanism of DNMT3A in proliferation and differentiation of porcine intramuscular preadipocytes[D]. Yangling: Northwest A&F University, 2018. (in Chinese)
[28] MEHTA F, THEUNISSEN R, POST M J. Adipogenesis from bovine precursors. Methods in Molecular Biology (Clifton, N.J.), 2019, 1889: 111-125. doi: 10.1007/978-1-4939-8897 -6_8.
[29] 柴孟龙, 李青莹, 姜昊, 刘红羽, 张嘉保, 吕文发. 锌指蛋白15在猪前体脂肪细胞分化中的作用. 吉林农业大学学报, 2016, 38(3): 325-329+335. doi: 10.13327/j.jjlau.2016.3143.
CHAI M L, LI Q Y, JIANG H, LIU H Y, ZHANG J B, LÜ W F. Role of zinc finger protein15 in differentiation of porcine preadipocyte. Journal of Jilin Agricultural University, 2016, 38(3): 325-329+335. doi: 10.13327/j.jjlau.2016.3143. (in Chinese)
[30] 张娟娟. miR-20a-5p通过靶向Klf3调控小鼠骨髓间充质干细胞成脂分化的研究[D]. 天津: 天津医科大学, 2018.
ZHANG J J. MiR-20a-5p Modulates adipogenic differentiation in mouse bone marrow derived stromal cells by targeting Klf3[D]. Tianjin: Tianjin Medical University, 2018. (in Chinese)
[31] ZHENG X, KUANG Y, LV W, CAO D, SUN Z, SUN X. Genome-wide association study for muscle fat content and abdominal fat traits in common carp (). PloS One, 2016, 11(12): e0169127. doi: 10.1371/journal.pone.0169127.
[32] KIM J, LEE T, KIM T H, LEE K T, KIM H. An integrated approach of comparative genomics and heritability analysis of pig and human on obesity trait: Evidence for candidate genes on human chromosome 2. BMC Genomics, 2012, 13: 711. doi: 10.1186/1471- 2164-13-711.
[33] PALMER N D, GOODARZI M O, LANGEFELD C D, WANG N, GUO X Q, TAYLOR K D, FINGERLIN T E, NORRIS J M, BUCHANAN T A, XIANG A H,. Genetic variants associated with quantitative glucose homeostasistraits translate to type 2 diabetes in Mexican Americans: The GUARDIAN (Genetics Underlying Diabetes in Hispanics) Consortium[EB/OL]. Diabetes, 2015, 64(5): 1853-1866. doi:10.2337/ db14-0732.
[34] SHEN X, HU Y, JIANG Y, LIU H, ZHU L, JIN X, SHAN H, ZHEN X, SUN L, YAN G, SUN H. Krüppel-like factor 12 negatively regulates human endometrial stromal cell decidualization. Biochemical and Biophysical Research Communications, 2013, 433(1): 11-17. doi: 10.1016/j.bbrc.2013.02.078.
[35] HAYWOOD N J, SLATER T A, DROZD M, WARMKE N, MATTHEWS C, CORDELL P A, SMITH J, RAINFORD J, CHEEMA H, MAHER C, BRIDGE K I, YULDASHEVA N Y, CUBBON R M, KEARNEY M T, WHEATCROFT S B. IGFBP-1 in cardiometabolic pathophysiology-insights from Loss-of-Function and Gain-of-Function studies in male mice. Journal of the Endocrine Society, 2020, 4(1): bvz006. doi: 10.1210/jendso/bvz006.
[36] WHEATCROFT S B, KEARNEY M T. IGF-dependent and IGF- independent actions of IGF-binding protein-1 and -2: Implications for metabolic homeostasis. Trends in Endocrinology and Metabolism: TEM, 2009, 20(4): 153-162. doi: 10.1016/j.tem.2009.01.002.
[37] HAYWOOD N J, SLATER T A, MATTHEWS C J, WHEATCROFT S B. The insulin like growth factor and binding protein family: Novel therapeutic targets in obesity & diabetes[EB/OL]. Molecular Metabolism, 2019, 19:86-96. doi:10.1016/j.molmet.2018.10.008.
[38] PÉREZ-TORRES I, GUTIÉRREZ-ALVAREZ Y, GUARNER-LANS V, DÍAZ-DÍAZ E, MANZANO PECH L, CABALLERO-CHACÓN S D C. Intra-Abdominal Fat Adipocyte Hypertrophy through a progressive alteration of lipolysis and lipogenesis in metabolic syndrome rats. Nutrients, 2019, 11(7). doi: 10.3390/nu11071529.
[39] RUPPERT P M M, KERSTEN S. A lipase fusion feasts on fat. The Journal of Biological Chemistry, 2020, 295(10): 2913-2914. doi: 10.1074/jbc.H120.012744.
[40] NIMONKAR A V, WELDON S, GODBOUT K, PANZA D, HANRAHAN S, CUBBON R, XU F, TRAUGER J W, GAO J, VOZNESENSKY A. A lipoprotein lipase-GPI-anchored high-density lipoprotein-binding protein 1 fusion lowers triglycerides in mice: Implications for managing familial chylomicronemia syndrome. The Journal of Biological Chemistry, 2020, 295(10): 2900-2912. doi: 10.1074/jbc.RA119.011079.
[41] JEON Y G, LEE J H, JI Y, SOHN J H, LEE D, KIM D W, YOON S G, SHIN K C, PARK J, SEONG J K, CHO J Y, CHOE S S, KIM J B. RNF20 functions as a transcriptional coactivator for PPARγ by promoting NCoR1 degradation in adipocytes. Diabetes, 2020, 69(1): 20-34. doi: 10.2337/db19-0508.
[42] MORÁN-SALVADOR E, LÓPEZ-PARRA M, GARCÍA-ALONSO V, TIOS E, MARTÍNEZ-CLEMENTE M, GONZÁLEZ-PÉRIZ A, LÓPEZ-VICARIO C, BARAK Y, ARROYO V, CLÁRIA J. Role for PPARγ in obesity-induced hepatic steatosis as determined by hepatocyte- and macrophage-specific conditional knockouts. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 2011, 25(8): 2538-2550. doi: 10.1096/ fj.10-173716.
[43] RODEHEFFER M S, BIRSOY K, FRIEDMAN J M. Identification of white adipocyte progenitor cells. Cell, 2008, 135(2): 240-249. doi: 10.1016/j.cell.2008.09.036.
[44] MITTERBERGER M C, LECHNER S, MATTESICH M, KAISER A, PROBST D, WENGER N, PIERER G, ZWERSCHKE W. DLK1 (PREF1) is a negative regulator of adipogenesis in CD105+/CD90+/ CD34+/CD31−/FABP4−adipose-derived stromal cells from subcutaneous abdominal fat pats of adult women. Stem Cell Research, 2012, 9(1): 35-48. doi: 10.1016/j.scr.2012.04.001.
Knockdown Goatto Promote Subcutaneous Adipocytes Differentiation

1Key Laboratory of Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Utilization, Ministry of Education/Sichuan Province, Southwest Minzu University, Chengdu 610041;2College of Animal Science and Veterinary Medicine, Southwest Minzu University, Chengdu 610041;3State Key Laboratory for Agrobiotechnology, College of Biological Sciences, China Agricultural University, Beijing 100193
【】Subcutaneous adipose tissue (SAT) under the skin is an important factor affecting the taste of meat. Exploring the molecular regulation mechanisms of SAT deposition is very important for breeding improvement and the development of animal husbandry. Krüppel-like factors 12 () is a conserved transcription factor that evolutionarily conserved, and it was found that it could be expressed in a variety of cell types and control a wide range of cellular processes. 【】This study aimed to obtain the coding sequence (CDS) of goatand to explore its molecular characteristics. Moreover, the study also intended to clarify the expression pattern of, so as to provide a theoretical basis for further research on the potential role of【】In this study, the goatCDS sequence was cloned by Reverse Transcription PCR ( RT-PCR) method, and the nucleotide sequence and amino acid sequence of goatwere analyzed on online bioinformatics analysis software. The Quantitative Real-time PCR (qRT-PCR) technology was used to detect the expression levels ofsmall interfering RNA (si-) was chemically synthesized and transfected into goat subcutaneous preadipocyte in vitro by using Lipofectamine RNAiMAX transfection reagent. Subsequently, 100 µmol·L-1oleic acid induced adipocyte differentiation. Oil red O and Bodipy staining methods and qRT-PCR techniques were used to clarify the effects of interferenceon the accumulation of lipid droplets in subcutaneous preadipocytes and the mRNA expression levels of adipose differentiation marker genes from the perspectives of morphology and molecular biology. 【】The goat(1 315 bp) were successfully obtained, which contained an Open Reading Frame (ORF) (1 209 bp) and encoded 402 amino acids. The subcellular localization results showed that KLF12 was mainly located in the nucleus. In addition, KLF12 had no transmembrane domain and signal peptide but 3 typical zinc finger domains (ZnF_C2H2) at amino acids 317-341, 347-371 and 377-399. Tissue expression profile showed that the expression level of12 in goats’ heart and spleen were significantly higher than that in other tissues (<0.01). Moreover, during subcutaneous preadipocytes differentiation, the expression level of12 was peaked at 60 h. After transfection of si-into goat subcutaneous preadipocytes, the results of oil red O and Bodipy saining showed that accumulation of lipid droplets in adipocytes were significantly increased. At the same time, the results of qRT-PCR showed that the expression levels of key adipogenic regulatory genes like lipoprotein lipase () and peroxisome proliferator-activated receptor γ () were significantly increased (<0.05), while the expression level of preadipocyte growth factor () was extremely significantly reduced (<0.01). Combined with the morphological observation results and the changes in the expression levels of key adipogenic regulatory genes, it was speculated thatplayed a negative regulatory role in the differentiation of subcutaneous adipocytes. 【】By investigating the basic molecular biological characteristics and its expression pattern between tissues and cells of goatand analyzing the potential regulatory effects ofon differentiation process of goat subcutaneous adipocytes, the results suggested thatplayed a negative role in goats subcutaneous preadipocytes differentiation, and this effect achieved by regulating,and, which laid a foundation for further exploring the molecular mechanism of.
goat;; molecular characteristics; knockdown; subcutaneous adipocytes

10.3864/j.issn.0578-1752.2022.01.015
2020-11-10;
2021-10-31
国家自然科学基金(32072723,31672395)、四川省应用基础研究计划重点项目(2018JY0036)、西南民族大学中央高校基本科研业务费专项资金(2020PTJS15004)
杜宇,E-mail:dy17882230767@163.com。通信作者林亚秋,E-mail:linyq1999@163.com
(责任编辑 林鉴非)
