膜吸附法结合可视化环介导等温扩增技术检测柑橘黄龙病菌
2022-02-22李镇希李文婷黄家权郑正许美容邓晓玲
李镇希, 李文婷, 黄家权, 郑正, 许美容, 邓晓玲
膜吸附法结合可视化环介导等温扩增技术检测柑橘黄龙病菌
李镇希, 李文婷, 黄家权, 郑正, 许美容, 邓晓玲
华南农业大学植物保护学院,广州 510642
柑橘黄龙病(Huanglongbing,HLB)是由候选韧皮部杆菌亚洲种(‘Liberibacter asiaticus’,CLas)侵染引起的一种柑橘病害。对于该病害的防治主要采取综合措施,包括实施检疫、种植无病苗木、及时挖除病树和集中大面积联防联控柑橘木虱等。前3种方法都需要依靠准确的柑橘黄龙病诊断技术。【】利用环介导等温扩增技术(loop-mediated isothermal amplification, LAMP),结合膜吸附法DNA快速提取和Gelgreen荧光染料可视化,建立黄龙病田间核酸快速检测方法。以黄龙病菌-操纵子与原噬菌体DNA聚合酶基因为模板设计LAMP特异性引物,包括外引物F3/B3、内引物FIP/BIP、环引物LoopF/LoopB和茎引物StemF/StemB。通过对环引物和茎引物设定不同的用量组合,对LAMP引物体系进行优化,确定合适的引物浓度。用优化后的LAMP引物体系对188份田间柑橘叶片进行检测,并构建受试者工作特征(receiver operating characteristic,ROC)曲线分析实时荧光LAMP(qLAMP)在CLas检测上的准确性。对qLAMP预混反应液进行两步的常温干燥,分别设定不同的存放条件,评估LAMP常温干燥试剂的稳定性。用本研究建立的CLas可视化LAMP快速检测方法,对田间71个柑橘叶片样品和35个柑橘果实样品进行检测,与实时荧光定量PCR(qPCR)比较两者的符合率。在LAMP体系中加入环引物、茎引物或增加其浓度都能促进反应速率的提升,并且同时加入终浓度均为1.6 μmol·L-1的环引物和茎引物能进一步提高LAMP反应速率。LAMP预混液通过两步法干燥在不同温度存放1—4周均能保持反应活性基本不变,表明制备的两步法干燥LAMP试剂检测性能较好,在低温和常温环境下的稳定性尚可,仅35℃高温存放会略微增加LAMP试剂的反应时间。使用孔径0.1 μm尼龙膜代替纤维素滤纸作为核酸吸附材料能提升CLas快速诊断技术的灵敏度。结合DNA快速提取和可视化LAMP建立的CLas快速核酸诊断方法最低能检测到浓度为102copies/μL的重组质粒样品,总体准确率高。经配对卡方检验,该方法的诊断结果与qPCR无显著差异。可视化LAMP快速检测相较常规检测有着更低的成本和耗时,而且可视化LAMP快速检测无需离心机和PCR仪等昂贵的仪器,仅需一台65℃恒温设备即可。建立的CLas快速核酸检测方法成本低,30 min即可观察到检测结果,操作简便,准确性高,可替代qPCR在田间进行黄龙病的快速鉴定。
柑橘黄龙病;候选韧皮部杆菌亚洲种;田间检测;膜吸附法;DNA快速提取;可视化环介导等温扩增技术
0 引言
【研究意义】柑橘黄龙病(Huanglongbing,HLB)是由候选韧皮部杆菌亚洲种(‘Liberibacter asiaticus’,CLas)侵染引起的柑橘病害,在田间主要通过带病苗木和带菌的柑橘木虱()进行传播,是柑橘生产上的一种毁灭性病害。目前尚未有有效的药剂可以治疗柑橘黄龙病,对于该病害的防治主要采取综合的措施,包括实施检疫、种植无病苗木、及时挖除病树和集中大面积联防联控柑橘木虱等,前3种方法都需要依靠准确的柑橘黄龙病诊断技术。另外,密切了解果园中柑橘黄龙病的发病情况是防治的首要条件之一,通常果农会将疑似黄龙病的柑橘枝条交由专业的研究所或高校检测,但往往需要较高的检测成本和较长的检测时间。因此,建立黄龙病菌的田间快速检测技术对黄龙病的防治具有重要意义。【前人研究进展】田间诊断法被最早应用于症状鉴别,人们通过观察田间柑橘植株是否具有典型的黄龙病症状,来判断该植株是否感染黄龙病菌。在发病初期,柑橘植株通常表现为黄梢,病叶会出现斑驳型黄化或缺锌状黄化[1]。但叶片的症状受营养条件、气候环境和生长时期等多种因素影响,单从叶片症状就鉴定柑橘植株是否感染黄龙病菌并不可靠[2]。实时荧光定量PCR(qPCR)利用了DNA指数扩增期间的相对荧光强度变化来实时分析目的基因的拷贝数变化趋势,具有操作简便、快速和高灵敏度的特点;其次,在封闭的体系中完成扩增并进行实时测定,大大降低了气溶胶污染的可能性[3]。2004年,我国首次建立柑橘黄龙病菌qPCR检测体系[4]。2000年,Notomi等[5]发明了一种新的DNA扩增方法——环介导等温扩增技术(loop-mediated isothermal amplification,LAMP),根据目标基因的6个特异性序列设计两对引物,在具有强烈的链置换活性的DNA聚合酶参与下,可以使DNA无需热变性过程就能大量扩增,降低了对设备的要求;2005年,Okuda等[6]首次根据黄龙病菌KJAL-B操纵子序列设计引物,建立了一种检测黄龙病菌的LAMP方法。之后,利用LAMP技术诊断柑橘黄龙病的研究逐渐增多[7-17],但是将目前的研究应用到黄龙病田间诊断仍有一定的局限性,例如引物靶标设计在种间差异较大的原噬菌体短串联重复区域[7],引物间形成二级结构造成假阳性[9],对操作人员的技术要求较高,试剂需要在低温下运输储存和诊断耗时较长等。而Keremane等[12]利用便携式的实时荧光恒温仪快速检测柑橘木虱体内黄龙病菌的-操纵子与原噬菌体DNA聚合酶基因保守序列获得较好的效果,但对于植物样本快速检测的研究仍然较少[9,18]。【本研究切入点】基础的两对引物LAMP反应速率较慢,通常需要反应60 min以上[13-17],检测耗时长,本研究通过设计和加入环引物和茎引物来加快反应速率。实验室常用的DNA提取试剂盒和LAMP试剂盒难以在田间使用,迫切需要操作和使用简易的DNA提取技术和LAMP试剂。【拟解决的关键问题】利用LAMP常温干燥试剂,结合膜吸附法DNA快速提取技术,建立CLas田间核酸快速鉴定技术,为后续CLas田间检测试剂盒的开发提供理论基础和技术指导。
1 材料与方法
1.1 材料
1.1.1 植物材料 柑橘叶片采集:2018年9月至2020年9月,从广东省惠州博罗杨村、梅州、肇庆、广州从化等不同地区的果园和华南农业大学长岗山网室采集疑似感染黄龙病和健康的不同柑橘品种叶片,柑橘品种包括砂糖橘(cv. Shatangju)、尤力克柠檬()、沙田柚(cv. Shatian Yu)、红心蜜柚(cv. Guangximiyou)、年橘(cv. NianJu)、贡柑(var. Gonggan)、甜橙()、红橘(cv. Tangerina)、沃柑(var. Orah)。
柑橘果实采集:2019年7月,从广东省惠州博罗杨村果园和广州从化柑橘果园分别采集疑似感染黄龙病和健康枝条上的砂糖橘和沃柑果实。
采集叶片和果实时尽量保证材料不受损伤,把样品放入保鲜塑料封口袋中,用湿纸巾包好进行保湿保鲜。样品从田间采回实验室后,置于4℃冰箱保存备用。
1.1.2 主要试剂 E.Z.N.A.® HP Plant DNA Kit(200)试剂盒购自OMEGA BIO-TEK公司;2.0 WarmStart®DNA Polymerase、10×Isothermal Amplification Buffer、100 mmol·L-1MgSO4Solution购自纽英伦生物技术(北京)有限公司;EveGreen(20×水溶液)购自上海翊圣生物有限公司;SuperGreen/GelGreen核酸染料(10 000×水溶液)购自兰杰柯科技有限公司;TMGreen qPCR SuperMix购自北京全式金生物技术有限公司。
1.2 方法
1.2.1 CLas DNA的常规提取 采用OMEGA BIO- TEK公司的E.Z.N.A.® HP Plant DNA Kit试剂盒,称取柑橘叶片叶中脉或果实橘络约0.1 g,参考试剂盒说明书提取样品不同部位的柑橘总DNA。
1.2.2 CLas DNA的膜吸附法提取 具体提取步骤如下:(1)吸附核酸的膜材料圆盘制备:使用打孔器制备直径为3 mm的纤维素滤纸或尼龙膜(孔径0.1 μm)小圆盘若干,用于核酸的吸附。(2)柑橘组织裂解液的配制:裂解液包含20 mmol·L-1Tris(pH 8.0)、25 mmol·L-1NaCl、2.5 mmol·L-1Na2EDTA、0.05% SDS、3% PVP和2% DTT。(3)膜材料漂洗液的配制:漂洗液包括75%乙醇溶液和吐温缓冲液。吐温缓冲液包含10 mmol·L-1Tris(pH 8.0)和0.1%吐温-20;(4)DNA的提取:在处理不同的样品和部位前,均用工业酒精对剪刀、刀片和镊子进行消毒。用剪刀剪取叶片中脉组织。将果实的果皮拨剥开,用镊子从囊壁和果皮上小心撕出橘络。每个样品的不同部位各称取约0.01 g植物组织,置于1.5 mL的离心管中,并加入50 μL柑橘组织裂解液,用一次性研磨棒研磨30 s。将核酸吸附材料圆盘浸入柑橘组织裂解液中至少3 s,然后转移到200 μL的75%乙醇溶液和吐温缓冲液中先后洗涤至少3 s。最后将圆盘转移至配制好的反应体系中进行DNA扩增或浸泡在TE缓冲液中洗脱获得DNA粗提取物。
1.2.3 CLas的实时荧光PCR检测 参考Zheng等[19]使用RNRf/RNRr引物检测CLas的方法,采用PerfectStartTMGreen qPCR SuperMix试剂盒进行实时荧光PCR检测,具体操作步骤参考试剂盒说明书。
1.2.4 实时荧光/可视化LAMP的引物设计和CLas检测 从Genbank数据库上获取CLas菌株A4(CP010804)的全基因组序列,根据LAMP引物设计要求,以基因簇B-E-G-KAJL-B与原噬菌体DNA聚合酶基因作为靶基因拟定各LAMP引物序列,通过引物设计软件Oligo 7分析各引物之间的二聚体发生情况,确定本研究的LAMP引物,引物序列见表1。

表1 柑橘黄龙病菌LAMP检测引物序列
实时荧光LAMP(qLAMP)反应体系包含F3/B3引物各0.4 μmol·L-1,FIP/BIP引物各1.6 μmol·L-1,LoopF/LoopB和StemF/StemB各0.4—1.6 μmol·L-1,1×Isothermal Amplification Buffer,MgSO46 μmol·L-1,dNTPs 1.4 μmol·L-1,2.0 DNA Polymerase 0.32 U·μL-1,1×Evegreen,DNA模板1 μL,其余补充ddH2O至10 µL。将以上混合体系置于CFX ConnectTMqPCR检测系统上进行扩增,反应温度为65℃,反应时间为30 min,每分钟采集一次荧光强度信号。
1.2.5 实时荧光/可视化LAMP常温干燥试剂的制备和田间应用 LAMP反应干燥试剂的制备方法参考Diego等[20]的方法稍作改良。具体操作如下:将1.36 μL引物和0.224 μL海藻糖(2 mol·L-1)混匀置入0.2 mL离心管底部,于真空浓缩仪以V-AQ模式常温干燥30 min。然后,将1.4 μL dNTPs、0.4 μL聚合酶和0.6 μL海藻糖(2 mol·L-1)混匀加至沉淀底部,可视化LAMP需要将1 μL 800×Gelgreen核酸荧光染料加到离心管管盖上,以相同模式室温干燥15 min。在进行LAMP反应前,往LAMP干燥试剂加入1 μL 10×LAMP Buffer、0.6 μL MgSO4(100 mmol·L-1)和1 μL DNA模板,qLAMP则需要加入0.5 μL Evegreen,最后补充去离子水使最终体积为10 μL,并且加入10 μL液体石蜡防止LAMP反应液蒸发。
将干燥LAMP试剂分别保存在常温环境(25℃)、低温环境(4℃)和高温环境(35℃)中,分别于干燥第1周、第2周和第4周复溶后进行qLAMP扩增检测,并设置未干燥的新鲜配制qLAMP试剂为对照组。通过可视化LAMP快速检测技术检测106个柑橘田间样品,与常规检测方法比较,使用Microsoft Excel软件对不同干燥方法和存放条件的Tt值进行线性拟合比较不同处理对qLAMP的影响。以常规提取检测方法作为金标准,统计不同样本通过膜吸附法结合可视化LAMP快速检测的准确率。使用MedCalc 19软件进行ROC曲线分析膜吸附法结合可视化LAMP快速检测的敏感性和特异性。使用IBM SPSS 26软件对快速检测和常规检测的结果进行配对表格的McNemar检验和Kappa检验。
2 结果
2.1 CLas LAMP检测引物的设计和评价
CLas LAMP检测引物A3的引物设计如图1所示,其中CLas-F1c和CLas-StemF之间,CLas-B1c、CLas-LoopB和CLas-StemB之间有部分序列重叠。靶序列长度为189 bp,引物经过在线BLAST软件比对到NCBI基因组数据库中的CLas全基因组上,未发现存在SNP。各引物之间通过引物设计软件Oligo 7分析,未预测到影响较大的引物二聚体。
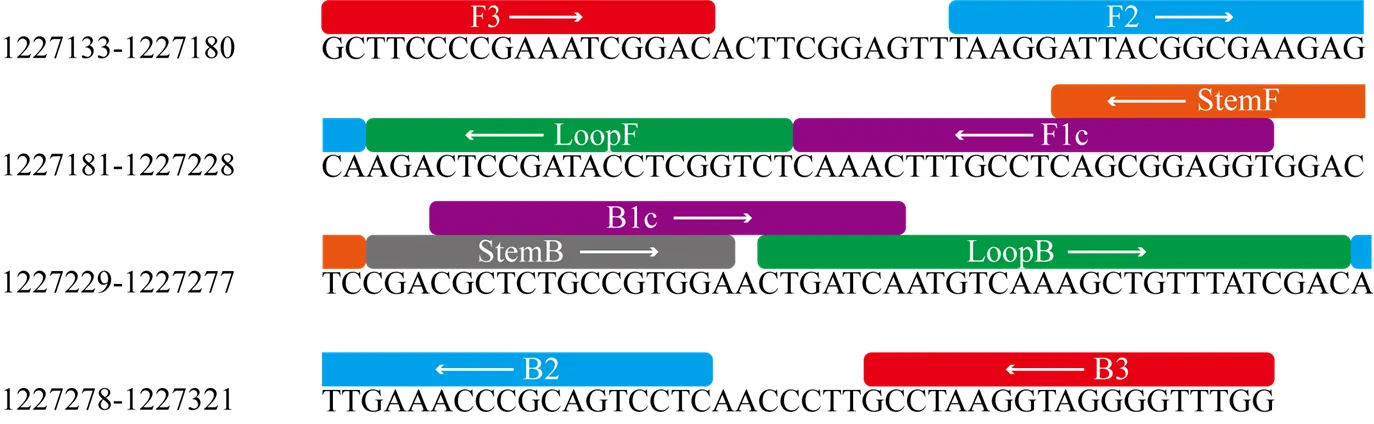
图1 LAMP引物与黄龙病菌菌株A4基因组比对示意图
进行qLAMP后,熔解曲线呈单峰,扩增曲线呈典型的S型动力学曲线,指数期和平台期明显,为理想的熔解曲线和扩增曲线,如图2所示。
2.2 CLas LAMP检测引物体系的优化
通过在LAMP反应体系中加入不同浓度的环引物和茎引物,比较qLAMP在不同反应条件下的Tt值,绘制Tt值随目的片段重组质粒浓度对数值变化的标准曲线,筛选环引物和茎引物的最佳浓度,结果如图3所示。单独加入0.4 μmol·L-1茎引物的LAMP反应扩增效率最低,反应所需时间较长。其余反应条件均有接近的扩增效率,随着环引物浓度增加,反应所需时间缩短,但浓度高于1.6 μmol·L-1时提升不明显。当环引物和茎引物的总浓度在1.6 μmol·L-1以上时,环引物和茎引物等浓度加入反应体系中对反应速率的提升要高于单独添加环引物。
以RNRf/RNRr-qPCR结果作为金标准,当Ct值小于32时判定为阳性,评价A3-qLAMP诊断CLas的准确性。通过ROC曲线分析,ROC曲线下面积为0.995(图4),qLAMP的最佳诊断Tt值为8.03,敏感性为100%,特异性为96.24%,说明qLAMP检测CLas的效果良好。

图2 polA3-qLAMP的扩增曲线和熔解曲线

图3 不同环引物和茎引物浓度下qLAMP的标准曲线

图4 qLAMP诊断黄龙病菌的ROC曲线
两种检测方法诊断黄龙病结果的配对四格表如表2所示,qLAMP在最佳诊断Tt值下和qPCR的诊断结果一致性优良(Kappa=0.937,<0.001);qLAMP的真阳性率为91.67%,真阴性率为100%,总体准确率为97.34%。经McNemar检验,两种检测方法诊断结果无显著差异(>0.05),表明在田间检测中可用qLAMP代替qPCR鉴定柑橘黄龙病。

表2 RNRf/RNRr-qPCR与qLAMP诊断黄龙病结果
2.3 LAMP检测试剂的常温干燥
通过两步法干燥的qLAMP试剂与液态未干燥qLAMP试剂(对照试剂)的检测效果,评价常温干燥试剂的生物活性。Gelgreen核酸荧光染料常温干燥后摊平黏附在管盖内,呈橙红色蜡质固体;LAMP预混液常温干燥后聚集于管底,呈半透明胶状固体。用于干燥LAMP试剂复溶的溶液中含有与对照试剂相同浓度的模板。与液态未干燥qLAMP试剂相比,经过干燥程序的常温干燥试剂生物活性有所下降,但常温干燥试剂在3个存放温度条件之间,扩增效率均没有发生明显变化,只有存放在高温环境中的干燥试剂随存放时间增加,相同浓度模板下的Tt值有所上升,扩增标准曲线见图5。

A:在4℃存放 Stored at 4℃;B:在25℃存放 Stored at 25℃;C:在35℃存放 Stored at 35℃
用两步法干燥LAMP试剂和相同模板进行Gelgreen可视化LAMP检测,比较干燥LAMP试剂在不同温度存放条件下的灵敏度。如图6所示,常温和高温环境下存放1周的灵敏度为102copies/μL,随存放时间增加,常温环境下的灵敏度没有变化,而高温环境下的灵敏度从第2周开始下降为103copies/μL,低温环境下存放1周的灵敏度为101copies/μL,在第4周下降为102copies/μL。
利用Gelgreen-可视化LAMP比较纤维素滤纸和尼龙膜(孔径0.1 μm)快速提取DNA的效果,结果如图7所示。以纤维素滤纸作为核酸吸附材料时,Gelgreen-可视化LAMP的灵敏度为103copies/μL,而且阴性管中的纤维素滤纸在紫外灯下也发出微弱的荧光;以尼龙膜(孔径0.1 μm)作为核酸吸附材料时,Gelgreen-可视化LAMP的灵敏度为102copies/μL。
2.4 膜吸附法结合可视化LAMP快速检测田间样品
采用膜吸附法结合可视化LAMP快速检测田间71个柑橘叶片样品和35个柑橘果实样品,验证黄龙病可视化LAMP检测(快速检测)的可行性,以DNA试剂盒法提取和RNRf/RNRr-qPCR(常规检测)作为对照,当Ct值小于32时判断为阳性。部分叶片检测结果如图8所示,快速检测能有效检出不同柑橘品种和症状叶片中的CLas,其中斑驳型黄化叶片的检测结果均为阳性,“绿岛”、缺素型黄化叶片的检测结果既有阳性也有阴性,对少数无明显症状的叶片也能检测出阳性结果。

同一存放条件的8个管依次加入了不同拷贝数的黄龙病菌LAMP阳性质粒(分别为107、106、105、104、103、102、101、100 copies/μL)

A:纤维素滤纸 Cellulose filter paper;B:尼龙膜 Nylon membrane。从左往右依次从含有浓度为105、104、103、102、101、100、0 copies/μL CLas β-操纵子重组质粒的植物组织液中快速提取核酸 Nucleic acids were rapidly extracted from plant tissue extract containing CLas β-operon recombinant plasmids with concentrations of 105, 104, 103, 102, 101, 100, 0 copies/μL, respectively
快速检测方法和实验室常规检测方法诊断黄龙病结果的配对四格表如表3所示,快速检测和常规检测诊断结果一致性较好(Kappa=0.867,<0.001);快速核酸检测方法的真阳性率为98.18%,真阴性率为88.24%,总体准确率为93.40%。经McNemar检验,两种检测方法诊断结果无显著差异(>0.05)。

表3 可视化LAMP快速检测与常规检测诊断黄龙病结果
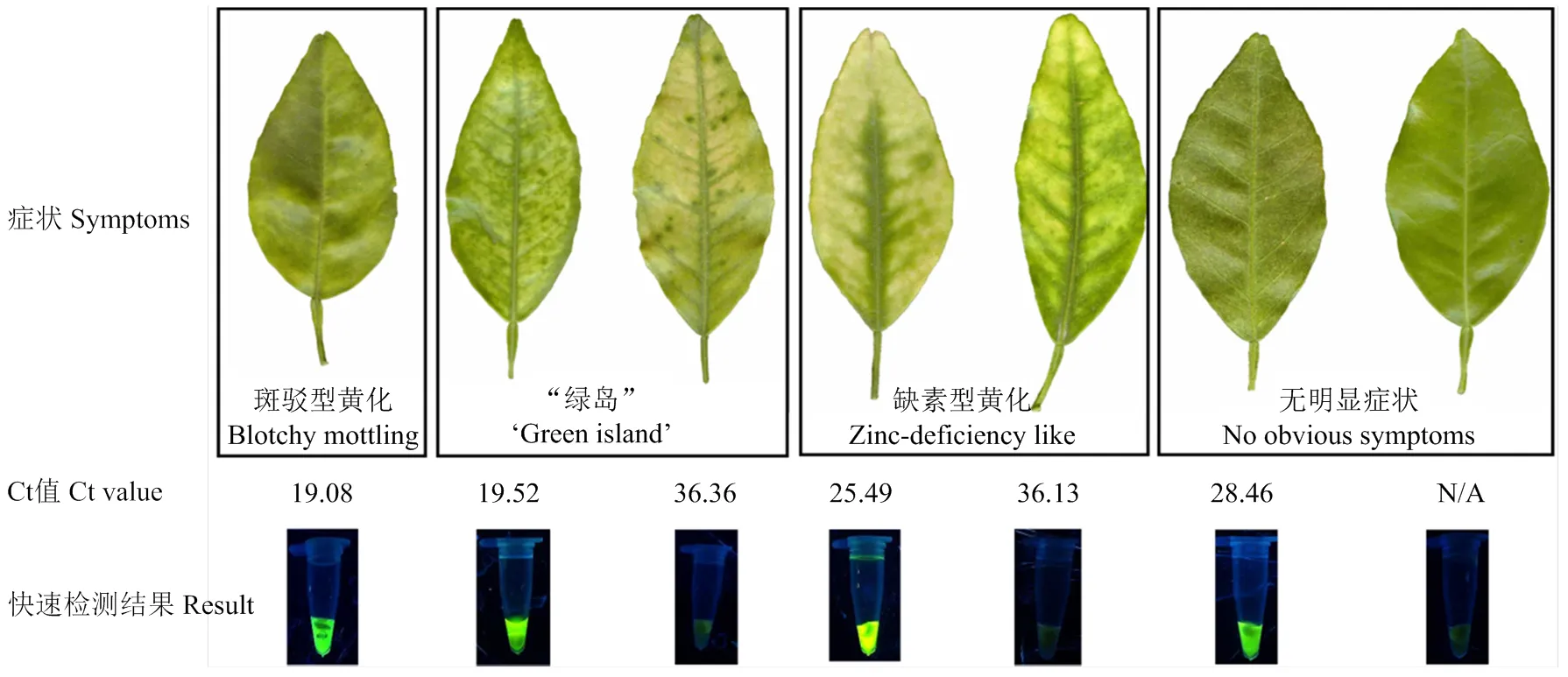
N/A:未产生Ct值/未确定No Ct value or undetermined
叶片样品共计71个,其中快速检测结果与常规检测结果一致的样品有65个,符合率为91.55%;有一个样品的快速检测结果为阳性而常规检测结果为阴性,假阳性率为1.41%;有5个样品的快速检测结果为阴性而常规检测为阳性,假阴性率为7.04%。其中显症叶片35个,无明显症状叶片36个,快速检测结果与常规检测结果一致的样品分别有33和32个,符合率分别为94.29%和88.89%,假阳性率分别为0%(0/35)和2.78%(1/36),假阴性率分别为5.71%(2/35)和8.33%(3/36)。果实样品共计35个,其中快速检测结果与常规检测结果一致的样品有34个,符合率为97.14%;果实样品的快速检测没有假阳性,但有一个样品出现假阴性,占所有样品的2.86%。
膜吸附法结合可视化LAMP快速检测每个样品的耗材成本和耗时相比于DNA试剂盒法提取和qPCR检测(常规检测)都大幅度降低,其中,快速检测的成本降低了85%,而耗时缩短了69%,具体信息如表4所示。
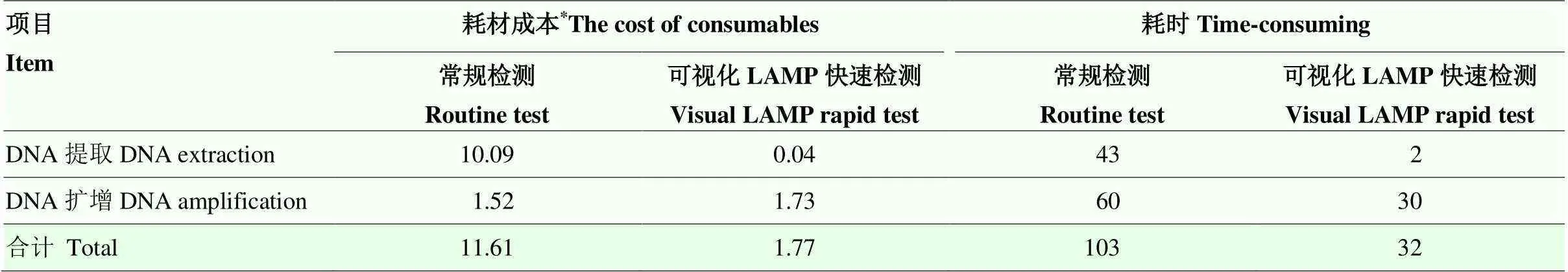
表4 柑橘黄龙病常规检测与可视化LAMP快速检测的耗材成本(元/样本)与步骤耗时(分钟/样本)比较
*各试剂耗材成本的价格参考锐竞科研采购平台(https://www.rjmart.cn/)在2021年3月的数据所得
*The prices of the consumables are based on data from the Reagent Procurement Platform (https://www.rjmart.cn/) in March 2021
3 讨论
3.1 环引物与茎引物/群引物联用显著提升LAMP扩增效率
常规的四引物LAMP由于反应时间较长,目前研究者更青睐于设计环引物、茎引物或者是群引物加快反应速率[21-23]。通常情况下,F2和B2在目的片段上的距离应在120—160 bp,但在该条件下会造成F1和B1的距离过短,难以在F1和B1之间设计茎引物[24]。因此,本研究通过将StemF和F1c共用部分序列,LoopB、B1c和StemB共用部分序列,这些共用部分序列的引物有着相同的延伸方向,理论上不会发生交叉反应,绕开了环引物和茎引物设计在空间不足上的限制。从图1可以看出,在靶序列F1和B1区域之间仅有9 bp的距离下设计了共33 bp的茎引物,根据茎引物(结合在F1和B1之间的“茎”上)和群引物(结合在F1、B1上或者附近)的定义[22-23],本研究的茎引物在定义上更接近为群引物,两者的关系有待进一步研究。Khorosheva等[25]通过数字单分子LAMP进行引物设计优化,发现加入环引物能提高LAMP的灵敏度,而LAMP的反应速率与灵敏度之间没有显著的相关性。本研究发现,加入环引物、茎引物以及增加其浓度均能促进反应速率的提升,但反应速率的提升并不能带来较大的灵敏度提升。另一方面,环引物对反应速率的提升会随着自身浓度的升高而缩小,而茎引物对反应速率的提升不如环引物,但在自身浓度较高的情况下继续增加浓度依然能提高一定的反应速率,与Martineau等[23]的结论比较吻合,说明在低引物浓度下,环引物浓度的影响更大;而高引物浓度下,茎引物浓度的影响更大。虽然Qian等[9]在进行可视化LAMP检测时由于高浓度高长度引物形成二级结构,在常温下出现强烈的背景信号,但在本研究中,即使加入了高浓度的环引物和茎引物,紫外灯下的阴性管也未见有荧光信号,说明高浓度高长度的引物不是导致有二级结构的原因,应该在引物设计时就避免引物二聚体或“发卡”结构的出现。
3.2 DNA提取是制约可视化LAMP准确性的关键步骤
总体来看,膜吸附法的DNA得率较低和DNA聚合酶抑制剂残留是造成黄龙病快速诊断出现假阴性的主要原因。由于黄龙病菌寄生在韧皮部组织中[26],要获取黄龙病菌的DNA需要将植物和细菌的细胞壁、细胞膜都彻底裂解,而膜吸附法中省略了65℃恒温孵育的步骤,对细胞壁和细胞膜的裂解不够彻底,使得DNA的提取效率较低。本研究后续可以进一步探讨尼龙膜的不同孔径对PCR或LAMP反应的影响,开发DNA吸附或提取效果更好的膜材料;尝试提高PCR或LAMP反应体系的体积,从而相对减少核酸吸附膜材料本身和提取试剂残留对DNA聚合酶活性的影响。Gelgreen可视化LAMP结合膜吸附法的灵敏度稍低于结合常规提取,为102copies/μL,但基本满足田间检测的需要。后续可以通过设计引物变体来进行检出限测定,进一步提高引物A3的灵敏度,或者基于黄龙病菌基因组的、和等高拷贝数基因设计引物[19,27]。
3.3 两步法干燥有效提升LAMP试剂稳定性
Hayashida等[28]使用两步法干燥和羟基溴酚蓝(HNB)、Evagreen双指示剂法,先将指示剂、引物和海藻糖混合放置在管盖干燥,再将dNTPs、聚合酶和海藻糖混合放置在管底干燥,做成LAMP干燥试剂用于人类非洲锥虫病的快速检测;Diego等[20]使用一步法干燥LAMP反应试剂,发现一步法干燥试剂在室温存放1个月后完全丧失了反应活性。本研究结果表明,两步法干燥的LAMP试剂在不同温度存放1—4周均能保持反应活性基本不变,说明干燥LAMP试剂检测性能较好,在低温和常温环境下的稳定性尚可,仅35℃高温存放会略微增加LAMP试剂的反应时间。本研究通过真空浓缩仪获得的干燥试剂外观为黏附在管底的透明胶状沉淀,而张建中[29]通过冷冻干燥器制备的PCR冻干试剂呈白色光滑小球,扩增效率与未干燥的PCR反应体系相比基本一致,说明冻干试剂没有受到干燥过程的影响,但是冷冻干燥的制备复杂,仪器成本高,较难推广应用于田间检测。
3.4 LAMP快速检测橘络组织有更高的准确率
受限于膜吸附法提取技术存在DNA损失和DNA聚合酶抑制剂残留的问题,可视化LAMP快速检测柑橘叶片诊断黄龙病会有较大的假阴性率(7.04%),但对于柑橘果实则有较高的准确率(97.14%),这是因为本试验所用到的柑橘果实主要从表现黄龙病相关症状的枝条上采摘,在同一感染黄龙病的带果枝条上,果实橘络中的黄龙病菌浓度往往高于其他部位,其浓度可达叶中脉的26倍,果实橘络也被认为具有富集黄龙病菌的作用[30-31]。另外,果实橘络的木质化程度低于叶中脉,组织纤细柔软,便于研磨,使植物细胞裂解更加充分。因此,笔者建议采用果实橘络作为可视化LAMP快速检测的DNA提取部位,避免发生叶中脉中的黄龙病菌浓度或DNA得率较低而出现假阴性的情况。
3.5 膜吸附法结合可视化LAMP有较大的田间应用潜力
由表4可知,可视化LAMP快速检测相较常规检测有着更低的成本和更短的耗时;其次,可视化LAMP快速检测的DNA提取和DNA扩增步骤无需离心机和PCR仪等昂贵的仪器,DNA扩增步骤仅需一台65℃恒温设备即可进行;最后,LAMP预混液的干燥延长了试剂在常温下的稳定性,在减少运输和储存成本的同时,也减少了实验操作步骤及其带来的交叉污染问题。因此,可视化LAMP快速检测技术非常适合在基础设施较落后的地区进行黄龙病田间检测。
4 结论
应用膜吸附法结合可视化LAMP建立的柑橘黄龙病快速鉴定技术具有操作简单快捷、灵敏度高等优点,在柑橘黄龙病的田间快速诊断中发挥作用,可为柑橘黄龙病菌检测试剂盒的开发提供技术支持。
[1] 罗志达, 叶自行, 许建楷, 胡桂兵. 柑桔黄龙病的田间诊断方法. 广东农业科学, 2009(3): 91-93.
LUO Z Z, YE Z X, XU J K, HU G B. Field diagnostic methods for citrus Huanglongbing. Guangdong Agricultural Sciences, 2009(3): 91-93. (in Chinese)
[2] 许美容, 陈燕玲, 邓晓玲. 柑橘黄龙病症状与“Liberibacter asiaticus” PCR检测结果的相关性分析. 植物病理学报, 2016, 46(3): 367-373.
XU M R, CHEN Y L, DENG X L. Correlationships between symptoms of citrus Huanglongbing and PCR detection of ‘Liberibacter asiaticus’. Acta Phytopathologica Sinica, 2016, 46(3): 367-373. (in Chinese)
[3] FREEMAN W M, WALKER S J, VRANA K E. Quantitative RT-PCR: pitfalls and potential. Biotechniques, 1999, 26(1): 112-122, 124-125.
[4] 廖晓兰, 朱水芳, 赵文军, 罗宽, 漆艳香, 陈红运, 何昆, 朱晓湘. 柑桔黄龙病病原16S rDNA克隆、测序及实时荧光PCR检测方法的建立. 农业生物技术学报, 2004, 12(1): 80-85.
LIAO X L, ZHU S F, ZHAO W J, LUO K, QI Y X, CHEN H Y, HE K, ZHU X X. Cloning and sequencing of citrus Huanglongbing pathogen 16S rDNA and its detection by real-time fluorescent PCR. Journal of Agricultural Biotechnology, 2004, 12(1): 80-85. (in Chinese)
[5] NOTOMI T, OKAYAMA H, MASUBUCHI H, YONEKAWA T, WATANABE K, AMINO N, HASE T. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research, 2000, 28(12): e63.
[6] OKUDA M, MATSUMOTO M, TANAKA Y, SUBANDIYAH S, IWANAMI T. Characterization of theB-E-G-KAJL-B gene cluster of the citrus greening organism and detection by loop-mediated isothermal amplification. Plant disease, 2005, 89(7): 705-711.
[7] CHOI C W, HYUN J W, HWANG R Y, POWELL C A. Loop- mediated isothermal amplification assay for detection of ‘Liberibacter asiaticus’, a causal agent of citrus Huanglongbing. The Plant Pathology Journal, 2018, 34(6): 499-505.
[8] 丁鹏, 卢占军, 黄爱军, 苏华楠, 刘映雪, 周承华, 邹俊丞, 黄玉玲. 柑桔黄龙病菌LAMP检测制样方法比较. 中国南方果树, 2018, 47(1): 12-16.
DING P, LU Z J, HUANG A J, SU H N, LIU Y X, ZHOU C H, ZOU J C, HUANG Y L. Comparison of LAMP methods for detection of citrus Huanglongbing pathogen. South China Fruits, 2018, 47(1): 12-16. (in Chinese)
[9] QIAN W J, MENG Y Q, LU Y, WU C, WANG R, WANG L, QIAN C, YE Z Z, WU J, YING Y B. Rapid, sensitive, and carryover contamination-free loop-mediated isothermal amplification-coupled visual detection method for ‘Liberibacter asiaticus’. Journal of Agricultural and Food Chemistry, 2017, 65(38): 8302-8310.
[10] GHOSH D K, BHOSE S, WARGHANE A, MOTGHARE M, SHARMA A K, DHAR A K, GOWDA S. Loop-mediated isothermal amplification (LAMP) based method for rapid and sensitive detection of ‘Liberibacter asiaticus’ in citrus and the psyllid vector,Kuwayama. Journal of Plant Biochemistry and Biotechnology, 2016, 25(2): 219-223.
[11] WU X H, MENG C L, WANG G H, LIU Y Z, ZHANG X, YI K X, PENG J. Rapid and quantitative detection of citrus Huanglongbing bacterium ‘Liberibacter asiaticus’ by real-time fluorescent loop-mediated isothermal amplification assay in China. Physiological and Molecular Plant Pathology, 2016, 94: 1-7.
[12] KEREMANE M L, RAMADUGU C, RODRIGUEZ E, KUBOTA R, SHIBATA S, HALL D G, ROOSE M L, JENKINS D, LEE R F. A rapid field detection system for citrus Huanglongbing associated ‘Liberibacter asiaticus’ from the psyllid vector,Kuwayama and its implications in disease management. Crop Protection, 2015, 68: 41-48.
[13] 王贤达, 林雄杰, 胡菡青, 王宗华, 范国成. 柑橘黄龙病可视化LAMP检测技术的建立及应用. 热带作物学报, 2014, 35(5): 918-924.
WANG X D, LIN X J, HU H Q, WANG Z H, FAN G C. Establishment and application of visual loop-mediated amplification assay on citrus Huanglongbing. Chinese Journal of Tropical Crops, 2014, 35(5): 918-924. (in Chinese)
[14] 程保平, 赵弘巍, 彭埃天, 陈霞, 宋晓兵, 凌金锋. 以基因为靶标的3种检测方法对柑橘黄龙病菌检测效果比较. 广东农业科学, 2014, 41(5): 141-145.
CHENG B P, ZHAO H W, PENG A T, CHEN X, SONG X B, LING J F. Comparative study on citrus Huanglongbing molecular detection methods with thetarget gene. Guangdong Agricultural Sciences, 2014, 41(5): 141-145. (in Chinese)
[15] 孔德英, 孙涛, 李应国, 滕少娜, 陆丽华, 邓朝晖. 柑桔黄龙病LAMP快速检测方法的建立. 中国南方果树, 2013, 42(1): 8-11.
KONG D Y, SUN T, LI Y G, TENG S N, LU L H, DENG C H. Development and evaluation of a loop-mediated isothermal amplification method for the rapid detection of Huanglongbing. South China Fruits, 2013, 42(1): 8-11. (in Chinese)
[16] 彭军, 廖孝文, 杨海中, 曾凡云, 龙海波, 裴月令, 郭建荣. 柑桔黄龙病环介导等温扩增检测方法建立及应用. 热带作物学报, 2013, 34(10): 1998-2003.
PENG J, LIAO X W, YANG H Z, ZENG F Y, LONG H B, PEI Y L, GUO J R. Rapid detection of citrus Huanglongbing using a LAMP method. Chinese Journal of Tropical Crops, 2013, 34(10): 1998-2003. (in Chinese)
[17] 黄丽, 苏华楠, 唐科志, 黄爱军, 周常勇, 李中安. 柑橘黄龙病LAMP快速检测方法的建立及应用. 果树学报, 2012, 29(6): 1121-1126, 1155.
HUANG L, SU H N, TANG K Z, HUANG A J, ZHOU C Y, LI Z A. Establishment and application of loop-mediated isothermal amplification assay for the detection of citrus Huanglongbing. Journal of Fruit Science, 2012, 29(6): 1121-1126, 1155. (in Chinese)
[18] 王华堂, 曾鑫年, 薛培培, 杨柳. Direct-PCR检测柑橘黄龙病的快速制样方法研究. 果树学报, 2014, 31(4): 733-738.
WANG H T, ZENG X N, XUE P P, YANG L. Research on DNA extraction methods for Direct-PCR detection of citrus Huanglongbing. Journal of Fruit Science, 2014, 31(4): 733-738. (in Chinese)
[19] ZHENG Z, XU M R, BAO M L, WU F N, CHEN J C, DENG X L. Unusual five copies and dual forms ofin ‘Liberibacter asiaticus’: biological implications and PCR detection application. Scientific Reports, 2016, 6: 39020.
[20] DIEGO J G, FERNÁNDEZ-SOTO P, CREGO-VICENTE B, ALONSO-CASTRILLEJO S, FEBRER-SENDRA B, GÓMEZ- SÁNCHEZ A, VICENTE B, LÓPEZ-ABÁN J, MURO A. Progress in loop-mediated isothermal amplification assay for detection ofDNA: towards a ready-to-use test. Scientific reports, 2019, 9: 14744.
[21] NAGAMINE K, HASE T, NOTOMI T. Accelerated reaction by loop-mediated isothermal amplification using loop primers. Molecular and cellular probes, 2002, 16(3): 223-229.
[22] GANDELMAN O, JACKSON R, KIDDLE G, TISI L. Loop- mediated amplification accelerated by stem primers. International Journal of Molecular Sciences, 2011, 12(12): 9108-9124.
[23] MARTINEAU R L, MURRAY S A, CI S F, GAO W M, CHAO S H, MELDRUM D R. Improved performance of loop-mediated isothermal amplification assays via swarm priming. Analytical Chemistry, 2017, 89(1): 625-632.
[24] TOMITA N, MORI Y, KANDA H, NOTOMI T. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products. Nature protocols, 2008, 3(5): 877-882.
[25] KHOROSHEVA E M, KARYMOV M A, SELCK D A, ISMAGILOV R F. Lack of correlation between reaction speed and analytical sensitivity in isothermal amplification reveals the value of digital methods for optimization: validation using digital real-time RT-LAMP. Nucleic Acids Research, 2016, 44(2): e10.
[26] ACHOR D, WELKER S, BEN-MAHMOUD S, WANG C X, FOLIMONOVA S Y, DUTT M, GOWDA S, LEVY A. Dynamics of ‘Liberibacter asiaticus’ movement and sieve-pore plugging in citrus sink cells. Plant Physiology, 2020, 182(2): 882-891.
[27] BAO M, ZHENG Z, SUN X, CHEN J, DENG X. Enhancing PCR capacity to detect ‘Liberibacter asiaticus’ utilizing whole genome sequence information. Plant disease, 2020, 104(2): 527-532.
[28] HAYASHIDA K, KAJINO K, HACHAAMBWA L, NAMANGALA B, SUGIMOTO C. Direct blood dry LAMP: A rapid, stable, and easy diagnostic tool for human African trypanosomiasis. PLoS Neglected Tropical Diseases, 2015, 9(3): e0003578.
[29] 张建中. 应用于即时检测的核酸提取与扩增试剂冷冻干燥研究[D]. 厦门: 厦门大学, 2019.
ZHANG J Z. Study on freeze-drying of reagents for nucleic acid extraction and amplification in point of care testing[D]. Xiamen: Xiamen University, 2019. (in Chinese)
[30] 郭亨玉, 罗小玲, 李桃, 邓晓玲, 郑正. 柑橘黄龙病菌在染病贡柑枝条和果实橘络内的分布规律. 植物病理学报, 2020, 50(5): 543-548.
GUO H Y, LUO X L, LI T, DENG X L, ZHENG Z. Distribution of ‘Liberibacter asiaticus’ in Huanglongbing-affectedBlanco cv. Gongkan branches and the fruit pith. Acta Phytopathologica Sinica, 2020, 50(5): 543-548. (in Chinese)
[31] 李桃, 郑正, 邓晓玲. 离体砂糖橘黄龙病病果中病菌浓度变化规律的探究. 植物病理学报, 2021, 51(2): 298-302.
LI T, ZHENG Z, DENG X L. Quantitative analysis of ‘Liberibacter asiaticus’ in the excised citrus fruits. Acta Phytopathologica Sinica, 2021, 51(2): 298-302. (in Chinese)
Detection of ‘Liberibacter asiaticus’ by membrane adsorption method combined with visual loop-mediated isothermal amplification
LI ZhenXi, LI WenTing, HUANG JiaQuan, ZHENG Zheng, XU MeiRong, DENG XiaoLing
College of Plant Protection, South China Agricultural University, Guangzhou 510642
【】Citrus Huanglongbing (HLB) is a citrus disease caused by ‘Liberibacter asiaticus’ (CLas). The main approaches to control HLB include plant quarantine, establishing disease-free nurseries, removing disease trees, and concentrating on large area joint control of citrus psyllids (). The first three methods all rely on accurate HLB diagnosis techniques.【】The objective of this study is to establishment of a rapid and handy field/laboratory nucleic acid detection method of CLas using loop-mediated isothermal amplification (LAMP) combined with membrane adsorption rapid DNA extraction and Gelgreen fluorescence dye visualization.【】The LAMP primers were designed using the-operon and the prophage DNA polymerase gene of CLas as templates, including outer primer F3/B3, inner primer FIP/BIP, loop primer LoopF/LoopB and stem primer StemF/StemB. The LAMP primer set was optimized by setting different dosage combinations for loop primers and stem primers to determine the appropriate primer concentration. A total of 188 field citrus leaves were detected using the optimized LAMP primer set, and the receiver operating characteristic (ROC) curves were constructed to analyze the accuracy of real-time fluorescent LAMP (qLAMP) for CLas detection. The qLAMP premixed reaction solution was dried in two steps at room temperature, storage temperature (4, 25 and 35℃) and storage time (1, 2 and 4 weeks) were also set to assess the enzyme activity stability of the dry LAMP reagent. Using dry LAMP reagent, combined with membrane adsorption rapid DNA extraction technique in this study, 71 citrus leaf samples and 35 citrus fruit samples collected in the field were detected, while the detection results of real-time fluorescent quantitative (qPCR) were used as controls to compare the coincidence rates of the two detection methods.【】The addition of loop primer, stem primer or increasing their concentrations in LAMP reaction could promote the increase of reaction rate, and the addition of both loop primer and stem primer at a final concentration of 1.6 μmol·L-1could further improve the reaction rate. The reaction activity of LAMP premix could be maintained unchanged by two-step drying at different temperatures for 1-4 weeks, indicating that the two-step drying LAMP reagent prepared in this experiment had good detection performance and fair stability at low and room temperatures, and only at 35℃ storage would slightly increase the reaction time of LAMP reagent. Using 0.1 μm pore size nylon membrane instead of cellulose filter paper as nucleic acid adsorption material could improve the sensitivity of rapid diagnostic techniques. The overall accuracy of rapid DNA diagnosis for HLB established by combining rapid DNA extraction and visual LAMP was high, and the lowest detectable plasmid concentration was 102copies/μL. The diagnostic results of this method were not significantly different from those of qPCR by paired Chi-square test. Thevisual LAMP rapid detection was less cost and time-consuming than routine detection, and visual LAMP rapid detection required no expensive instruments such as centrifuges and PCR instruments, requiring only a 65℃ thermostatic device.【】The rapid DNA detection method for CLas established in this study has low cost and can observe detection results in 30 min, easy to operate and high accuracy, which can replace qPCR for rapid identification of HLB in the field.
citrus Huanglongbing; ‘Liberibacter asiaticus’ (CLas); field detection; membrane adsorption; rapid DNA extraction; visual LAMP

10.3864/j.issn.0578-1752.2022.01.007
2021-06-03;
2021-07-06
国家重点研发计划(2018YFD0201500)、广西创新驱动发展专项(桂科AA18118046)、广东省重点领域研发计划(2019B020217003)
李镇希,E-mail:554706824@qq.com。通信作者邓晓玲,E-mail:xldeng@scau.edu.cn
(责任编辑 岳梅)
