高低氮处理下小麦旗叶性状的遗传分析
2022-02-22武亚瑞刘锡建杨国敏刘红伟孔文超吴永振孙晗秦冉崔法赵春华
武亚瑞,刘锡建,杨国敏,刘红伟,孔文超,吴永振,孙晗,秦冉,崔法,赵春华
高低氮处理下小麦旗叶性状的遗传分析
武亚瑞1,刘锡建1,杨国敏2,刘红伟1,孔文超1,吴永振1,孙晗1,秦冉1,崔法1,赵春华1
1鲁东大学农学院,山东烟台 264025;2菏泽市土壤肥料工作站,山东菏泽 274000
【】旗叶是小麦光合碳固定的重要场所,对小麦产量起十分重要的作用。研究小麦旗叶在高、低氮环境下的遗传特性,分析其遗传机制,为优异株型育种、高产育种提供参考依据。以科农9204和京411为亲本所构建的188个RIL群体为材料,分别种植在6个不同的高、低氮环境下,通过对群体旗叶性状调查并进行遗传分析,从而确定控制各性状的基因数目,估计遗传效应值及遗传率,并对小麦旗叶性状与产量之间的关系进行分析。在遗传估测中,低氮环境下:旗叶长在E3环境的最适遗传模型为2MG-CE,即2对互补作用主基因遗传模型,其加性×加性上位性互作效应值为1.098,主基因遗传率为31.35%,在其他低氮环境下均表现为多基因遗传;旗叶宽均表现为多基因遗传;旗叶面积(除E5)的最适遗传模型均为2MG-CE,加性×加性上位性互作效应值为1.884,主基因遗传率为36.7%,在E5为多基因遗传。高氮环境下:旗叶长(除E4)的最适遗传模型为2MG-CE,加性×加性上位性互作效应值为1.133,主基因遗传率为32.6%,在E4环境的最适遗传模型为2MG-ER,即2对隐性上位主基因遗传模型,其第一对主基因的加性效应值为1.431,第二对主基因的加性效应值为1.108,主基因遗传率为51.77%;旗叶宽(除E2)的最适遗传模型为2MG-CE,加性×加性上位性互作效应值为0.119,主基因遗传率为37.29%,在E2表现为多基因遗传;旗叶面积的最适遗传模型为2MG-CE,加性×加性上位性互作效应值为3.067,主基因遗传率为44.42%。旗叶性状在不同环境的遗传模型不同,在高氮环境下遗传较为稳定,在低氮下受环境影响较大。在旗叶与产量性状的相关性分析中,旗叶性状与穗粒数、穗粒重、单株产量之间呈显著正相关,且在不同环境下的影响程度不同。旗叶性状易受外界环境影响,在高、低氮环境下的表现不同。旗叶在低氮环境下表现为不同的主基因遗传和多基因遗传;在高氮环境下大多表现为主基因遗传,由2对基因控制,并且存在基因之间的相互作用,且可能存在效应较大的主效QTL。改善旗叶性状可以提高小麦的单株产量、穗粒重等产量性状。
小麦;旗叶性状;遗传模型;产量;相关分析
0 引言
【研究意义】植物叶片的光合作用是转换能量生产营养物质的基础[1],可作为验证植物生长状况的指标[2-4]。旗叶是小麦进行光合作用的主要场所,对产量起非常重要的作用[5-7]。氮素作为作物生长需要的大量营养元素之一,施用氮肥较少或过量均可能对作物产量和品质产生一定的影响[8-10]。因此,利用主基因+多基因数量性状混合遗传模型[11-14],分析小麦旗叶在不同氮素环境下的遗传特点,可为合理施用氮肥,提高小麦产量提供参考。【前人研究进展】植物的大多性状是数量性状。随着科技的发展,将数量性状与植物遗传育种结合,利用数学统计和遗传模型分析群体数量性状遗传规律,可为现代植物育种提供科学依据[15-18]。目前,对小麦旗叶性状QTL定位有较多的研究[19-23],但对其遗传模型的研究较少。主基因+多基因数量性状混合遗传模型[11-14]已经在大量作物中广泛应用[24-28]。如江建华等[29]对水稻柱头性状进行研究,测得该性状由2对主效基因和微效基因共同控制;黄冰艳等[30]利用F2群体分析花生油酸和亚油酸含量的遗传方式,结果表明,这两个性状均为2对主基因加性-显性-上位性遗传模型,并且存在多基因效应和基因互作;解松峰等[31-32]利用小麦重组自交系(RIL群体)对产量相关性状进行研究,结果表明,穗部性状以多基因遗传为主,其他产量性状(单株产量、千粒重、株高、穗下节间长、旗叶上节间长和分蘖数)在不同环境下受到主基因+多基因混合遗传控制。【本研究切入点】迄今为止,对于高、低氮环境下小麦旗叶性状的数量性状遗传分析仍鲜见报道,中国科学院遗传与发育生物学研究所农业资源研究中心李俊明研究员课题组以科农9204和京411为亲本构建了重组自交系群体。【拟解决的关键问题】本研究通过对构建的RIL群体(F7:8和F8:9)旗叶性状的表型数据进行分析,运用主基因+多基因混合遗传模型的方法确定旗叶性状在高、低氮环境下的遗传模型和基因作用方式,为小麦旗叶性状的遗传规律、育种研究提供理论参考。
1 材料与方法
1.1 试验材料
供试材料为科农9204和京411作为亲本组成的重组自交系群体(KJ-RIL),由中国科学院遗传与发育生物学研究所农业资源研究中心李俊明研究员课题组提供。田间种植包括6个环境,将亲本和RIL群体分别在2011—2012年石家庄低氮环境(E1)、2011—2012年石家庄高氮环境(E2)、2012—2013年石家庄低氮环境(E3)、2012—2013年石家庄高氮环境(E4)、2012—2013年北京低氮环境(E5)、2012—2013年北京高氮环境(E6)进行种植。每个环境中0—20 cm土层内的土壤硝态氮及总氮含量见文献[33]。每个高氮小区播种前施磷酸二胺300 kg·hm-2、尿素150 kg·hm-2,每年伸长期施尿素150 kg·hm-2。在低氮小区,小麦生长期不施氮肥(缺氮)。每个材料种植2行,每行40粒种子,2 m行长,行距0.25 m。各环境随机区组设计,设置2个重复。
1.2 试验方法
每个环境在小麦开花后15 d进行旗叶长和旗叶宽的测定,每个家系选择5株长势一致的单株进行主茎穗旗叶长和旗叶宽的测量,分别量取旗叶最长和最宽部位。旗叶面积为旗叶长×旗叶宽×0.83。其他农艺性状的测量参考Fan等[34]方法。
1.3 数据分析
应用EXCEL2010和SPSS 24.0软件对旗叶性状表型数据分析极值、变异系数、偏度和峰度等,并分析不同环境下旗叶与产量之间的相关性。根据植物数量性状主基因+多基因混合遗传模型分析方法,利用章元明教授课题组开发的Windows软件包中的SEA对小麦旗叶性状进行遗传分析[11-14]。通过极大似然法和ECM算法等对混合分布中的有关成分分布参数做出估计,然后通过AIC值的判别选出AIC值最小的模型或AIC值相近的几个模型再根据均匀性检验(12、22、32)、Smirnov检验(2)和Kolmogorov检验()进行适合性检验选择出最适遗传模型。最后根据最小二乘法估计各性状的主基因和多基因效应值等遗传参数。
2 结果
2.1 旗叶性状的表型数据分析
对不同环境下2个亲本进行方差分析(表1)。结果表明,环境对旗叶长、旗叶宽和旗叶面积的影响都极显著;亲本的遗传对旗叶宽和旗叶面积的影响极显著,对旗叶长的影响不显著。对小麦RIL群体旗叶性状的表型进行测定,并分析了该群体旗叶长、宽、面积在6个环境下的表现(表2)。低氮环境下,亲本科农9204和京411的旗叶长分别为13.08和13.81 cm,旗叶宽分别为1.49和1.34 cm,旗叶面积分别为16.10和15.67 cm2。群体的旗叶长介于9.33—19.45 cm,均值为14.47 cm,超过两亲本均值;群体的旗叶宽介于1—1.73 cm,均值为1.33 cm,偏向于低值亲本;群体的旗叶面积介于9.26—25.88 cm2,均值为16.04 cm2,略低于高值亲本。高氮环境下,亲本科农9204和京411的旗叶长分别为18.26和17.87 cm,旗叶宽分别为1.64和1.42 cm,旗叶面积分别为25.04和21.85 cm2。群体的旗叶长介于12.96—24.62 cm,均值为18.24 cm,略低于高值亲本;群体的旗叶宽介于1.07—2.05 cm,均值为1.49 cm,偏向于低值亲本;群体的旗叶面积介于13.88—36.44 cm2,均值为22.91 cm2,略高于低值亲本。旗叶性状在高氮环境下表型值整体高于低氮环境。

表1 不同环境下两亲本旗叶性状的方差分析
FLL:旗叶长;FLW:旗叶宽;FLA:旗叶面积。下同
FLL: Flag leaf length; FLW: Flag leaf width; FLA: Flag leaf area. The same as below
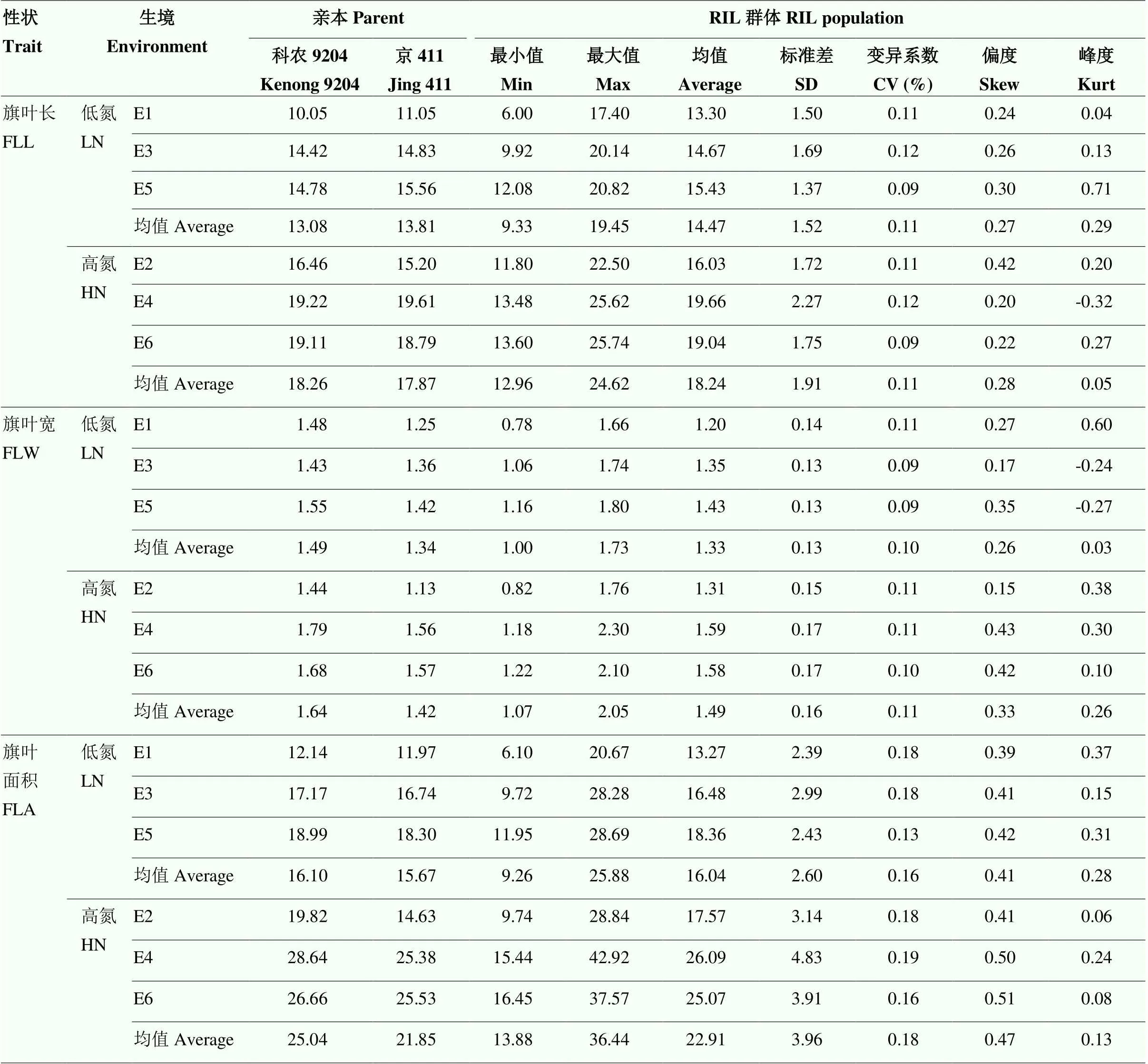
表2 不同生境下旗叶性状的统计值
LN:低氮;HN:高氮。下同 LN: Low nitrogen; HN: High nitrogen. The same as below
6个环境下,各性状极值变化范围很大,变异幅度大,适合进行遗传分析。旗叶面积的变异系数(13%—19%)略高于旗叶长(9%—12%)和旗叶宽(9%—11%),说明旗叶面积在形态变异上比旗叶长和旗叶宽丰富。整体旗叶性状的变异系数为9%—19%,表明群体表型变异稳定。整体旗叶长、宽和面积的偏度和峰度系数绝对值均小于1,表现为数量性状遗传特征。
由图1可知,旗叶性状在不同环境下均表现为正态分布,符合遗传分析的要求。旗叶性状在高、低氮环境下均表现为单峰分布,符合主基因+多基因表型分布特征。

LN:低氮;HN:高氮;FLL:旗叶长;FLW:旗叶宽;FLA:旗叶面积。E1:2011—2012年石家庄低氮;E2:2011—2012年石家庄高氮;E3:2012—2013年石家庄低氮;E4:2012—2013年石家庄高氮;E5:2012—2013年北京低氮;E6:2012—2013年北京高氮
2.2 旗叶性状高低氮遗传模型分析
利用植物数量性状主基因+多基因混合遗传模型分析小麦旗叶性状,选取AIC值最小或与AIC最小值比较接近的几个模型作为备选模型,对备选模型进行适合性检验从而得到旗叶性状的最适遗传模型(表3)。结果表明,低氮环境下,旗叶长在E3的最适遗传模型为2MG-CE,该模型具有最小的AIC值,为1 464.11;旗叶面积在E1、E3的最适遗传模型2MG-CE,该模型具有最小的AIC值,分别为1 714.21和1 890.73;旗叶长在E1、E5与旗叶宽在低氮环境下以及旗叶面积在E5的最适遗传模型均为0MG,具有最小的AIC值。高氮环境下,旗叶长在E2、E6的最适遗传模型为2MG- CE,具有最小的AIC值,分别为1 470.30和1 493.63,在E4的最适遗传模型2MG-ER,该模型具有最小的AIC值,为1 684.05;旗叶宽在E2的最适遗传模型为0MG,该模型有最小的AIC值,为-82.91,旗叶宽在E4、E6环境下的最适遗传模型均为2MG-CE,具有最小的AIC值;旗叶面积的最适遗传模型为2MG-CE。

表3 旗叶性状在重组自交系群体中的最适遗传模型分析
B模型表示2对主基因,无多基因遗传模型;—:空缺;MG:主基因模型;ER:隐性上位;CE:互补作用。下同
B: Two major genes without polygene; —: the value is absent; MG: Major gene model; ER: Epistasis recessively; CE: Complementary effect. The same as below
2.3 旗叶性状高低氮遗传参数估计
通过R语言的SEA软件包对旗叶性状最适遗传模型估计其一阶及二阶遗传参数(表4)(部分一阶遗传参数、多基因遗传方差及遗传率为空值)。低氮环境下,旗叶长在E3的主基因遗传率为31.35%,加性×加性上位性互作效应值为1.098;旗叶面积在E1的主基因遗传率为38.35%,加性×加性上位性互作效应值为1.726;旗叶面积在E3的主基因遗传率为34.97%,加性×加性上位性互作效应值为2.042。高氮环境下,旗叶长在E2、E6的主基因遗传率分别为42.41%和22.79%,加性×加性上位性互作效应值分别为1.302和0.963,因此,旗叶长表现为2对互补作用主基因遗传时,主基因遗传率相差较大,多基因遗传率未能检出;旗叶长在E4的主基因遗传率为51.77%,第一对主基因的加性效应值为1.431,第二对主基因的加性效应值为1.108,旗叶长在该环境表现为2对隐性上位主基因遗传,主基因遗传率较高,遗传较为稳定;旗叶宽在E4、E6的主基因遗传率分别为38.58%和35.99%,加性×加性上位性互作效应值分别为0.122和0.116;旗叶面积在E2、E4、E6的主基因遗传率分别为42.77%、44.54%和45.96%,加性×加性上位性互作效应值分别为2.39、3.716和3.095。
旗叶性状在其余环境下都表现为多基因遗传模型,但是检测不到基因遗传的数据特征,没有办法显示多基因效应,其是否存在多基因修饰需要进行多世代的联合分离分析,从而确定数量性状的遗传特征。
2.4 小麦RIL群体旗叶性状与产量性状的相关性分析
对旗叶性状与产量性状进行相关性分析(表5)。旗叶长在4个环境(除E5、E6)与穗粒数呈显著正相关;所有环境下与穗粒重显著正相关;4个环境(除E2、E6)与单株产量显著正相关;在E4和E5与有效穗数显著正相关;在E5环境下与千粒重显著正相关。旗叶宽在4个环境下(除E1、E2)与穗粒数正相关性显著;在5个环境下(除E2)与穗粒重显著正相关;在2个环境下(E3、E4)与单株产量显著正相关;在E2环境与有效穗数显著正相关;在E6环境下与有效穗数、千粒重显著负相关。旗叶面积在所有环境下与穗粒数、穗粒重显著正相关;在5个环境下(除E6)与单株产量正相关性显著;在E4环境与有效穗数显著正相关;在E6环境与有效穗数显著负相关。

表4 小麦RIL群体旗叶性状的各阶遗传参数
m:群体均方;d:主基因效应值;da:第一对主基因的加性效应值;db:第二对主基因的加性效应值;iab(i*):第一对主基因的加性效应×第二对主基因的加性上位性互作效应;²:群体方差;²:主基因遗传方差;²:误差方差(环境方差);²(%):主基因遗传率
m: The mean value of P 1 generation; d: Main gene effect value; da: Addictive effect of the first pair major gene; db: Addictive effect of the second pair major gene; iab(i*): Addictive effect plus addictive effect of the 1st pair major genes × the 2ndpair major gene;²: Phenotypic variance;²: Major gene variance;²: error variance;²(%): Heritability of major gene
3 讨论
前人对旗叶的研究多侧重于QTL定位分析[19-23]、旗叶光合特性及其生理特性[35-37]等,而对其遗传模型的分析较少。Khan等[38]对2个小麦杂交组合的P1、P2、F1、F2、B1和B26个基本代的旗叶面积进行了混合遗传分析,结果表明,该性状主要受1个主基因与多基因组合的控制,主基因遗传力高于多基因遗传力,遗传变异受环境波动的影响。本研究旗叶面积在大多数环境下表现为2对互补作用的主基因遗传,且由环境引起的变异占总变异的幅度较大。Fan等[34]利用该RIL群体的旗叶性状进行QTL定位分析,在8个不同环境中共检测到38个与旗叶性状相关的加性QTL,其中,旗叶宽、与旗叶面积的QTL在5个环境以上均表现稳定,为主效稳定QTL,旗叶长没有检测到主效稳定的QTL。
本研究表明旗叶性状在高氮环境下受2对主基因及基因间的作用共同控制,旗叶长的最适遗传模型存在差异。在低氮环境下,旗叶性状有许多为0MG的最适遗传模型,表现为多基因遗传,环境对2对主基因表达的影响较大。旗叶性状在各环境下的主基因遗传率为31.35%—51.77%,且由环境引起的变异较大,表明在旗叶性状的遗传过程中环境与基因之间存在互作,因此,在实践过程中应充分考虑基因和环境效应的相互影响。旗叶长主要表现为主基因遗传,且在E4环境下的主基因遗传率较大,受环境影响较小,可以作为改善旗叶性状早期选择的直接指标,提高育种效率。旗叶宽在低氮环境下表现为多基因遗传,受环境影响较大。旗叶面积在不同环境下的最佳遗传模型相同,可能与一因多效或基因连锁有关。在小麦育种过程中,要加强理论与实践的结合,并且考虑不同生态环境的影响。

表5 小麦RIL群体的旗叶性状与产量性状间的相关性
*:<0.05水平相关性显著;**:<0.01水平相关性显著
*: significant correlation at<0.05; **: significant correlation at<0.01
钮力亚等[39]研究表明旗叶面积与穗粒数、产量之间存在显著或极显著的正相关;王敏等[40]发现旗叶性状与穗粒重、穗粒数和小区产量呈现极显著正相关;黄杰等[41]研究表明旗叶宽、旗叶面积与穗粒数显著正相关;姜莉莉等[42]研究表明旗叶宽与千粒重呈负相关。本研究结果与其一致。因此,在小麦品种选育中,要充分考虑旗叶对产量的影响,选择合适的旗叶长和旗叶宽以提高小麦产量。
4 结论
明确了小麦旗叶性状是数量性状并且可以进行遗传分析,群体的正态分布图可以较好地反映旗叶表型分布特征。旗叶主要由2对主基因控制,并且存在基因间的相互作用,主基因遗传率为31%—51%。由于环境和遗传的共同作用,使小麦旗叶的遗传模型也有所差异。明确了小麦旗叶与产量之间存在明显联系,与穗粒数、穗粒重显著相关。
[1] 夏江宝, 张光灿, 许景伟, 李传荣. 干旱胁迫下常春藤净光合速率日变化及其影响因子分析. 水土保持通报, 2010, 30(3): 78-82.
XIA J B, ZHANG G C, XU J W, LI C R. Analysis on diurnal variation of net photosynthetic rate and its influencing factors under drought stress. Bulletin of Soil and Water Conservation, 2010, 30(3): 78-82. (in Chinese)
[2] 马富举, 李丹丹, 蔡剑, 姜东, 曹卫星, 戴廷波. 干旱胁迫对小麦幼苗根系生长和叶片光合作用的影响. 应用生态学报, 2012, 23(3): 724-730.
MA F J, LI D D, CAI J, JIANG D, CAO W X, DAI T B. Effects of drought stress on root growth and leaf photosynthesis of wheat seedlings. Chinese Journal of Applied Ecology, 2012, 23(3): 724-730. (in Chinese)
[3] 贺安娜, 姚奕. 虎耳草冬季净光合速率、蒸腾速率日变化及其影响因子分析. 西南农业学报, 2011, 24(4): 1298-1302.
HE A N, YAO Y. Analysis of diurnal variation of net photosynthetic rate, transpiration rate and its influencing factors in winter. SouthwestChina Journal of Agricultural Sciences, 2011, 24(4): 1298-1302. (in Chinese)
[4] 张治安, 杨福, 陈展宇, 徐克章. 菰叶片净光合速率日变化及其与环境因子的相互关系. 中国农业科学, 2006, 39(3): 502-509.
ZHANG Z A, YANG F, CHEN Z Y, XU K Z. Diurnal variation of net photosynthetic rate in leaves of wild rice and its relationship with environmental factors. Scientia Agricultura Sinica, 2006, 39(3): 502-509. (in Chinese)
[5] 唐晓培, 杨丽, 冯冬雪, 高壮壮, 张文杰, 刘海军. 非充分灌溉下8个小麦品种旗叶光合与产量及水分利用效率的关系. 干旱地区农业研究, 2020, 38(4): 245-252+265.
TANG X P, YANG L, FENG D X, GAO Z Z, ZHANG W J, LIU H J. The relationship between flag leaf photosynthesis and yield and water use efficiency of eight wheat cultivars under inadequate irrigation. Agricultural Research in the Arid Areas, 2020, 38(4): 245-252+265. (in Chinese)
[6] 徐恒永, 赵君实. 高产冬小麦的冠层光合能力及不同器官的贡献. 作物学报, 1995, 21(2): 204-209.
XU H Y, ZHAO J S. Canopy photosynthetic capacity and contribution of different organs in high-yielding winter wheat. Acta Agronomica Sinica, 1995, 21(2): 204-209. (in Chinese)
[7] LIU L P, SUN G L, REN X F, LI C D, SUN D F. Identification of QTL underlying physiological and morphological traits of flag leaf in barley. BMC Genetics, 2015, 16(1):29.
[8] 熊淑萍, 吴克远, 王小纯, 张捷, 杜盼, 吴懿鑫, 马新明. 不同氮效率基因型小麦根系吸收特性与氮素利用差异的分析. 中国农业科学, 2016, 49(12): 2267-2279.
XIONG S P, WU K Y, WANG X C, ZHANG J, DU P, WU Y X, MA X M. Analysis of root absorption characteristics and nitrogen utilization of wheat genotypes with different n efficiency.Scientia Agricultura Sinica,2016, 49(12): 2267-2279. (in Chinese)
[9] LIDIYA M, OREST F, VALERIY P, et al. Nitrogen balance of crop production in Ukraine. Journal of Environmental Management, 2019, 246: 860-867.
[10] LASSALETTA L, BILLEN G, GARNIER J, BOUWMAN L, VELAZQUEZ E, MUELLER N D, GERBER J S. Nitrogen use in the global food system: Past trends and future trajectories of agronomic performance, pollution, trade, and dietary demand. Environmental Research Letters, 2016, 11(9):095007.
[11] 盖钧镒, 章元明, 王建康. QTL混合遗传模型扩展至2对主基因+多基因时的多世代联合分析. 作物学报, 2000, 26(4): 385-391.
GAI J Y, ZHANG Y M, WANG J K. A joint analysis of multiple generations for QTL models extended to mixed two major genes plus polygene.Acta Agronomica Sinica, 2000, 26(4): 385-391. (in Chinese)
[12] WANG J K, PODLICH D W, COOPER M, DELACY I H. Power of the joint segregation analysis method for testing mixed major-gene and polygene inheritance models of quantitative traits. Theoretical and Applied Genetics, 2001, 103: 804-816.
[13] WANG J K, GAI J Y. Mixed inheritance model for resistance to agromyzid beanfly (Zehntner) in soybean. Euphytica, 2001, 122(1): 9-18.
[14] GAI J Y. Segregation analysis on genetic system of quantitative traits in plants. Frontiers of Biology, 2006, 1(1): 85-92.
[15] KHAN M I, KHATTAK G S S, KHAN A J, SUBHAN F, MOHAMMAD T, ALI A. Genetic control of flag leaf area in wheat () crosses. African Journal of Agricultural Research, 2012, 7(27): 3978-3990.
[16] KUMAR S. Quantitative genetics, molecular markers, and plant improvement.Scholarly Journal of Agricultural Science, 2014, 4(10): 502-511.
[17] BECHE E, BENIN G, SILVA C L, MUNARO L B, MARCHESE J A. Genetic gain in yield and changes associated with physiological traits in Brazilian wheat during the 20th century. European Journal of Agronomy, 2014, 61: 49-59.
[18] 盖钧镒, 章元明, 王建康. 植物数量性状遗传体系. 北京: 科学出版社, 2003: 96-102.
GAI J Y, ZHANG Y M, WANG J K. Genetic system of quantitative traits in plants. Beijing: Science Press, 2003: 96-102. (in Chinese)
[19] MA J, TU Y, ZHU J, LUO W, LIU H, LI C, LI S, LIU J J, DING P Y, AHSAN H. Flag leaf size and posture of bread wheat: genetic dissection, QTL validation and their relationships with yield-related traits. Theoretical and Applied Genetics, 2020, 133(1): 297-315.
[20] FAROKHZADEH S, FAKHERI B A, NEZHAD N M, TAHMASEBI S, MIRSOLEIMANI A. Mapping QTLs of flag leaf morphological and physiological traits related to aluminum tolerance in wheat (L.). Physiology and Molecular Biology of Plants, 2019, 25(4): 975-990.
[21] LIU K Y, XU H, LIU G, GUAN P F, ZHOU X Y, PENG H R, YAO Y Y, NI Z F, SUN Q X, DU J K. QTL mapping of flag leaf-related traits in wheat (L.).Theoretical and Applied Genetics, 2018, 131(4): 839-849.
[22] FRANCKI M G, WAIKER E, LI D A, FORREST K. High-density SNP mapping reveals closely linked QTL for resistance toblotch (SNB) in flag leaf and glume of hexaploid wheat. Canadian Journal of Genetics and Cytology, 2018, 61(2): 145-149.
[23] HUSSAIN W, BAENZIGER P S, BELAMKAR V, GUTTIERI M J, VENEGAS J P, EASTERLY A, SALLAM A, POLAND J. Genotyping-by-sequencing derived high-density linkage map and its application to QTL mapping of flag leaf traits in bread wheat. Scientific Reports, 2017, 7(1): 16394.
[24] 赵倩茹, 钟兴华, 张飞, 房伟民, 陈发棣, 滕年军. 切花小菊绿心性状杂种优势与混合遗传分析. 中国农业科学, 2018, 51(5): 964-976.
ZHAO Q R, ZHONG X H, ZHANG F, FANG W M, CHEN F D, TENG N J. Heterosis and mixed genetic analysis of green-center trait of spray cut chrysanthemum. Scientia Agricultura Sinica, 2018, 51(5): 964-976. (in Chinese)
[25] 叶红霞, 吕律, 海睿, 胡雨晴, 汪炳良. 甜瓜果实糖含量的主基因+多基因遗传分析. 浙江大学学报(农业与生命科学版), 2019, 45(4): 391-400.
YE H X, Lü L, HAI R, HU Y Q, WANG B L. Genetic analysis of main gene + polygene in sugar content of melon fruit. Journal of Zhejiang University(Agriculture and Life Sciences), 2019, 45(4): 391-400. (in Chinese)
[26] 曹齐卫, 张允楠, 王永强, 杨桂兰, 孙小镭, 李利斌. 黄瓜节间长的主基因+多基因混合遗传模型分析. 农业生物技术学报, 2018, 26(2): 205-212.
CAO Q W, ZHANG Y N, WANG Y Q, YANG G L, SUN X L, LI L B. Genetic analysis of internode length using mixed major-gene plus polygene inheritance model in. Journal of Agricultural Biotechnology, 2018, 26(2): 205-212. (in Chinese)
[27] 汪文祥, 胡琼, 梅德圣, 李云昌, 周日金, 王会成, 洪涛, 付丽, 刘佳. 甘蓝型油菜分枝角度主基因+多基因混合遗传模型及遗传效应. 作物学报, 2016, 42(8): 1103-1111.
WANG W X, HU Q, MEI D S, LI Y C, ZHOU R J, WANG H C, HONG T, FU L, LIU J. Genetic effects of branch angle using mixture model of major gene plus polygene in. Acta Agronomica Sinica, 2016, 42(8): 1103-1111. (in Chinese)
[28] YE Y J, WU J Y, FENG L, JU Y Q, CAI M, CHENG T R, PAN H T, ZHANG Q X. Heritability and gene effects for plant architecture traits of crape myrtle using major gene plus polygene inheritance analysis.Scientia Horticulturae, 2017, 225: 335-342.
[29] 江建华, 张武汉, 党小景, 荣慧, 叶琴, 胡长敏, 张瑛, 何强, 王德正. 水稻核不育系柱头性状的主基因+多基因遗传分析.作物学报, 2021, 47(7): 1215-1227.
JIANG J H, ZHANG W H, DANG X J, RONG H, YE Q, HU C M, ZHANG Y, HE Q, WANG D Z. Genetic analysis of the stigma trait in rice nuclear male sterile lines. Acta Agronomica Sinica, 2021, 47(7): 1215-1227. (in Chinese)
[30] 黄冰艳, 张新友, 苗利娟, 刘华, 秦利, 徐静, 张忠信, 汤丰收, 董文召, 韩锁义, 刘志勇. 花生油酸和亚油酸含量的遗传模式分析. 中国农业科学, 2012, 45(4): 617-624.
HUANG B Y, ZHANG X Y, MIAO L J, LIU H, QIN L, XU J, ZHANG Z X, TANG F S, DONG W Z, HAN S Y, LIU Z Y. Inheritance analysis of oleic acid and linoleic acid content of. Scientia Agricultura Sinica, 2012, 45(4): 617-624. (in Chinese)
[31] 解松峰, 吉万全, 王长有, 胡卫国, 李俊, 张耀元, 师晓曦, 张俊杰, 张宏, 陈春环. 小麦穗部性状的主基因+多基因混合遗传模型分析. 中国农业科学, 2019, 52(24): 4437-4452.
XIE S F, JI W Q, WANG C Y, HU W G, LI J, ZHANG Y Y, SHI X X, ZHANG J J, ZHANG H, CHEN C H. Analysis of mixed genetic model of major gene and polygene for wheat panicle traits. Scientia Agricultura Sinica,2019, 52(24): 4437-4452. (in Chinese)
[32] 解松峰, 吉万全, 张耀元, 张俊杰, 胡卫国, 李俊, 王长有, 张宏, 陈春环. 小麦重要产量性状的主基因+多基因混合遗传分析. 作物学报, 2020, 46(3): 365-384.
XIE S F, JI W Q, ZHANG Y Y, ZHANG J J, HU W G, LI J, WANG C Y, ZHANG H, CHEN C H. Genetic analysis of major genes and polygenes in important yield traits of wheat.Acta Agronomica Sinica, 2020, 46(3): 365-384. (in Chinese)
[33] CUI F, FAN X L, ZHAO C H, ZHANG W, CHEN M, JI J, LI J M. A novel genetic map of wheat: utility for mapping QTL for yield under different nitrogen treatments. BMC Genetics, 2014, 15: 57-74.
[34] FAN X L, CUI F, ZHAO C H, ZHANG W, YANG L J, ZHAO X Q, HAN J, SU Q N, JI J, ZHAO Z W, TONG Y P, LI J M. QTLs for flag leaf size and their influence on yield-related traits in wheat (L.). Molecular Breeding, 2015, 35(1): 1-16.
[35] 胡燕美, 苏慧, 朱玉磊, 李金鹏, 李金才, 宋有洪. 花后早期增温对小麦旗叶光合和抗氧化特性及籽粒发育的影响. 麦类作物学报, 2020, 40(10): 1247-1256.
HU Y M, SU H, ZHU Y L, LI J P, LI J C, SONG Y H. Effects of early post-anthesis warming on photosynthesis and antioxidant characteristics of flag leaves and grain development of wheat. Journal of Triticeae Genetics, 2020, 40(10): 1247-1256. (in Chinese)
[36] 高娣, 吴宏亮, 刘根红, 康建宏, 坚天才, 李鑫. 不同追氮时期对花后高温胁迫下春小麦旗叶蛋白质和核酸代谢的影响. 农业科学研究, 2020, 41(3): 21-25.
GAO D, WU H L, LIU G H, KANG J H, JIAN T C, LI X. Effects of nitrogen topdressing on protein and nucleic acid metabolism in flag leaves of spring wheat under post-anthesis heat stress. Research in Agricultural Sciences, 2020, 41(3): 21-25. (in Chinese)
[37] 尹嘉德, 侯慧芝, 张绪成, 王红丽, 于显枫, 方彦杰, 马一凡, 张国平, 雷康宁. 全膜覆土下施有机肥对春小麦旗叶碳氮比、光合特性和产量的影响. 应用生态学报, 2020, 31(11): 3749-3757.
YIN J D, HOU H Z, ZHANG X C, WANG H L, YU X F, FANG Y J, MA Y F, ZHANG G P, LEI K N. Effects of organic fertilizer application on carbon nitrogen ratio, photosynthetic characteristics and yield of flag leaf of spring wheat. Chinese Journal of Applied Ecology, 2020, 31(11): 3749-3757. (in Chinese)
[38] Khan M I, Khattak G S S, KHAN A J, KHAN A J, SUBHAN F, MOHAMMAD T, ALI A. Genetic control of flag leaf area in wheat () crosses.African Journal of Agricultural Research, 2012, 7(27): 3978-3990.
[39] 钮力亚, 王伟伟, 王伟, 王奉芝, 赵松山, 于亮. 小麦功能叶对产量及其构成因素的影响. 作物研究, 2018, 32(4): 295-298.
NIU L Y, WANG W W, WANG W, WANG F Z, ZHAO S S, YU L. Effects of functional leaves on yield and its components in wheat. Crop Research, 2018, 32(4): 295-298. (in Chinese)
[40] 王敏, 张从宇. 小麦旗叶性状与产量因素的相关与回归分析. 种子, 2004, 23(3): 17-21.
WANG M, ZHANG C Y. Correlation and regression analysis of flag leaf traits and yield factors in wheat. Seed, 2004, 23(3): 17-21. (in Chinese)
[41] 黄杰, 乔冀良, 苗运武, 张振永, 葛昌斌, 廖平安. 小麦产量与旗叶性状的相关性分析. 中国种业, 2018(1): 63-64.
HUANG J, QIAO J L, MIAO Y W, ZHANG Z Y, GE C B, LIAO P A. Correlation analysis of wheat yield and flag leaf traits. China Seed Industry, 2018(1): 63-64.(in Chinese)
[42] 姜莉莉, 王东. 不同年代小麦产量性状与农艺性状的相关性比较. 华北农学报, 2017, 32(S1): 130-134.
JIANG L L, WANG D. Comparison of yield and agronomic traits of wheat in different ages. Acta Agriculturae Boreali-Sinica, 2017, 32(S1): 130-134. (in Chinese)
Genetic Analysis of Flag Leaf Traits in Wheat Under High and Low Nitrogen
WU YaRui1, LIU XiJian1, YANG GuoMin2, LIU HongWei1, KONG WenChao1, WU YongZhen1, SUN Han1, QIN Ran1, CUI Fa1, ZHAO ChunHua1
1College of Agriculture, Ludong University, Yantai 264025, Shandong;2Soil and Fertilizer Workstation in Heze City, Heze 274000, Shandong
【】Flag leaf is an important place for wheat photosynthetic carbon fixation,which plays an important role in wheat yield. The genetic characteristics and the genetic mechanism were analyzed under high and low nitrogen for flag leaf traits of wheat, which will provide a reference for excellent plant-type breeding and high-yield breeding. 【】188 recombinant inbred line (RIL) populations derived from a cross between Kenong9204 and Jing411 was used in this study, which were planted in low nitrogen (LN) and high nitrogen (HN), respectively. The flag leaf traits of 188 RILs were investigated in 6 different environments, then the genetic analysis was conducted to determine the number of genes controlling each trait, and to estimate the genetic effect value and the heritability. In addition, the relationship between flag leaf characters and yield related traits of wheat was also studied.【】Under LN environment: the optimal genetic model of flag leaf length was 2MG-CE (two pairs of interaction major genes) in E3. The additive × additive epistatic interaction value was 1.098, and the heritability of major genes was 31.35%. The flag leaf length was polygenic in another LN environment. The width of flag leaf was polygenic in all the LN environment. The optimal genetic model for flag leaf area (except E5) was 2MG-CE. The additive × additive epistatic interaction value was 1.884 and the heritability of major genes was 36.7%, while it was polygenic inheritance in E5. Under HN environment: The optimal genetic model for flag leaf length (except E4) was 2MG-CE, the additive × additive epistatic interaction value was 1.133, and the heritability of major genes was 32.6%. The optimal genetic model was 2MG-ER (two pairs of recessive epistatic major genes) in E4, which the additive effect value was 1.431 and 1.108 for the first and the second major genes respectively, and the heritability of the major gene was 51.77%. The optimal genetic model for flag leaf width (except E2) was 2MG-CE, the additive × additive epistatic interaction value was 0.119, and the heritability of major genes was 37.29%, while it showed polygenic inheritance in E2. The optimal genetic model for flag leaf area was 2MG-CE, which the additive × additive epistatic interaction value was 3.067 and the heritability of the main gene was 44.42%. The genetic models of flag leaf traits were different in different environments, which the genetic model was more stable under HN than that in LN. The correlation analysis of flag leaf and yield traits showed that flag leaf traits were significantly positively correlated with grain number per spike, grain weight per spike and yield per plant, and the influence degree was different in the 6 environments. 【】Flag leaf traits are easily affected by environment, and the performance of flag leaf traits is different in HN and LN. Flag leaf traits exhibited different major gene inheritance and polygene inheritance in LN, while they showed major gene inheritance which controlled by two pairs of interactions genes in most of HN environment, which might be major QTLs. Yield per plant and grain weight per spike could be increased by improving flag leaf traits.
wheat; flag leaf traits; genetic model; production; correlation analysis

10.3864/j.issn.0578-1752.2022.01.001
2021-06-07;
2021-08-16
山东省农业良种工程(2019LZGC016)、山东省自然科学基金重大基础研究(ZR2019ZD16)、山东省高等学校青创科技计划(2019KJF002)、烟台市新旧动能研究院(2019XJDN007)
武亚瑞,E-mail:1684813375@qq.com。通信作者崔法,E-mail:sdaucf@126.com。通信作者赵春华,E-mail:sdauzch@126.com
(责任编辑 李莉)
