中老年2 型糖尿病患者血小板计数/淋巴细胞计数比值与颈动脉粥样硬化病变的关系
2022-02-22杨少玲王凤翎张巧娜范林艳张红珍林文华顾家红
胡 静,赵 坤,杨少玲,王凤翎,张巧娜,范林艳,张红珍,林文华,顾家红
(1.安徽理工大学医学院,安徽 淮南 232000;2.上海市第八人民医院超声医学科,上海 200030;3.安徽理工大学附属奉贤区中心医院心脏血管超声科,上海 201400)
国际糖尿病联盟(international diabetes federation,IDF)报道,人类正面临着糖尿病全球流行的趋势[1]。糖尿病已成为严重威胁人类健康的非传染性疾病[2]。无论是发达国家还是发展中国家,糖尿病的防控形势不容乐观[3]。糖尿病患者易并发大血管病变,其中颈动脉粥样硬化(carotid atherosclerosis,CAS)并发症发生率较高,病情发展快,严重程度高,是导致患者致死致残的主要原因之一[4]。糖尿病属于慢性炎症性疾病,血小板与淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)作为一种新的炎症标志物,与糖尿病肾病及心脑血管疾病密切相关[5,6]。颈动脉粥样硬化表现为颈动脉内中膜增厚及粥样硬化斑块的形成,尤其是中老年T2DM 患者颈动脉粥样硬化发生率较高。本研究探讨中老年T2DM 患者PLR 与颈动脉粥样硬化病变的关系,为早期预防T2DM 患者动脉粥样硬化并发症的发生提供依据。
1 资料与方法
1.1 研究对象
选取2018 年9 月~2020 年9 月于安徽理工大学附属奉贤区中心医院内分泌科住院治疗且经过超声检查的420 例中老年T2DM 患者为研究对象,其中男性249 例(59.3%),女性171 例(40.7%),年龄40~88 岁,平均年龄(62.60±11.34)岁,研究对象均符合中国2 型糖尿病防治指南(2013 年版)的T2DM诊断标准[7]。其中颈动脉内膜-中层厚度(CIMT)正常者(CIMT 正常组)111 例,CIMT 增厚者(CIMT增厚组)103 例,颈动脉粥样硬化斑块者(CAS 斑块组)206 例。排除标准:(1)入院时有危及生命的急性代谢紊乱,糖尿病急性并发症的患者;(2)伴有急慢性感染等症状的患者;(3)严重的心、肝和其他脏器功能不全的患者;(4)患有肿瘤、自身免疫性疾病、过敏性疾病及血液系统疾病的患者。所有患者签署知情同意书。
1.2 仪器与方法
1.2.1 超声检查 采用Phillips EPIQ 7c 彩色多普勒超声诊断仪,配备L12-5 探头,频率为5~12 MHz,由从事超声工作10 年以上的医师进行颈动脉超声检查。检查前受试者至少休息15 min,去枕取仰卧位,头后仰并偏向检查对侧,以充分暴露颈前部。分别测量两侧颈总动脉内中膜厚度、记录是否有粥样硬化斑块。CIMT 增厚标准参照颈动脉超声检查规范指南[8]以CIMT<1.0 mm 为内中膜正常,CIMT≥1.0 mm 为内中膜增厚;局部颈总动脉内中膜厚度≥1.5 mm 定义为斑块。
1.2.2 临床观察指标收集 住院医师工作站收集患者的性别、年龄、身高、体重、糖尿病病程、高血压病程、收缩压(SBP)、舒张压(DBP)、饮酒史、吸烟史等一般资料。计算体质指数(body mass index,BMI)=体重(kg)/身高2(m2)和脉压差(PP)=SBP-DBP。罗氏E602 型分析仪电化学发光法检测空腹C 肽(F-CP)、胱抑素C(Cys-C);AU5800-全自动生化仪检测空腹血糖(FBG)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、血清尿酸(UA)、糖化白蛋白(GA);高效液相色谱法测量糖化血红蛋白(HbAlc)。XN-10 全自动模块血液分析仪检测超敏C 反应蛋白(hs-CRP);血小板与淋巴细胞计数比值(PLR)。
1.3 统计学处理
采用SPSS 23.0 统计软件分析,符合正态分布的计量资料以表示,采用独立样本t检验;非正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示。计数资料以%表示,采用卡方检验;计量资料组间比较用单因素方差分析(one-way ANOVA),方差不齐用Welch检验。多因素二元Logistic 回归分析中老年T2DM 患者颈动脉粥样硬化的影响因素。变量赋值见表1。以上统计分析均采用双侧检验,检验水准α=0.05。采用受试者工作曲 线(receiver operating curve,ROC)评 估PLR 和Logit P 诊断CAS 斑块效能,P<0.05 为差异有统计学意义。
表1 CAS 斑块影响因素的二元Logistic 回归分析变量赋值Tab 1 Variable assignment of binary Logistic regression analysis for influencing factors of CAS plaque
2 结果
2.1 各组一般资料比较
CIMT 增厚组的年龄、糖尿病病程、高血压病程均高于CIMT 正常组,差异均有统计学意义(P<0.05);CAS 斑块组的年龄、脉压差、吸烟比例、饮酒比例、糖尿病病程、高血压病程、TG、LDL-C、GA、HbA1c、hs-CRP、Cys-C、PLR 均高于CIMT 正常组,差异有统计学意义(P<0.05 或P<0.01);CAS 斑块组年龄、吸烟比例、饮酒比例、糖尿病病程、Cys-C、PLR 均高于CIMT 增厚组(P<0.05 或P<0.01);3组间的性别比例、BMI、FC、FBG 水平比较差异均无统计学意义(P均>0.05),见表2。彩色多普勒超声检查CIMT 增厚者的影像及CAS 斑块者的影像,见图1。

表2 各组一般资料比较Tab 2 Comparison of general conditions among three groups

图1 彩色多普勒超声检查Fig 1 Color doppler ultrasonography
2.2 中老年T2DM 患者CAS 斑块影响因素的多因素Logistic 回归分析
以是否发生结局变量Y1(CAS 斑块)为因变量(0=不发生,1=发生)将PLR(连续性变量)为自变量,纳入未经校正Logistic 回归模型结果显示,PLR升高是中老年T2DM 患者CAS 斑块的危险因素。在校正性别、年龄、体质量指数、脉压差、糖尿病病程、高血压病程、吸烟、饮酒、空腹血糖、空腹C 肽、胱抑素C、TG、TC、HDL-C、LDL-C、HbAlc、GA 和超敏C 反应蛋白后的Logistic 回归结果显示,PLR 升高是中老年T2DM 患者CAS 斑块的危险因素。
将PLR(PLR 分类性变量,PLR 均值=115,0=PLR<115 为参考,1=PLR≥115)纳入多因素Logistic 回归模型(Model 3)显示,PLR≥115 的患者是PLR<115 的患者CAS 斑块的1.678 倍(OR=2.678,95%CI=1.672~4.687,P=0.000),提示PLR升高仍是中老年T2DM 患者CAS 斑块的危险因素,见表3。
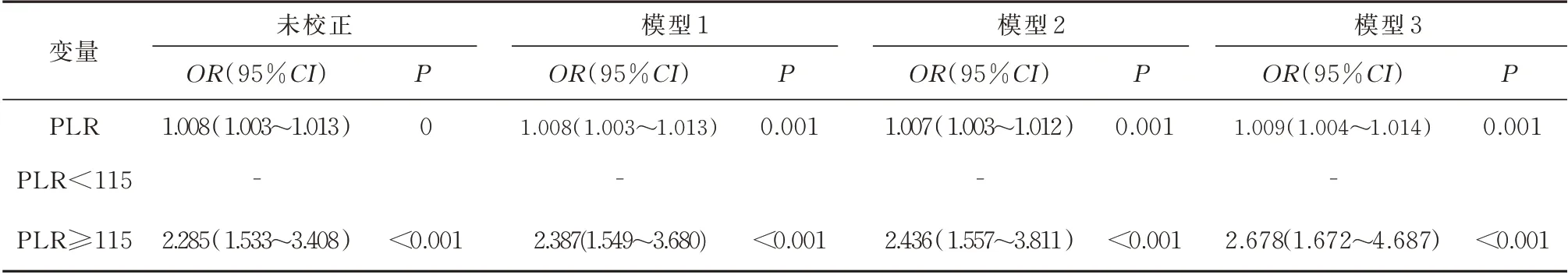
表3 中老年T2DM 患者CAS 斑块影响因素的多因素Logistic 回归分析Tab 3 Multivariate logistic regression analysis of influencing factors of CAS plaque in middle-aged and elderly patients with T2DM
2.3 ROC 评 价PLR 和LogitP 诊 断CAS 斑 块 效 能
ROC 结 果 显 示,PLR 诊 断CAS 斑 块 效 能(AUC=0.642,95%CI=0.578~0.707,P<0.001);多因素Logit P 模型诊断CAS 斑块效能为(AUC=0.807,95%CI=0.759~0.858,P=0.000),见图2。
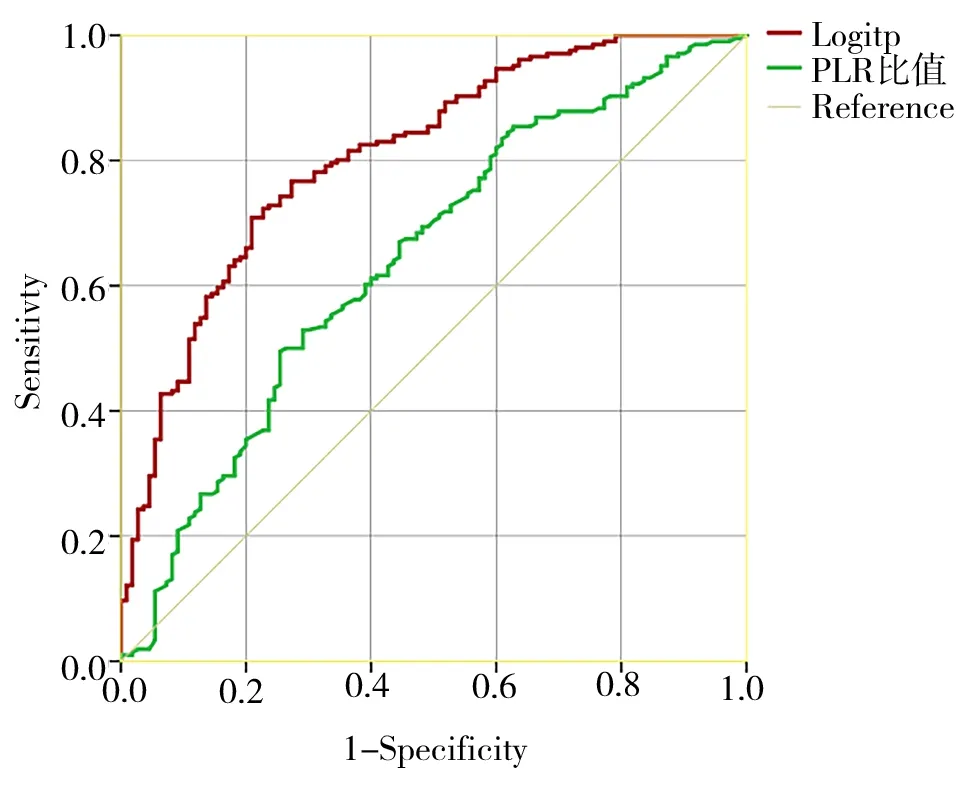
图2 ROC 评价PLR 和LogitP 诊断CAS 斑块效能Fig 2 Evaluation of the efficacy of PLR and LogitP in the diagnosis of CAS plaque by ROC
3 讨论
随着对糖尿病研究的不断深入,人们已逐渐认识到糖尿病的本质是血管病变。糖尿病血管病发症是糖尿病患者并发冠心病、脑卒中等心脑血管不良事件的主要因素,也是导致糖尿病患者死亡的主要原因,而动脉粥样硬化是糖尿病大血管病变的病理基础[9],尤其在中老年患者颈动脉粥样硬化的发生率居高不下。找到中老年T2DM 患者发生颈动脉粥样硬化的危险因素并及早干预,有望有效地预防冠心病、脑卒中等心脑血管不良事件的发生。颈动脉超声检查作为评价全身动脉硬化的“窗口”,可精准测量CIMT 和检测有无CAS 斑块形成,对心脑血管事件的风险评估及预测有重要的临床意义[10,11]。本 研 究 主 要 探 讨 中 老 年T2DM 患 者PLR与颈动脉粥样硬化的关系,结果发现CAS 斑块组PLR 均值显著高于CIMT 正常组PLR 均值。多因素Logistic 回归分析显示,PLR 升高是T2DM 患者CAS 斑块形成的独立危险因素,这与董荣静等[12]研究结果一致。监测T2DM 患者PLR 值的变化有可能成为早期预防T2DM 患者发生动脉粥样硬化并发症的有效方法。
糖尿病属于慢性炎症性疾病,慢性炎症参与动脉粥样硬化的发生发展的全过程[13]。研究表明PLR 作为一种新型炎症预测指标,当机体出现慢性炎症、自身免疫性疾病时,可以不受感染、应激等混杂因素的影响,更精准、敏感地反映机体内的炎症程度[14]。血小板诱导的炎症在糖尿病患者动脉粥样硬化的形成中起重要作用,活化的血小板所释放的有丝分裂物质及炎性介质,可促进更多的白细胞及血小板募集到炎症部位。因T2DM 合并动脉粥样硬化患者血浆中淋巴细胞总数减少,致使机体抗炎能力下降,低度炎症将持续存在[15]。研究表明,血小板计数的升高和淋巴细胞计数的下降可能会参与动脉粥样硬化的发生及发展[16]。因此,PLR 可能是早期预测动脉粥样硬化发生风险的标志。
国内外研究报道[17,18],PLR 与冠脉粥样硬化的严重程度独立且呈正相关,冠状动脉粥样硬化越严重,PLR 值 越 高。Varim 等[19]通 过 分 析PLR 与CAS 严重程度之间的相关性,发现PLR 值可用于预测颈动脉的严重狭窄。陈颖聪等[20]在青年初诊T2DM 患者中发现,PLR 是预测T2DM 患者颈动脉粥样硬化的严重程度的标志。本研究发现PLR 是CAS 病变发生的重要危险因素之一,同时本研究建立的多因素Logistic 回归模型在预测中老年T2DM患者CAS 病变具有临床参考价值。这与王研[21]等研究结果一致。本研究在校正性别、年龄、体质量指数、脉压差、糖尿病病程、高血压病程、吸烟、饮酒、空腹血糖、空腹C 肽、胱抑素C、TG、TC、HDLC、LDL-C、HbAlc、GA 和超敏C 反应蛋白各种混杂因素后,以PLR 为连续性变量纳入Logistic 回归模型结果显示,PLR 升高是中老年T2DM 患者CAS斑块的危险因素。以PLR 为分类性变量(0=PLR<115,1=PLR≥115)纳入多因素Logistic 回归模型(Model 3)结果显示,PLR≥115 的患者是PLR<115 的 患 者CAS 斑 块 的1.678 倍(OR=2.678,95%CI=1.672~4.687,P=0.000),提示PLR 升高仍是中老年T2DM 患者CAS 斑块的危险因素。ROC 曲线结果进一步显示,PLR 诊断CAS 斑块效能 (AUC=0.642, 95%CI=0.578~0.707,P<0.001);多因素LogitP模型诊断CAS 斑块效能为(AUC=0.807,95%CI=0.759~0.858,P<0.001),表明PLR 被认为是诊断中老年T2DM 患者CAS 斑块简易临床指标。
本研究也存在局限性:首先本研究属于回顾性横断面设计,未能纵向观察患者PLR 指标的变化,尚不能明确PLR 与中老年T2DM 患者CAS 病变之间的因果关系;其次,本研究未纳入40 岁以下的T2DM 患者,可能造成结果存在一定的偏倚。因此,今后还需更多大样本、多中心的前瞻性临床研究进一步证实PLR 在T2DM 患者CAS 斑块形成中的作用。
综上所述,本研究发现PLR 升高是中老年T2DM 患者CAS 斑块的危险因素。PLR 指标易获取、价格低,提醒临床医生对于PLR≥115 的中老年T2DM 患者应进一步行血管超声检查,及早预防并筛查颈动脉内中膜病变是糖尿病患者改善预后的关键。
作者贡献度说明:
胡静:构思文章与设计并撰写论文、统计分析;杨少玲:对文章进行可行性分析及修订。赵坤:进行数据采集及分析;王凤翎、张巧娜、范林艳、张红珍、林文华、顾家红:采集数据。
本文无利益冲突。
