正清风痛宁治疗类风湿关节炎疗效及安全性系统评价和GRADE证据级别评价①
2022-02-21向高何克剑尹龙侯晓强冯知涛
向高 何克剑 尹龙 侯晓强 冯知涛
(三峡大学第一临床医学院,宜昌市中心人民医院,宜昌 443003)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性系统性自身免疫性疾病,主要导致关节疼痛、压痛、肿胀和破坏,从而导致残疾[1]。据估测,我国RA发病率约为0.4%,以此计算,目前我国RA患者约有500余万人,是最常见的炎症性关节炎之一[2]。RA病程长、病势迁延难愈,给患者家庭和社会带来巨大的经济负担。虽然现代医疗技术不断进展,但早期诊断、早期治疗仍是控制RA病情发展的重要方法。
目前,治疗RA的常用药物有传统抗风湿药、糖皮质激素、生物制剂等[3]。然而,传统抗风湿药和糖皮质激素毒副作用大难以维持,生物制剂靶向药物的价格高昂无法全面推广,因此,寻找一种有效的方案治疗RA已成为当今迫切需要解决的问题[4]。传统中草药治疗风湿类疾病具有悠久的历史,其中正清风痛宁在临床治疗RA有显著疗效[5]。青藤碱为正清风痛宁的主要活性成分,既往研究显示其具有抗炎、镇痛、免疫抑制等作用,用于治疗RA、痛风、强直性脊柱炎[6-7]。尽管已有学者对正清风痛宁的疗效和安全性进行了分析[8-9],但上述研究的用药方案过于单一、评价结局指标不全且偏于主观化,难以有效评价治疗RA的疗效,临床指导性较差。故本文纳入多种临床常用的联合用药方案,增加了纳入研究的证据评价等级系统(grading of recommendations,assessment,development and evaluation,GRADE)评分,采用客观化的评价指标如28关节疾病活动评分(disease activity score in 28 joints,DAS28)、美国风湿病学会20%改善标准(American College of Rheumatology 20,ACR20)、ACR50,并通过亚组分析来说明各研究异质性的来源,系统评价正清风痛宁联合用药治疗RA的有效性和安全性,以期为正清风痛宁联合用药治疗RA提供循证医学依据,更好地指导临床。
1 资料与方法
1.1 纳入标准
1.1.1 研究类型公开发表的正清风痛宁治疗RA随 机 对 照 实 验(randomized controlled trial,RCT),语种不限。
1.1.2 研究对象明确诊断为RA的患者,诊断标准参照1987年ACR(American College of Rheumatology)标准,年龄、性别、种族不限。
1.1.3 干预措施对照组采用非甾体抗炎药(nonsteroidal antiinflammatory drugs,NSAIDs)和改善病情抗风湿药(disease modifying antirheumatic drugs,DMARDs)单用或联用;试验组为正清风痛宁或青藤碱(盐酸青藤碱)联合对照组,疗程不限。
1.1.4 结局指标主要标准:总有效率;次要标准:晨僵时间、关节压痛数目、红细胞沉降率(eryth⁃rocyte sedimentation rate,ESR)、类风湿因子(rheu⁃matoid factor,RF)、C-反应蛋白(C-reaction protein,CRP)、DAS28、ACR20、ACR50、不良反应。
1.2 排除标准非RCT;无法获得全文的研究;综述性文献、病例报告、前瞻性回顾性研究的文献;无具体数据的研究;动物研究等。
1.3 检索策略计算机检索中国期刊全文数据库(CNKI)、万方数据库、维普数据库(VIP)及PubMed、EMbase、Web of Science数据库,搜集正清风痛宁(盐酸青藤碱)治疗RA的RCT,检索时间均从建库时间至2021年6月30日。中文检索词包括“正清风痛宁”“青藤碱”“盐酸青藤碱”“类风湿关节炎”等,英文的检索词为“Zhengqing Fengtongning”“Sinome⁃nine”“RA”“rheumatoid arthritis”。外语检索策略如表1所示。

表1 外语文献检索策略Tab.1 Search strategy of foreign language literature
1.4 文献筛选由2名研究者根据事前确定的标准独立筛选文献,提取资料并进行交叉核对,将文献检索结果提交给有文献筛选经验的研究员进一步审核最终得到目标文献。使用NoteExpress软件剔除重复文献,阅读剩余文献的标题及摘要进行初步筛选,排除明显不符合标准的文献。进一步阅读全文,确定是否纳入。建立Excel提取表提取纳入文献资料,提取内容为:①研究的基本信息:篇名、作者、发表年份;②患者特征:样本量、用药方案、疗程;③结局指标。
1.5 纳入文献的方法学质量评价文献的质量评价依据Cochrane手册推荐的RCT偏倚风险评估工具Review Manager 5.3质量评估标准进行评估,评价标准包括随机分组、分组结果隐藏、试验人员盲法、研究人员盲法、数据完整、选择性报告、其他,最终对文献做出“风险高”“风险低”“风险不确定”的判断。
1.6 统计分析使用Review Manager 5.3进行Meta分析,若结局指标为二分类变量则用相对危险度(odds ratio,OR)作为效应量,若结局指标为连续性变量则采用均方差(mean difference,MD)或标准均方差(standardized mean difference,SMD)作为效应量,并分别计算95%置信区间(credibility interval,CI)。研究间的异质性通过I²和卡方检验进行统计分析。当I²<50%或P≥0.1视为无显著异质性,采用固定效应模型进行Meta分析;当I²≥50%或P<0.1时,视为有显著异质性,使用随机效应模型进行Meta分析并通过Stata16进行敏感度分析来检验异质性来源。
2 结果
2.1 文献检索初步检索得到1 114篇相关文献,使用NoteExpress软件去除重复文献339篇,排除其他类型文献526篇后剩余249篇,阅读文献题目和摘要,初步筛选出58篇作为全文评估,进一步阅读全文,剔除不符合要求的文献,最终纳入17项研究[10-26],17项研究全部为中文研究,共涉及1 365例患者,试验组患者721例,对照组患者644例;涉及用药方案3种。文献筛选流程如图1所示,纳入文献基本特征如表2所示。

表2 纳入文献基本特征Tab.2 Basic characteristics of included literatures

图1 文献筛选流程Fig.1 Literature screening process
2.2 纳入研究质量评价共纳入17项研究,有2项研究未交待分组方法,4项研究使用了随机数字分组,其余交代了随机分组未说明具体分组方式,所有研究均未交待分配方法;所有研究均未使用试验人员、研究人员盲法,均未发现数据不完整、选择性报告、其他偏倚风险,见图2。

图2 偏倚风险评估图Fig.2 Assessment diagram of risk of bias
2.3 Meta分析
2.3.1 总有效率共有9项研究报告了有效率,异质性检验提示各项研究之间无异质性(P=0.82,I²=0%),Meta分析结果显示OR=2.81,95%CI(1.89,4.17),表明正清风痛宁联合用药治疗RA总有效率优于对照组(P<0.000 01),见图3。
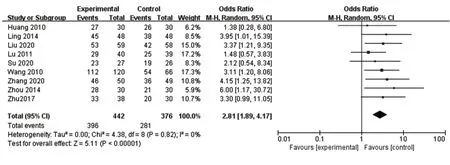
图3 总有效率森林图Fig.3 Forest map of overall response rate
2.3.2 晨僵共有11项研究报告了晨僵时间,异质性检验提示各项研究之间有较大异质性(P<0.000 01,I²=96%),故采用随机效应模型并进行亚组分析,结果显示试验组晨僵时间明显少于对照组[MD=-14.72,95%CI(-21.14,-8.29)],且在减少晨僵时间上正清风痛宁联合NSAIDs效果最好,见图4。

图4 晨僵时间森林图Fig.4 Forest map of morning stiffness time
2.3.3 关节压痛数共有7项研究报告了关节压痛数,异质性检验提示各项研究之间有较大异质性(P<0.000 01,I²=81%),逐一排除后发现李霞[19]的研究对异质性影响较大,剔除后采用随机效应模型并进行亚组分析,结果显示试验组关节压痛个数少于对照组[MD=-2.19,95%CI(-3.11,-1.27)],且正清风痛宁联合DMARDs与NSAIDs效果最好,见图5。
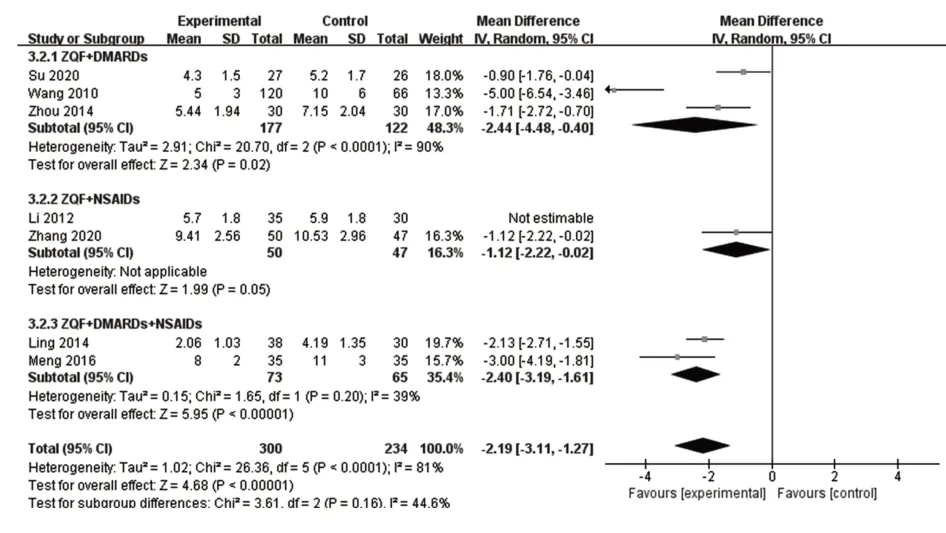
图5 关节压痛森林图Fig.5 Forest map of tenderness number of joint
2.3.4 ESR 17项研究均报告了ESR这一指标,异质性检验提示各项研究之间有较大异质性(P<0.000 01,I²=95%),敏感性分析提示刘颖等[17]的研究对异质性影响较大,见图6。剔除后采用随机效应模型并对其进行亚组分析,结果显示试验组ESR小于对照组[MD=-10.30,95%CI(-14.40,-6.20)],且正清风痛宁联合NSAIDs降低RA患者红细胞沉降率的效果好,见图7。
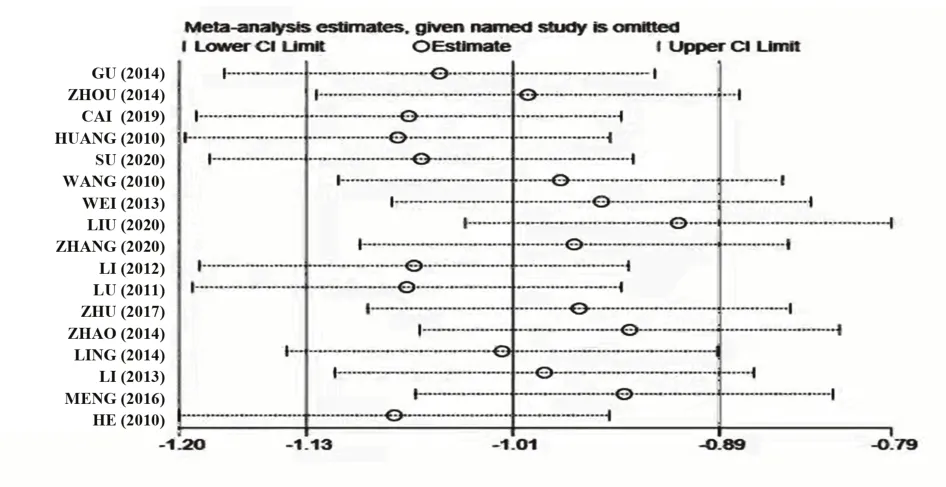
图6 ESR敏感性分析森林图Fig.6 Forest map of sensitivity analysis
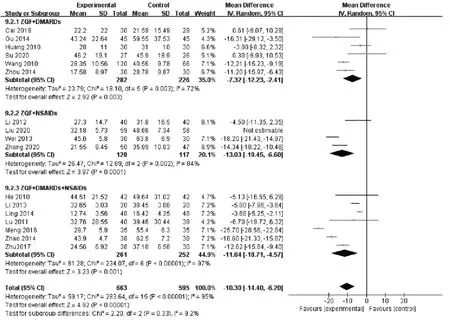
图7 ESR森林图Fig.7 Forest map of ESR
2.3.5 RF共有16项研究报告了RF,异质性检验提示各项研究之间有较大异质性(P<0.000 01,I²=94%),因为各研究数据相差较大故采用随机效应模型、SMD作为效应量进行亚组分析,结果显示SMD=-1.01,95%CI(-1.50,-0.51),表明正清风痛宁联合用药能更好地降低患者RF,见图8。

图8 RF森林图Fig.8 Forest map of RF
2.3.6 CRP有15项研究报告了CRP,异质性检验提示各项研究之间有较大异质性(P<0.000 01,I²=98%),故采用随机效应模型并进行亚组分析,结果显示试验组CRP优于对照组[MD=-4.21,95%CI(-5.69,-2.74)],且正清风痛宁联合DMARDs与NSAIDs能更有效地降低RA患者CRP,见图9。

图9 CRP森林图Fig.9 Forest map of CRP
2.3.7 DAS28有6项研究报告了DAS28,异质性检验提示各项研究之间有较大异质性(P<0.000 01,I²=93%),故采用随机效应模型并进行亚组分析,结果显示试验组DAS28优于对照组[MD=-0.80,95%CI(-1.47,-0.13)],且 正 清 风 痛 宁 联 合DMARDs与NSAIDs能更好地缓解患者28个关节症状,见图10。

图10 DAS28森林图Fig.10 Forest map of DAS28
2.3.8 ACR20仅有3项研究报告了ACR20。异质性检验提示各项研究之间有较大异质性(P=0.07,I²=62%),采用随机效应模型进行分析,结果显示OR=3.11,95%CI(1.14,8.50),表明正清风痛宁联合用药相比对照组能有效提高20%缓解率(P=0.03),见图11。

图11 ACR20森林图Fig.11 Forest map of ACR20
2.3.9 ACR50有3项研究报告了ACR50,异质性检验未发现异质性(P=0.88,I²=0%),结果显示OR=2.30,95%CI(1.29,4.11),表明正清风痛宁联合用药能有效提高50%缓解率(P=0.005),见图12。
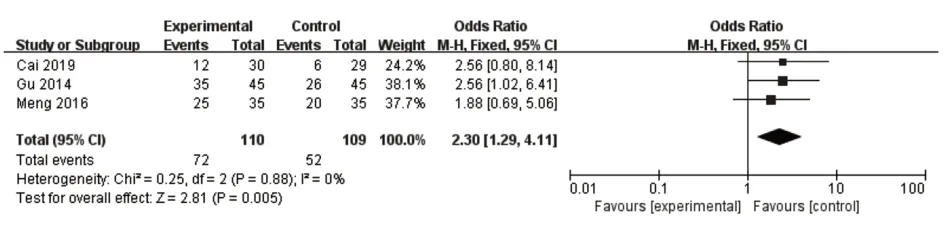
图12 ACR50森林图Fig.12 Forest map of ACR50
2.3.10 不良反应共有11项研究报告了不良反应,其中试验组最常见的不良反应中是皮疹、胃肠道反应、瘙痒,对照组最常见的不良反应是胃肠道反应和肝功能损害。
异质性检验提示各研究之间异质性小(P=0.23,I²=22%),采用固定效应模型分析,结果显示OR=0.66,95%CI(0.45,0.98),试验组不良反应发生率少于对照组(P=0.04),表明相比于对照组,正清风痛宁联合用药的不良反应发生率低安全性好,见图13。

图13 不良反应森林图Fig.13 Forest map of adverse reactions
2.4 发表偏倚选取结局指标的纳入研究数量超过10项的晨僵和ESR进行发表偏倚的评估,结果显示左右不完全对称,提示存在发表偏倚风险,这可能与纳入文献质量不高、各研究组的基线人群不一致、用药方案不同、研究时间等有关,见图14、图15。

图14 晨僵时间漏斗图Fig.14 Funnel plot of morning stiffness
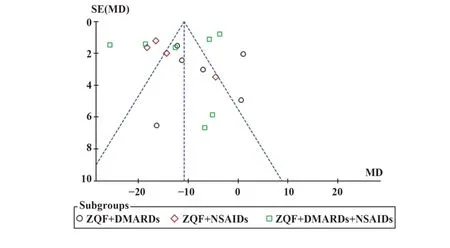
图15 ESR发表偏倚漏斗图Fig.15 Funnel plot of ESR
2.5 GRADE评分应用GRADE pro 3.6软件对结局指标进行证据质量评价。由于各研究均缺失盲法实施、分配隐藏、各研究间异质性高,可能存在发表偏倚,结局指标中除总有效率证据级别为低级,其他均为极低级,见表3。
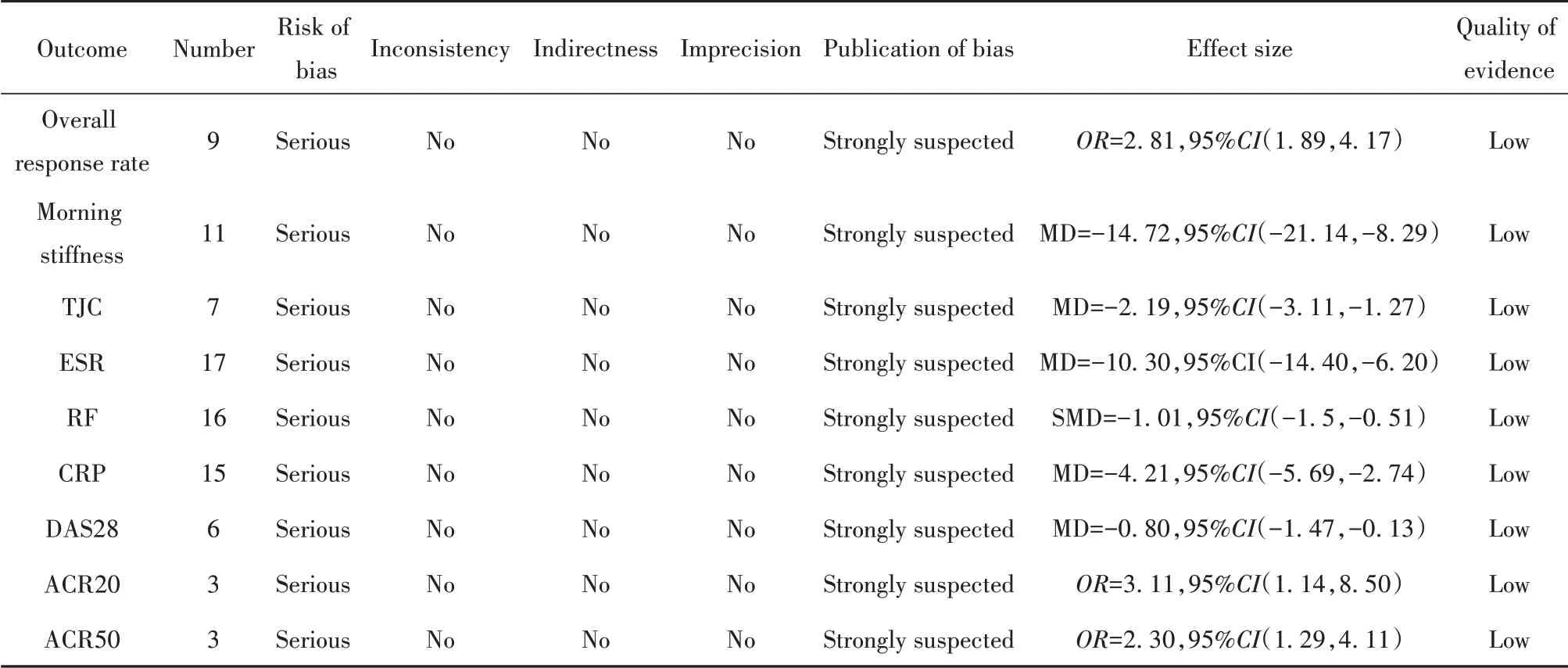
表3 正清风痛宁治疗RA的GRADE证据质量评价Tab.3 Evidential quality evaluation of GRADE in treatment of RA with Zhengqing Fengtongning
3 讨论
RA是最常见的免疫性疾病之一,目前尚无法根治,需要终身监测和治疗[27]。临床上常采用改善病情抗风湿药来缓解症状、消除炎症、恢复关节功能来改善RA患者生活质量,虽然能在一定程度缓解病情进展,但长期使用易引起不良反应[28-29]。国外一项大样本的RCT研究显示,小剂量MTX也会导致胃肠道感染、肺部疾病等多种不良反应[30]。反观植物化学物质则显示出协同治疗效果,同时降低了当前RA治疗的毒性反应[31]。正清风痛宁因其强抗炎免疫调节特性,广泛用于治疗各种风湿免疫疾病,且取得了显著临床疗效。青藤碱是其主要药理成分,现代基础研究表明青藤碱可通过多靶点、多通路、多途径来达到治疗RA的目的[32]。其作用机制有:①抑制α7nAChR表达发挥抗炎作用[33];②抑制RA-FLS中MyD88和TRAF-6的表达,预防软骨和软骨下骨破坏[34];③抑制CaN/NFAT信号通路活性,减少破骨细胞分化,进而抑制RA骨破坏[35];④抑制mPGES-1表 达 并 抑 制 炎 症 和 关 节 炎[36];⑤下 调miR-192并抑制NF-κB和MAPK信号传导的激活缓解脂多糖(lipopolysaccharide,LPS)介导的软骨源性ATDC5细胞损伤[37];⑥通过阻断激活的TLR4/NF-κB信号通路抑制LPS诱导的巨噬细胞免疫反应[38]。青藤碱的副作用较传统药物小,目前的研究表明青藤碱有皮疹、胃肠道反应等不良反应,这可能与其较强的组胺释放及促肥大细胞脱落有关[39-40]。但与常规治疗相比,青藤碱联合用药不良反应发生率更低[29],与本研究一致。基于以上观点,本文对正清风痛宁联合用药治疗RA有效性和安全性进行了系统评价。
Meta分析结果提示:相对于常规治疗,正清风痛宁联合用药能显著提高总有效率、缓解临床症状(晨僵、关节压痛、DAS28、ACR20、ACR50)、降低炎症因子水平(ESR、RF、CRP),且不良反应比对照组低。对晨僵时间、关节压痛个数、ESR、RF、CRP、DAS28均进行了亚组分析,结果显示:在3种治疗方案中,正清风痛宁联合NSAIDs在降低晨僵时间、ESR效果更佳,正清风痛宁联合DMARDs与NSAIDs在缓解关节压痛数、改善DAS28上效果更明显。对晨僵时间及ESR进行了发表偏倚分析,发现各研究组所对应的点不完全对称,偏倚可能与用药方案不同有关。对各结局指标进行GRADE证据等级分析,结果表明证据等级较低,可能与相关研究方案设计不严谨、异质性较高有关。
本研究也存在一定的局限性:①纳入的RCT研究在分配隐藏、盲法方面均未做出明确的叙述,导致其质量评价较低;②纳入的研究虽然在用药方案上进行了限定,但联用的药物并不完全一致,其种类及剂量的选择可能对结果产生影响;③纳入研究的疗程不一致,可能导致了部分研究组之间相关指标存在较大差异,而影响结果的判定;④纳入的研究仅有3项对ACR20、ACR50进行了评价,存在一定的偶然性;⑤纳入研究的结局指标均显示了一定的异质性影响结论的可信度。
综上所述,正清风痛宁联合用药在治疗RA上具有较好的疗效和安全性,但鉴于本研究存在纳入研究的质量一般、异质性较大、疗程不一等问题,研究结论尚需高质量和设计严谨的RCT来进一步验证。
