肺炎克雷伯菌铁摄取调节蛋白(Fur)的生物学功能及对fyuA 的转录调控
2022-02-21张加雪袁灵月谌丽妃李迎丽邱景富
杜 玲,张加雪,袁灵月,谌丽妃,李迎丽,邱景富
(重庆医科大学 公共卫生与管理学院,重庆 400016)
肺炎克雷伯菌(Klebsiella pneumonia)是革兰阴性杆菌,根据致病性分为2 个类型:经典肺炎克雷伯菌(classicKlebsiella pneumonia,cKP)和高毒力肺炎克雷伯菌(hypervirulentKlebsiella pneumonia,hvKP)[1-2].K.pneumoniae在临床上可引起泌尿道感染、菌血症、化脓性肝脓肿和脑膜炎等疾病,相关的毒力因子包括荚膜多糖、脂多糖(lipopolysaccharide,LPS)、菌毛(fimbriae)及铁载体(siderophores)等[3],其中铁载体包括气杆菌素、肠杆菌素、沙门菌素和耶尔森菌素4 类.与cKP 相比,hvKP 具有更强的摄铁能力可分泌更多的铁载体,是其毒力特征之一[4].
铁对于大多数生物来说是生长过程中的必需元素,它作为一些酶的辅因子在物质代谢、DNA 的合成和基因调控等方面发挥着重要作用[5-6].然而过量的铁会通过Fenton 反应产生活性氧(ROS),从而对细胞大分子造成损害.随着环境改变,原核细胞和真核细胞均已演变出一系列维持铁稳态的机制,其中铁摄取调节蛋白(ferric uptake regulator,Fur)起主导作用[7].当胞内铁含量过高时,Fur 与Fe2+形成二聚体,结合在靶基因的启动子区抑制靶基因转录和铁摄取相关基因的表达[8],某些情况下,Fur 也可以起激活剂的作用[9-11];当环境中的铁受到限制时,Fur−Fe2+复合物解离,形成Fur 单体,进而解除其抑制作用.同时,缺铁条件下会诱导细菌铁载体合成基因的表达,生成的铁载体分泌到环境中以结合铁,细胞通过外膜受体和内膜转运蛋白将铁−铁载体复合物运输到胞内以满足生长需要[12].
强毒力岛(high pathogenicity island,HPI)在肠杆菌科中广泛存在,与致病性及毒力密切相关,所携带的基因主要参与铁载体耶尔森菌素的合成、调节与转运[13].HPI 由功能核心区和可变区两部分构成,菌群之间会发生水平转移[14].目前,已在大肠杆菌、沙门菌、霍乱弧菌及克雷伯菌中发现HPI 的存在[15-16].与大肠杆菌序列进行比较,K.pneumoniae存在HPI 中的部分基因,即irp2、irp1、ybtU、ybtT、ybtE和fyuA,其中fyuA基因作为耶尔森菌素的受体,是HPI 基因簇的核心基因之一.有相关文献报道fyuA与许多肠杆菌科细菌毒力相关[17],而K.pneumoniae中 对fyuA的研究 却鲜有报道.我们通过生物信息学分析,发现K.pneumoniae中fyuA基因启动子区可能存在Fur 的结合位点.
Fur 蛋白由fur基因编码,是一个全局性调控因子,能与其他调控系统协同作用,在维持细菌铁稳态时,也影响着细菌的生理和代谢[7].大多数生物体内都有Fur 蛋白的存在,并已证明它在物种之间具有高度的序列同源性,且有相似的空间结构.在大肠杆菌中,已对Fur 的转录调控方式进行了深入研究,建立出完整的调控网络[18].不同细菌体内Fur 功能存在差异,而细菌的特异性造成敲除fur基因后呈现不同的表型变化[19-21].目前在肺炎克雷伯菌中缺少对Fur 的研究,Fur 对fyuA的转录调控机制也尚不清楚.故本研究采用基因敲除技术构建肺炎克雷伯菌fur基因缺失株,对其功能进行研究;并通过分子实验明确Fur 对fyuA的调控机制,为肺炎克雷伯菌的深入研究提供实验依据与材料.
1 材料与方法
1.1 实验菌株和质粒肺炎克雷伯菌NTUH−K2044、温敏型自杀载体质粒pKO3−km(含卡那霉素抗性基因和一个sacB基因)受赠于台湾大学的Jing-Town Wang 教授,荧光质粒pPRObe−gfp(卡那霉素抗性)购自addgene 公司,菌株E.coliDH5α 和质粒pBAD33(氯霉素抗性)由本实验室保存.
1.2 主要试剂与引物Pfu DNA聚合酶、ExTaqDNA 聚合酶、dNTPs 均购自宝生物工程大连有限公司;限制性内切酶、T4DNA 连接酶、T4 Buffer为New England Biolabs 公司产品;PCR 纯化试剂盒、PrimeScript™逆转录试剂盒、琼脂糖凝胶回收试剂盒为Takara 公司产品;RNeasy mini kit 试剂盒和质粒小提试剂盒为Qiagen 公司产品;其他常用生化试剂均为国产分析纯试剂.本实验所用引物均由生工生物工程(上海)股份有限公司合成,引物序列见表1.

表1 实验所用引物Tab.1 Primers used in the experiment
1.3 突变株Δfur 及回补株C−Δfur 的构建以野生株NTUH−K2044 总DNA 为模板,采用融合PCR得到敲除fur基因的上下游同源臂拼接片段后,克隆到自杀质粒pKO3−Km 上.将构建的重组质粒pKO3−km−Δfur电转入NTUH−K2044 的感受态细胞中,通过同源重组并利用蔗糖反向筛选出无痕突变株Δfur.PCR 扩增得到fur片段,与pBAD33 表达质粒进行酶切连接,通过电转的方式导入突变株Δfur中筛选出C−Δfur菌株,具体方法见参考文献[22].
1.4 生长曲线分别将野生株、突变株、回补株的单菌落接于15 mL LB 培养基中(回补株中加入35 μg/mL 氯霉素),37 ℃,200 r/min 过夜培养.次日,按1∶100 接种量转接至50 mL LB 或含有200 μmol/L 2,2′−dipyridyl 的LB 液体培养基中,37 ℃,200 r/min振荡培养;每隔2 h 测定培养物的OD600值,持续检测20 h,每个时间点重复检测3 次取其平均值.使用GraphPad Prism 8.0.1 软件绘制生长曲线.
1.5 CAS 检测法使用铬天青S(CAS)琼脂平板和溶液测量铁载体的生成量.从平板上挑取野生株和突变株的单菌落接于15 mL MM9 基础培养基中,回补株单菌落接于15 mL MM9 培养基中(含氯霉素 35 μg/mL),37 ℃,200 r/min 过夜培养.次日,将细菌悬液OD600值调至同一水平,取5 μL 点于CAS平板上,并在37 ℃下培养14 h,通过细菌菌落周围橘黄色螯合圈大小初步判定铁载体的生成.为了定量测定铁载体的产生,将过夜培养的菌液按1%转接培养至OD600为1.5.每株菌各取0.5 mL 细菌悬液离心10 min,将上清液稀释30 倍后加入0.5 mL CAS 检测液,再加入10 μL Shuttle 溶液,混匀反应30 min 后,使用分光光度计测量630 nm 处的吸光度,重复测定3 次.铁载体的生成计算如下:
铁载体相对质量分数=[(Ar−As)/Ar]×100%,其中As和Ar分别代表样品组和对照组的吸光度.
1.6 结晶紫实验野生株、突变株和回补株的单菌落接于15 mL LB 培养基中(回补株中含氯霉素35 μg/mL),28 ℃,200 r/min 过夜培养.次日,转接培养至OD600为1.0,再1∶100 稀释至装有2 mL MM9 肉汤的玻璃试管中28 ℃静置培养.将培养24、36、48 h 生物膜的试管取出,吸出菌液后用ddH2O 润洗3 次,烘箱静置15 min 烘干;加入0.1%结晶紫溶液染色30 min,ddH2O 润洗5 次;加入DMSO,每管2 mL,放置1~2 h 溶解结晶紫.
生物膜 的相对 形成量=1 000×OD570/(OD600×V1×V2)[23],其中,V1为初始菌液体积(mL),V2为DMSO 体积(mL).
1.7 GFP 报告基因融合实验将NTUH−K2044中fyuA基因启动子区域的片段经PCR 扩增后克隆到pPROBE−gfp质粒gfp基因上游.再通过电转将构建的重组质粒pPROBE−fyuA导入K2044 和Kp∶Δfur中,pPROBE−gfp电转入K2044 中.所得菌株分别接入MM9 基础培养基中(含Kan 50 μg/mL),37 ℃过夜培养;次日,按1∶100 转接至MM9 培养基或含有100 μmol/L FeSO4的MM9 培养基中(含Kan 50 μg/mL 培养6 h.测量菌液OD600值并将其调至同一水平0.2 左右,每个菌株做3 份,用ELx808酶标仪测定相对荧光量(RFU),计算RFU/OD600的值.
1.8 实时定量逆转录PCR(RT−qPCR)从平板上挑取K2044 和Kp∶Δfur的单菌落于15 mL LB 培养基中,37 ℃、200 r/min 过夜培养.按1∶100 将菌株分别转接于含FeSO4(终浓度为100 μmol/L)的LB培养基中至OD600为1.0,使用试剂盒裂解细菌后提取总RNA.通过分光光度计对RNA 进行定量,琼脂糖凝胶电泳检测其完整性.逆转录按PrimeScript™试剂盒要求操作,使RNA 转化为cDNA.使用CFX96 Real−Time PCR 系统进行反应,以rho基因作为内参基因,采用2−ΔΔCt计算fyuA基因的相对表达量.
1.9 数据处理每组实验重复至少3 次,应用GraphPad Prism 8.0.1 软件作图,SPSS 24.0 统计学软件进行数据处理.定量资料以x¯±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组内两两比较采用LSD 检验.P<0.05 为差异有统计学意义.
2 结果
2.1 突变株的构建用PCR 筛选出无痕突变株.以突变株基因组DNA 作为模板,KP1_fur−A/D 为引物对进行PCR 扩增,得到的产物大小为1 135 bp(图1 泳道3),对应的条带低于以野生株为模板扩增获得的大小为1 590 bp(图1 泳道1)的片段.以野生株基因组DNA 作为模板,内引物对KP1_fur−RT−F/R 进行PCR 扩增时,得到大小为191 bp(图1泳道4)的片段,而突变株无扩增产物.结果(图1)表明电泳结果符合预期,成功构建突变株Δfur.
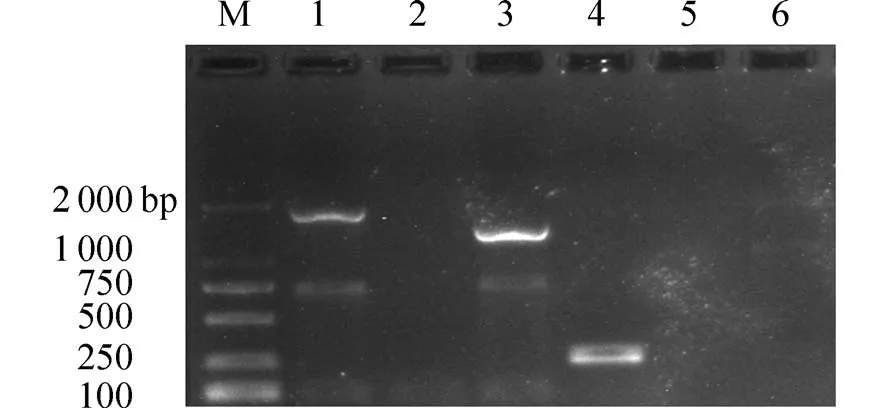
图1 突变株Δfur 的PCR 鉴定结果Fig.1 Identification of mutant strain Δfur by PCR
2.2 回补株的构建以NTUH−K2044 和C−Δfur基因组DNA 为模板,KP1_fur−HB−KpnI−F/KP1_fur−HB−HindⅢ−R 为引物进行验证.结果见图2,以回补株作为模板的PCR 产物大小(泳道2)与野生株作为模板时产物大小一致,表明成功构建回补株C−Δfur.
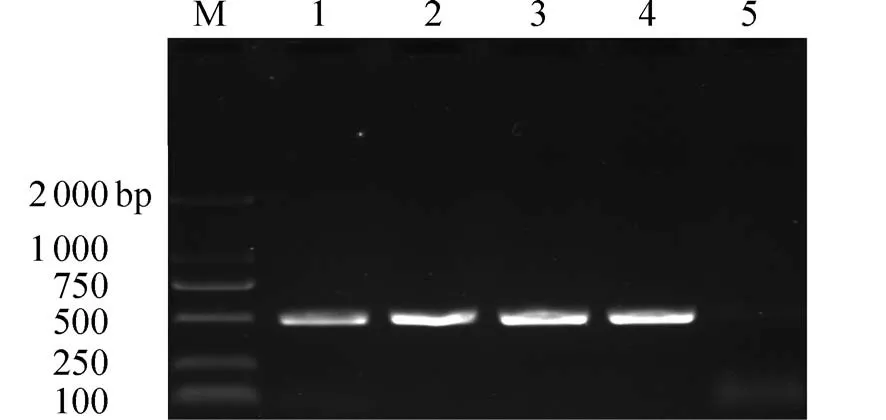
图2 回补株C−Δfur 的PCR 鉴定结果Fig.2 Identification of complementation strain C−Δfur by PCR
2.3 生长曲线为了探究敲除fur基因是否对菌株的生长速率产生影响,在有铁和缺铁环境下培养细菌,通过测定不同时间点的OD600值绘制生长曲线(图3).结果显示,2 种环境下3 株菌株的生长趋势整体一致,但不同时间点对应的菌浓度(以OD600值计算)存在差异.通过t检验可知,无论是有铁环境还是缺铁环境,野生株和回补株的生长速度均快于突变株且具有统计学意义,表明fur基因对细菌的生长具有一定影响.
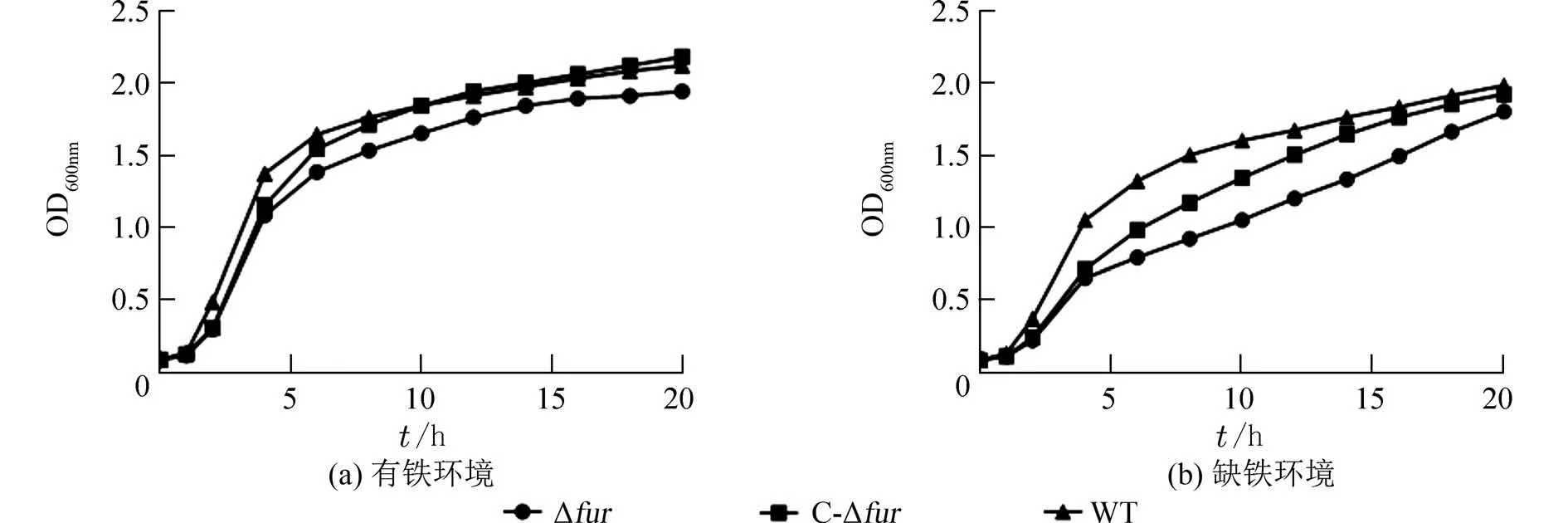
图3 不同环境下菌株的生长曲线Fig.3 Growth curves of strains under different environments
2.4 铁载体生成能力测定
2.4.1 CAS 平板检测 利用CAS 平板检测野生株、突变株及回补株铁载体生成量.从图4 中可以看出,几株菌均能产生橘黄色螯合圈,但是螯合圈直径大小各异,表明铁载体生成量有所差异.在蓝色CAS 平板上能明显看到Δfur菌株周围的螯合圈最大,回补株C−Δfur产生的黄色螯合圈大小介于突变株Δfur与野生株WT 之间.在野生株中导入空质粒构建WT−vector 重组质粒,所产生的螯合圈大小与野生株相同,排除质粒所产生的影响.因此,实验表明fur与细菌铁载体合成相关.
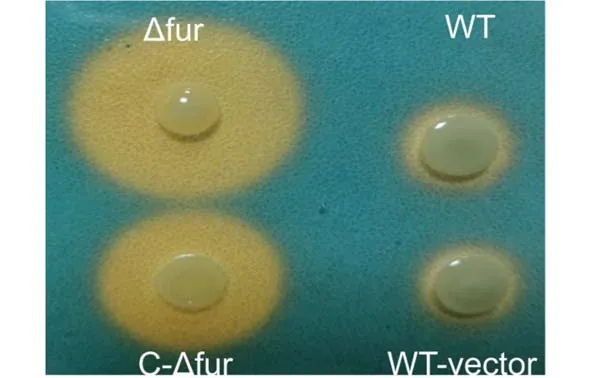
图4 CAS 平板检测细菌产铁载体的能力Fig.4 The ability of bacteria to produce siderophores detected by CAS plate
2.4.2 CAS 液体检测 通过CAS 液体检测对4株菌生成的铁载体进行定量分析,利用630 nm 处测得的吸光度计算铁载体的相对形成量.结果见图5,可以看出突变株生成的铁载体多于野生株和回补株,而回补株低于突变株.结果与定性实验CAS 平板检测结果一致,即Fur 会影响肺炎克雷伯菌铁载体的形成.

图5 铁载体的相对形成量Fig.5 Relative content of siderophores
2.5 Fur 影响生物膜的形成生物膜的形成对肺炎克雷伯菌的生存及感染起重要作用.通过结晶紫染色实验计算分析,发现24、36 h 处野生株形成生物膜的量明显多于突变株,培养至48 h 野生株与回补株形成生物膜的能力均强于突变株(图6).结果表明Fur 正向调控肺炎克雷伯菌生物膜的生成.
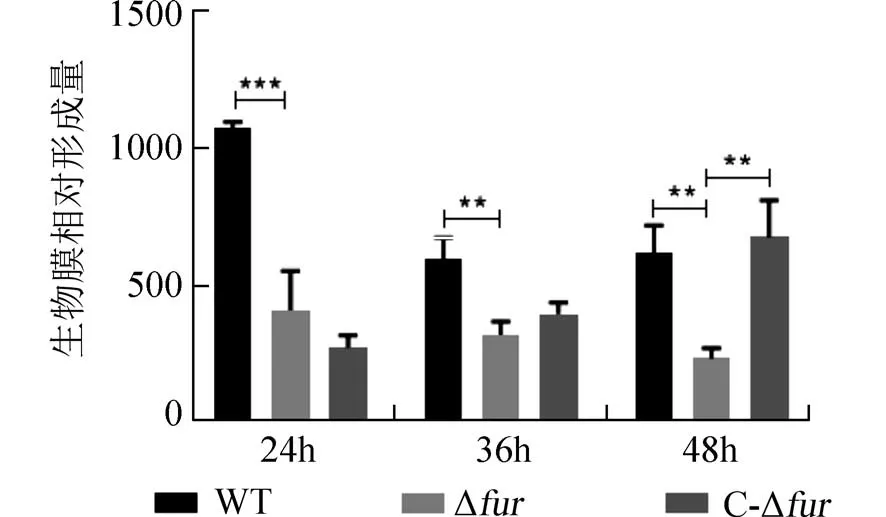
图6 生物膜的相对形成量Fig.6 The relative amount of biofilm formation
2.6 Fur 通过作用于fyuA 启动子区域调控基因的表达Fur 作为铁响应调控因子,参与胞内铁稳态的调节并影响相关基因的表达,实验通过改变环境中的铁含量探索Fur 对fyuA的转录调控.将构建的重组质粒pPROBE−fyuA分别电转入Kp2044 与Kp:Δfur中,经GFP 报告基因融合实验测定其相对荧光量并分析目的基因的表达.结果如图7,菌株在MM9 基础培养基中生长,Kp2044/pPROBE−fyuA和Kp:Δfur/pPROBE−fyuA的荧光表达量无统计学差异;添加100 μmol/L FeSO4至MM9 培养基中,在铁充足条件下,Kp2044/pPROBE−fyuA与Kp:Δfur/pPROBE−fyuA相比荧光表达量显著降低;添加250 μmol/L Dip 至MM9 培养基时,Kp2044/pPROBE−fyuA和Kp:Δfur/pPROBE−fyuA的荧光表达量虽有差异,但均高于有铁环境下的表达量,表明铁充足条件下Fur 抑制fyuA基因的表达.提取细菌总RNA 通过RT-qPCR进一步证明,在铁充足环境中,Fur 负调控fyuA的表达.
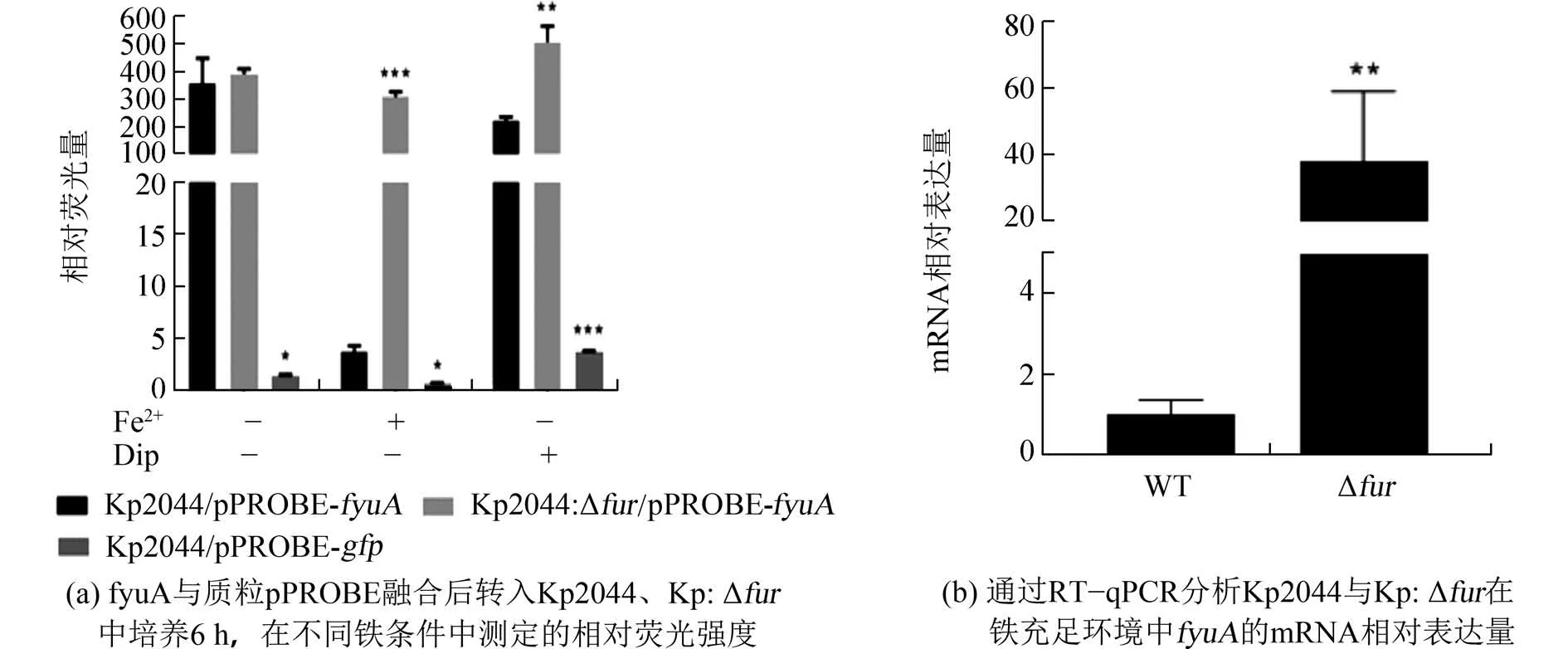
图7 Fur 对fyuA 的转录调控Fig.7 Transcriptional regulation offyuA by Fur
3 讨论
Fur 作为病原菌中存在的整体调控子,在铁代谢中扮演了重要角色.同时,不同菌株间Fur 发挥的功能不尽相同,比如:金黄色葡萄球菌fur基因的缺失使菌株表现出生长缺陷和对H2O2的高敏性,生物膜的形成量也随之增加[19];铜绿假单胞菌fur的缺失使其生长受损,生物膜的形成却无影响[21];而同属革兰氏阴性菌的霍乱弧菌敲除fur基因后,生物膜的形成增加,定殖能力减弱[20].本研究经生长曲线分析可知,fur基因的缺失使菌株的生长受到抑制,表明Fur 影响K.pneumoniae的生长增殖.通过对fur基因敲除株铁载体的形成能力进行测定,发现Δfur突变株产生的螯合圈最大,fur基因的缺失使菌株铁载体的分泌量增加,说明Fur 影响肺炎克雷伯菌铁的摄取,进而对其毒力产生影响.
肺炎克雷伯菌生物膜的形成能力与耐药性及致病性密切相关,且受多种调控因子及靶基因的影响[24].当环境改变时,微生物可通过分泌、释放一些特定的信号分子调控生理功能,这种适应环境变化的交流机制称群体感应(quorum sensing,QS)[25],它贯穿K.pneumoniae生物膜形成的整个过程.Wu等[26]研究结果表明,37 ℃下培养肺炎克雷伯菌fur基因敲除株会减少生物膜的形成.本研究在37 ℃下培养野生株NTUH−K2044、突变株Δfur及回补株C−Δfur,3 株菌的生物膜形成量无统计学差异;将温度降至28 ℃,发现Fur 对K.pneumoniae生物膜的形成起正调控作用,与Wu 等[26]结果一致.温度对生物膜的形成产生影响,猜测Fur 及群体感应过程产生的某些分子共同调控K.pneumoniae生物膜的形成.值得注意的一点,试管壁生物膜不断加厚,使得生物膜的活性及粘附受到影响,外力作用下可引起其部分脱落丢失.这是实验中观察到野生株生物膜形成量为不断增加的过程,但实际测得36、48 h 处生物膜的生成量相对减少的原因.
本研究通过RT−qPCR 和GFP 报告基因融合实验明确了Fur 对fyuA的调控,铁充足条件下Fur 抑制fyuA的表达.Fur 可与其他调控因子共同作用影响菌株的生理活动及代谢,如环磷酸腺苷受体蛋白(cAMP receptor protein,CRP)对细菌的运动、生物膜形成及毒力因子产生都有一定的调控作用[27].故培养基中加入铁螯合剂Dip 造成铁缺乏时,野生株与突变株之间fyuA的表达量存在差异.然而,Fur对fyuA的调控方式以及是否对K.pneumoniae的毒力产生影响需进一步深入研究.因HPI 具有可移动性,转移过程会发生部分基因缺失或修饰,故不同菌株之间HPI 可能存在差异[14],它在K.pneumoniae中转移及功能也有待探索.
4 结论
本研究采用同源重组的基因敲除技术成功构建突变株,并通过生长曲线、CAS 检测和结晶紫染色实验发现,肺炎克雷伯菌的生长、铁载体及生物膜的形成均与fur基因相关.Fur 作为一个重要的调控因子,当环境中的铁充足时,Fur 负调控耶尔森菌素受体fyuA基因的表达.这为后续深入探索Fur 在肺炎克雷伯菌中的功能和调控机制奠定了基础并提供新思路.
