加味六安煎对咳嗽变异性哮喘豚鼠肺组织病理及辅助性T细胞1、2类细胞因子的影响
2022-02-21张叶李盼盼吴力群陈海鹏霍婧伟徐方蔚张宁宁路晨陈宇航廖欣婷
张叶 李盼盼 吴力群 陈海鹏 霍婧伟 徐方蔚 张宁宁 路晨 陈宇航 廖欣婷


摘要 目的:觀察加味六安煎对咳嗽变异性哮喘豚鼠肺组织病理及辅助性T细胞1、2类细胞因子水平的影响,探讨免疫相关作用机制。方法:将30只雄性豚鼠随机分为对照组、模型组、孟鲁司特钠组、中药低中高剂量组。除对照组外均腹腔注射卵蛋白及氢氧化铝致敏后用卵蛋白雾化激发,建立咳嗽变异性哮喘(CVA)模型,相应给药处理。观察肺组织病理形态变化,检测CVA豚鼠肺泡灌洗液中白细胞介素-12(IL-12)、白细胞介素-13(IL-3)。结果:光镜:CVA模型豚鼠较正常组支气管平滑肌增生肥厚,肺组织充血水肿,体积增大,周围炎症细胞浸润,杯状细胞及黏液栓增多,肺泡扩张、塌陷;观察组较模型组肺组织充血水肿、平滑肌增生肥厚及黏液栓等情况均不同程度减轻。透射电镜:模型组较正常组肺泡壁增厚、肺间质充血明显,Ⅱ型肺泡上皮绒毛脱落,线粒体数量减少,部分肿胀。观察组较模型组肺泡壁增厚、肺泡上皮绒毛脱落程度轻,胞质内线粒体数量多。肺泡灌洗液(BALF):模型组较正常组IL-12降低,IL-13升高,IL-12/IL-13下降但不显著;观察组较模型组IL-12均上升,其中中药中、高剂量组上升显著;IL-13降低但不显著,IL-12/IL-13均上升,中药中、高剂量组升高明显。结论:加味六安煎能减少CVA豚鼠炎症细胞浸润,减轻肺组织充血水肿及平滑肌增生肥厚,其作用机制可能与改善IL-12及IL-13水平,调控辅助性T细胞1、2免疫失衡有关。
关键词 加味六安煎;咳嗽变异性哮喘;豚鼠;肺泡灌洗液;肺组织病理;白细胞介素-12;白细胞介素-13;辅助性T细胞1/辅助性T细胞2
Abstract Objective:To observe the effects of Modified Liu′an Decoction on lung histopathology and Th1/Th2 cytokine levels of guinea pigs with cough variant asthma(CVA),and to explore its immune-related mechanism.Methods:A total of 30 male guinea pigs were randomly divided into a normal control group,a CVA model group,a montelukast sodium group,and a modified Liuan Decoction low,medium and high dose groups.Ovalbumin and aluminum hydroxide was injected intraperitoneally for sensitization,and the CVA model was established by egg protein atomization stimulation.Each group was given corresponding administration treatment,with the exception of the normal control group.The pathological changes of lung tissue were observed,and the levels of interleukin 12(IL-12) and interleukin 13(IL-13) in the CVA guinea pigs′ alveolar lavage fluid(BALF) were measured.Results:Observation under light microscopy:Compared with the normal group,the CVA model guinea pig presented with bronchial smooth muscle hyperplasia,lung tissue congestion and edema.There was also an increased volume,inflammatory cell infiltration in the surroundings,increase in goblet cells and mucus plugs,alveolar expansion and collapse.Compared with the CVA model group,the conditions of lung tissue congestion and edema,smooth muscle hyperplasia and mucus embolism in each drug intervention group were reduced to varying degrees.Observation under transmission electron microscope:Compared with the normal group,the alveolar wall of the CVA model group thickening and interstitial congestion were significant.In addition,there was a loss of type Ⅱ alveolar epithelial villi and a decrease in the number of mitochondria with and some swelling.The alveolar walls of each treatment group had varying degrees of thickening but not as severe as the model group.The loss of alveolar epithelial villi was lesser than that of the model group,and the number of mitochondria in the cytoplasm was greater than that of the model group.BALF:Compared with the normal group,IL-12 decreased,IL-13 increased and IL-12/IL-13 decreased but not significantly in the model group; Compared with the model group,IL-12 in the treatment group increased significantly,especially in the medium and high dose groups; IL-13 decreased but not significantly,IL-12/IL-13 increased,especially in medium and high dose groups.Conclusion:Modified Liu′an Decoction can reduce inflammatory cell infiltration in CVA guinea pigs,reduce lung congestion,edema,and smooth muscle hypertrophy.Its mechanism may be related to the improvement in IL-12 and IL-13 levels,as well as the regulation of Th1/Th2 immune imbalance.
Keywords Modified Liuan Decoction; Cough variant asthma; Guinea pigs; Alveolar lavage fluid; Lung histopathology;Interleukin 12; Interleukin 13;Th1/Th2
中图分类号:R285.5文献标识码:A doi:10.3969/j.issn.1673-7202.2022.01.014
咳嗽变异性哮喘(Cough Variant Asthma,CVA)是一个特殊的哮喘类型,是慢性咳嗽的主要病因,约占41.95%,近年其患病率呈上升趋势,未经治疗的患者约30%可发展为典型哮喘[1-3]。CVA发病机制复杂,与典型哮喘相似,具有慢性非特异性气道炎症反应,其气道炎症与免疫紊乱之间关系密切,主要表现为辅助性T细胞1(Th1)/辅助性T细胞2(Th2)比例失衡。白细胞介素(Interleukin,IL)-12、IL-13分属于Th1和Th2的细胞因子,二者水平变化影响机体免疫调节功能。本课题组前期研究表明加味六安煎治疗CVA患儿临床疗效可观[4],并经动物实验证实加味六安煎可以减少CVA大鼠咳嗽次数,减轻气道炎症[5],改善气道重塑[6],但其作用机制在免疫调节方面研究尚不明确。本研究通过观察加味六安煎对CVA豚鼠肺组织病理影响,分析肺泡灌洗液(Bronchoalveolar Lavage Fluid,BALF)中IL-12、IL-13水平变化,探讨其治疗CVA对免疫调节方面的影响。
1 材料与方法
1.1 材料
1.1.1 动物 选取4周龄健康清洁级雄性Hartley豚鼠30只,体质量250~300 g,购自北京维通利华实验動物技术有限公司[许可证号:SCXK(京2016-0011)]。经北京中医药大学东方医院实验动物伦理委员会批准(伦理审批号:P2018053),于室温(23±2)℃,湿度50%~60%环境下饲养,自由饮水与进食。
1.1.2 药物 加味六安煎(组成包括法半夏6 g、茯苓6 g、杏仁6 g、橘红6 g、海浮石20 g、白芥子6 g、胆南星4 g、瓜蒌10 g、炒莱菔子10 g、葶苈子6 g),配制成浓度分别为0.74 g/mL、1.48 g/mL、2.22 g/mL的溶液(低、中、高剂量组),分别相当于体质量70 kg成人用量的5倍、10倍、15倍,由北京中医药大学东方医院制剂室制备;孟鲁司特钠(规格4 mg/片,杭州默沙东制药有限公司,生产批号:N007972),用0.9%氯化钠溶液配制成混悬液,于4 ℃冰箱保存。
1.1.3 试剂与仪器 卵蛋白(Ovalbumin,OVA,北京索莱宝科技有限公司,生产批号:421C033)、氢氧化铝(国药集团化学试剂有限公司,生产批号:20131125)、0.9%氯化钠溶液(国药集团化学试剂有限公司,货号:53101968)、水合氯醛(国药集团化学试剂有限公司,货号:30037516)、磷酸盐缓冲液(北京中杉金桥生物技术有限公司,货号:ZLI-9061)、甲醇溶液(国药集团化学试剂有限公司,货号:10014108)、雾化器(飞利浦Philips公司,型号:Sami型)、离心机(Sigma,型号:3K18)、透射电镜[日立(中国)有限公司,型号:H-600]、白细胞介素12、13酶联免疫试剂盒(上海酶联生物科技有限公司,货号:EIA-2693、EIA-2634)。
1.2 方法
1.2.1 分组与模型制备 选取健康豚鼠30只,按照随机数表法分为6组,每组5只。A组,正常组;B组,模型组;C组,西药组;D组,低剂量加味六安煎组;E组,中剂量加味六安煎组;F组,高剂量加味六安煎组。上述方法正常饲养3 d后开始实验。除A组外,其余各组每只豚鼠均在第1、8天进行腹腔注射10% OVA和AL(OH)3混合溶液1 mL致敏。自第15天起,B、C、D、E、F组豚鼠予以1%OVA溶液超声雾化激发2 min,1次/d,共10 d。激发时观察豚鼠反应,如出现咳嗽、竖毛、喷嚏、干呕、呼吸困难、极度烦躁等现象中2种和(或)以上,或抽搐、虚脱现象之一者,判定为造模成功。
1.2.2 干预方法 各组给药剂量按人与豚鼠体表面积换算公式计算。激发之日即从实验的第15天开始,用雾化器激发前30 min,各组分别药物灌胃干预,共治疗10 d。A组:不作处理。B组:灌服0.9%氯化钠溶液1.7 mL/(100 g·d)。C组:灌服孟鲁司特钠混悬液1.2 mg/kg。D组:灌服低浓度加味六安煎溶液,1.7 mL/(100 g·d)。E组:灌服中浓度加味六安煎溶液,1.7 mL/(100 g·d)。F组:灌服高浓度加味六安煎溶液,1.7 mL/(100 g·d)。各组均为1次/d,连续灌胃10 d。
1.2.3 检测指标与方法
1.2.3.1 细胞因子检测 豚鼠予以10 mg/kg水合氯醛腹腔注射进行麻醉,夹板固定后打开胸腔,行气管插管术后结扎右肺,使用磷酸盐缓冲液(Phosphate Buffered Saline,PBS)分3次行支气管肺泡灌洗,每次2 mL PBS,并回收BALF。以3 000 r/min,离心半径10 cm,离心10 min,离心后留取上清液置-20 ℃冰存。采用酶联免疫吸附试验法检测BALF中IL-12、IL-13含量。严格按照相关试剂盒说明书提供方法进行检测操作。
1.2.3.2 光镜观察肺组织病理形态学变化 豚鼠予以10 mg/kg水合氯醛腹腔注射进行麻醉,迅速打开胸腔,暴露肺部及心脏,取出肺组织,放入10%甲醛溶液中固定,石蜡包埋,切片,HE染色。光镜下观察肺组织中炎症细胞浸润情况,支气管黏膜、上皮细胞以及肺泡损害情况,基底膜、平滑肌以及杯状细胞增生情况等病理变化。
1.2.3.3 透射电镜观察肺组织病理形态学变化 上述操作后取1 mm×1 mm×1 mm大小的肺组织放入2.5%戊二醛中固定,制备电镜标本。用透射电镜观察肺组织上皮细胞、线粒体、内质网等超微结构的改变。
1.3 统计学方法 采用SPSS 20.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,符合正态分布,方差齐性,选择单因素方差分析,否则采用非参数秩和检验中Kruskal-Wallis检验,以P<0.05为差异有统计学意义。
2 结果
2.1 CVA豚鼠肺组织病理变化
2.1.1 光镜观察肺组织病理形态学变化 正常组豚鼠支气管黏膜光滑完整,管腔通畅,肺泡结构完整,未见平滑肌层及管壁增厚,无明显的炎症细胞浸润。CVA模型组豚鼠支气管黏膜充血水肿,炎症细胞浸润,基底膜增生、肥厚,气管腔内黏液栓,上皮细胞及杯状细胞数量增加,肺泡扩张塌陷。与模型组比较,各药物干预组病理变化均有不同程度的减轻,镜下可见黏膜充血水肿减轻,炎症细胞减少,管腔内黏液减少,基底膜变薄,杯状细胞及上皮细胞减少。见图1。
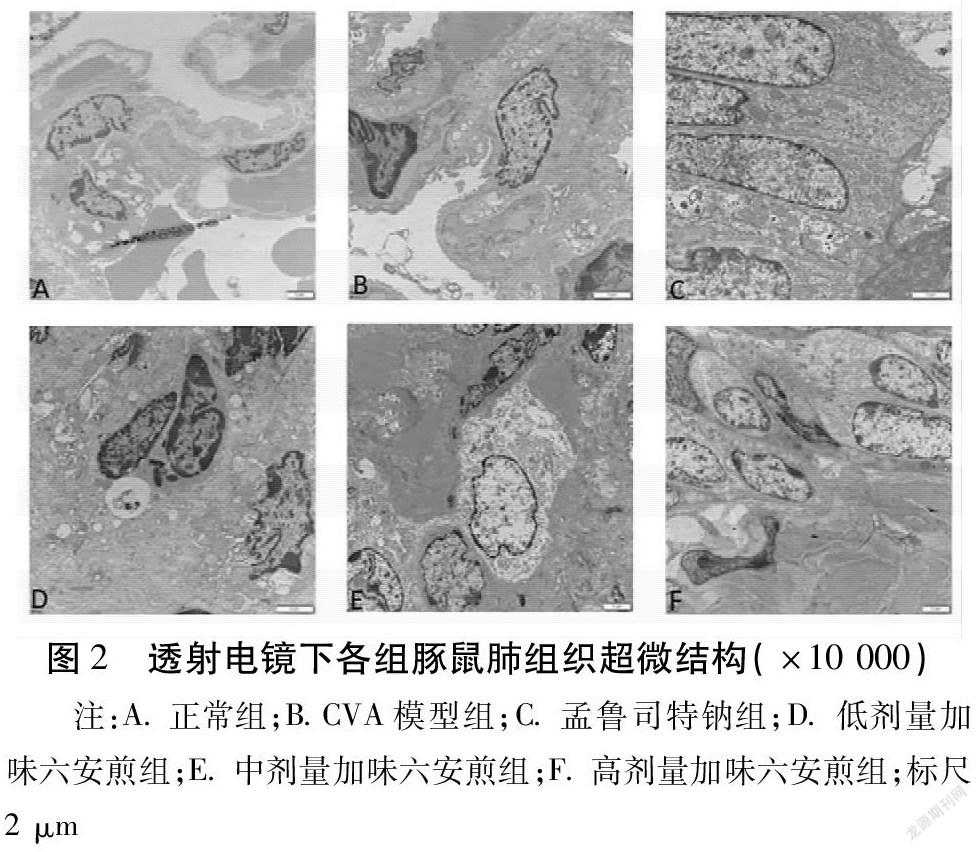
2.1.2 透射电镜观察肺组织病理形态学变化 正常组肺泡壁未见增厚,肺泡间质血管丰富、充血。肺泡上皮细胞绒毛丰富、完整。胞质内可见丰富的板层小体。线粒体、内质网和核糖体均正常。模型组肺泡壁明显增厚,肺间质血管充血明显,Ⅱ型肺泡上皮绒毛脱落,线粒体数量减少,部分出现肿胀,内质网核糖体丰富。各观察组肺泡壁均有不同程度的增厚但不如模型组重,肺泡上皮绒毛脱落较模型组轻,胞质内线粒体数量较模型组多,内质网、核糖体变化不明显。见图2。
2.2 CVA豚鼠BALF中IL-12及IL-13水平变化 经Kruskal-Wallis检验,CVA豚鼠模型组与正常组、中药各剂量组之间、中药组与西药组IL-12水平,模型组与给药干预组、加味六安煎各剂量组间、中药组与西药组之间IL-13水平,模型组与正常组、加味六安煎各剂量组间、中药组与西药组之间IL-12/IL-13比值,差异均无统计学意义(均P>0.05);與模型组比较,各观察组IL-12水平、IL-12/IL-13比值均有所升高,其中中药组中、高剂量组IL-12水平升高,正常组IL-13水平较低,中药组中、高剂量组L-12/IL-13比值升高,差异有统计学意义(均P<0.05)。见表1。
3 讨论
中医学并无CVA病名,历代医家根据CVA主要临床表现将其归为“哮咳”“风咳”“咳嗽”等范畴。其主要病机为内有“伏痰”,外邪引动,内外相合而发之,痰饮内伏为咳嗽之根本,可见“伏痰”在疾病的发生和发展中起关键作用。《河间六书》指出“治咳者,治痰为先”。导师吴力群教授禀承从痰论治思想,选用《景岳全书·新方八阵》中的六安煎,并遵循小儿生理特点及病邪传变性质进行化裁,摒弃生姜辛温散寒之品,加用海浮石、瓜蒌、胆南星、葶苈子等清肺化痰之药;其中半夏、陈皮、茯苓可健脾、燥湿、化痰,杜生痰之源,杏仁、白芥子、莱菔子既可调畅气机又有豁痰止咳之功,以“健脾化痰,清肺降气”为基本治则辨治CVA。
CVA属于慢性非特异性气道炎症,其发病机制与典型哮喘相似,主要由多种炎症细胞、炎症介质和细胞因子共同参与所致,其中嗜酸性粒细胞为主要的效应细胞,其增殖、分化、成熟、浸润等与慢性炎症的病理过程相关[7]。T淋巴细胞介导的免疫调节失衡在CVA发病机制中起关键作用,主要表现为Th1型细胞因子释放减少、Th2型细胞因子增加,Th1/Th2细胞因子比例失衡与CVA疾病的进展关系密切。Th2可以直接调节嗜酸性粒细胞的活化,促进炎症细胞的浸润,诱导炎症反应[8]。IL-13主要由Th2细胞分泌产生,可以促进淋巴细胞、嗜酸性粒细胞、肥大细胞等在气道内渗出,从而引起气道黏膜水肿、支气管平滑肌痉挛、气道气流受限,是促使某些细胞因子对气道上皮损伤而发生病理变化的重要因素[9]。梁冰红[10]研究显示,CVA患儿血清中IL-13表达水平明显增高,可能通过参与某种机制或通路调控儿童CVA的发生、发展。此外亦有研究表明CVA大鼠模型中IL-13水平明显增高,给予药物干预后可抑制IL-13在模型大鼠中的过度表达[11]。本研究显示:CVA豚鼠模型组IL-13水平明显高于正常对照组,各观察组经药物干预后IL-13水平明显降低,与既往研究相符合,加味六安煎高剂量组降低最明显,但各观察组之间IL-13水平差异无统计学意义。IL-12主要由Th1细胞分泌可上调T细胞和自然杀伤细胞的γ干扰素(IFN-γ)的产生,促进Th1反应,抑制Th2细胞因子的表达[12]。IL-12能抑制B细胞合成IgE,减少嗜酸性粒细胞向气道内浸润,其水平下降是哮喘炎症反应的重要特征[13-14]。既往研究表明哮喘患儿和模型小鼠血清中IL-12水平均较正常组降低,经布地奈德治疗后均有所升高[15]。本研究中CVA豚鼠模型组IL-12表达水平较正常组降低,药物干预后各观察组IL-12水平均较模型组有所升高,且中药组中、高剂量与模型组比较差异有统计学意义。相关研究表明CVA、哮喘等疾病患者体内存在不同程度的免疫功能异常,且与Th1/Th2细胞比例异常,免疫功能失衡有关[16-17]。研究提示CVA患儿体内存在Th1/Th2细胞因子失衡,导致机体免疫力降低,与疾病进展和反复发作关系密切[18]。Th1和Th2类细胞因子之间相互制约,通过达到动态平衡维持机体免疫功能,纠正Th1/Th2细胞免疫功能紊乱有助于减轻气道炎症反应[19]。本研究分别选取Th1和Th2类细胞因子中IL-12、IL-13,通过观察二者之间水平的变化,观察加味六安煎对CVA模型豚鼠Th1/Th2免疫平衡调节。研究结果显示CVA模型豚鼠与正常组比较,BALF中IL-13水平升高,IL-12水平下降,表明CVA模型豚鼠存在Th1/Th2失衡,与CVA发病机制中Th2细胞过度分化相符合[20]。经加味六安煎治疗后中、高剂量组的IL-12水平明显上升,IL-13水平下降,IL-12/IL-13比值明显升高,加味六安煎中、高剂量组尤为显著(P<0.05),表明加味六安煎对Th1/Th2失衡状态具有调节作用。气道炎症细胞释放各种炎症反应的自由基,如过氧化氢和一氧化氮,自由基易损伤线粒体,致其超微结构发生改变,而线粒体的损伤也会增加气道炎症,二者之间相互作用[21-22]。线粒体损伤在气道炎症和气道重塑之间起桥梁作用,抑制其损伤可减少上皮细胞损伤,抑制气道重塑[23]。通过光镜和透射电镜观察CVA模型豚鼠肺组织病理变化显示支气管黏膜充血水肿,炎症细胞浸润,基底膜增生、肥厚等,肺泡壁明显增厚,肺间质血管充血明显,Ⅱ型肺泡上皮绒毛不明显,线粒体数量减少,经加味六安煎干预后CVA豚鼠支气管黏膜充血水肿减轻,炎症细胞减少,基底膜变薄,肺泡壁增厚不明显,线粒体数量多于模型组等。
综上所述,加味六安煎可以明显减轻CVA豚鼠肺组织支气管黏膜充血水肿及炎症细胞浸润程度,减缓肺泡壁增厚情况,从而减少胞质内线粒体的损伤,其可能通过升高机体IL-12水平,降低IL-13水平,调节Th1/Th2的失衡,减轻气道炎症,从而抑制气道重塑,发挥治疗CVA的作用。但本研究仅检测CVA豚鼠BALF中IL-12、IL-13水平,关于加味六安煎对CVA豚鼠及CVA患儿血清中IL-12、IL-13水平的影响仍需要进一步探索。
参考文献
[1]中华医学会儿科学分会呼吸学组慢性咳嗽协作组,《中华儿科杂志》编辑委员会.中国儿童慢性咳嗽诊断与治疗指南(2013年修订)[J].中华儿科杂志,2014,52(3):184-188.
[2]候丹,黄帅阳,吕明圣,等.桑梅止咳颗粒对咳嗽变异性哮喘大鼠气道炎症反应的作用及机制[J].中国实验方剂学杂志,2022,28(2):62-66.
[3]Fujimura M,Nishizawa Y,Nishitsuji M,et al.Predictors for typical asthma onset from cough variant asthma[J].J Asthma,2005,42(2):107-111.
[4]苟旭蕾.六安煎加减治疗儿童咳嗽变异性哮喘脾虚痰热证的临床研究[D].北京:北京中医药大学,2016.
[5]霍婧伟,魏丽娜,苟旭蕾,等.加味六安煎对咳嗽变异性哮喘大鼠肿瘤坏死因子-α和白细胞介素-5的影响[J].环球中医药,2016,9(1):6-9.
[6]张宁宁,吴力群,霍婧伟,等.加味六安煎对咳嗽变异性哮喘大鼠气道重塑病理形态学的影响[J].北京中医药大学学报,2020,43(1):50-55.
[7]赵雅婷,张焕萍.痰嗜酸粒细胞在支气管哮喘气道炎症中作用的研究进展[J].医学综述,2019,25(10):1889-1893.
[8]郭靖,刘亚楠,郝明明,等.哮喘患儿合并肺炎支原体感染免疫状态及Th1/Th2平衡的变化[J].中华医院感染学杂志,2020,30(9):1412-1416.
[9]Klose C,Mahlakiv T,Moeller JB,et al.The neuropeptide neuromedin U stimulates innate lymphoid cells and type 2 inflammation[J].Nature,2017,549(7671):282-286.
[10]梁冰红.咳嗽变异性哮喘患儿血清CCL11、IL-4、IL-13表达水平的变化及意义[J].热带医学杂志,2019,19(9):1150-1153.
[11]李冬梅,施雷,王文丽.CVA模型大鼠痰瘀同治气道炎症TGF-β1、IL-13、VEGF及NF-κB之间的相关性研究[J].中医药学报,2016,44(6):37-41.
[12]Hsu CY,Liu HE,Sheu FY,et al.Synergistic therapeutic effects of combined adenovirus-mediated interleukin-10 and interleukin-12 gene therapy on airway inflammation in asthmatic mice[J].J Gene Med,2010,12(1):11-21.
[13]王红阳,王宏丽,王袁,等.IL-12对小鼠哮喘模型气道炎症及TNF-α和IL-10水平的影响[J].细胞与分子免疫学杂志,2012,28(9):982-984.
[14]Chen T,Liang W,Gao L,et al.Association of single nucleotide polymorphisms in interleukin 12(IL-12A and-B)with asthma in a Chinese population[J].Hum Immunol,2011,72(7):603-606.
[15]Zhang YL,Luan B,Wang XF,et al.Peripheral blood MDSCs,IL-10 and IL-12 in children with asthma and their importance in asthma development[J].PLoS One,2013,8(5):e63775.
[16]Lee SY,Bae CS,Seo JH,et al.Mycoleptodonoides aitchisonii suppresses asthma via Th2 and Th1 cell regulation in an ovalbumin induced asthma mouse model[J].Mol Med Rep,2018,17(1):11-20.
[17]Britt RD Jr,Thompson MA,Sasse S,et al.Th1 cytokines TNF-α and IFN-γ promote corticosteroid resistance in developing human airway smooth muscle[J].Am J Physiol Lung Cell Mol Physiol,2019,316(1):L71-L81.
[18]张卜元,范静华.咳嗽变异性哮喘患儿NGF、NKA、SP表达与Th1/Th2细胞因子的相关性分析[J].南昌大学学报:医学版,2020,60(6):48-52.
[19]罗波,尧雪洲,廖敏,等.黄芪甲苷Ⅳ对卵清蛋白诱导的哮喘小鼠CD4+T细胞亚型Th1、Th2免疫活性的抑制作用[J].中华中医药杂志,2018,33(9):4071-4074.
[20]Wenzel SE.Emergence of Biomolecular Pathways to Define Novel Asthma Phenotypes.Type-2 Immunity and Beyond[J].Am J Respir Cell Mol Biol,2016,55(1):1-4.
[21]Zifa E,Daniil Z,Skoumi E,et al.Mitochondrial genetic background plays a role in increasing risk to asthma[J].Mol Biol Rep,2012,39(4):4697-4708.
[22]王文珊.線粒体损伤在支气管哮喘发生机制中的作用[D].武汉:华中科技大学,2013.
[23]王植嘉.线粒体在哮喘发病机制中的作用[J].国际儿科学杂志,2018,45(12):924-928.
(2021-04-13收稿 本文编辑:王明)
