大孔吸附树脂-硅胶柱层析法部分纯化藜麦β-蜕皮激素
2022-02-20郑雅莹马挺军
郑雅莹, 马挺军
(北京农学院食品科学与工程学院,北京 102206)
藜麦是藜科一年生草本双子叶植物,原产于南美洲的安第斯山脉,具有数千年的种植历史[1]。藜麦被联合国粮食及农业组织认定为唯一能满足人体基本营养需求的单一植物[2],因为藜麦中含有丰富的高质量蛋白质,氨基酸组成均衡,并且相较于真谷物,藜麦不含麸质蛋白,适合乳糜泻患者食用;藜麦中膳食纤维含量丰富,适合减肥人群食用;藜麦中含有多不饱和脂肪酸,如亚油酸和α-亚麻酸等;藜麦也是矿物质和维生素的重要来源;同时,藜麦中含有多种生物活性成分,如多酚类、黄酮类、γ-氨基丁酸、蜕皮激素等[3,4]。有研究表明,藜麦具有抗氧化、降血糖、抑菌等[5,6]活性,因此藜麦被列为全球十大健康营养食物之一。
蜕皮激素属于一类天然多羟基类固醇,被人们广泛熟知是其在昆虫体内具有控制蜕皮和繁殖的类固醇激素,但植物中所含有的蜕皮激素被证明对哺乳动物和人类具有多种生物活性,如抗氧化、抗肥胖、抗炎、降血糖、促进蛋白质合成等活性[7]。藜麦是唯一含有植物蜕皮激素的假谷物,藜麦中的蜕皮激素主要分为两大类,C-27和C-28植物蜕皮激素。β-蜕皮激素(又称20-羟基蜕皮激素,20-hydroxyecdysone)是藜麦C-27植物蜕皮激素中最主要的物质,含量为0.184~0.484 mg/g,还含有一些微量单体属于C-28植物蜕皮激素,如罗汉松甾酮A等[8]。结构式如图1所示。
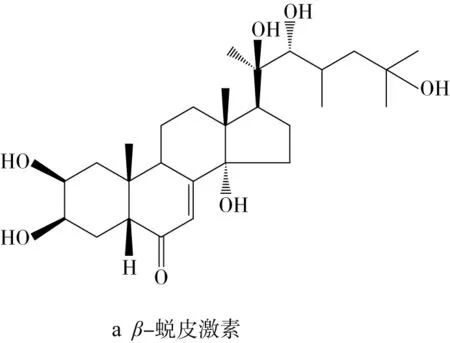
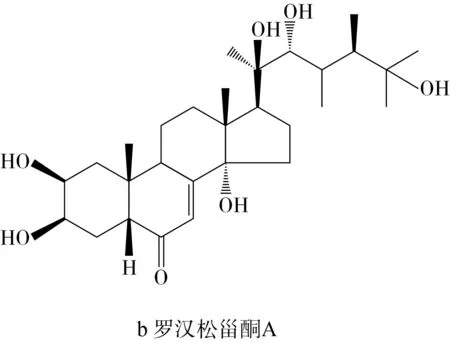
图1 藜麦中主要蜕皮激素化合物结构式
藜麦经溶剂超声提取后得到β-蜕皮激素粗提物,含有糖类、黄酮多酚以及皂苷等杂质,需要进一步纯化得到蜕皮激素[9]。目前蜕皮激素的分离纯化方法有溶剂萃取法、大孔吸附树脂法、硅胶柱层析法等[10]。溶剂萃取法虽然可以对粗提物中的成分进行有效分离,但需要使用大量有机溶剂,存在污染环境,危险并且有害健康等不足;大孔吸附树脂法具有理化性质稳定,易于再生,安全且价格低廉等优点,但其产品纯度不高,需要进一步纯化;硅胶柱层析法可进一步提高产物的纯度,纯化效果好。朱向东等[11]通过大孔吸附树脂法纯化露水草中的β-蜕皮激素;杜月等[12]运用大孔吸附树脂、硅胶柱层析方法分离纯化祁州漏芦花,得到蜕皮激素;欧阳文等[13]采用层析法对土牛膝抗炎活性成分进行分离,通过核磁鉴定所得化合物为β-蜕皮激素。
国内对藜麦蜕皮激素的研究较少,本文探讨大孔吸附树脂-硅胶柱层析对藜麦β-蜕皮激素的分离纯化并对比纯化前后藜麦β-蜕皮激素的抗氧化活性,为藜麦蜕皮激素的进一步研究和在功能食品中利用提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
β-蜕皮激素标准品(纯度≥98%);“冀藜l号”藜麦;大孔吸附树脂(AB-8、D101、HPD600、ADS-7、S-8);硅胶(300-400目)
甲醇(色谱纯)、2,4,6-三(2-吡啶基)-1,3,5-三嗪(TPTZ)、DPPH、抗坏血酸(VC);甲醇(分析纯)、三氯甲烷(分析纯)、无水乙醇;硫酸亚铁、氯化铁、乙酸钠。

表1 大孔吸附树脂的型号及物理性能
1.2 仪器与设备
DH-101型电热恒温鼓风干燥箱,小型高速粉碎机;电子分析天平,KQ-700E型超声波清洗器,TDZ5M型台式低速离心机,旋转蒸发器(RE-2000),常规冷凝装置,SH B-Ⅲ循环水式多用真空泵,真空冷冻干燥机,高效液相色谱,LabTech UV9100D紫外分光光度计,WD-9403B紫外分析仪。
1.3 方法
1.3.1 藜麦蜕皮激素提取
藜麦洗净干燥、除杂、粉碎、过60 目筛,按1∶14 g/mL的料液比加入60%的乙醇,于30 ℃、700 W、40 kHz下超声30 min,4 000 r/min离心10 min,取上清液,旋蒸至无醇味,冷冻干燥,得到β-蜕皮激素粗提物(纯度为5.06%)。
1.3.2 标准曲线的绘制及蜕皮激素含量测定
以β-蜕皮激素为标准品,准确配制0.005、0.01、0.02、0.04、0.08 mg/mL的β-蜕皮激素标准溶液,根据色谱图中峰面积计算β-蜕皮激素含量,实验重复3次,计算平均值,以色谱图中峰面积为纵坐标y,以待测样品质量浓度为横坐标x绘制标准曲线。回归方程为y=2×107x+9 075.5(R2=0.999 7),根据标准曲线计算出蜕皮激素的含量。
采用高效液相色谱法检测,色谱柱:XDB-C18(4.6×250 mm,5 μm);流动相∶甲醇∶水=40∶60;流速:0.8 mL/min;检测波长:246 nm;柱温:31 ℃;进样量:10 μL。
1.3.3 树脂预处理
将大孔吸附树脂于95%乙醇中浸泡24 h,去离子水洗至无醇味;于5%盐酸溶液中浸泡4 h,去离子水洗至中性;于5%氢氧化钠溶液中浸泡5 h,去离子水洗至中性,备用。
1.3.4 最佳大孔吸附树脂的筛选
将藜麦β-蜕皮激素粗提物溶于250 mL去离子水中,配制成一定浓度的藜麦β-蜕皮激素溶液。准确称取3 g树脂加入装有10 mL藜麦β-蜕皮激素溶液的锥形瓶中,于水浴振荡器中(26 ℃,120 r/min)吸附24 h,采用HPLC法测定滤液中的藜麦β-蜕皮激素含量。在吸附平衡的树脂中加入10 mL 70%的乙醇溶液,于水浴振荡器中(26 ℃,120 r/min)解吸24 h,将滤液旋干,加入2 mL甲醇重溶,采用HPLC法测定β-蜕皮激素质量浓度。大孔吸附树脂的吸附率和解吸率计算公式为:


式中:C0、C1分别为吸附前与吸附后溶液中β-蜕皮激素质量浓度/mg/mL;C2为解吸液中β-蜕皮激素质量浓度/mg/mL。
1.3.5 D101型大孔吸附树脂吸附动力学曲线
称取预处理后的D101型大孔吸附树脂3 g,置于25 mL锥形瓶中,加入10 mL质量浓度为25.0mg/mLβ-蜕皮激素粗提液,摇匀,放入水浴恒温振荡器中振荡(26 ℃,120 r/min)。按时取样,测定β-蜕皮激素含量,以时间为横坐标,吸附量为纵坐标绘图,得到D101型大孔吸附树脂的静态吸附动力学曲线。
1.3.6 D101型大孔吸附树脂动态吸附解吸实验
取10 g预处理后的D101型大孔吸附树脂湿法装柱,将粗提物配制成不同浓度的溶液上样至大孔吸附树脂,以吸附率为指标。分别考察上样质量浓度(5、25、45 mg/mL)和上样流速(1.0、1.5、2.0、2.5、3.0 mL/min)对藜麦β-蜕皮激素吸附效果的影响。每10 mL收集1组流份,采用高效液相色谱法测定上样液及流出液中β-蜕皮激素质量浓度,绘制泄漏曲线,确定上样浓度以及最佳上样流速。
在最佳吸附条件下,D101型大孔吸附树脂吸附饱和后,经去离子水洗至流出液澄清,以β-蜕皮激素质量浓度为指标,分别考察乙醇体积分数(10%、30%、50%、70%、90%)和解吸流速(1.5、2.0、2.5、3.0、3.5 mL/min)对β-蜕皮激素解吸效果的影响。每30 mL收集1组流出液,测定β-蜕皮激素质量浓度,绘制动态洗脱曲线,确定最佳洗脱剂体积分数和流速。
1.3.7 硅胶柱层析纯化及纯度测定
取50 g硅胶(300~400目)湿法装柱,将大孔吸附树脂后样品用甲醇配制成质量浓度为100 mg/mL的溶液上样,以三氯甲烷-甲醇(8∶1→5∶1→4∶1)为洗脱剂,以7 mL/min流速进行梯度洗脱,收集洗脱液,每30 mL收集1管。将收集组分分别薄层点样,合并相同组分,减压回收溶剂,产物浓缩至干,甲醇重溶后采用高效液相色谱测定含量。按公式计算纯度:

式中:m1为产物中蜕皮激素质量/g;m0为产物质量/g。
1.3.8 抗氧化活性测定1.3.8.1 总抗氧化能力(T-AOC)
配制0.2、0.4、0.6、0.8和1.0 mmol/L FeSO4标准溶液,分别取0.1 mL加入0.3 mL去离子水和3 mL FARP工作液(10 mmol/L TPTZ、20 mmol/L FeCl3、0.3 mol/L醋酸钠缓冲溶液以1∶1∶10混合,预热至37 ℃)。摇匀后37 ℃放置4 min,于593 nm处测定吸光度值。以FeSO4浓度为x轴,吸光度为y轴,公式为y=0.562x+0.144 6,R2=0.999 8。样品的总抗氧化能力以每克样品的FeSO4浓度表示,单位为mol/g。
1.3.8.2 DPPH自由基清除实验
将2 mL待测液及2 mL DPPH溶液置于具塞试管中,摇匀,放置30 min。以无水乙醇为空白,用紫外分光光度计于517 nm测其吸光度记为Ai;2 mL样品与2 mL无水乙醇混合溶液的吸光度记为Aj;2 mL DPPH溶液与2 mL无水乙醇混合溶液的吸光度记为Ac。
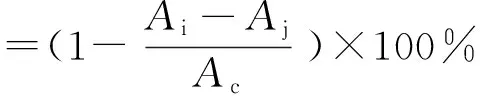
2 结果与分析
2.1 最佳大孔吸附树脂的筛选
多种因素都可能会影响大孔吸附树脂对化合物的分离,如树脂的极性、比表面积和孔径大小等[14]。由图2可知,5种树脂的吸附率差异较小;而解吸率方面,D101和HPD600型树脂的解吸率相对较高,高于其他3种大孔吸附树脂,尤其是D101型大孔吸附树脂的解吸率高达80.72%。D101是非极性树脂,HPD600为极性树脂,2种树脂的比表面积相近,但是平均孔径D101小于HPD600,由此可以推断出树脂的极性和孔径对β-蜕皮激素的吸附解吸过程影响较大。综合吸附率和解吸率2个指标,选择D101型大孔吸附树脂进行后续实验。
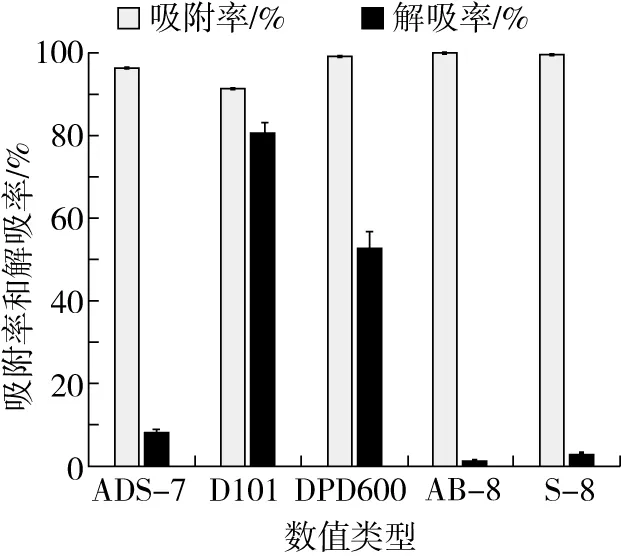
图2 不同大孔吸附树脂对吸附率和解吸率的影响
2.2 D101型大孔吸附树脂吸附动力学曲线
D101型大孔吸附树脂对β-蜕皮激素的吸附属于快速平衡型,在吸附的起始阶段吸附量迅速增加,很快达到吸附平衡。60~200 min吸附量随时间延长迅速增加,可能是由于开始时树脂表面活性吸附位点较多,吸附速率较快;在200 min后,吸附量趋于平稳,可能是由于蜕皮激素从树脂表面进入树脂内部孔径时受到一定阻力[15]。200 min达到吸附平衡,因此选择最佳吸附时间为200 min。
2.3 D101型大孔吸附树脂动态吸附解吸结果
2.3.1 上样浓度对吸附效果影响分析
由图3所示,随着收集流份的增加,藜麦β-蜕皮激素质量浓度逐渐增大。当上样质量浓度为5 mg/mL时,在流出液达到100 mL时才出现泄漏,并一直保持低浓度泄漏;上样浓度为25 mg/mL时,80 mL开始出现泄漏;上样质量浓度为45 mg/mL时,40 mL就开始出现泄漏,但在此浓度下β-蜕皮激素在水中的溶解性变差。因此,为提高树脂利用率,避免样品溶液的浪费,选择25 mg/mL为最佳的上样质量浓度。
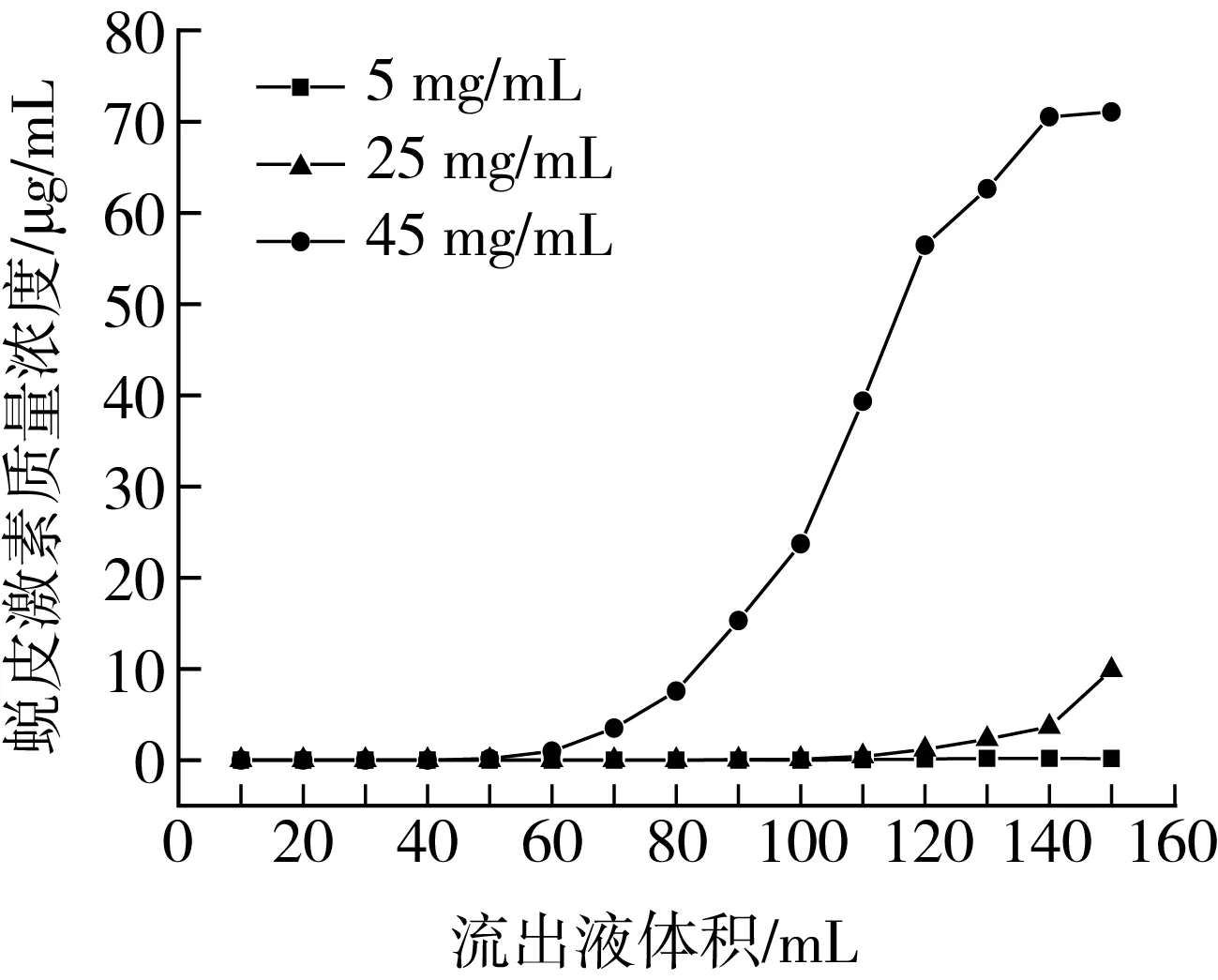
图3 泄漏曲线
2.3.2 吸附流速对吸附效果影响分析
动态吸附过程中流速是影响树脂吸附率的主要因素[16]。当上样流速在1.0~2.0 mL/min范围内,随上样流速的增加,吸附率变化较小;上样流速高于2.0 mL/min后,吸附率下降,是因为流速过大,样液中藜麦蜕皮激素与树脂接触不够充分,引起样液流失,导致吸附量下降。因此,为提高效率,选用最佳的上样流速为2.0 mL/min。
2.3.3 解吸剂体积分数对解吸效果影响分析
由图4可以看出,在5、25、45 mg/mL质量浓度下,都是30%乙醇洗脱剂可以解吸得到最高的蜕皮激素质量浓度。当上样质量浓度为25 mg/mL时,30%乙醇部分的蜕皮激素质量浓度为225.3 μg/mL。β-蜕皮激素易溶于乙醇,其结构中含有多个羟基,所以也能溶于水。因此,30%乙醇为最佳的洗脱剂浓度。崔娜等[17]采用SP825-L型大孔吸附树脂,对川牛膝的正丁醇萃取物以不同乙醇浓度梯度洗脱,50%乙醇洗脱得到蜕皮激素。这可能是由于川牛膝中蜕皮激素类化合物结构与藜麦中有所不同,从而导致化合物的极性不同,乙醇洗脱剂浓度有所差异。
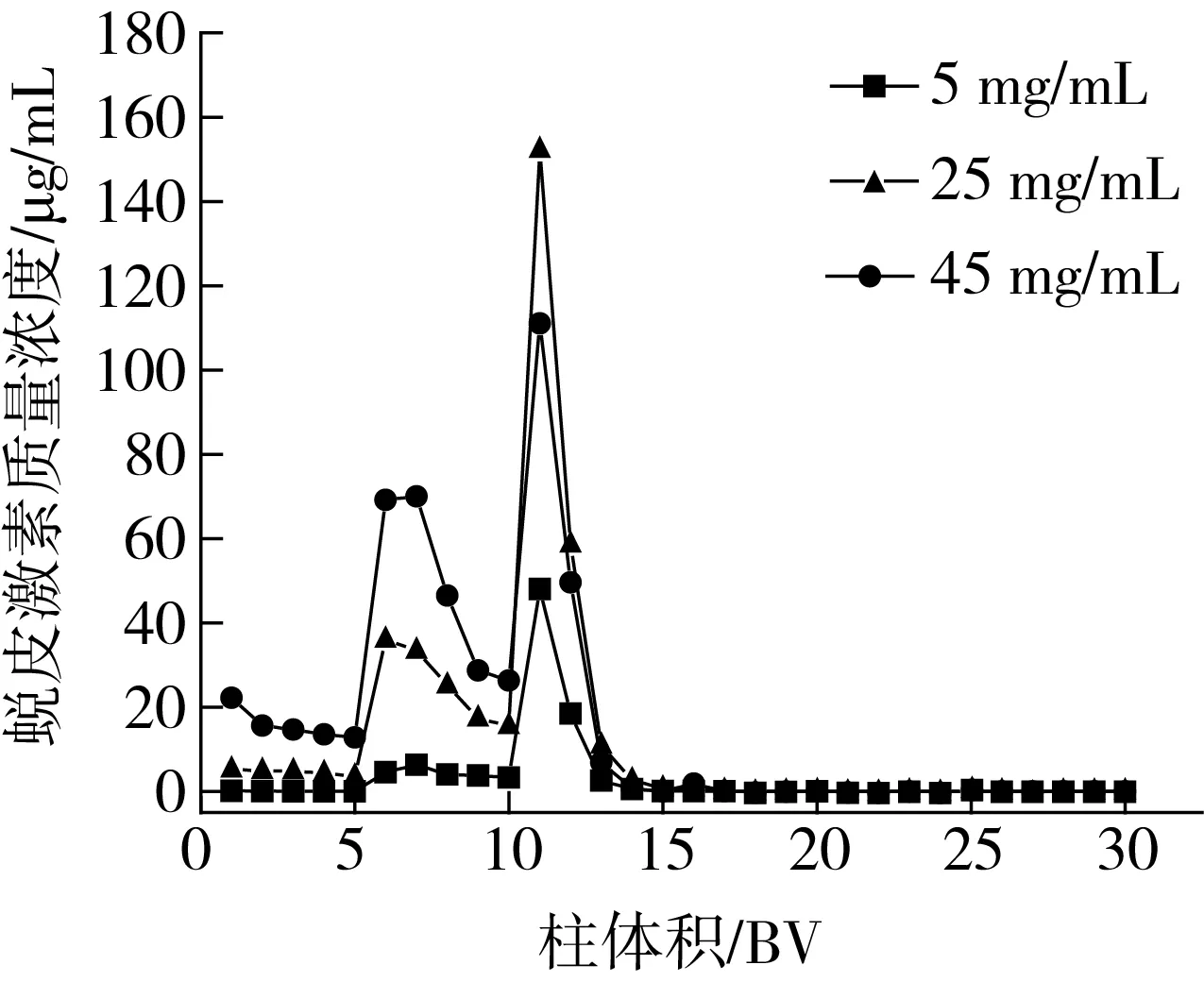
注:1~5 BV为去离子水;6~10 BV为10%乙醇;11~15 BV为30%乙醇;16~20 BV为50%乙醇;21~25 BV为70%乙醇;26~30 BV为90%乙醇。图4 洗脱曲线
2.3.4 解吸流速对解吸效果影响分析
解吸流速在1.5~2.0 mL/min范围内时,随流速增加,β-蜕皮激素解吸率逐渐上升;在2.0~3.5 mL/min范围内时,随流速增加,β-蜕皮激素解吸率逐渐下降,这是由于解吸剂与大孔吸附树脂接触时间较短,无法起到充分解吸β-蜕皮激素的作用。因此,为保证解吸剂与树脂充分接触,选用最适解吸流速为2.0 mL/min。
2.4 硅胶柱层析纯化及纯度测定
柱层析前先用薄层层析筛选适合的展开剂,具有节约时间、操作简便的特点[18]。以三氯甲烷-甲醇梯度(8∶1→5∶1→4∶1)洗脱,根据硅胶柱层析流份的薄层色谱结果(见图5),可确定V(三氯甲烷)∶V(甲醇)=4∶1的前90 mL含有β-蜕皮激素,合并洗脱液得到β-蜕皮激素组分。

图5 薄层色谱图
藜麦β-蜕皮激素粗提物经过大孔吸附树脂-硅胶柱层析纯化后,藜麦β-蜕皮激素的纯度由5.06%提高至40.78%,液相色谱图见图6,杂峰相对较少,仍需要进一步纯化。
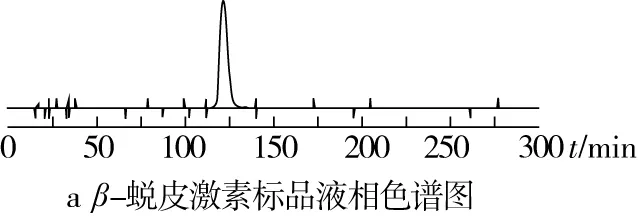
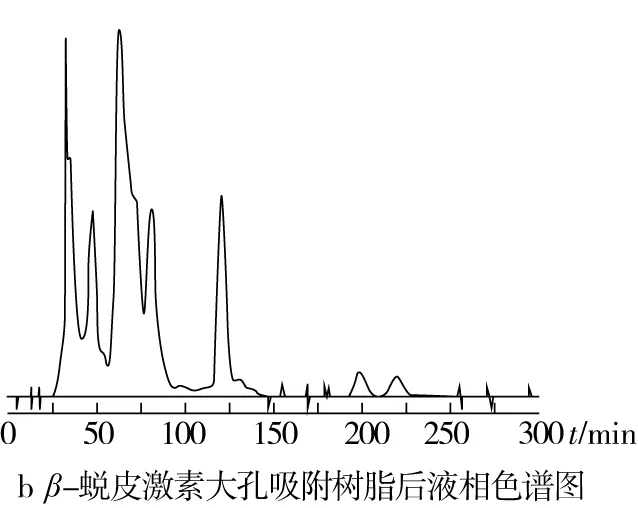
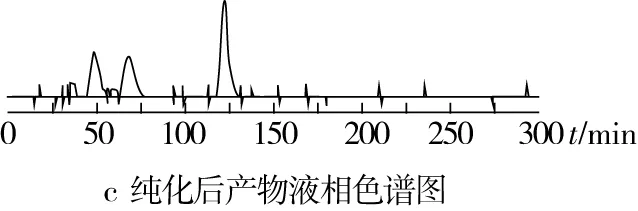
图6 液相色谱图
2.5 体外抗氧化活性测定
2.5.1 总抗氧化能力的测定
由图7可知,随着藜麦β-蜕皮激素的纯度提高,总抗氧化能力逐渐增加。藜麦β-蜕皮激素纯化前和纯化后产物总抗氧化能力分别为(0.44±0.01)mol/g和(6.46±0.46) mol/g,部分纯化后总抗氧化能力提高14.68倍,相当于VC总抗氧化能力的42.60%。
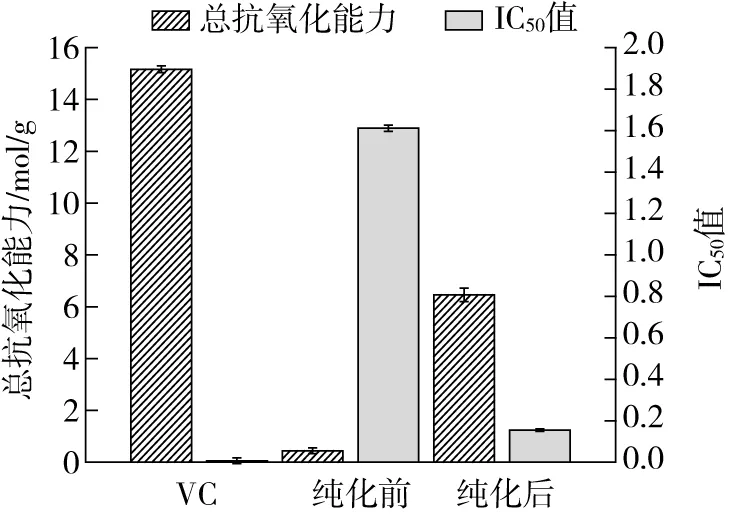
图7 蜕皮激素抗氧化能力比较
2.5.2 DPPH自由基清除能力
随着β-蜕皮激素溶液浓度的增大,清除率不断上升。纯化后的藜麦β-蜕皮激素在质量浓度为0.3 mg/mL时,清除率已经达到86.11%。由图7可知,藜麦β-蜕皮激素纯化前和纯化后产物对DPPH自由基清除率的IC50值分别为(1.611±0.015) mg/mL和(0.155±0.010) mg/mL,纯化后产物DPPH自由基清除能力为纯化前10.39倍,相当于VC清除DPPH自由基能力的4.37%。纯化后的藜麦β-蜕皮激素具有更强的DPPH自由基清除能力,这可能是由于β-蜕皮激素为清除自由基作用的主要化合物,因此藜麦β-蜕皮激素纯度提高,DPPH自由基清除能力增强。
3 结论
采用D101型大孔吸附树脂为柱层析的填料,以30%乙醇体积分数洗脱,得到纯度为12.12%的蜕皮激素。进一步采用硅胶为柱层析填料,以不同比例的三氯甲烷-甲醇为洗脱剂进行梯度洗脱,在V(三氯甲烷)∶V(甲醇)=4∶1洗脱部位得到β-蜕皮激素,经HPLC鉴定纯度为40.78%。纯化后总抗氧化能力和DPPH自由基清除能力分别比纯化前提高14.68倍和10.39倍;纯化后总抗氧化能力和DPPH自由基清除能力分别为VC的42.60%和4.37%。
本研究优化的藜麦β-蜕皮激素分离纯化方法,虽然能够提高蜕皮激素的纯度,但与预期的纯度还有很大差距,需要使用反相ODS柱色谱、制备液相色谱进一步的纯化,为鉴定结构,阐明结构与功效关系提供理论基础。同时可继续深入探究β-蜕皮激素的抗氧化机理,为藜麦蜕皮激素功能性食品的开发提供理论支撑。
