3-氨基苯硼酸联合乙二胺四乙酸碳青霉烯酶抑制增强试验检测肠杆菌目细菌产碳青霉烯酶的研究
2022-02-20周银娣燕张韩仁如胡付品
周银娣,郭 燕张 琴,韩仁如胡付品
肠杆菌目细菌是引起医院感染最常见的病原菌,产超广谱β 内酰胺酶和碳青霉烯酶是其对β 内酰胺类抗菌药物的主要耐药机制[1]。碳青霉烯类是目前临床上治疗多重耐药肠杆菌目细菌所致感染最有效的抗菌药物之一。但随着该类药物在临床上的广泛应用,碳青霉烯类耐药肠杆菌目细菌(CRE)尤其是耐药肺炎克雷伯菌(CR-KPN)的检出率呈快速上升趋势。由于CRE 菌株往往表现为广泛耐药特征,导致其所致感染的高病死率。文献报道,我国临床上分离的CRE 菌株产生碳青霉烯酶的种类多,对碳青霉烯类的水解能力亦有较大的差异。由于不同酶抑制剂复合制剂对产不同类型碳青霉烯酶菌株的抑制能力不同,故不同类型碳青霉烯酶菌株感染的临床治疗方案也不尽相同[2]。因此,为应对碳青霉烯类耐药革兰阴性杆菌所致感染带来的挑战,喻华等[3]的《肠杆菌目细菌碳青霉烯酶的实验室检测和临床报告规范专家共识》倡议,要求采用一种3-氨基苯硼酸(PBA)联合乙二胺四乙酸(EDTA)碳青霉烯酶增强试验对CRE 菌株的产酶机制进行检测并将检测结果向临床报告。为此,复旦大学附属华山医院抗生素研究所对已用分子生物学方法明确基因型的部分CRE 菌株采用PBA 联合EDTA 协同试验检测细菌产生的碳青霉烯酶,此方法亦称碳青霉烯酶抑制剂增强试验(简称PBA-EDTA),并与近年来CLSI 推荐的改良碳青霉烯灭活试验(mCIM-eCIM 法)[4]对临床分离的CRE 菌株产生的碳青霉烯酶检测符合率进行了比较,现将研究结果报道如下。
1 材料与方法
1.1 材料
1.1.1 菌株来源 研究的275 株受试菌均为抗生素研究所菌种库2017—2018 年经PCR 及DNA 测序明确为产碳青霉烯酶的非重复CRE 保存菌株,其相关特性见表1。质控菌株为大肠埃希菌ATCC 25922、肺炎克雷伯菌ATCC BAA-1705。

表1 经分子生物学检测的275 株产碳青霉烯酶细菌在肠杆菌目细菌中的分布Table 1 Prevalence of carbapenemase genes in 275 nonduplicate strains of Enterobacterales species by molecular test n(%)
1.1.2 主要试剂和抗菌药物纸片 美罗培南纸片为英国OXOID 商品,纸片药物含量为10 μg/片,碳青霉烯酶抑制剂试剂盒购于珠海迪尔生物工程有限公司,内含EDTA 和PBA,每次使用量为10 μL/片,规格为 1 mL/瓶。
1.2 方法
1.2.1 PBA-EDTA 法 按Tsakris 等[5]2010 年 描述的PBA-EDTA 法操作步骤进行:将受试菌调节成0.5 麦氏浊度菌悬液,均匀涂布于纸片法药敏试验MH 琼脂平板上,每个平板贴4 张不同成分的美罗培南纸片,分别为单纯美罗培南(MER,细菌耐药对照)、美罗培南加PBA(10 μL)、美罗培南加EDTA(10 μL)、美罗培南加PBA 加EDTA。见图1。空气环境、35℃±2℃孵育16~18 h。判读标准为:PBA+MER 或EDTA+MER 或PBA+EDTA+MER 的抑菌圈直径比单药美罗培南的抑菌圈直径扩大≥5 mm 者,分别判读为该受试菌为产A 组碳青霉烯酶或产B 组碳青霉烯酶;同时产A组和B 组复合碳青霉烯酶;如抑菌圈直径扩大<5 mm 者,则判断该菌不产A 组或B 组碳青霉烯酶[6]。此方法中的美罗培南纸片可以用亚胺培南(10 μg/片)纸片替代(摩根菌科细菌除外)。
1.2.2 mCIM-eCIM 法 CLSI 描述[7]mCIM 可以检测肠杆菌目和铜绿假单胞菌中的碳青霉烯酶,但不能对检测阳性的菌株进行碳青霉烯酶相关金属酶和丝氨酸酶的定性,但 mCIM-eCIM 联合后可以在mCIM 检测产酶阳性的基础上结合eCIM 检测的结果将检测的酶型进一步检测分类定性,操作步骤为:准备2 管胰蛋白大豆肉汤(TSB),每管体积2 mL,其中一管加入一张10 μg/片美罗培南纸片和1 μL 接种环一环受试菌悬液,另一管加入一张10 μg/片美罗培南纸片和1 μL 受试菌悬液和20 μL 0.5 mol/L EDTA,空气环境、35℃±2℃孵育4 h±15 min;将哥伦比亚血琼脂平板上生长的美罗培南敏感的标准菌株大肠埃希菌ATCC 25922 调节成0.5 麦氏浊度菌悬液,均匀涂布于纸片法药敏试验MH 琼脂平板上,将2 管TSB 中的美罗培南纸片取出贴在MH 琼脂平板上,CLSI 称mCIM-eCIM为改良碳青霉烯灭活试验。根据EDTA 可以抑制MβL(金属碳青霉烯酶)的原理,如受试菌株产MβL 酶,加入EDTA 抑制剂后可以抑制相应的酶,则可使碳青霉烯类(美罗培南)抑菌圈直径比未加入EDTA 时扩大,如图2 所示:如mCIM 检测结果阳性(抑菌圈直径在6~15 mm 或在16~18 mm 抑菌圈内存在针尖样菌落)提示菌株为产碳青霉烯酶菌株;eCIM 结果判读在mCIM 结果阳性基础上,如果eCIM 纸片抑菌圈直径较mCIM 纸片抑菌圈直径扩大≥5 mm 者,提示菌株产金属酶;如果抑菌圈直径扩大<5 mm 者,提示该菌株产丝氨酸碳青霉烯酶。
1.2.3 统计学分析 采用SPSS 21.0 软件,分析PBA-EDTA 法和mCIM-eCIM 法检测CRE 菌株产碳青霉烯酶的能力以及两种方法与分子生物学检测的符合率。
2 结果
2.1 PBA-EDTA 法检测碳青霉烯酶
PBA-EDTA 法对275 株分子生物学方法鉴定为产碳青霉烯酶菌株的检测阳性率达87.3%(240株),其中,119 株产KPC 型酶的检出率为99.2%(118 株),对109 株产金属酶菌株的检出率为100%(109 株),对13 株产复合酶(KPC/NDM)菌株的检出率为100%(13 株),但未能检出分子生物学法检测并确认的34 株产D 组OXA 酶型的菌株。具体检测符合率见表2。PBA-EDTA 法检测结果见图1。
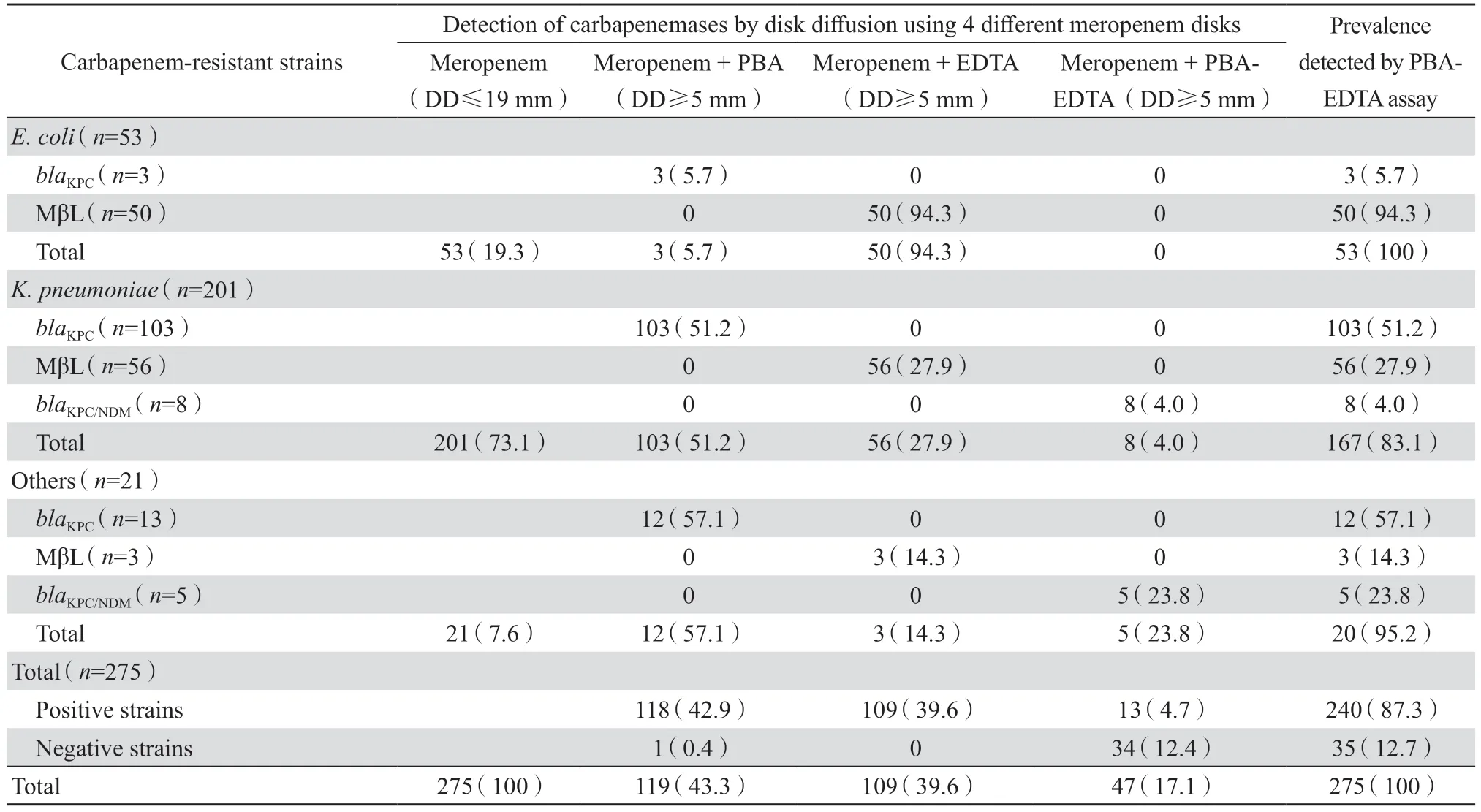
表2 PBA-EDTA 法对碳青霉烯类耐药肠杆菌目细菌275 株的碳青霉烯酶检测结果Table 2 Prevalence of carbapenemases in 275 strains of carbapenem-resistant Enterobacterales detected by carbapenemase inhibitor enhancement test using phenylboronic acid(PBA)and EDTA n(%)
2.2 mCIM-eCIM 法检测碳青霉烯酶
mCIM-eCIM 法检测产碳青霉烯酶菌株结果见图2,与已知的分子生物学检测结果相比,mCIMeCIM 法检测119 株产KPC 型碳青霉烯酶菌株的阳性符合率为100 %(119 株);检测109 株金属酶的阳性符合率为94.5%(103 株);检测D 类酶OXA-232 型的符合率为100%(34 株);mCIMeCIM 无法有效检测同时产NDM 和KPC 型碳青霉烯酶菌株。见表3。
2.3 PBA-EDTA 法与mCIM-eCIM 法检测结果比较
对119 株A 组丝氨酸KPC 酶菌株,PBAEDTA 法与mCIM-eCIM 法检出率差异无统计学意 义。109 株B 组金属酶菌株PBA-EDTA 法 与mCIM-eCIM 法检出率,统计学显示χ2和P值分别为3.7 和0.06,差异无统计学意义;13 株KPC/NDM 复合酶型的菌株,PBA-EDTA 法能正确检测出,但 mCIM-eCIM 法均未能正确检出。反之对OXA-232 型碳青霉烯酶产生株,mCIM-eCIM 法完全检出而PBA-EDTA 未能检出。见表4。
3 讨论
碳青霉烯类耐药肠杆菌目细菌的发生率正在逐年上升,据CHINET 2020 年报道肺炎克雷伯菌对亚胺培南和美罗培南的耐药率已经上升到21.5%和22.4%;鲍曼不动杆菌的耐药率亦已经分别达68.1%和69.0%;而细菌产生的碳青霉烯酶正是细菌对碳青霉烯类抗生素耐药的主要机制[8]。按照Ambler 分类法[9],此类耐药酶可以分为3 组:A 组丝氨酸酶,亦称功能分类2f 组,如最常见的KPC-2、KPC-3 型酶等KPC 酶即为这一组酶;B组金属β 内酰胺酶(MBL),包括NDM、VIM 和IMP;由肠杆菌目细菌产生的OXA-48 为D 组酶,亦称功能分类2 d 组,OXA-48 同A 组酶一样也带有丝氨酸残基,此酶有较弱的水解青霉素和碳青霉烯类抗生素的作用,不水解头孢菌素类,但OXA-48 如果和超广谱β 内酰胺酶(ESBL)、膜孔蛋白缺失协同作用将导致对碳青霉烯类药物的高水平耐药。由于碳青霉烯酶的产生,可直接导致该类耐药菌株所致感染濒于无药可用。因此临床微生物实验室如能对耐药菌赋予兼有耐药机制的药敏试验报告,将有助于临床合理用药,降低病死率,提高治愈率。文献报道,实验室如延迟对耐药菌株诸如产碳青霉烯酶型的诊断报告,将导致患者死亡率上升[10],因此快速、准确的碳青霉烯酶型的诊断十分重要。
目前关于碳青霉烯酶表型检测方法,CLSI、商品化的检测试剂以及文献均有许多相关报道和推荐,大都已为临床应用,但因使用过程中产生的各种弊端,故使用并不广泛。如2015 年CLSI推荐的一种碳青霉烯酶表型快速检测方法Carpa NP 试验,由于每次试验需要配制新鲜试剂[11]、且配制过程较为麻烦,还常会出现无效的检测结果。CLSI 2017 年推荐的mCIM 法仅适用于肠杆菌目细菌和铜绿假单胞菌中的碳青霉烯酶,虽然2018 年又推荐mCIM 联合eCIM 法可同时检测和区分肠杆菌目细菌产生的金属和丝氨酸碳青霉烯酶,但操作费时费力[12]。商品化的酶免疫层析技术可同时检测KPC、NDM、OXA-48、VIM 和IMP 等多种碳青霉烯酶,但价格昂贵[13]。近年来新出现的MLADI-TOF MS 涉及CRE 的研究较少,且没有统一标准[14]。PCR 是检测碳青霉烯酶的金标准,但目前在基层微生物室普及开展[15]尚有一定困难。
本组资料对275 株已知产碳青霉烯酶基因型的耐药肠杆菌目细菌,采用PBA-EDTA 法检测这些菌株中的碳青霉烯酶及其酶型分类,欲获取与原分子生物学方法检出结果的符合率,以便在临床上推广。此法的原理是利用PBA 抑制A 组丝氨酸碳青霉烯酶,EDTA 抑制B 组金属β 内酰胺酶,两者联合亦可同时检测和区分肠杆菌目细菌产生的A 组丝氨酸碳青霉烯酶和B 组金属β 内酰胺酶。结果显示PBA-EDTA 联合检测275 株碳青霉烯类耐药菌株的碳青霉烯酶型谱与原菌种分子生物学鉴定的碳青霉烯酶型谱大致相仿,检测出的产KPC、MβL 和KPC+MβL 复合酶的各种酶型的符合率分别为99.2%、100%和100%。采用mCIM-eCIM 法对275 株细菌的检出结果与分子生物学鉴定的结果符合率略高于PBA-EDTA 法相应的检出率,而对MβL 的检出率略低于PBA-EDTA法相应的检出率,分别为100%和94.5%。虽然有1 株细菌用PBA-EDTA 法未能检出,而mCIMeCIM 法可检测出分子生物学检测出的KPC 酶的结果(分子生物学检测分型),但经统计学分析,两者检出结果与分子生物学检出结果的符合率差异无统计学意义。此外mCIM-eCIM 法未能检测出产KPC+MβL 复合酶菌株,截然不同于能100%检测出产复合酶菌株的PBA-EDTA 法。同样另有34株产D 组blaOXA-232碳青霉烯酶菌株(分子生物学检测分型)可100%(34/34)经mCIM-eCIM 法顺利地检出,但PBA-EDTA 法却未能检出。mCIMeCIM 法原理是在mCIM 检测结果为阳性的基础上,表示耐药菌株产生碳青霉烯酶,但不能分类酶型;如果此时eCIM 法结果亦为阳性,则意味耐药细菌为产B 组金属酶的菌株,如为阴性结果则可判别这株细菌为产丝氨酸酶型菌株。应该说明的是本组资料中这34 株分子生物学检测为D 组blaOXA-232酶,虽然mCIM-eCIM 法检出为产酶菌株,但无法将A 组和D 组丝氨酸酶型分类,也就无法明确是产KPC 或OXA 酶,仅是明确为丝氨酸酶产生株。也提示本组资料采用的PBA-EDTA 法虽然不能检测出34 株D 组OXA 酶,但是能检测出分子生物学检测和确认的189 株A 组(2f 组)丝氨酸酶即KPC 酶。
van Dijk 等[16]以及Pournaras 等[6]分别对128株以及189 株临床分离非重复肠杆菌目细菌检测细菌产碳青霉烯酶,亦采用PBA-EDTA 法,并与分子生物学法比较。van Dijk 等[16]采用分子生物学方法检测产KPC 和金属酶的菌株分别为37 株和31 株,PBA-EDTA 法检测出35 株 和28 株;Pournaras 等[6]采用分子生物学方法检测KPC 和金属酶分别为60 株和9 株,PBA-EDTA 法检测出57株和9 株。本研究的符合率与上述文献报道大致相仿。但需要注意的是,PBA-EDTA 法不适用于对除肠杆菌目细菌外的碳青霉烯酶耐药机制的检测。由于铜绿假单胞菌等其他不发酵糖革兰阴性菌的耐药机制较为复杂,如铜绿假单胞菌天然产生染色体介导的AmpC 酶,而PBA-EDTA 检测法中的PBA 可抑制AmpC 酶的活性,可能将导致碳青霉烯酶检测结果呈假阴性。此外,mCIM-eCIM法可用于铜绿假单胞菌碳青霉烯酶的检测。
总体而言,PBA-EDTA 法适宜检测肠杆菌目细菌产生的A 组丝氨酸碳青霉烯酶、B 组金属酶以及同时产A 组和B 组碳青霉烯酶的菌株;操作较mCIM-eCIM 法简单易行,不需要对受试菌株进行繁琐的预处理,结果易读;便于临床微生物实验室使用和开展肠杆菌目细菌产生的A 组丝氨酸碳青霉烯酶和B 组金属酶,对未能检测酶型的为数不多的碳青霉烯类耐药菌株可继续开展分子生物学方法检测D 组OXA 碳青霉烯酶,为临床合理使用抗菌药物精准治疗提供实验室依据。
