利奈唑胺耐药肠球菌感染危险因素及耐药机制分析
2022-02-20李庆蓉和平安
夏 晴,吕 梅,李庆蓉,和平安,李 江,杨 旭
肠球菌为兼性厌氧的革兰阳性球菌,广泛分布于人和动物消化道内和自然环境中,是人体正常菌群之一,同时也是一种条件致病菌。近年来,由于临床上抗生素的广泛使用及侵袭性操作的普及,肠球菌已成为医院感染的主要病原菌之一。肠球菌对多种抗生素天然耐药,并可通过接受外来的耐药质粒、转座子或通过基因突变获得耐药性[1],给预防治疗带来了巨大挑战。
1 材料与方法
1.1 资料来源
1.1.1 研究对象 收集2018 年9 月—2020 年12月昆明医科大学第二附属医院分离的非重复肠球菌标本2 898 份,其中LRE 阳性标本38 份。根据LRE 感染来源分为医院获得性(HA-LRE)组和社区获得性(CA-LRE)组,同时在尽可能相同标本和科室中按照1∶4 的比例随机抽取利奈唑胺敏感肠球菌(LSE)感染者标本作为对照组。
肠球菌分离自患者无菌部位血液、体液标本,胸腔和腹腔保留积液标本,中段尿标本。分离的菌株吸附在滤纸上而后冷冻干燥保存于-80 ℃。
不同感染部位诊断[3]:①尿路感染,出现尿频、尿急、尿痛等尿路刺激症状,或有下腹触痛、肾区叩痛,伴或不伴发热,清洁中段尿培养肠球菌菌数≥104CFU/mL;②腹腔感染,引流液培养阳性和新的或加重的腹膜炎症状如腹部压痛和反跳痛,腹水量增加或性质改变;③烧伤后伤口感染,伤口愈合不良,切口周围出现红肿、发热和疼痛,渗出物明显增多,创面分泌物或脓液培养阳性;④血流感染为急性发热,白细胞及中性粒细胞明显增高,而无局限于某一系统的急性感染,出现皮疹、肝脾肿大、迁徙性脓肿等症状,血培养阳性。
1.1.2 病例资料收集 收集临床基本信息包括人口学特征(性别、年龄),住院特征(外院转入、住院科室、ICU 入住情况),基础疾病(高血压、糖尿病、泌尿系统疾病),免疫状态(低蛋白血症、肿瘤),侵袭性操作(近6 个月手术史、气管插管、导尿管),近6 个月抗菌药物使用史(碳青霉烯类、利奈唑胺),多数菌感染(同一患者有2 个或更多种细菌或真菌感染)。
1.2 方法
1.2.1 细菌鉴定及药敏试验 分离的LRE 采用纸片扩散法(K-B 法)进行验证,根据临床和实验室标准化协会(CLSI)M100-S30 的标准,最低抑菌浓度(MIC)≥8 mg/L 为耐药。通过在VITEK 2-Compact 全自动细菌鉴定及药敏分析系统(法国生物梅里埃公司)上使用AST-GP67 卡对分离株进行药物敏感性试验。
1.2.2 利奈唑胺耐药基因检测 复苏LRE 菌株,提取基因组 DNA 及质粒 DNA,采用PCR 技术分别扩增23S rRNA V 区基因、编码核糖体蛋白的L3、L4 基因及cfr、optrA和poxtA基因。阳性扩增产物送至北京擎科生物科技公司进行双向测序。与标准菌株粪肠球菌ATCC 29212 进行比对,确认肠球菌是否存在基因突变及耐药基因。
1.2.3 统计学方法 使用SPSS 26.0 统计软件进行数据分析。计量资料通过t检验(正态分布变量)或秩和检验(非正态分布变量)进行单因素分析,计数资料通过卡方检验或Fisher 精确概率法进行单因素分析,计算相关统计量用百分比(%)表示。单因素分析中P<0.1 的变量纳入logistic 回归模型中,用于评估LRE 感染的独立危险因素。优势比(OR)和95%置信区间(CI)以评估关联的强度。P<0.05 为差异具有统计学意义。
2 结果
2.1 临床特征
从38 例LRE 感染患者检出38 株LRE,排除资料不完整5 例,共纳入33 例LRE 感染患者。16例为医院获得性LRE 感染组,64 例医院获得性LSE 感染为对照组;17 例为社区获得性LRE 感染组,68 例社区获得性LSE 感染为对照组。38 株LRE 菌株主要来源为中段尿(20 例,52.6%),引流液(11 例,28.9%)。见图1。科室主要分布在泌尿外科(17 例,44.7%)。见图2。
2.2 药敏试验
所有LRE菌株利奈唑胺的MIC值为8~16 mg/L,呈低水平耐药。利奈唑胺耐药屎肠球菌(LREfm,6 株)对环丙沙星、红霉素、克林霉素、左氧氟沙星、莫西沙星、米诺环素、四环素均耐药,对万古霉素、替考拉宁和替加环素均敏感。利奈唑胺耐药粪肠球菌(LREfs,32 株)对克林霉素、奎奴普丁-达福普汀均耐药,对红霉素、四环素耐药率为90%以上,对替加环素100%敏感,有3 株对万古霉素耐药。多重耐药被定义为对3 种及以上抗菌药物不敏感,本研究中所有LRE菌株均为多重耐药。见表1。

表1 利奈唑胺耐药肠球菌对17 种抗菌药物的药敏试验Table 1 Susceptibility of linezolid-resistant Enterococcus to 17 antibiotics[n(%)]
2.3 耐药机制
HA-LRE 和CA-LRE 菌株主要耐药机制都是携带optrA基因,均未发现23S rRNA V 区突变和获得poxtA基因存在。有2 株LRE 菌株均未检测到23S rRNA V 区,核糖体蛋白L3、L4 基因突变和携带cfr、optrA和poxtA基因,是否存在其他耐药机制,有待进一步研究。见图3。
2.4 HA-LRE 感染危险因素分析
2.4.1 单因素分析 单因素分析结果显示,入住ICU、气管插管、膀胱冲洗是HA-LRE 感染主要的危险因素(P均<0.05)。见表2。
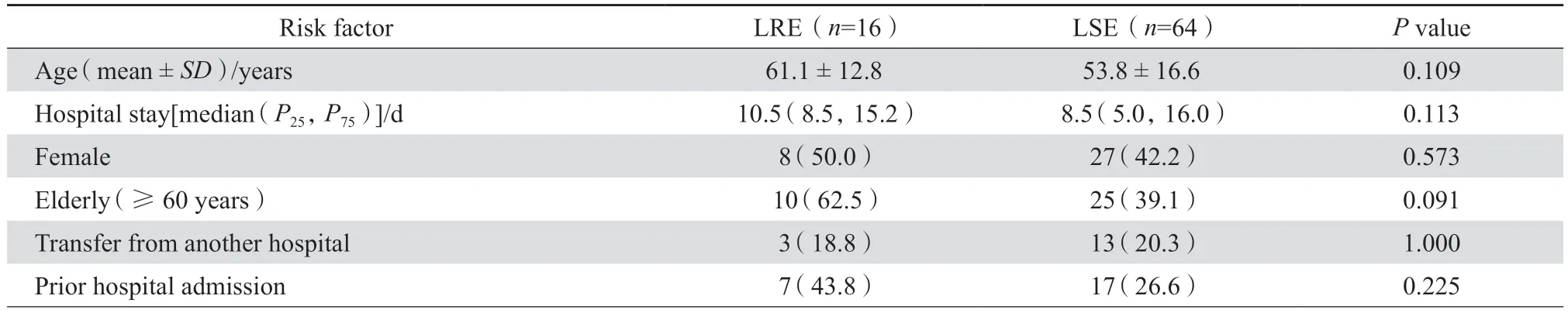
表2 医院获得性利奈唑胺耐药肠球菌感染危险因素的单因素分析Table 2 Univariate analysis of risk factors for hospital-acquired LRE infection
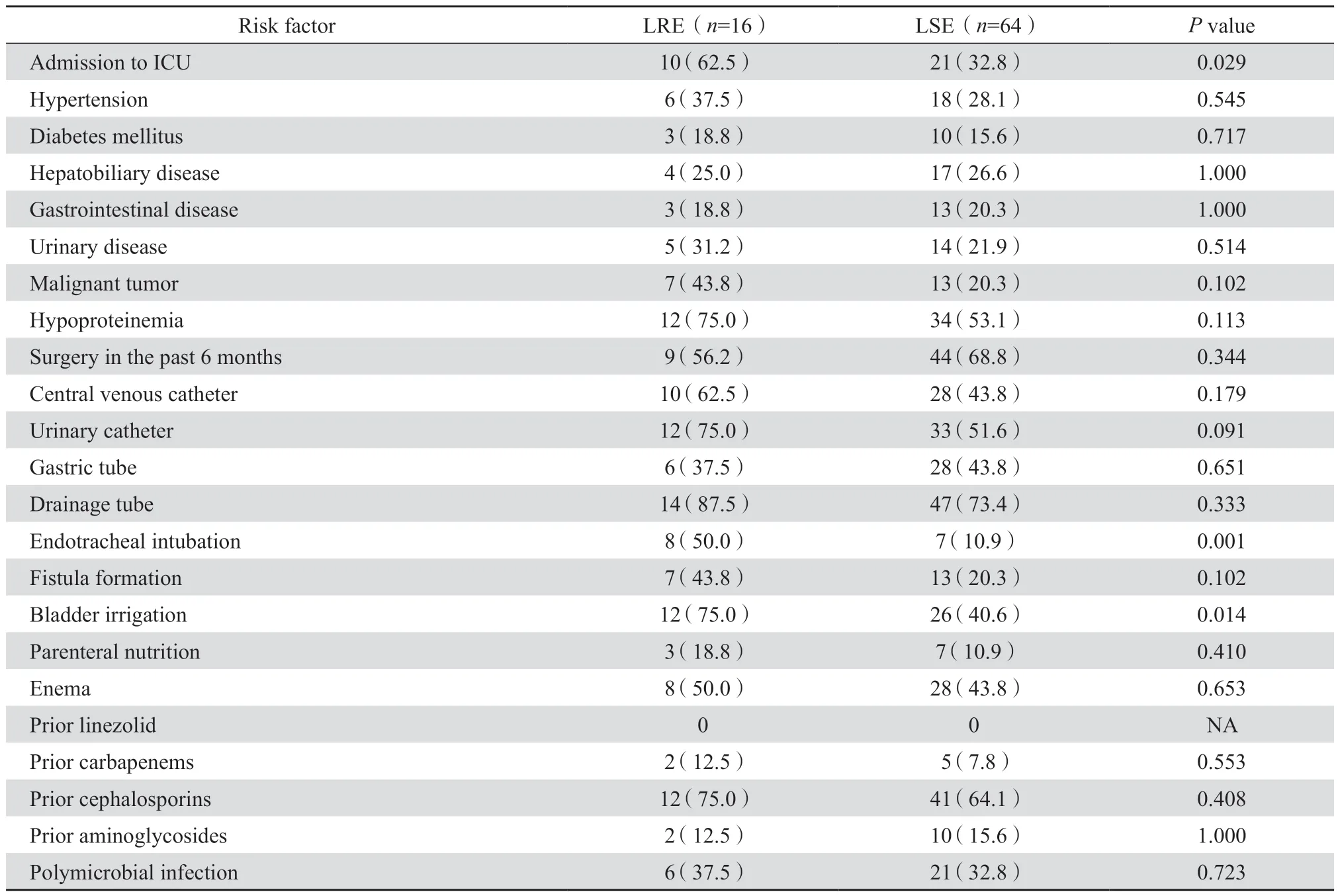
表2(续)Table 2(continued)
2.4.2 多因素分析 对单因素分析中P<0.1 的变量进行多变量logistic 回归分析发现气管插管(OR4.913,95%CI:1.119~21.571,P=0.035)是HALRE 感染的独立危险因素。logistic 回归模型的Hosmer Lemeshow 检验表明数据拟合良好(χ2=8.595,df=7,P=0.283)。
2.5 CA-LRE 感染危险因素分析
2.5.1 单因素分析 单因素分析结果显示,低蛋白血症、复数菌感染是CA-LRE 感染主要的危险因素(P均<0.05)。见表3。
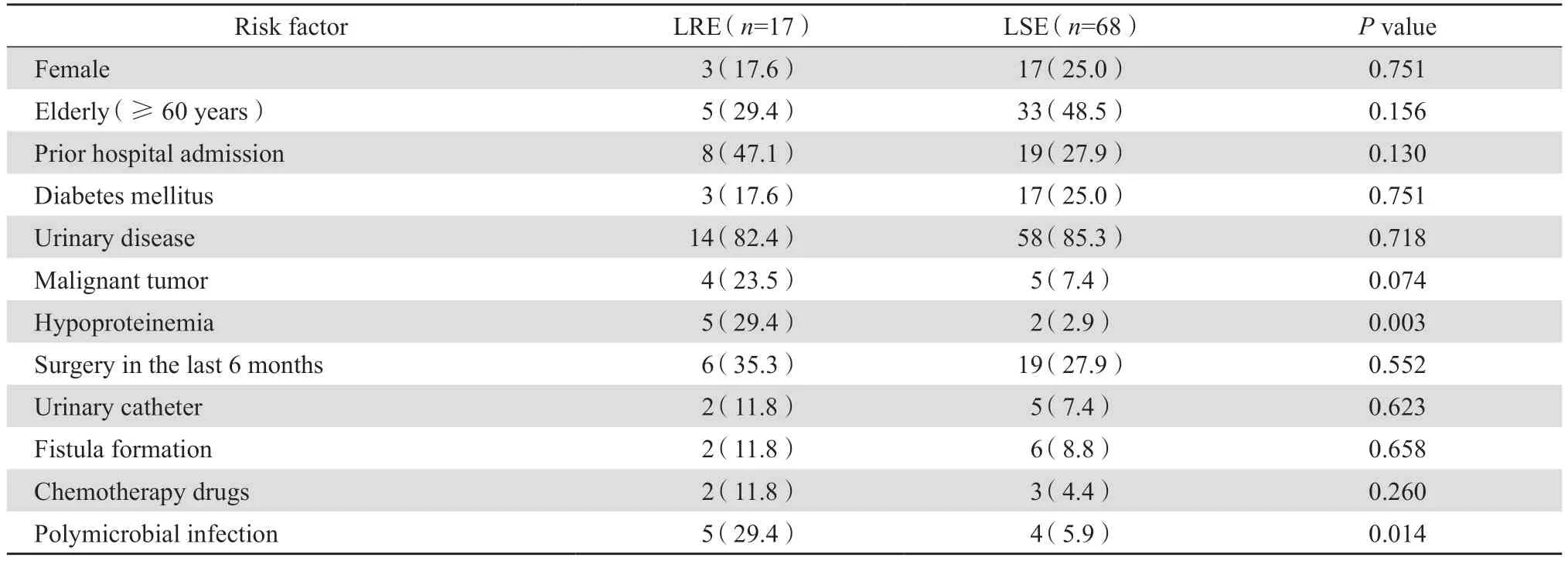
表3 社区获得性利奈唑胺耐药肠球菌感染危险因素的单因素分析Table 3 Univariate analysis of risk factors for community-acquired LRE infection
2.5.2 多因素分析 对单因素分析中P<0.1 的变量进行多变量logistic 回归分析发现低蛋白血症(OR10.166,95%CI:1.378~74.972,P=0.023)、复数菌感染(OR5.773,95%CI:1.198~27.828,P=0.029)是CA-LRE 感染的独立危险因素。logistic 回归模型的Hosmer Lemeshow 检验表明数据拟合良好(χ2=0.39,df=1,P=0.532)。
3 讨论
利奈唑胺是治疗由多重耐药革兰阳性细菌包括耐甲氧西林金黄色葡萄球菌(MRSA)和耐万古霉素肠球菌(VRE)引起严重感染的重要药物。在中国,2007 年将利奈唑胺引入临床实践后不久就出现了耐利奈唑胺的分离株[4]。近期研究显示,在几个监测项目中,肠球菌分离株对利奈唑胺耐药率较低(<2%)[5]。但是,一旦出现高耐药率,临床治疗就会出现问题,因此应该引起足够关注。本研究中,CA-LRE 感染占57.9%,表明社区感染不可忽视。我院分离的LRE 菌株主要来自泌尿外科,标本类型主要为中段尿,可能原因为泌尿系统疾病(肾结石、输尿管狭窄、前列腺增生、肿瘤等)引起排尿不畅,尿液潴留,增加了耐药菌繁殖,以及泌尿道相关侵袭性操作,导致防御功能减弱,增加了耐药菌感染的机会[6]。
本研究的38 株LRE 菌株对利奈唑胺呈低水平耐药性,MIC 值为8~16 mg/L。LREfs 对克林霉素、奎奴普丁-达福普汀均耐药,对红霉素、四环素耐药率为90%以上,与姚丹等[7]的研究相一致;与全国耐药监测数据相比[8],我院LREfs 菌株对左氧氟沙星和庆大霉素的耐药率明显增高,可能与这些抗菌药物普遍使用有关;其中有3 株对万古霉素耐药,对替加环素都敏感。LREfm 对环丙沙星、红霉素、克林霉素、左氧氟沙星、莫西沙星、米诺环素、四环素均有高的耐药率,LREfm 整体耐药水平高于LREfs。耐药性的差异提示临床应根据细菌种类、耐药率的变化合理选择治疗方案。
目前已明确的肠球菌对利奈唑胺耐药机制主要有5 种,包括23S rRNA V 区突变,L3、L4 核糖体蛋白突变,携带poxtA基因,多重耐药基因cfr介导的耐药以及近年来研究逐渐增多的optrA基因[9]。各国对肠球菌利奈唑胺耐药机制的报道越来越多,但主要耐药机制不同。在本研究中,可转移耐药基因optrA是对利奈唑胺耐药的主要机制,携带optrA基因菌株的高发率与韩国的先前研究相似[10]。爱尔兰研究表明[11],poxtA基因有较高流行。美国多中心研究发现利奈唑胺的主要耐药机制是23S rRNA 中的G2576T 突变[12]。然而我院未发现LRE 菌株携带poxtA基因和23S rRNA突变。表明主要耐药机制存在地域差异。
HA-LRE 感染危险因素中,气管插管是独立危险因素,与Ma 等[13]研究相一致。可能原因有:①气管插管的患者住院时间长,医院环境中可能存在LRE 定植,通过医源性感染、交叉感染等途径将其传播至患者;②患者免疫功能低下,同时伴有严重的基础疾病更易获得LRE 感染;③患者同时伴有更多部位的侵袭性操作容易破坏皮肤和黏膜的屏障,损害宿主的防御系统,并把LRE 带入机体引起感染。文献报道男性、入住ICU、肠道灌洗、外院转入、肿瘤等可能是LRE 感染的危险因素,不同的研究结果之间存在差异。本研究除气管插管外未发现其他危险因素,可能原因是样本量少。一些研究表明肠球菌对利奈唑胺耐药性与利奈唑胺长期暴露有关[14],但是也有从未接触过利奈唑胺的患者体内分离出利奈唑胺耐药肠球菌[15]。我院HA-LRE 感染患者住院期间均无利奈唑胺用药史,可能的解释是先前的暴露或者院外曾经使用但病史未记录等。
在CA-LRE 感染危险因素中,复数菌感染、低蛋白血症是独立危险因素。值得注意的是,肠球菌和大肠埃希菌的缀合实验确定了革兰阳性菌和革兰阴性菌之间利奈唑胺耐药基因的可转移性[16]。本研究发现复数菌感染是独立危险因素,可能原因是在肠球菌分离物中检测到的optrA基因可能是从临床中的其他细菌(如大肠埃希菌)转移而来的。通常低蛋白血症患者免疫功能降低,容易受到外来细菌的侵袭,耐药细菌间的水平传播也更易在该环境下进行。CA-LRE 耐药机制检测以optrA基因(78.9%)为主。有文献报道,optrA基因在动物来源肠球菌中检出率可能更高,动物源的肠球菌可能作为耐药基因的贮存库,成为社区内肠球菌optrA基因的潜在来源[17]。有研究表明,肠球菌对利奈唑胺耐药很可能通过耐药基因的克隆扩增或水平转移在社区环境中传播,然而社区环境中大多数病例与医疗相关,因此主要以医疗保健相关的方式传播[18]。CA-LRE 感染的增加需要考虑动物-环境-人的传播途径,动物和食物可能成为潜在的危险因素,需要加强食品安全管理。
综上所述,本研究发现HA-LRE 和CA-LRE感染的危险因素有所不同,因此医务人员应该意识到有这些危险因素的患者中存在LRE 感染的可能,并采取适当抗感染措施。在社区环境中optrA基因介导的LRE 的出现令人震惊,应该引起高度重视。
本研究存在一些局限性。首先,研究的LRE分离株的数量相对较少;其次,这是一项单中心研究。需要进一步的多中心研究来确认LRE 感染危险因素及其主要耐药机制。
