计算机模拟酶解制备驴乳清蛋白抗氧化肽的研究
2022-02-20邓龙雪刘建忠吴晓彤
梁 星,邓龙雪,张 宇,刘建忠,吴晓彤*
1内蒙古大学生命科学学院;2内蒙古蒙驴食品有限公司,呼和浩特 010070
驴乳,被誉为“最佳的人乳替代品”,脂肪含量低,不饱和脂肪酸、维生素及乳糖含量高,具有较强的保健功能和治疗人体免疫相关疾病等作用[1]。作为乳清蛋白性乳类,驴乳清蛋白中含有较高含量的α-乳白蛋白、β-乳球蛋白和溶菌酶。α-乳白蛋白可以有效抑制有害细菌,有利于婴幼儿的生长发育;β-乳球蛋白在消化过程中则可以和营养成分特异性结合[2],起到保护营养成分的作用;而含量较高的溶菌酶使驴乳具有较强的抗菌功能[3]。此外,驴乳清蛋白中还含有免疫球蛋白、血清白蛋白以及表皮生长因子等多种微量成分,对机体的抗病机制有着重要的影响。因而,驴乳的开发利用有着巨大的社会价值和市场前景。但目前国内驴乳产品单一,驴乳清蛋白的利用率更是被大为限制,其经济效益未能得到最大释放。利用蛋白酶酶解驴乳清蛋白制备生物活性肽有助于进一步研究驴乳产品的综合价值。
生物活性肽是指有利于生命机体活动和健康,能够优化机体代谢环境的小肽类物质[4],具有抗菌、抗氧化、免疫调节及降血压等多种生物活性功能[5-8]。其中,抗氧化活性肽可以通过提供质子、金属离子螯合物和抑制脂质过氧化等作用来清除体内多余的自由基[9]。同时,肽链中疏水性氨基酸和芳香族氨基酸所占比例与多肽抗氧化活性呈正相关关系,比例愈高,抗氧化活性愈强,愈有益于机体的氧化防御[10]。目前动物乳蛋白是国内外研究抗氧化活性肽的热点,但以牛乳蛋白为原材料居多,而针对驴乳蛋白抗氧化活性肽的研究却并不多见。
国外已有研究证实驴乳的总抗氧化能力高于人乳[11],表明驴乳经酶解后释放的肽具有一定的抗氧化能力,驴乳是提取抗氧化肽的优质原材料,然而国内对驴乳源抗氧化肽的研究较少,寻找一种可行的制备驴乳清蛋白抗氧化肽的工艺技术路线,对抗氧化肽应用于医学、食品、保健等领域具有重大的意义,也可以发挥出驴乳的开发意义及市场经济效益。所以本实验通过计算机模拟酶解筛选出最适蛋白酶后对驴乳清蛋白进行酶解,为开发抗氧化活性肽功能产品提供理论依据。
1 材料与方法
1.1 实验材料
驴乳清粉(陕西金润生物科技有限公司,批号为JRSW200513-1);1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH自由基,上海源叶生物科技有限公司);α-胰凝乳蛋白酶(1 500 U/mg,上海源叶生物科技有限公司);酪氨酸(纯度≥99%,上海吉至生化科技有限公司);福林酚试剂(1 mol/L,北京谱析公司);Na2CO3(分析纯,欣之然电线电缆专营店);氢氧化钠(分析纯,武汉吉业升化工有限公司);蛋白marker(北京赛默飞科技有限公司);无水乙醇(东光县东恒化工有限公司);盐酸(纯度≥31%,石家庄市艳起发化工有限公司);考马斯亮蓝染色液(上海源叶生物科技有限公司)。
1.2 实验仪器
JC-DN-04C型凯氏定氮仪(青岛聚创环保集团有限公司);LDZX-75KBS型高压灭菌锅(浙江简然仪器设备有限公司);BZF-500型真空干燥箱(青岛明博环保科技有限公司);DL-CJ-2N型超净工作台(河南信陵仪器设备有限公司);FD-1型真空冷冻干燥机(上海旦鼎国际贸易有限公司);BSA224S-CW型电子天平(济南欧威腾生物科技有限公司);HY-5A型涡旋振荡器(常州金坛良友仪器有限公司);DK-8D型水浴锅(常州金坛良友仪器有限公司);PHS-3C型雷磁pH计(上海仪电科学股份有限公司);SK7210HP型超声波清洗仪(上海沪粤明科学仪器有限公司);MULTISKANGO型全光谱酶标仪(济南欧莱博科学仪器有限公司);AI-F2130C型电泳槽(爱来宝生物技术有限公司);ChampGel 5000型凝胶成像仪(森西赛智科技有限公司);UV-2100型紫外可见分光光度计(济南千司生物技术有限公司);5804R型高速冷冻离心机(北京康高特仪器设备有限公司);JY-JX5L型聚丙烯酰胺凝胶电泳仪(赛默飞世尔科技有限公司);BS-2E型双层恒温摇床(常州金坛良友仪器有限公司)等。
1.3 实验方法与数据处理
1.3.1 驴乳清蛋白含量测定
驴乳清粉中乳清蛋白的含量依据国标GB 5009.5-2016凯氏定氮法[12]测定。
1.3.2 驴乳清蛋白氨基酸序列分析
经在UNIPROT、NCBI等蛋白质数据库中检索,可得驴乳清蛋白中含量较高的α-乳白蛋白、β-乳球蛋白、溶菌酶氨基酸序列如表1所示。

表1 氨基酸序列
将上述已知的蛋白质序列作为模板,利用BIOPEP数据库中内置软件对乳清蛋白进行模拟水解,选取的蛋白酶为数据库中存在的胰蛋白酶、胃蛋白酶、木瓜蛋白酶、α-胰凝乳蛋白酶,比较内置软件计算的各蛋白酶水解度并整理出各蛋白酶酶解产生的生物活性肽,筛选出能够产生抗氧化活性肽的蛋白水解酶。
1.3.3 蛋白酶活力的测定
依据国标GB/T 23527-2009福林-酚方法[13]测定。
分别配制0、10、20、30、40、50 μg/mL的酪氨酸标准溶液,预热5 min后,各取1 mL酪氨酸标准溶液加入到混有1 mL福林酚试剂和5 mL的Na2CO3溶液(42.4 g/L)中,经涡旋振荡后,在40±0.2 ℃水浴锅中静置20 min,取出后用紫外分光光度计测定680 nm处的吸光值,并以酪氨酸浓度为横坐标,以吸光度为纵坐标,绘制标准曲线。
称取少量蛋白酶,用相应缓冲液溶解并稀释至一定浓度,酪蛋白溶液在40±0.2 ℃恒温预热5 min,空白管中加入1 mL酶液,40±0.2 ℃恒温预热2 min后,加入2 mL三氯乙酸,40±0.2 ℃恒温预热10 min后,加入1 mL酪蛋白溶液摇匀,取出静置10 min,过滤,取1 mL滤液加入到混有1 mL福林酚试剂和5 mL的Na2CO3溶液(42.4 g/L)中,在40±0.2 ℃水浴锅中显色20 min,取出后用紫外分光光度计测定680 nm处的吸光值(试样管需做三个平行试样),将测定的吸光值代入标准曲线中按下式计算出相应的蛋白酶活:
式中:X3为样品的酶活力(U/g);A1为由标准曲线得出的样品最终稀释液的活力(U/mL);V1为溶解样品所使用的容量瓶的体积(mL);4代表反应试剂的总体积(mL);n1为样品的稀释倍数;m4为样品的质量(g);1/10为反应时间10 min,以1 min计,所得结果表示至整数。
1.3.4 DPPH自由基清除率的测定
称取19.7 mg的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH自由基)溶于乙醇,于避光条件下定容至250 mL棕色容量瓶中,配制成浓度为0.2 mmol/L的DPPH无水乙醇溶液。分别取相同体积的酶解肽与DPPH无水乙醇溶液相混合,震荡均匀,室温避光静置30 min,然后设置高速冷冻离心机参数为4 ℃,4 200 rpm,离心混合溶液10 min,将酶标仪事先预热15 min,取离心后的溶液上清液200 μL加入到96孔板中,用酶标仪检测样品在517 nm处的吸光值Ai,以等体积无水乙醇溶液替代DPPH无水乙醇溶液作为空白组,以等体积蒸馏水替代酶解肽样品作为对照组,用下式计算DPPH自由基清除率[14]:
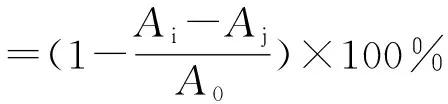
式中:A0为对照组(蒸馏水+DPPH无水乙醇溶液)的吸光值;Ai为样品组(酶解肽+DPPH无水乙醇溶液)的吸光值;Aj为空白组(酶解肽+无水乙醇)的吸光值。
1.3.5 乳清蛋白酶解工艺流程
将驴乳源乳清蛋白配置成4%质量浓度的溶液,85 ℃水浴加热10 min,待溶液冷却后调节溶液pH值至8,立即加入已配制好的α-胰凝乳蛋白酶溶液,经玻璃棒搅拌后放入已达到设定温度的水浴锅内静置,每间隔30 min测定溶液pH值,并以1 mol/L的氢氧化钠溶液维持pH值,水解至预定时间后,立即95 ℃水浴灭酶10 min,然后将溶液迅速冷却至室温,添加1 mol/L的盐酸溶液或1 mol/L的氢氧化钠溶液调pH至中性,高速冷冻离心机以4 200 rpm,4 ℃离心10 min,收集上清液并冷冻干燥制成酶解肽冻干粉。
1.3.6 乳清蛋白酶解工艺条件优化
1.3.6.1 单因素实验
取4%的蛋白液6 mL置于离心管中,经85 ℃水浴加热10 min后,取出冷却,选择温度、pH、酶底比三个因素,以其中一项因素改变时,其他因素不变进行单因素实验。各单因素变量分别是:温度(35、40、45、50、55 ℃)、pH(7、7.5、8、8.5、9)、酶底比(2%、3%、4%、5%、6%)。
加入α-胰凝乳蛋白酶搅拌均匀,将离心管放入水浴锅中,每隔30 min测定反应液pH值,以1 mol/L的氢氧化钠溶液维持pH值在设定值±0.05之间,水解4 h后,立即95 ℃灭酶10 min,迅速冷却至室温,调节溶液pH至中性,4 200 rpm,4 ℃离心10 min,取上清液冷冻干燥得到酶解肽冻干粉,测定其DPPH自由基清除率。每组重复3次。
1.3.6.2 响应面实验
根据单因素实验结果,以pH、酶解温度、酶底比为自变量,DPPH自由基清除率为响应值,设计响应面实验(见表2)。利用Design Expert 8.0.6软件进行Box-Behnken实验设计和数据处理。

表2 响应面实验因素水平表
1.3.7 SDS-PAGE电泳分析
取一定量的乳清蛋白和酶解肽冻干粉,分别配制成7 mg/mL的溶液,以4∶1的比例加入5×蛋白上样缓冲液中,沸水煮5~10 min后离心,收集上清液采用SDS-PAGE凝胶电泳法进行分离,设置电压200 V,电泳时间45 min,考马斯亮蓝染色液染色,脱色后将染好的胶片置于凝胶成像系统拍摄,分析结果。
2 结果
2.1 蛋白质含量测定结果
利用凯氏定氮法测得本实验使用的驴乳清蛋白含量为66.4%,且查询数据库可知驴乳清蛋白氨基酸序列中疏水性氨基酸较多,说明驴乳清蛋白适合用来制备抗氧化活性肽。
2.2 蛋白酶的筛选结果
为获得高抗氧化活性的生物活性肽,利用UniProtdatabase(http://www.uniprot.org/)、NCBI等数据库获得原料蛋白质一级结构,查询含量较高的蛋白氨基酸序列,并以其作为生物信息模板,由BIOPEP(http://www.uwm.edu.pl/biochemia/index.php/en/biopep)数据库中内置软件进行模拟水解后,得到的各酶的水解度如表3所示。
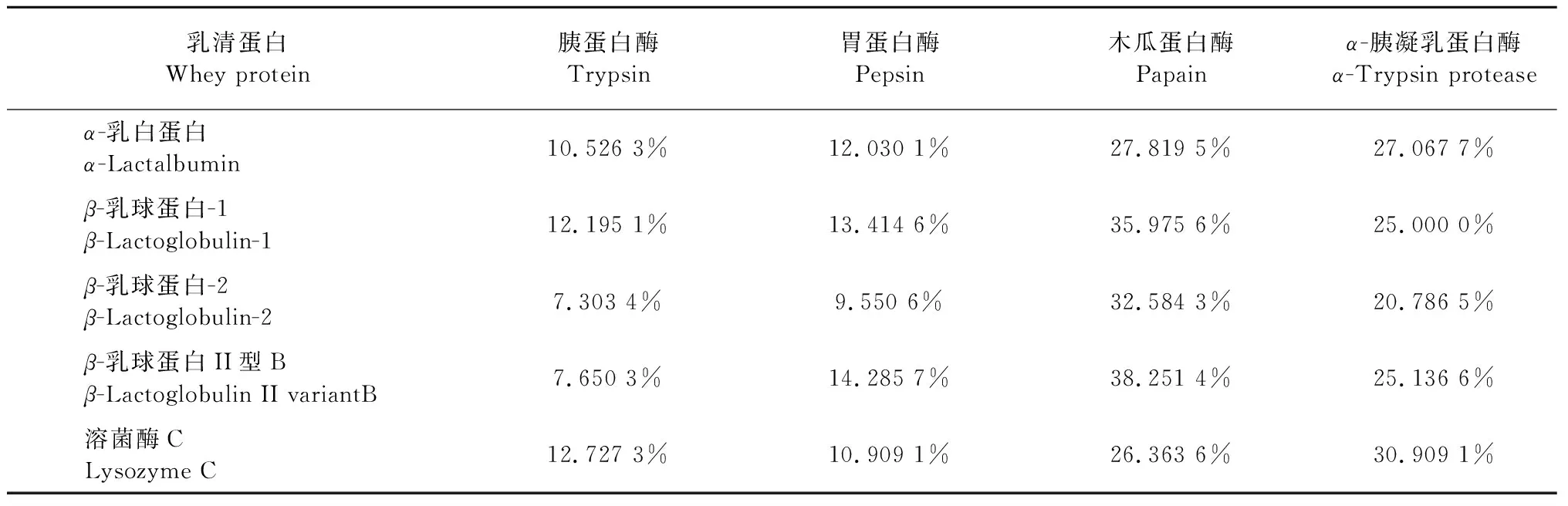
表3 各蛋白酶水解度的比较
将BIOPEP数据库水解得到的多肽整理分类,与数据库中的抗氧化肽进行对比,计算机模拟水解预测具有抗氧化活性的肽段如表4所示,胃蛋白酶水解程度较低且预测结果为不具有抗氧化活性,木瓜蛋白酶水解度虽然高,但是预测其也不具有抗氧化活性,且木瓜蛋白酶虽然属于内切肽酶,但其对含巯基(—SH)肽链特异性较强,因此呈现出较差的酶解效果[15],而胰蛋白酶和α-胰凝乳蛋白酶的酶解多肽均具有抗氧化活性,且α-胰凝乳蛋白酶比胰蛋白酶得到的抗氧化活性酶解肽段多,因此综合上述水解度的考量,本实验筛选出可以产生抗氧化活性肽段的α-胰凝乳蛋白酶对驴乳清蛋白进行酶解。
2.3 蛋白酶活力的测定
由图1可知,L-酪氨酸标准曲线为y=0.009 5x-0.008 2,R2=0.998 9。实测α-胰凝乳蛋白酶的吸光值为0.405 A,进一步代入公式计算出α-胰凝乳蛋白酶酶活为1 740 U/mg,与商品标签(1 500 U/mg)上酶活数量级一致,结果可靠。
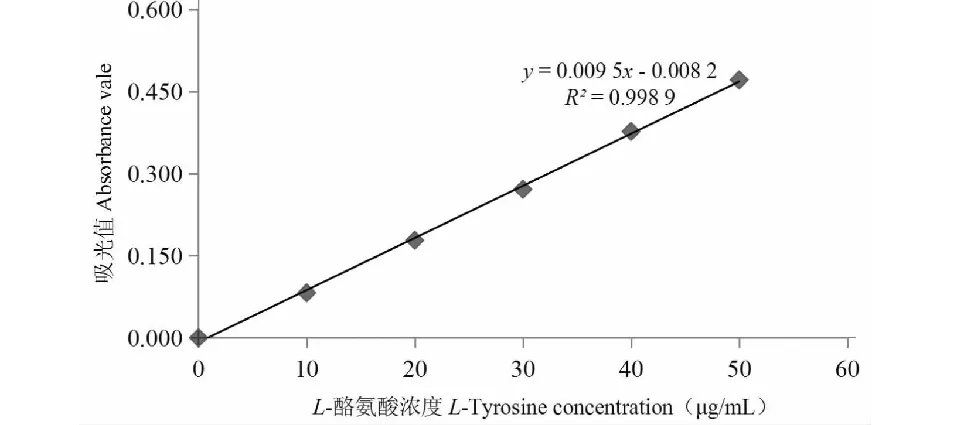
图1 L-酪氨酸标准曲线Fig.1 L-Tyrosine standard curve
2.4 驴乳清蛋白酶解工艺的单因素结果分析
2.4.1 温度对乳清蛋白酶解效果的影响

表4 驴乳清蛋白肽序列与功能预测
图2为底物浓度4%,酶底比4%,时间4 h,pH 8时不同温度对驴乳清蛋白酶解肽DPPH自由基清除率的影响。由图可知,酶解肽的DPPH自由基清除率随着温度的升高呈现出先升高后下降的趋势,当40 ℃时达到最大值为46.19%。低于最适温度时,DPPH自由基清除率随温度增加而增加,这可能是因为温度的升高提高了酶的活力,从而促进了反应的进行[16]。当温度继续升高,高于最适温度时,由于酶蛋白变性,进而使得DPPH自由基清除率逐渐下降,因此选取40 ℃作为最适酶解温度。

图2 温度对驴乳清蛋白酶解肽DPPH自由基清除率的影响Fig.2 Effect of temperature on DPPH radical scavenging rate of donkey whey peptides hydrolyzed by protease
2.4.2 pH对乳清蛋白酶解效果的影响
pH是酶解反应的重要影响因素之一,通过改变pH可以影响蛋白酶活性中心的空间构象和一些基团的解离程度,进而影响酶解的进行。当只有达到最适pH时,酶的催化效力才会达到最高[17]。由图3可知,随着pH的增大,驴乳清蛋白DPPH自由基清除率呈现先上升后下降的趋势,当pH 8时DPPH自由基清除率达到最大值为45.33%。低于最适pH时,DPPH自由基清除率随pH增加而增加,高于最适pH时,DPPH自由基清除率随pH增加而下降,这是由于pH会影响酶和底物可解离基团的带电情况,从而影响酶与底物的相互作用,因此选取PH 8作为最适酶解pH。

图3 pH对驴乳清蛋白酶解肽DPPH自由基清除率的影响Fig.3 Effect of pH on DPPH radical scavenging rate of donkey whey peptides hydrolyzed by protease
2.4.3 酶底比对乳清蛋白酶解效果的影响
由图4可知,驴乳清蛋白DPPH自由基清除率随着酶底比的升高呈现出先上升后下降的趋势,在4%时达到最大值为45.24%。低于最适酶底比时,DPPH自由基清除率随酶底比增加而增加,高于最适酶底比时,DPPH自由基清除率随酶底比增加而下降,这可能是因为随着酶解反应的进行,肽键断裂生成了越来越多的抗氧化肽段,当酶底比过高时,蛋白酶过度水解肽段,氨基酸含量增加,导致了活性的下降,因此选取4%作为最适酶底比。

图4 酶底比对驴乳清蛋白酶解肽DPPH自由基清除率的影响Fig.4 Effect of enzyme substrate ratio on DPPH radical scavenging rate of donkey whey peptides hydrolyzed by protease
2.4.4 驴乳清蛋白酶解工艺的响应面结果分析
在单因素实验结果基础上,固定蛋白底物浓度为4%,酶解时间4 h,选用温度、pH、酶底比作为自变量,以DPPH自由基清除率为指标,依据Box-Behnken设计原理设计了L9(34)响应面实验,实验设计及结果如表5所示。

表5 响应面实验设计及结果

表6 响应面方差分析
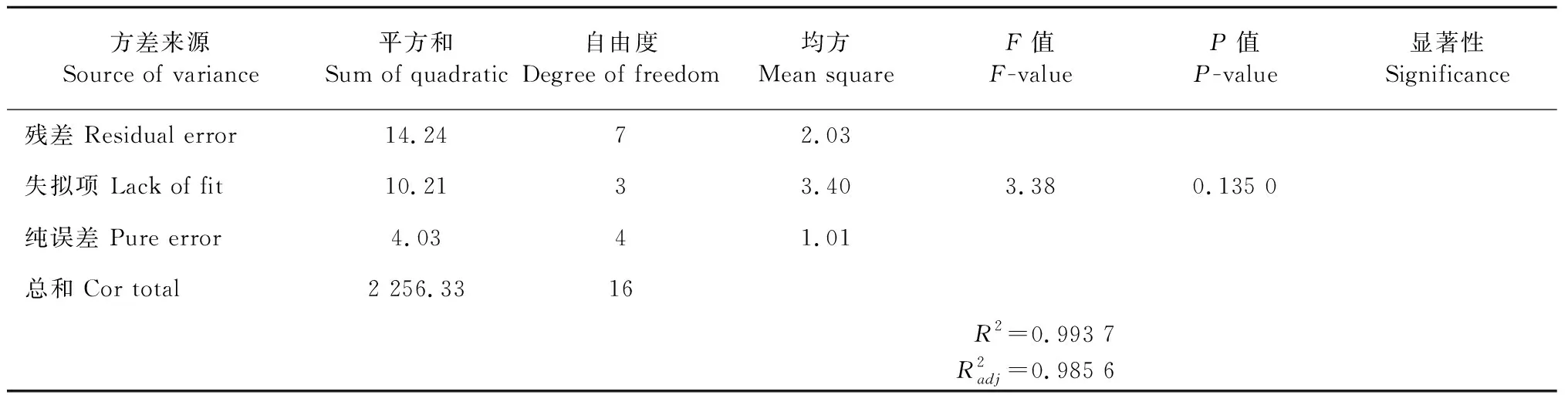
续表6(Continued Tab.6)

图5 各试验因素交互作用对DPPH自由基清除率影响Fig.5 Effect of interaction of various experimental factors on DPPH radical scavenging rate
由表3得到回归模型方程:Y=45.45-1.90A+5.73B-1.66C-0.3875AB+3.21AC-2.86BC-8.19A2-15.61B2-9.37C2

2.4.5 响应面实验因素交互作用分析
实验三因素对DPPH自由基清除率的交互作用如图5所示,得到三因素间均具有一定的交互作用,DPPH自由基清除率随着温度、pH和酶底比的增加而先增加后减小,温度和酶底比的交互作用及pH与酶底比的交互作用达到极显著。
2.4.6 最佳酶解条件的确定及验证
当固定底物浓度4%,酶解时间4 h时,分别研究酶解温度,酶解pH及酶底比对驴乳清蛋白酶解肽抗氧化活性的影响。在单因素实验的基础上,利用响应面优化酶解工艺条件,得到最佳工艺条件为温度39.2 ℃,pH 8.1,酶底比4%,此时驴乳清蛋白酶解肽的DPPH自由基清除率可达46.28%。为方便实际应用,调整pH为8,温度为39 ℃,进行验证实验,此时测量值为46.23%,与理论预测值相接近,说明通过响应面法得到的最佳酶解工艺条件可靠。
2.5 聚丙烯酰胺凝胶电泳测定蛋白质酶解程度
α-乳白蛋白是乳清蛋白中唯一能结合钙离子的蛋白,且4个天冬氨酸残基均能结合钙离子,其独特的氨基酸序列和三维结构赋予α-乳白蛋白突出的功能特性和生物学活性,在其消化过程中,会生成各种生物活性肽,有抗氧化、抗菌等作用[18];β-乳球蛋白属于一种脂质转运蛋白,具有多个结合位点,包括β-乳球蛋白分子内部的疏水内腔和表面的疏水裂缝,因此对脂溶性维生素、脂肪酸及多酚类生物活性物质都具有极高的亲和性,能够防止这些生物活性物质的氧化降解,提高其在机体内的转运效率,并促进这些物质的吸收[19]。
驴乳清蛋白中α-乳白蛋白和β-乳球蛋白含量均占较大组成部分,且分子量相似,α-乳白蛋白分子量大致为14.2 kDa[20],β-乳球蛋白分子量大致为18.36 kDa[2]。由图6可知,驴乳清蛋白在14.0、18.0 kDa分子量处均有较为清晰的条带,说明驴乳清蛋白中的确富含α-乳白蛋白和β-乳球蛋白,且经4 h的α-胰凝乳蛋白酶酶解后,驴乳清蛋白已充分酶解完全。

图6 驴乳清蛋白及酶解结果Fig.6 Donkey whey protein and enzymatic hydrolysis results
3 结论
利用UniProt database数据库获得原料蛋白质中含量较高蛋白的氨基酸序列,并作为生物信息模板,采用BIOPEP数据库中内置软件进行模拟酶解驴乳清蛋白手段,筛选出可以产生抗氧化活性肽段的α-胰凝乳蛋白酶,采用Design-Expert V8.0.6设计响应面试验,确定驴乳清蛋白制备抗氧化肽的最佳工艺条件为:底物浓度4%,酶解时间4 h,温度39 ℃,pH 8,酶底比4%。该条件下得到的酶解肽的DPPH自由基清除率最大值为46.23%。
