基于膜解剖的腹腔镜脾门淋巴结环周清扫术与前方清扫术的对比研究
2022-02-20李俊鹏许燕常
李俊鹏,许燕常
(1.福建医科大学第三临床学院,福建 福州,350108;2.福建医科大学莆田市第一医院教学医院胃肠外科一区)
全球范围内,胃癌在恶性肿瘤中发病率(5.7%)居第五位、死亡率(8.2%)居第三位[1]。我国胃癌发病与死亡人数分别占全球的42.6%与45.0%[2],90%的患者就诊时已属进展期[3]。D2根治术作为可治愈进展期胃上部癌的标准术式,第5版《日本胃癌治疗指南》前[4-5]均将脾门淋巴结纳入清扫范围,然而第5版《日本胃癌治疗指南》[6]对于非大弯侧进展期胃上部癌,依据JCOG0110试验结果[7]将脾门淋巴结清扫剔除D2根治术范畴,对于大弯侧进展期胃上部癌推荐联合脾切除以彻底清扫脾门淋巴结。第6版《日本胃癌治疗指南》[8]的意见与之相同。值得注意的是:(1)①JCOG0110试验旨在研究非大弯侧进展期胃上部癌全胃切除时预防性脾切除的意义,结论认为应避免脾切除,该试验并未研究是否需行脾门淋巴结清扫,更未研究是否需行保脾的脾门淋巴结清扫;②入组病例中Ⅰ期占40.00%(202/505)、Ⅱ期及以上占60.00%(303/505),T3、T4期仅占26.73%(135/505),保脾组仅筛选23%(58/251)体型较瘦的患者施行脾门淋巴结清扫,脾门淋巴结转移率仅3.40%(2/58),无法真实反应非大弯侧进展期胃上部癌患者的脾门淋巴结转移情况与规律;③两组脾门淋巴结转移率明显低于未限定脾门淋巴结转移高危病例的JCOG9501试验[9]报道的8.4%;④虽然我国胃癌手术长期以来普遍按照《日本胃癌治疗指南》的要求进行,但鉴于我国进展期胃癌患者高达90%,绝大部分为T3与T4期,肿瘤较大,因此进展期胃上部癌施行D2根治术时清扫脾门淋巴结仍然十分必要。(2)对于大弯侧进展期胃上部癌患者,由于联合脾切除术创伤大、术后并发症多、影响患者免疫功能,保脾的脾门淋巴结清扫术受到越来越多学者的认可[10]。由于脾门周边结构复杂、解剖层面不清、手术难度大,易发生脾门出血及损伤,不管开腹手术抑或腔镜手术,原位保脾的脾门淋巴结清扫一直局限于脾叶血管前侧方淋巴结,脾叶血管后方淋巴结的清扫一直缺乏有效手段,很少施行,相关报道甚少,可能存在脾门淋巴结清扫范围及程度不足,达不到肿瘤根治的要求。随着以胚胎发育、局部解剖为基础的全直肠系膜切除术(total mesorectal excision,TME)[11]、完整结肠系膜切除术(complete mesocolic excision,CME)[12]的开展,人们以胚胎学基础、以筋膜层面为导向,开始了全/完整胃系膜切除术的研究,进而发展提出胃癌膜解剖手术。我中心积极探索实施基于膜解剖的腹腔镜胃癌D2根治术,发现沿脾门区域胃系膜存在的疏松血管的筋膜间隙解剖分离,能安全高效地完成脾叶血管前侧方及后方淋巴结的环周清扫,实现肿瘤根治的整块切除及无瘤原则。现将2016年12月至2019年12月我中心实施的基于膜解剖的腹腔镜原位保脾脾门淋巴结环周清扫术与前方清扫术进行对比分析,探讨基于膜解剖的腹腔镜原位保脾脾门淋巴结环周清扫术的安全性、可行性及近期疗效,为其推广应用提供临床经验。
1 资料与方法
1.1 临床资料 回顾分析2016年12月至2019年12月福建省莆田市第一医院胃肠外科一区为105例局部进展期胃上部癌患者施行基于膜解剖的腹腔镜保脾脾门淋巴结清扫术的临床资料,按脾门淋巴结清扫方式,分为环周组(n=49,清扫脾叶血管前侧方及后方淋巴结)与前方组(n=56,仅清扫脾叶血管前侧方淋巴结)。通过查阅电子病历及回顾手术录像收集患者资料,TNM分期遵循第八版AJCC分期标准。病例纳入标准:(1)术前经胃镜及病理诊断为胃腺癌;(2)术前临床分期为局部进展期胃上部癌(cT2~4a,N-/+,M0,根据第八版AJCC TNM肿瘤分期);(3)术前检查未见远处转移,肿瘤无直接侵犯胰腺、脾脏及其他邻近器官;(4)术前未接受新辅助化疗;(5)术后病理诊断为R0切除;(6)病历资料完整,无心、肺、脑、肾等重要器官功能不全。排除标准:(1)上腹部手术史(腹腔镜胆囊切除史除外);(2)术前影像学检查提示区域融合肿大淋巴结(最大径≥3 cm),包括脾门淋巴结明显肿大或融合成团;(3)术中证实区域淋巴结融合成团无法确保R0切除或包绕重要血管不具备可切除性;(4)术中因脾脏及脾血管存在明显肿瘤浸润需行脾切除;(5)术中/术后证实为T4b或M1;(6)胃癌合并出血、穿孔、梗阻而需急诊手术;(7)姑息性手术;(8)严重营养不良及肥胖。
1.2 手术方法 两组手术均由同一位主刀500台以上腹腔镜胃癌根治术、具备丰富经验的外科医生完成。手术及清扫标准:依据第4版《日本胃癌治疗指南》,施行全胃切除、D2淋巴结(包括原位保脾脾门淋巴结)清扫术,做腹部辅助小切口行食管空肠Roux-en-Y吻合。
1.2.1 环周组 在膜解剖指导下行腹腔镜原位保脾脾门淋巴结环周清扫术。步骤一:显露胰腺后上间隙。超声刀紧贴胰腺上缘切开胃系膜在胰腺被膜的附着缘,进入胰腺前筋膜与胰腺固有筋膜形成的胰腺前间隙(图1),沿胰腺前间隙向上游离达脾动脉起始部,于脾血管前间隙(图2)跨过脾动脉表面向后方游离,达脾静脉上极或胰腺后方,进入胰腺后筋膜与胰腺固有筋膜形成的胰腺后上间隙(图3),继续向上在Toldt融合筋膜前间隙(图4)游离至左侧膈肌前筋膜,在胰腺后上间隙及脾血管前间隙内向左游离,至胰尾末端达脾上极,全程显露脾动脉干,根部离断胃后血管(图5),完整切除胰腺上缘左侧区胃系膜。见图6。步骤二:显露胰腺后下间隙。变换体位,术者立于患者两腿之间,助手及扶镜手立于患者右侧,患者取头高脚低15°~20°、右倾20°~30°位。超声刀切开胃网膜左系膜在左侧横结肠系膜的附着缘,沿两者的融合筋膜间隙(图7)向胰尾后下方游离(图8),进入胰腺后筋膜与胰腺固有筋膜形成的胰腺后下间隙,向外达脾下极,向内达胰体尾部,在胰腺后下间隙向上游离与胰腺后上间隙汇合。见图9。步骤三:显露脾门后方。外侧:由脾下极向上切开胃网膜左系膜在脾脏的附着缘,超声刀从入脾的下极脾叶血管向近端胰尾后方游离,在血管前间隙完整游离脾叶血管后方的胃网膜左系膜(图10);内侧:切开胃网膜左系膜在胰尾后方的附着缘进入胰腺后间隙,向外侧游离过渡至胃网膜左系膜与脾叶血管形成的血管前间隙,向远端游离胃网膜左系膜(图11),与外侧汇合,完成脾叶血管后方(即No.10b)淋巴结的清扫,脉络化的下极脾叶血管予以保留。见图12。步骤四:显露脾门前方。转入胰尾前方,切开胃网膜左系膜在胰尾前方的附着缘进入胰腺前间隙(图13),向外侧游离过渡至胃网膜左系膜与脾叶血管形成的血管前间隙(图14),向远端逐根裸化脾叶血管(图15),达脾上极,并游离胃短系膜,根部离断胃网膜左血管(图16)、胃短血管(图17),完成脾叶血管前侧方(即No.10a)淋巴结的清扫。见图18。至此,完成脾门淋巴结环周清扫术。
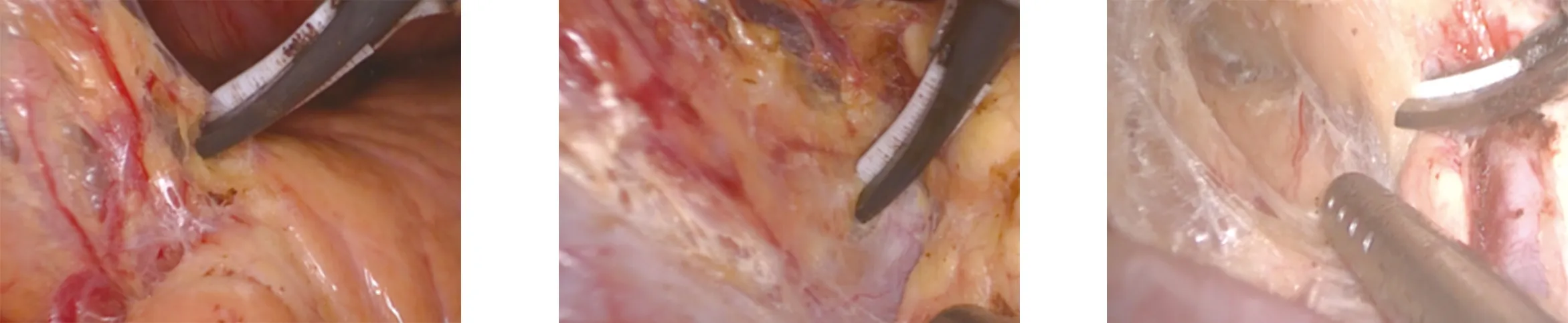
图1 切开胃系膜在胰腺被膜的附 图2 脾血管前间隙 图3 胰腺后上间隙 着缘进入胰腺前间隙
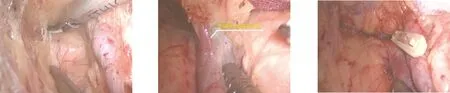
图4 Toldt融合筋膜前间隙 图5 根部离断胃短血管 图6 显露胰腺后上间隙手术效果
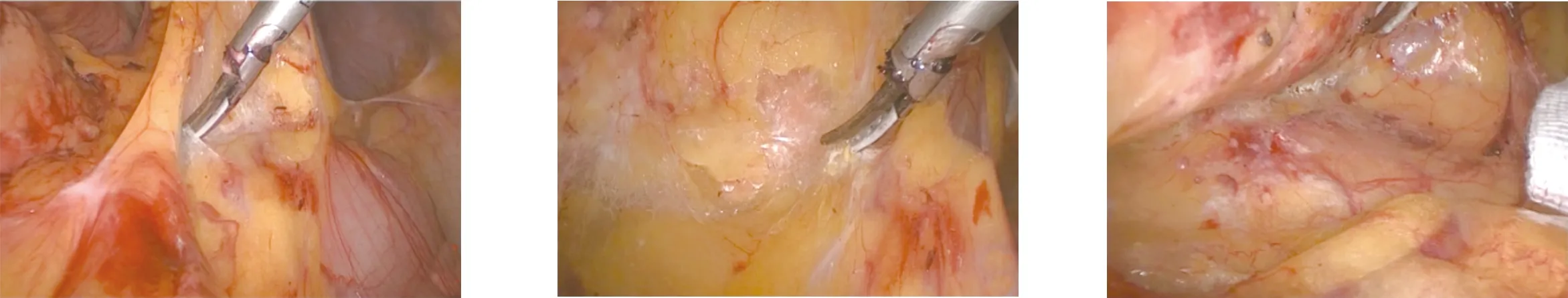
图7 切开胃网膜左系膜在左侧横 图8 向胰尾后下方游离 图9 显露胰腺后下间隙手术效果 结肠系膜的附着缘,进入两者 的融合筋膜间隙
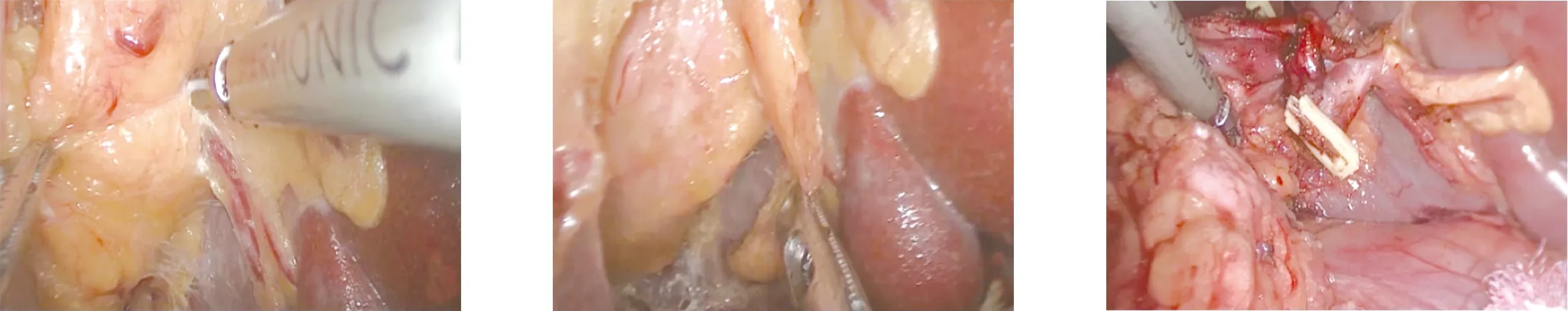
图10 在血管前间隙游离脾叶血管 图11 游离胰尾后方的胃网膜左系 图12 显露脾门后方手术效果 后方的胃网膜左系膜 膜
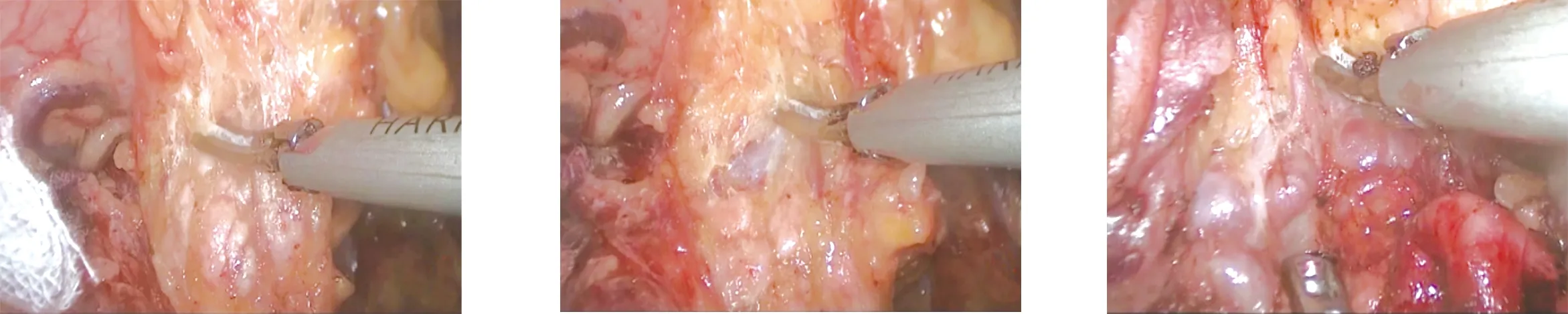
图13 切开胃网膜左系膜在胰尾 图14 向外侧游离过渡至胃网膜左 图15 向远端逐根裸化脾叶血管 前方的附着缘进入胰腺前 系膜与脾叶血管形成的血管 间隙 前间隙
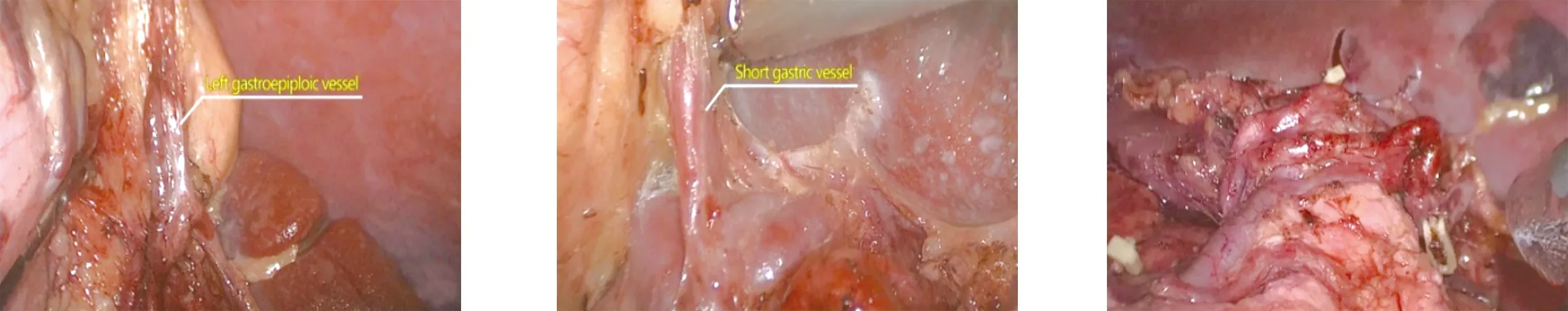
图16 根部离断胃网膜左血管 图17 根部离断胃短血管 图18 显露脾门前方手术效果
1.2.2 前方组 在膜解剖指导下行腹腔镜原位保脾脾门淋巴结前方清扫术。步骤一:显露胰腺后上间隙。手术操作同环周组步骤一。步骤二:显露脾门前方。患者体位、术者站位同环周组。超声刀切开胃网膜左系膜在左侧横结肠系膜的附着缘,沿两者的融合筋膜间隙向胰尾后下方游离,向外达脾下极,向内达胰体尾部。外侧:由脾下极向上切开胃网膜左系膜在脾脏的附着缘,超声刀从入脾的下极脾叶血管的前侧方向近端胰尾前方游离,在血管前间隙完整游离脾叶血管前侧方的胃网膜左系膜;内侧:切开胃网膜左系膜在胰尾前方的附着缘进入胰腺前间隙,向外侧游离过渡至胃网膜左系膜与脾叶血管形成的血管前间隙,向远端逐根裸化脾叶血管达脾上极,并游离胃短系膜,根部离断胃网膜左血管、胃短血管,完成脾叶血管前侧方(即No.10)淋巴结的清扫。脉络化的下极脾叶血管予以保留。至此,完成脾门淋巴结前方清扫术。
1.3 观察指标 统计两组总手术时间、术中出血量、脾门淋巴结清扫时间、首次排气时间、左腹腔引流管拔除时间、进食流质时间、术后住院时间、胃周淋巴结清扫总数、脾门淋巴结清扫总数、胃周阳性淋巴结数量、脾门阳性淋巴结数量、脾门淋巴结阳性患者数及脾门淋巴结阳性率、术中与术后并发症;分析脾门淋巴结阳性的相关因素。
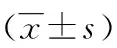
2 结 果
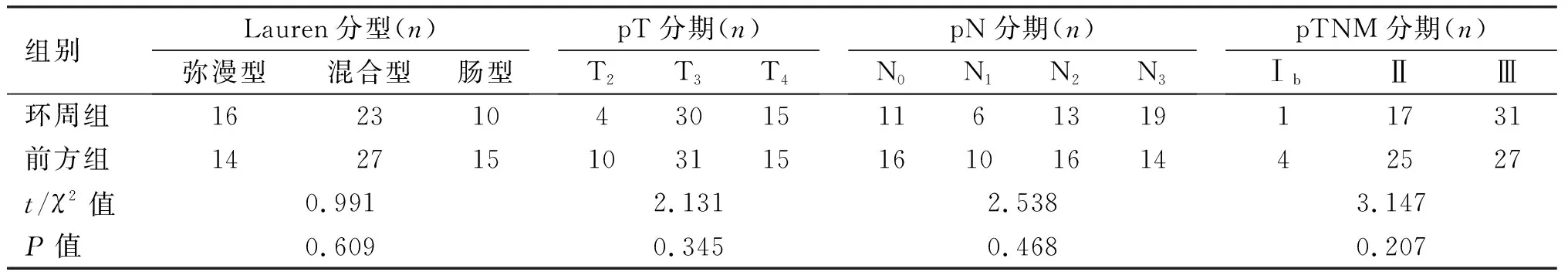
2.1 两组临床资料的比较 两组患者临床资料(性别、年龄、BMI、基础病、ASA评分、肿瘤大小、Lauren分型、pTNM分期等)具可比性,见表1。
表1 两组患者临床资料的比较
续表1
2.2 两组近期临床疗效的比较 两组总手术时间、术中出血量、首次排气时间、左腹腔引流管拔除时间、进食流质时间、术后住院时间差异无统计学意义(P>0.05);环周组脾门淋巴结清扫时间长于前方组(P<0.05),环周组胃周淋巴结清扫总数、脾门淋巴结清扫总数多于前方组(P<0.05);胃周阳性淋巴结数量、脾门阳性淋巴结数量两组差异无统计学意义(P>0.05),见表2。
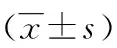
表2 两组患者近期疗效的比较

续表2
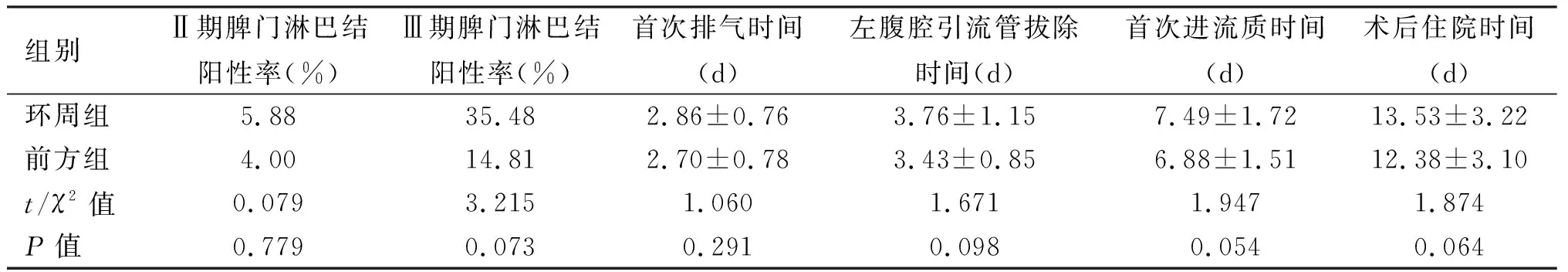
续表2
2.3 脾门淋巴结阳性相关因素分析及脾门淋巴结阳性率的比较 105例患者中脾门淋巴结阳性率为16.19%(17/105),χ2检验显示,肿瘤大小、第2站淋巴结阳性、pTNM分期与脾门淋巴结阳性有关(P<0.05)。其中肿瘤<4 cm的患者脾门淋巴结阳性率为7.14%(3/42),≥4 cm为22.22%(14/63);第2站淋巴结阴性患者脾门淋巴结阳性率为6.78%(4/59)、阳性患者为28.26%(13/46);T2患者脾门淋巴结阳性率为7.14%(1/14),T3、T4期为17.58%(16/91);Ⅱ期患者脾门淋巴结阳性率为4.76%(2/42),Ⅲ期为25.86%(15/58),见表3、图19。环周组中脾门淋巴结阳性12例(24.49%),其中T3、T4期患者为26.67%(12/45),Ⅱ期患者为5.88%(1/17)、Ⅲ期患者为35.48%(11/31)。前方组脾门淋巴结阳性5例(8.93%),其中T3、T4期患者为8.70%(4/46),Ⅱ期患者为4.00%(1/25)、Ⅲ期患者为14.81%(4/27)。环周组脾门淋巴结阳性例数多于前方组(12 vs. 5,P=0.031),见表2。环周组中脾门前方淋巴结阳性12例,其中3例同时伴有脾门后方淋巴结阳性,3例均为T4期、Ⅲ期患者,即脾门前方淋巴结阳性患者中25.00%(3/12)存在脾门后方淋巴结阳性,脾门后方淋巴结阳性率为6.12%(3/49);T4期患者脾门后方淋巴结阳性率为20.00%(3/15),Ⅲ期患者为9.68%(3/31),见表2。
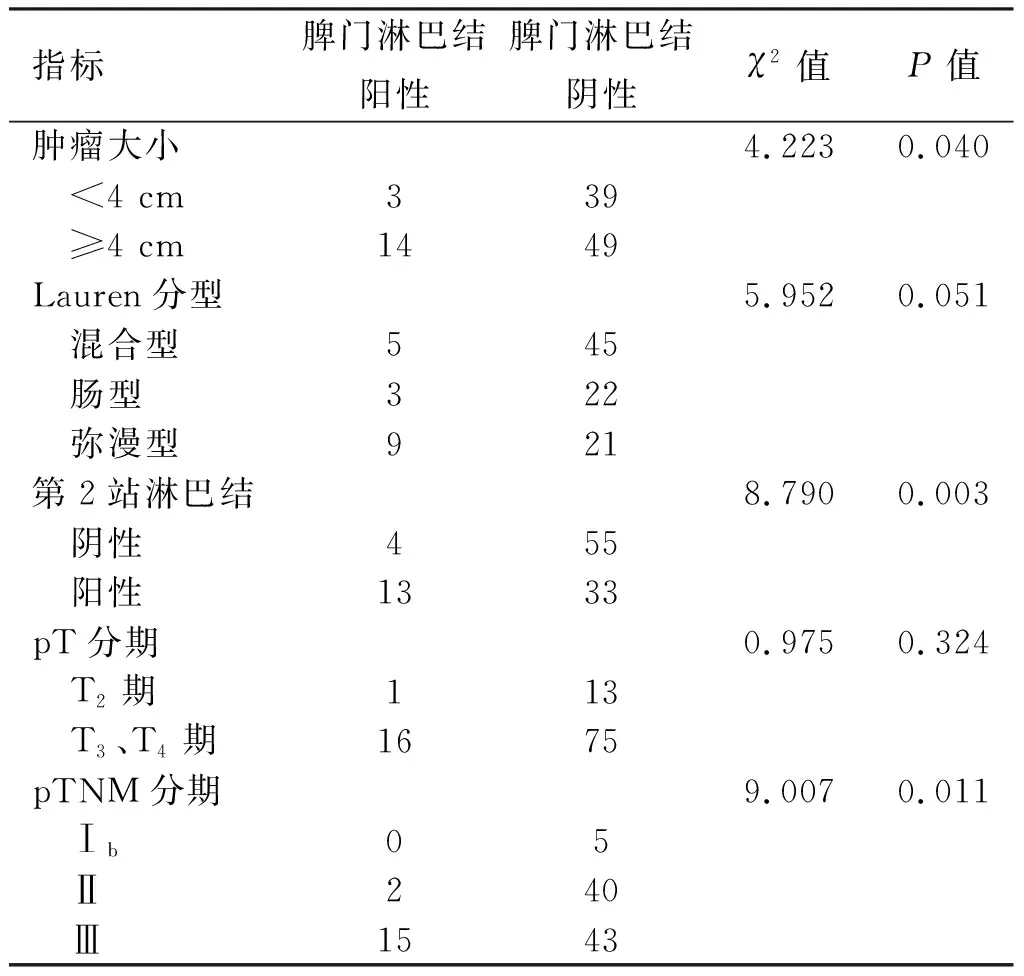
表3 脾门淋巴结阳性的相关临床因素分析(n)
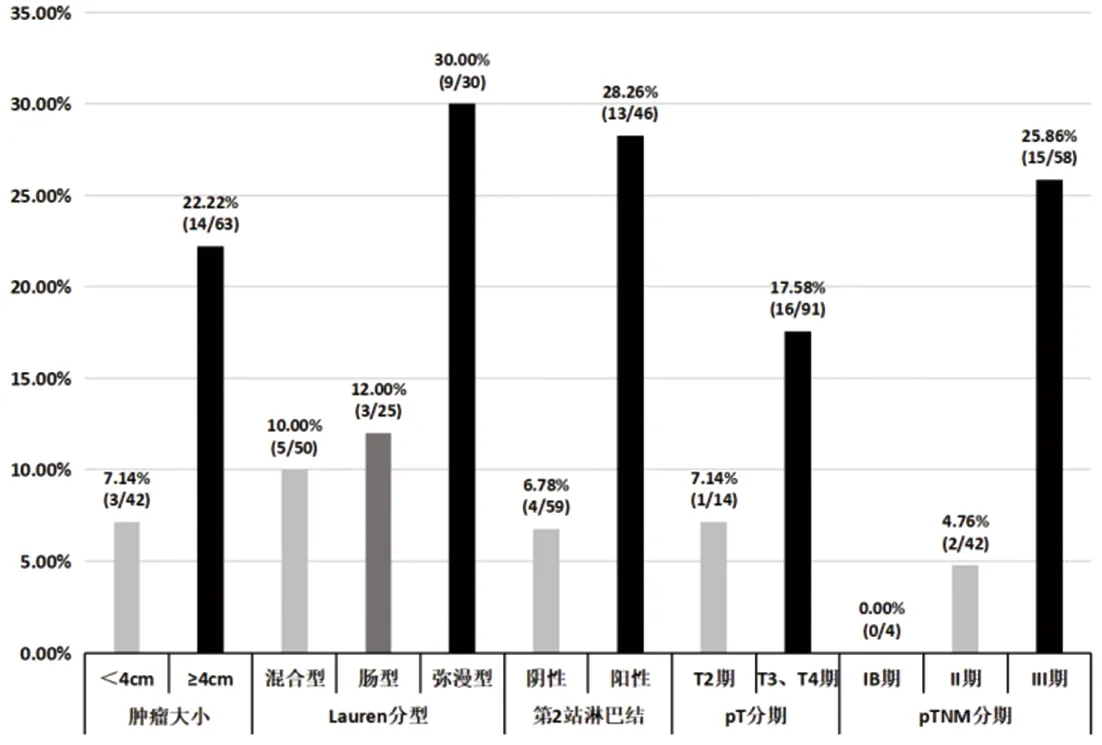
图19 不同因素下脾门淋巴结阳性率
2.4 两组术中并发症的比较 环周组发生术中并发症3例,均为胰腺损伤,发生率为6.12%;前方组亦发生3例,发生率为5.36%;两组术中并发症发生率差异无统计学意义(χ2=0.028,P=0.866)。两组术中均无邻近脏器(结肠、肾)损伤、脾实质/血管损伤导致中转开腹或切脾,无脾梗死。
2.5 两组术后并发症的比较 环周组发生术后并发症12例,发生率为24.49%;前方组亦发生12例,发生率为21.43%;两组术后并发症发生率差异无统计学意义,术后并发症主要集中在肺部感染。两组均无围手术期死亡病例,见表4。
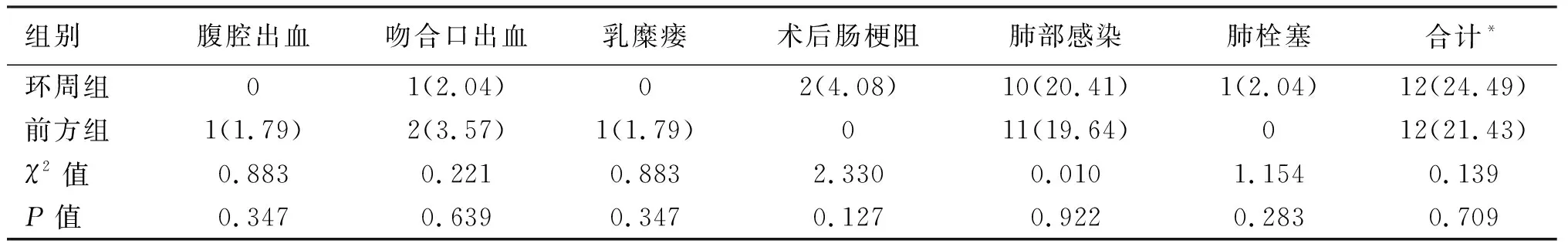
表4 两组患者术后并发症比较[n(%)]
3 讨 论
受TME、CME的启发,人们以胚胎学基础、筋膜层面为导向,开始了全/完整胃系膜切除术的研究,进而发展提出胃癌膜解剖手术,及其基础理论与临床实践,目前探讨较多的是篠原尚的“膜的解剖”及龚建平的“膜解剖”。(1)2013年篠原尚[13]从膜的解剖的角度重新认识传统胃癌手术,认为胃系膜有5层结构(腹膜-腹膜下筋膜-实质层-腹膜下筋膜-腹膜)、相邻系膜融合形成不可剥离的融合筋膜,如胃系膜与横结肠系膜融合形成9层结构(图20),手术剥离只能在融合筋膜浅层或深层的腹膜下筋膜进行,图解出解剖分离的精准筋膜层面。然而,在现有腹腔镜放大倍数下外科医师难以精确辨认胃系膜的5层结构或相邻系膜融合形成的9层结构,术中精准地在融合筋膜的浅层或深层解剖分离难度较大;如果按照篠原尚的观点施术,往往变成胃全网膜囊切除的范畴,已在目前手术中摒弃,手术范围有扩大之嫌。(2)2015年龚建平[14]提出“广义的系膜”“系膜床”“膜桥”等概念及膜解剖理论,认为相邻系膜融合形成融合间隙(图21),指出切开“膜桥”进入“广义的系膜”与“系膜床”形成的融合间隙解剖分离,淡化切开“膜桥”进入篠原尚述及的融合筋膜与腹膜下筋膜的具体层次,在现有腹腔镜放大倍数下容易实施,然而龚建平教授未说明胃系膜的具体起止点及所在的筋膜层面,难以指导外科医师在手术操作上做到精准手术入路及精准系膜切除。
我中心积极探索实施以胚胎学为基础、以膜解剖为指导的腹腔镜胃癌D2根治术,提出在D2范围的基础上,完整切除外科学意义上的胃系膜,其由胃网膜右系膜、胃右系膜、胃左系膜、胃后系膜、胃网膜左系膜、胃短系膜构成,包绕胃周血管、淋巴结及脂肪结缔组织形成一个完整连续的整体结构,与Coffey等[16]的“肠系膜是一个完整连续的整体结构”类似。前肠与中肠、后肠经过旋转形成复杂的折叠与融合,使得胃癌膜解剖手术的难度明显大于结直肠癌的TME、CME。我中心术中借助腹腔镜的放大作用及超声刀的腔隙化效应,通过寻找胃系膜的起点,切开系膜表面的腹膜进入胃系膜的六个筋膜间隙(图22),利用解离胃系膜的三种方式(系膜与系膜之间、系膜与脏器之间、系膜与血管之间)还原胃系膜的折叠与融合,最后在胃系膜根部(止点)离断胃周血管,实现彻底完整切除胃系膜内的淋巴结与脂肪结缔组织(图23)。概括来说,我中心提出完整胃外科系膜切除的对策在于“形、根、面”的运用:(1)形:了解胃系膜的形态、起止点、轮廓与范围;(2)根:辨认并处理胃系膜的根部(起止点);(3)面:寻找胃系膜的六个筋膜间隙,掌握解离胃系膜的三种方式。
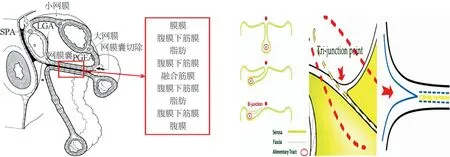
图20 篠原尚-胃系膜与横结肠系膜融合形成9层 图21 龚建平-相邻系膜融合形成融合间隙(基 结构(基于参考文献[13]修改) 于参考文献[15]修改)
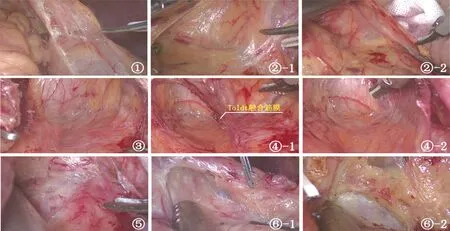
图22 胃系膜的六个筋膜间隙(①腹膜下筋膜间隙;②-1幽门下方胃结肠系膜间隙;②-2脾门下方胃结肠系膜间隙;③胰腺后筋膜间隙;④-1 Toldt融合筋膜;④-2 Toldt融合筋膜后间隙;⑤膈肌前筋膜间隙;⑥-1动脉前间隙;⑥-2静脉前间隙)
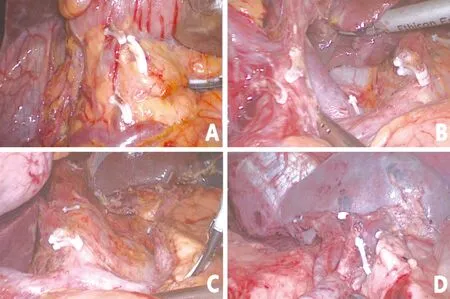
图23 我中心基于膜解剖的腹腔镜胃癌D2根治术效果(A:幽门下清扫后效果;B:胰腺上缘右侧清扫后效果;C:胰腺上缘左侧清扫后效果;D:脾门清扫后效果)
在清扫脾门淋巴结方面,脾叶血管前侧方及后方淋巴结属于胃网膜左系膜范畴,从完整系膜切除角度,我中心总结出一套安全高效的腹腔镜原位保脾脾门淋巴结环周清扫术。胚胎学里胰、脾及其血管发生于前肠双层背侧系膜内,由于原始消化管的旋转及胃背系膜突向左侧,导致:(1)包被胰腺的双层系膜后层与后腹膜融合形成腹主动脉左侧的Toldt融合筋膜;(2)包被脾的双层系膜移向腹腔左侧衍化为胃网膜左系膜、胃短系膜填塞在脾门周围,并与邻近的后腹膜、胰腺、横结肠系膜形成融合筋膜间隙;(3)脾血管走行在双层系膜内的胰腺上缘,出胰尾后发出脾叶血管进入脾脏,发出胃网膜左血管进入胃壁。我中心术中通过寻找胃网膜左系膜在横结肠系膜、胰体尾的起点,切开系膜表面的腹膜进入胃结肠系膜间隙、胰腺前间隙、胰腺后筋膜间隙,然后在胃系膜与横结肠系膜、胃系膜与胰腺、胃系膜与脾血管、胃系膜与后腹膜之间解剖分离,还原胃系膜在脾门区域的折叠与融合,最后在胃系膜根部(止点)离断胃网膜左血管、胃短血管,将系膜包绕的血管、淋巴及可能有“第五转移”[15]的脂肪结缔组织完整切除,实现脾叶血管前侧方及后方淋巴结的彻底清扫,符合肿瘤根治的整块切除及无瘤原则。
我中心的腹腔镜原位保脾脾门淋巴结环周清扫术,采用基于膜解剖的胰后尾侧入路,加以设计合理规范的手术流程,实现了脾叶血管前侧方及后方淋巴结的清扫,解决了目前国内外多数腹腔镜原位保脾脾门淋巴结清扫术[17-18]不能清扫脾门后方淋巴结的问题。(1)应用膜解剖拓展间隙层面,解决了腹腔镜原位保脾脾门淋巴结环周清扫术层面不清的问题。膜解剖的关键在于精准切开系膜表面的腹膜进入正确的筋膜间隙,其为腔镜下像“天使发丝”结构的疏松结缔组织。(2)采用胰后尾侧入路,解决了腹腔镜原位保脾脾门淋巴结环周清扫术显露不清的问题。腹腔镜由下向上的视野,利于显露脾门周围的组织结构、容易进入脾门周围的筋膜间隙、方便充分解剖分离胰尾及脾门后方的系膜,使得脾蒂悬空、减轻牵拉张力,防止脾脏及血管撕裂出血,降低了脾门淋巴结清扫的难度[19]。(3)合理规范的手术流程,解决了腹腔镜原位保脾脾门淋巴结环周清扫不彻底的问题:①显露胰腺后上间隙:识别胃系膜在胰腺上缘附着缘处的“黄白交界线”,切开系膜表面的腹膜,进入胰腺前间隙,避免切开过深突破胰腺固有筋膜,从而损伤胰腺实质。向上拓展进入胰腺后上间隙的过程经历了系膜与脏器(胰腺)、系膜与血管(脾血管)、系膜与系膜(后腹膜)的游离,前两者因有若干血管穿支进入胰腺实质,因此以锐性游离(切)为主;后者因间隙疏松,因此以钝性游离(推)为主。在胰腺后上间隙及脾血管前间隙向胰尾、脾上极方向游离,全程显露胰腺段脾动脉的手术操作上,我中心认为应尽可能完整切除脾动脉干前侧方及后方的系膜,因为胚胎学里脾动脉干前侧方及后方的系膜属于胃系膜范畴,从完整系膜切除的角度理应彻底完整切除胰腺上缘左侧区胃系膜。②显露胰腺后下间隙:寻找并切开胃网膜左系膜在左侧横结肠系膜附着缘处的起点,沿两者的融合筋膜间隙向上游离达胰腺后下间隙(即Toldt融合筋膜前间隙),与胰腺后上间隙汇合,注意避免切入过深突破Toldt融合筋膜后间隙,从而损伤后方脏器。③显露脾门后方+脾门前方:环周清扫脾门淋巴结时,我中心遵循先后再前、先外再内、由下向上、由干到支、由近及远的原则,手术要点包括以“微张力”牵拉显露、以“小步慢走”应用超声刀,注意识别胰腺前间隙、胰腺后间隙、脾血管前间隙,保持胃系膜完整游离。为避免脾门后方无标识导致的脾脏损伤,我中心的经验是在游离完外侧系膜充分显露脾脏表面后垫一纱布标示。
本研究中,两组总手术时间、术中出血量、首次排气时间、左腹腔引流管拔除时间、进食流质时间、术后住院时间差异无统计学意义(P>0.05);环周组脾门淋巴结清扫时间较前方组延长(P<0.05),系增加清扫脾门后方淋巴结所致。两组术中、术后并发症发生率差异无统计学意义,术中均无邻近脏器(结肠、肾)损伤、脾实质/血管损伤导致的中转开腹或切脾、脾梗死,术后均无围手术期死亡病例,说明环周组并不增加术中、术后并发症。综上说明,基于膜解剖的腹腔镜原位保脾脾门淋巴结环周清扫术安全性高、可行性强。
本研究105例患者中脾门淋巴结阳性率16.19%(17/105),χ2检验显示,肿瘤大小、第2站淋巴结阳性与否、pTNM分期与脾门淋巴结阳性有关(P<0.05)。其中肿瘤≥4 cm的患者脾门淋巴结阳性率为22.22%(14/63),第2站淋巴结阳性患者脾门淋巴结阳性率为28.26%(13/46),T3与T4期患者脾门淋巴结阳性率为17.58%(16/91),Ⅲ期患者脾门淋巴结阳性率为25.42%(15/59)。综上说明,肿瘤≥4 cm、第2站淋巴结阳性、T3与T4期、Ⅲ期胃上部癌患者脾门淋巴结阳性率较高,需要清扫脾门淋巴结。
本研究中,环周组脾门淋巴结阳性患者12例,脾门淋巴结阳性率为24.49%(12/49),其中T3与T4期患者脾门淋巴结阳性率为26.67%(12/45),Ⅲ期患者为35.48%(11/31);前方组脾门淋巴结阳性患者5例,脾门淋巴结阳性率为8.93%(5/56),其中T3与T4期患者脾门淋巴结阳性率为8.70%(4/46),Ⅲ期患者为14.81%(4/27)。环周组脾门淋巴结阳性患者例数较前方组明显增多(12例 vs. 5例,P=0.031)。环周组脾门前方淋巴结阳性患者12例,其中3例同时伴有脾门后方淋巴结阳性,3例均为T4期、Ⅲ期患者,即脾门前方淋巴结阳性患者中25.00%(3/12)存在脾门后方淋巴结阳性。综上说明:(1)脾门淋巴结环周清扫可发现脾门后方淋巴结阳性患者,仅行脾门前方淋巴结清扫可能遗漏脾门后方阳性淋巴结,因此脾门淋巴结环周清扫利于提高脾门淋巴结清扫的彻底性及手术根治效果;(2)随着脾门淋巴结清扫范围的扩大,脾门淋巴结阳性率更高,有助于发现更多脾门淋巴结阳性患者,提高手术根治效果;(3)T4期、Ⅲ期胃上部癌患者脾门淋巴结阳性率高,同时存在脾门后方淋巴结阳性,因此有必要施行脾门淋巴结环周清扫。
本研究中,两组胃周阳性淋巴结数量、脾门阳性淋巴结数量差异无统计学意义(P>0.05);环周组脾门淋巴结清扫总数多于前方组,并且明显多于文献报道[17-18,20],同时环周组胃周淋巴结总数更多。表明随着环周组脾门淋巴结清扫范围的扩大,可清扫更多的脾门淋巴结。近年多项研究显示,胃癌淋巴结检出数量与患者总体生存期呈正相关趋势,即清扫淋巴结数量越多,预后越好[21];脾门淋巴结环周清扫可清扫更多的脾门淋巴结及胃周淋巴结,因此理论上进展期胃上部癌患者行脾门淋巴结环周清扫有助于改善预后,可能取得更好的远期疗效。
综上,基于膜解剖的腹腔镜原位保脾脾门淋巴结环周清扫术安全、可行、近期疗效可靠,与前方清扫术相比,可彻底清扫脾叶血管前侧方及后方淋巴结,获得更多的脾门淋巴结总数及脾门淋巴结阳性例数,有助于避免脾门后方阳性淋巴结遗漏,增强胃癌手术清扫效果,尤其适于T4期、Ⅲ期胃上部癌患者,有助于进一步研究脾门淋巴的转移规律,使患者受益,值得临床推广应用。然而本研究为单中心回顾性分析,且入组患者不多,一定程度上影响了研究结果的说服力,此外,此技术是否在肿瘤学上有更多的获益,尚待进一步的随访及前瞻性多中心随机对照研究的证据支持。
