基于FAERS数据库的托伐普坦不良事件信号挖掘与分析
2022-02-20陈亚昆周鹏翔孙瑞芳赵荣生
陈亚昆 周鹏翔 孙瑞芳 赵荣生

中圖分类号 R969.3;R972 文献标志码 A 文章编号 1001-0408(2022)03-0352-06
DOI 10.6039/j.issn.1001-0408.2022.03.16
摘 要 目的 基于美国FDA不良事件报告系统(FAERS)数据库挖掘托伐普坦的药品不良事件(ADE)信号,为临床安全用药提供参考。方法 收集FAERS数据库2004年第一季度至2020年第三季度的托伐普坦ADE数据,利用比例失衡法中的报告比值比(ROR)法和比例报告比值(PRR)法进行数据挖掘。结果 共获得目标药物托伐普坦ADE报告4 744例,涉及1 279个ADE,上报的国家以美国、日本等为主。共挖掘出托伐普坦ADE信号199个,涉及21个系统器官分类(SOC),主要集中在各类检查(n=56)、肝胆系统疾病(n=17)、肾脏及泌尿系统疾病(n=14)等,其中未在我国现有药品说明书中提及的信号有80个,包括肾小球滤过率降低、位置性眩晕、肾囊肿破裂、肾囊肿感染、肺恶性肿瘤等。结论 使用托伐普坦治疗前应做好患者的用药评估,特别应重视有心力衰竭、肝功能不全、肾功能不全等基础疾病的患者;治疗期间应密切监测患者肝功能、肾功能指标,如发生ADE或疾病进展,应及时采取干预措施,避免因ADE导致的相关损伤和疾病恶化。
关键词 托伐普坦;药品不良事件;FAERS数据库;比例失衡法;信号挖掘
Signal mining and analysis of adverse drug events for tolvaptan based on FAERS database
CHEN Yakun1,2,3,ZHOU Pengxiang1,SUN Ruifang3,ZHAO Rongsheng1,2(1. Dept. of Pharmacy, Peking University Third Hospital, Beijing 100191,China;2. Dept. of Pharmacy Administration and Clinical Pharmacy,School of Pharmaceutical Sciences,Peking University,Beijing 100191, China;3. Dept. of Pharmacy, Civil Aviation General Hospital, Beijing 100123, China)
ABSTRACT OBJECTIVE To mine the signals of adverse drug events (ADE) for tolvaptan based on FAERS database, and to provide reference for safe use of drugs in clinic. METHODS The data of tolvaptan-induced ADE were collected from FAERS database during the first quarter of 2004 to the third quarter of 2020; the reporting odds ratio (ROR) method and the proportional reporting ratio(PRR) method of disproportional method were used for data mining. RESULTS A total of 4 744 ADE reports of the target drug tolvaptan were extracted, involving 1 279 ADEs. The reporting countries were mainly the United States and Japan, etc. A total of 199 ADE signals were obtained, involving 21 system organ classes(SOCs), which mainly focused on various examinations (n=56), hepatobiliary disorders(n=17), renal and urinary disorders(n=14), etc. Among them, 80 signals were not mentioned in existing instructions for tolvaptan in China, such as decreased glomerular filtration rate, positional vertigo, rupture of renal cyst, renal cyst infection, pulmonary malignant tumor. CONCLUSIONS Before using tolvaptan, drug evaluation should be performed well, especially the patients with basic diseases such as heart failure, liver insufficiency and renal insufficiency. During treatment, the indexes of liver function and renal function should be closely monitored; timely intervention measures should be taken to avoid related injury and disease deterioration caused by ADE when ADE or disease progression occurs.
KEYWORDS tolvaptan; adverse drug event; FAERS database; disproportional method; signal mining
托伐普坦为选择性精氨酸血管加压素(arginine vasopressin,AVP)V2受体拮抗剂,可竞争性阻断精氨酸血管加压素与肾单位远端集合管主细胞V2受体,阻断肾脏对水的重吸收,使尿液中无电解质成分的游离水排出增多,从而使血浆中钠离子浓度升高且不影响钾、镁离子排泄[1-3]。2009年5月,美国FDA批准该药用于治疗高容量性或正常容量性低钠血症,包括心力衰竭、肝硬化和抗利尿激素分泌异常综合征(syndrome of inappropriate antidiuretic hormone secretion,SIADH)。2011年9月,托伐普坦经国家食品药品监督管理总局批准在中国上市;2017年9月,其被批准增加心力衰竭所引起的体液潴留的适应证。美国、日本、加拿大等国的药品监督管理部门还批准托伐普坦用于治疗常染色体显性遗传性多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)[4-7]。由托伐普坦的药品说明书可见,其常见不良反应(adverse drug reaction,ADR)轻微,主要表现为口干、多尿、便秘、高钠血症、尿频等[3-4]。2013年4月,美国FDA 发布警告称,托伐普坦存在严重、可能致命的肝损伤风险,且有潜在肝脏疾病的患者不应服用该药[8-9],并在其药品说明书中增加了肝毒性和快速纠正低钠血症可引起渗透性脱髓鞘作用的警示语。反观我国已上市托伐普坦的药品说明书批准其可用于肝硬化患者,而现有的安全性数据主要来源于上市前的相关临床试验数据。药品在临床使用过程中可能出现药品说明书未提及的ADR甚至严重ADR,需要不断通过ADR监测系统和真实世界数据进一步收集、获取。
美国FDA不良事件报告系统(FDA adverse event reporting system,FAERS)是一种收集自发呈报药物不良事件(adverse drug event,ADE)信息的数据库。自发呈报系统具有监测范围广且不受时间、空间限制的特点,能够及早地发现ADE信号。FARES因其数据量大、数据信息多样且免费对外公开,常被用于药物ADE挖掘[10]。本研究通过对FAERS数据库收集的有关托伐普坦的ADE数据进行分析,挖掘托伐普坦的可疑ADE信号,为其临床安全用药提供参考。
1 数据与方法
1.1 数据来源
本研究所用数据来源于美国FAERS数据库,其数据来源于患者或卫生健康系统人员自发呈报。本研究收集FAERS数据库中2004年第一季度至2020年第三季度共67个季度的ADE数据,导入自建数据库,收集的内容包括个人信息记录、ADE记录、药物使用记录、治疗结果记录、报告来源等。
1.2 数据清理
以托伐普坦通用名“tolvaptan”为目标药物检索词进行检索,结合FAERS数据库说明文件,去除个人信息记录中重复上报的ADE数据,仅保留最新记录。
本研究利用《监管活动医学词典》(Medical Dictio- nary for Regularly Activities,MedDRA)中药物ADR术语集的系统器官分类(system organ class,SOC)和首选语(preferred terms,PT)对ADE进行分类和描述;采用MedDRA 24.0软件对不良事件的PT、SOC进行中英文映射[11]。
1.3 数据挖掘方法
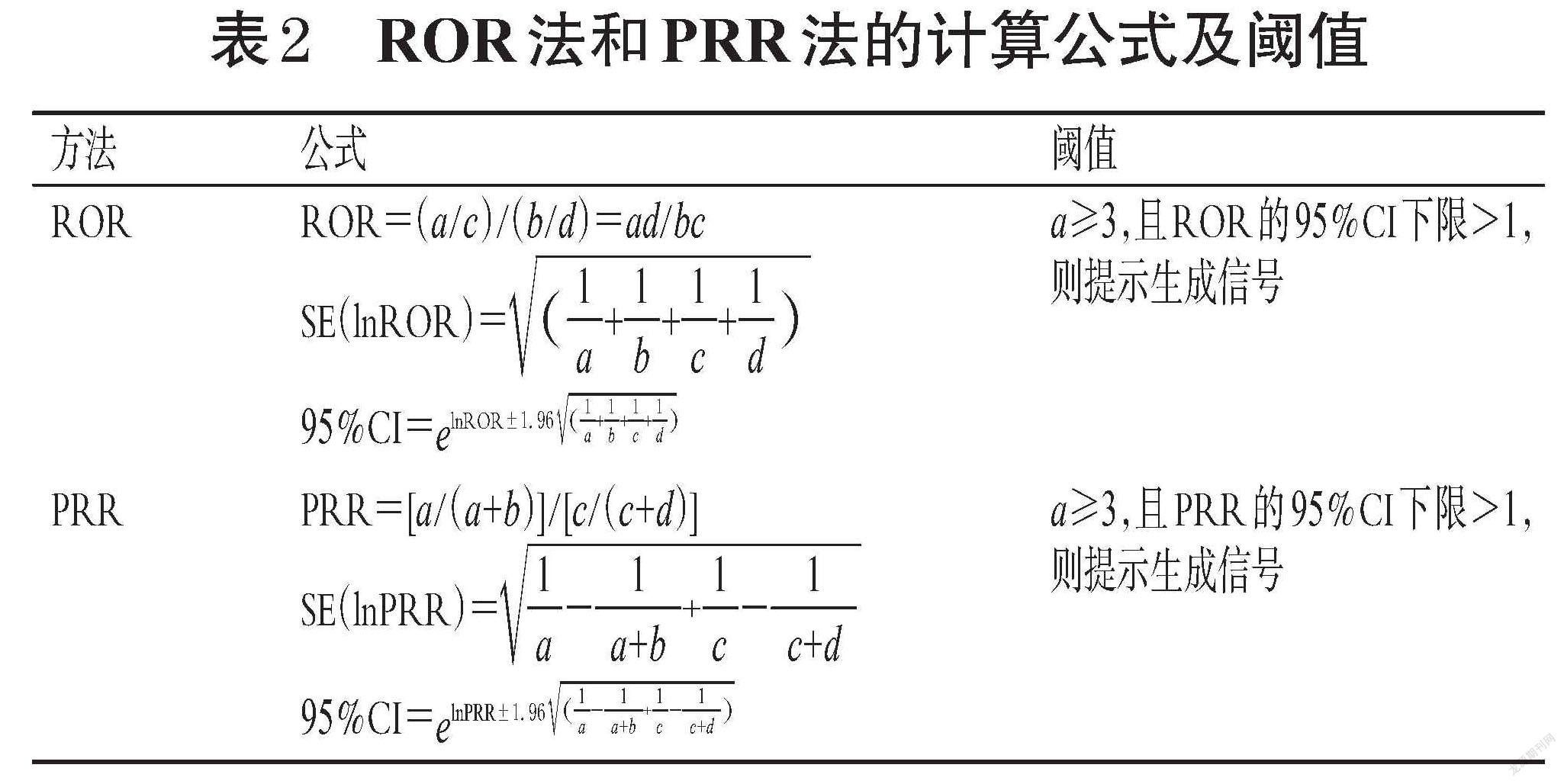
本研究中,信号挖掘采用比例失衡法中的报告比值比(reporting odds ratio,ROR)法和比例报告比值(proportional reporting ratio,PRR)法。这两种方法通过比较目标药物的目标ADE发生比例和其他全部药物的目标ADE发生比例,该比例若大于设置的阈值则称为失衡,提示生成潜在的ADE信号。两种研究方法均基于比例失衡法四格表(表1)。根据公式计算出ROR值、PRR值及相应的95%置信区间(95%CI)[12-14],并根据设置的阈值对信号进行筛选。ROR法和PRR法的计算公式及阈值见表2。
由表2可知,ROR法信号生成标准为:报告数(a)≥3,且ROR值的95%CI下限>1则提示生成信号;PRR法信号生成标准为:报告数(a)≥3,且PRR值的95%CI下限>1则提示生成信号[14-15]。95%CI的下限越大,表示信号越强,即目标药物与目标ADE之间的联系越强。两种方法具有较高的可信度和灵敏度,联合使用可降低假阳性信号的数量[12]。
1.4 统计学方法
本研究的统计分析采用SPSS 20.0软件和Microsoft Excel 2016软件。
2 结果
2.1 目标药物ADE报告基本情况
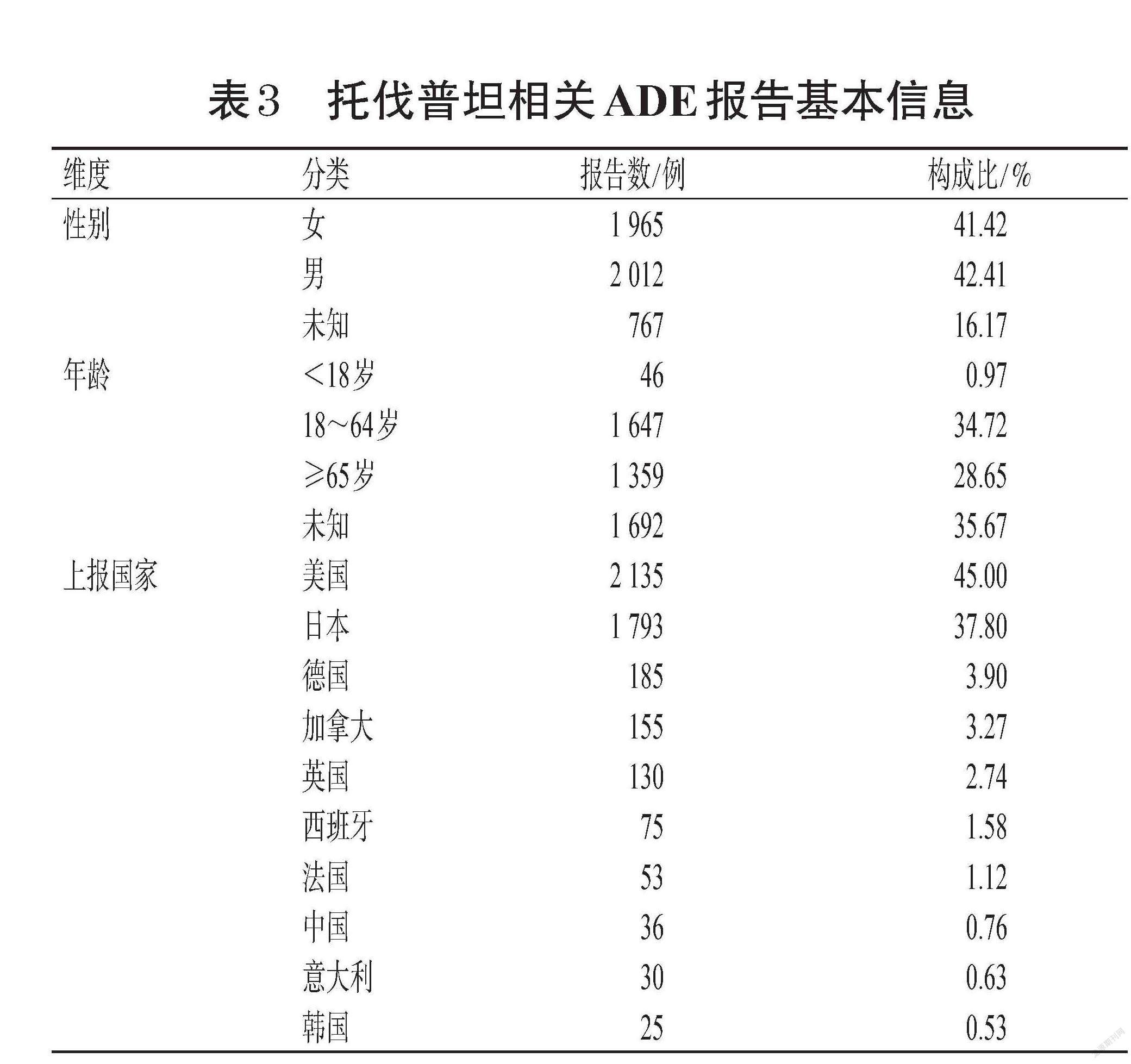
经过数据清洗,共检索到93 732 366例药物ADE报告,其中目标药物托伐普坦报告4 744例,共涉及1 279个ADE。报告数据来源于32个国家,其中上报数量排名前5位的依次是美国、日本、德国、加拿大、英国,合计占比92.71%;中国仅上报36例。在性别构成方面,男性(2 012例)略高于女性(1 965例);中位年龄为62岁,而18~65岁患者占34.72%。托伐普坦相关ADE报告基本信息见表3。
2.2 各SOC的ADE报告及挖掘信号情况
采用ROR法、PRR法,根据设置的阈值为筛选条件,逐一进行信号检测,得到以托伐普坦为目标药物的ADE信号235个,二次筛选排除产品问题、各类损伤、中毒及操作并发症、各种手术及医疗操作等与药物治疗无关的信号36个,最终得到199个信号,涉及21个SOC。研究结果显示,按SOC报告数排序前几位的依次是各类检查,肝胆系统疾病,呼吸系统、胸及纵隔疾病,肾脏及泌尿系统疾病。其中SOC“各类检查”项信号最多,共涉及56个信号(占28.14%,56/199),主要为血肌酐升高(141个,占11.02%,均为占1 279例ADE報告的比例,下同)、血钠降低(131个,占10.24%)、丙氨酸转氨酶升高(130个,占10.16%)、天门冬氨酸转氨酶升高(118个,占9.23%)、血钠升高(92个,占7.19%)。与我国已上市托伐普坦的说明书进行对照,有80个ADE信号(占40.20%,80/199)在现有药品说明书中未被提及。其中SOC良性、恶性及性质不明的肿瘤(包括囊状和息肉状),耳及迷路类疾病项下的ADE信号均为新信号;其余未提及的信号主要集中在呼吸系统、胸及纵隔疾病,肝胆系统疾病,肾脏及泌尿系统疾病及各类检查,详见表4。表4中排名前10位的各SOC项下报告数排前5位的ADE和信号分析结果详见表5。
2.3 ADE报告及其信号情况
对以托伐普坦为目标药物的ADE信号进行筛查,共检测出199个ADE信号,ROR法和PRR法筛选结果具有较高的一致性。对信号发生频次进行分析(表6),排序前20位的SOC中各类检查(n=7)的信号数最多,主要包括血肌酐升高、转氨酶升高、血钠升高、肾小球滤过率降低等ADE;其次为肾脏及泌尿系统疾病、肝胆系统疾病、代谢及营养类疾病;其中有3个ADE在我国现有药品说明书中未提及,其余与我国现有药品说明书中常见ADE吻合。以ROR法为例对ADE信号强度进行分析(表7),信号强度排序前20位的SOC中各类检查(n=6)的信号数最多,其次为肾脏及泌尿系统疾病、代谢及营养类疾病、肝胆系统疾病;其中9个ADE信号在我国现有药品说明书中未提及,信号强度排名前4位的肾囊肿破裂、肾源性水肿、肾囊肿感染、肾脏囊肿出血均未在我国现有说明书中出现。
3 讨论
本研究采用ROR法、PRR法对托伐普坦的ADE信号进行挖掘分析。两种方法均为ADE信号挖掘的常用方法。为减少假阳性,本研究同时使用两种方法进行计算和信号挖掘,以提高阈值。
3.1 常见ADE信号分析
本研究共挖掘出199个ADE信号,涉及21个SOC。发生频次高且信号强的ADE包括肝功能和肾功能相关指标异常、高钠血症、尿频、多尿、口渴、高尿酸血症、血肌酐升高、渗透性脱髓鞘综合征、转氨酶升高等。上述结果与药品说明书和以往文献报道中提及的常见ADE一致,这主要与其药理作用有关[6,16],也证实了本研究的可信度。
3.2 需要特别关注的ADE信号
本研究结果提示,SOC中肝胆系统疾病、肾脏及泌尿系统疾病项下潜在ADE信号多,报告数和信号强度高。1项ADPKD患者使用托伐普坦的研究发现托伐普坦可引起不可逆的、致命的肝损伤[17],分析其发生机制与胆汁酸分布的改变和该药对线粒体呼吸的抑制有关[18]。为防止此类ADE的发生,患者应在开始服药的2周内进行多次肝功能检查,一旦发生提示肝损伤的症状(疲劳、厌食、上腹不适、小便颜色异常变深等)应考虑与ADE有关,此时应立即进行肝功能检查,并进行相应干预,防止ADE的进一步恶化。在治疗期间,为避免严重ADE的发生,临床需密切关注患者的肝、肾功能和血钠水平,特别是有肝脏基础疾病的患者。托伐普坦的作用机制是与集合管上的V2受体结合并阻断其活性,减少肾脏对水的重吸收,使尿液中水的排出增多,减轻体液潴留,但同时会使肾小球滤过率、尿酸清除率降低,导致血清肌酐、血尿酸水平升高,从而造成肾功能损伤或者恶化[19-20]。现有研究结果对使用托伐普坦是否对患者肾功能产生影响存在争议[19,21-22],对于患有不同基础疾病的患者,肾功能结局也存在差异,有待于进一步研究分析。在使用该药的过程中,临床应密切关注患者血清肌酐、血尿酸等肾功能指标,特别是对于长期服用托伐普坦的患者,建议定期对其进行肾功能检查。
3.3 我国现有药品说明书中未提及的ADE
本研究共挖掘出80个我国现有药品说明书中未提及的潜在ADE,占比为40.20%,其中SOC良性、恶性及性质不明的肿瘤(包括囊状和息肉状),耳及迷路类疾病项下的ADE信号均为新信号。耳及迷路类疾病项下ADE“位置性眩晕”(a为4,ROR为10.31,95%CI下限为3.86),我国现有药品说明书和既往的文献研究中均未见相关报道,在临床使用中需要加强关注。良性、恶性及性质不明的肿瘤(包括囊状和息肉状)项下共发现12个ADE信号,主要集中在肺部肿瘤和进展性肿瘤。目前尚无证据指向托伐普坦可导致肺部肿瘤和肿瘤恶化的发生;有研究表明托伐普坦可有效改善肿瘤患者病程中出现的电解质紊乱、低钠血症及SIADH,提高患者的生活质量和抗肿瘤治疗的依从性,尤其是在小细胞肺癌患者中更为明显[23-26]。因肿瘤患者疾病和用药的复杂性,以及治疗方案的多样性,难以辨别是ADE还是疾病本身进展所造成的临床症状,因此托伐普坦在肿瘤患者中使用的安全性还应更为系统地进行评价。
本研究中,肾囊肿破裂、肾源性水肿、肾囊肿感染、肾脏囊肿出血等ADE的发生率不高,但ADE信号强,与托伐普坦的相关性也比较强,但是这些ADE未在我国现有药品说明书中提及。一些国家和地区批准托伐普坦可用于ADPKD患者 ,ADPKD是一种以肾囊肿的发展和生长为特征的慢性進行性疾病,随着疾病发展会出现疼痛、肾功能异常、心脑血管并发症以及肝脏和其他器官囊肿等症状,大多数 ADPKD患者最终会发展为终末期肾病并需要肾脏替代治疗[7]。考虑这些信号与ADPKD疾病本身及疾病进展的相关性强,建议临床在使用托伐普坦过程中要密切关注患者肾功能指标和原发疾病进展情况;若发生肾功能恶化或上述ADE,应及时进行ADE的甄别并采取干预措施,保障患者用药安全。
3.4 本研究的局限性
本研究仍存在一定的局限性:(1)本研究的数据来源于FARES自发呈报系统,数据库大、覆盖人群广但数据完整性差,可能存在漏报现象;(2)因不能获得使用托伐普坦但未发生ADE的患者数量,故而不能计算整体的ADE发生率;(3)ROR法、PRR法作为信号检测工具,仅能体现目标药物与ADE之间的联系强度,无法直接说明两者间的因果关系,具体还要结合文献和临床使用情况加以证明。
4 结论
本研究通过对FARES数据库中已上报的托伐普坦ADE报告数据进行挖掘分析,总结分析了临床使用过程中发生的各系统ADE信号。结果提示,在临床应用时应对托伐普坦引起的肝胆系统疾病(肝损伤、肝功能不全)、肾脏及泌尿系统疾病(肾功能不全、高尿酸血症)、代谢及营养类疾病(高钠血症)、各类神经系统疾病(肝性脑病、渗透性脱髓鞘综合征)等发生率高且信号强的ADE给予重点关注。在使用托伐普坦前应做好用药评估,使用中应密切监测上述指标以及原发疾病进展;如发生ADE或疾病进展,应及时进行干预,保障患者的用药安全。
参考文献
[ 1 ] KIUCHI S,IKEDA T. Hemodynamic and hormonal effects of tolvaptan for heart failure[J]. Intern Med,2019,58(4):471-475.
[ 2 ] MATSUE Y,SUZUKI M,MIE S Y,et al. Tolvaptan reduces the risk of worsening renal function in patients with acute decompensated heart failure in high-risk population[J]. J Cardiol,2013,61(2):169-174.
[ 3 ] S?NCHEZ SOBRINO P,FERN?NDEZ CATALINA P,LORENZO SOLAR M,et al. Lower doses of tolvaptan in hyponatremia due to syndrome of inappropriate antidiure- tic hormone secretion[J]. Med Clin (Barc),2015,145(3):138-139.
[ 4 ] MARX-BERGER D,MILFORD D V,BANDHAKAVI M,et al. Tolvaptan is successful in treating inappropriate antidiuretic hormone secretion in infants[J]. Acta Paediatr,2016,105(7):e334-e337.
[ 5 ] CIRILLO M. Treatment of autosomal dominant polycystic kidney disease (ADPKD):tolvaptan[J]. G Ital Nefrol,2016,33(5):gin/33.5.21.
[ 6 ] APERIS G,ALIVANIS P. Tolvaptan:a new therapeutic agent[J]. Rev Recent Clin Trials,2011,6(2):177-188.
[ 7 ] BLAIR H A,KEATING G M. Tolvaptan:a review in autosomal dominant polycystic kidney disease[J]. Drugs,2015,75(15):1797- 1806.
[ 8 ] FDA:肝病患者禁用托伐普坦[J].临床合理用药杂志,2014,7(2):160.
[ 9 ] 罗敏,吴斌,吴逢波,等.基于FAERS的托伐普坦相关死亡事件数据挖掘研究[J].中国药学杂志,2020,55(14):1215-1219.
[10] SUBEESH V,MAHESWARI E,SINGH H,et al. Novel adverse events of iloperidone:a disproportionality analysis in US food and drug administration adverse event reporting system (FAERS) database[J]. Curr Drug Saf,2019,14(1):21-26.
[11] TIEU C,BREDER C D. A critical evaluation of safety signal analysis using algorithmic standardised MedDRA queries[J]. Drug Saf,2018,41(12):1375-1385.
[12] 张婧媛,白羽霞,韩晟,等.数据挖掘方法检测药品不良反应信号的应用研究[J].药物不良反应杂志,2016,18(6):412-416.
[13] 代菲,舒丽芯,储藏,等.简述分析几种信号监测方法在药物不良事件中的应用[J].藥学实践杂志,2012,30(5):380-383.
[14] 李苑雅,张艳,沈爱宗.基于自发呈报系统药品不良反应信号检测方法的研究进展[J].安徽医药,2015,19(7):1233-1236.
[15] SAKAEDA T,TAMON A,KADOYAMA K,et al. Data mining of the public version of the FDA Adverse Event Reporting System[J]. Int J Med Sci,2013,10(7):796- 803.
[16] BERL T,QUITTNAT-PELLETIER F,VERBALIS J G, et al. Oral tolvaptan is safe and effective in chronic hyponatremia[J]. J Am Soc Nephrol,2010,21(4):705-712.
[17] WOODHEAD J L,BROCK W J,ROTH S E,et al. Application of a mechanistic model to evaluate putative mechanisms of tolvaptan drug-induced liver injury and identify patient susceptibility factors[J]. Toxicol Sci,2017,155(1):61-74.
[18] CHEBIB F T,PERRONE R D,CHAPMAN A B,et al. A practical guide for treatment of rapidly progressive ADPKD with tolvaptan[J]. J Am Soc Nephrol,2018,29(10):2458- 2470.
[19] FELKER G M,MENTZ R J,COLE R T,et al. Efficacy and safety of tolvaptan in patients hospitalized with acute heart failure[J]. J Am Coll Cardiol,2017,69(11):1399- 1406.
[20] BOERTIEN W E,MEIJER E,DE JONG P E,et al. Short- term renal hemodynamic effects of tolvaptan in subjects with autosomal dominant polycystic kidney disease at various stages of chronic kidney disease[J]. Kidney Int,2013,84(6):1278-1286.
[21] 張亚同,郑丽,朱翊,等.托伐普坦治疗心力衰竭合并利尿剂抵抗疗效的Meta分析[J].临床药物治疗杂志,2020,18(9):36-41.
[22] 马光,王国良,薛永亮,等.托伐普坦对急性失代偿性心力衰竭患者肾功能恶化疗效的Meta分析[J].中国循证心血管医学杂志,2019,11(6):664-669.
[23] THAJUDEEN B,SALAHUDEEN A K. Role of tolvaptan in the management of hyponatremia in patients with lung and other cancers:current data and future perspectives[J]. Cancer Manag Res,2016,8:105-114.
[24] KAI K,TOMINAGA N,KOITABASHI K,et al. Tolvaptan corrects hyponatremia and relieves the burden of fluid/dietary restriction and hospitalization in hyponatremic patients with terminal lung cancer:a report of two cases [J]. CEN Case Rep,2019,8(2):112-118.
[25] SALAHUDEEN A K,ALI N,GEORGE M,et al.Tolvaptan in hospitalized cancer patients with hyponatremia:a double-blind,randomized,placebo-controlled clinical trial on efficacy and safety[J]. Cancer,2014,120(5):744-751.
[26] FIORDOLIVA I,MELETANI T,BALEANI M G,et al. Managing hyponatremia in lung cancer:latest evidence and clinical implications[J]. Ther Adv Med Oncol,2017,9(11):711-719.
(收稿日期:2021-10-11 修回日期:2021-12-14)
(编辑:刘明伟)
主管药师,硕士研究生。研究方向:临床药学。电话:010- 85762244。E-mail:chenyakun_andy@sina.com
通信作者:主任药师,教授,博士生导师,博士。研究方向:临床药学、循证药学、临床药物治疗评价。电话:010-82265810。E-mail:zhaorongsheng@bjmu.edu.cn
