地屈孕酮治疗痛经有效性及安全性的前瞻性、随机对照、开放标签、多中心临床研究
2022-02-20李碧钦张颖周祖妹金文艳李荔周嘉禾张小伟许秋仪池瑞招李金艳马娟
李碧钦 张颖 周祖妹 金文艳 李荔 周嘉禾 张小伟 许秋仪 池瑞招 李金艳 马娟
中圖分类号 R711;R979.9 文献标志码 A 文章编号 1001-0408(2022)03-0344-08
DOI 10.6039/j.issn.1001-0408.2022.03.15
摘 要 目的 评估地屈孕酮治疗痛经的有效性及安全性。方法 采用前瞻性、随机对照、开放标签、多中心临床研究。108例痛经患者按1 ∶ 1比例随机分配到地屈孕酮组和对照组,每组54例。地屈孕酮组于月经周期第5~25天,口服地屈孕酮10 mg,每天2次,治疗3个月经周期。对照组于月经干净开始持续至下次月经第3天,口服桂枝茯苓胶囊0.93 g,每天3次,治疗3个月经周期。主要研究结果为治疗3个月经周期后两组视觉模拟评分量表(VAS)评分的变化,次要研究结果为治疗3个月经周期后COX痛经症状评分(CMSS)、生活质量健康调查简表(SF-36)评分和糖类抗原125(CA125)、白细胞介素6(IL-6)水平的变化,其他研究结果包括额外获益和药物安全性。结果 意向性分析与遵循研究方案分析数据集结果均显示,两组治疗痛经1、2、3个月经周期后的VAS评分均较治疗前下降,治疗时间越长VAS评分下降越明显(P<0.05),且地屈孕酮组VAS评分下降优于对照组(P<0.05)。治疗3个月经周期后,两组患者CMSS的严重程度、持续时间评分均较治疗前显著下降(P<0.05),且地屈孕酮组CMSS的严重程度、持续时间评分下降优于对照组(P<0.05)。治疗3个月经周期后,生活质量SF-36量表的8个维度中,地屈孕酮组在生理机能、生理职能、躯体疼痛、情感职能、社会功能、一般健康状况、精力7个维度的评分较治疗前显著升高(P<0.05),且躯体疼痛、社会功能、一般健康状况、精力4个维度评分升高优于对照组(P<0.05)。两组CA125、IL-6水平治疗前后差异均无统计学意义(P>0.05)。治疗3个月经周期后,地屈孕酮组月经周期、经期较治疗前缩短,经量显著下降(P<0.05),对照组上述指标则无明显改变(P>0.05)。治疗3个月经周期后,地屈孕酮组药物不良事件和不良反应发生率分别为32.69%(17/52)、28.85%(15/52),两组均未发生血栓等严重药物不良事件或不良反应。结论 地屈孕酮治疗痛经可有效降低患者VAS评分,缓解痛经相关症状,提高生活质量,疗效优于桂枝茯苓胶囊;且无严重不良反应,药物耐受性好。
关键词 地屈孕酮;痛经;有效性;安全性;视觉模拟评分;COX痛经症状评分
Effectiveness and safety of dydrogesterone in the treatment of dysmenorrhea: a prospective, random- controlled, open-label and multicenter clinical study
LI Biqin1,2,3,ZHANG Ying1,ZHOU Zumei4,JIN Wenyan1,LI Li1,ZHOU Jiahe1,ZHANG Xiaowei1,XU Qiuyi1,CHI Ruizhao2,LI Jinyan2,MA Juan3(1. Dept. of Gynaecology, Guangdong Maternal and Child Health Hospital Affiliated to Guangzhou Medical University, Guangzhou 511442, China; 2. Dept. of Gynaecology, Shenzhen Longgang District Seventh Peoples Hospital, Guangdong Shenzhen 518114, China; 3. Dept. of Gynaecology, Shenzhen Longgang District Second Peoples Hospital, Guangdong Shenzhen 518112, China; 4. Dept. of Gynaecology, Yangjiang Maternal and Child Health Hospital, Guangdong Yangjiang 529599, China)
ABSTRACT OBJECTIVE To evaluate the efficacy and safety of dydrogesterone in the treatment of dysmenorrhea. METHODS The prospective, random-controlled, open-label and multicenter clinical study was adopted. A total of 108 women with dysmenorrhea were randomly assigned into dydrogesterone group and control group according to the ratio of 1 ∶ 1, with 54 patients in each group. Dydrogesterone group was treated with dydrogesterone 10 mg orally, twice a day, on the 5th-25th day of menstrual cycle, for 3 menstrual cycles. Control group received Guizhi fuling capsule 0.93 g orally, three times a day, since the end of menstrual bleeding to the third day of the next menstruation, for 3 menstrual cycles. Main results were the changes of visual analogue scale (VAS) scores in 2 groups after 3 menstrual cycles; secondary results were the changes of COX menstrual symptom scale (CMSS), quality life of 36-item short form (SF-36), levels of carbohydrate antigen 125 (CA125) and interleukin 6 (IL-6) after 3 menstrual cycles; other findings included additional benefits and drug safety. RESULTS The results of intention to analysis data set and the follow-up study protocol analysis data set showed that VAS scores of 2 groups after treatment of dysmenorrhea for 1, 2 and 3 menstrual cycles were lower than those before treatment, the longer the treatment time, the more obvious the decrease of VAS score (P<0.05), and VAS score decline of dydrogesterone group was better than that of control group (P<0.05). After 3 menstrual cycles, both the two group showed significant reduction in the severity and duration scores of CMSS (P<0.05); and the decrease of the above scores in the dydrogesterone group was superior than in the control group (P<0.05). After 3 menstrual cycles, among 8 dimensions of SF-36 scale, the scores of 7 dimensions in dydrogesterone group were significantly higher than those before treatment, such as the scores of physiological function, physical role, physical pain, emotional function, social function, general health status and energy (P<0.05); the increase of the scores of four dimensions were higher than those in the control group, such as physical pain, social function, general health status, energy (P<0.05). There was no significant difference in the levels of CA125 and IL-6 between 2 groups before and after treatment (P>0.05). After 3 menstrual cycles, the menstrual cycle and menstrual period in the dydrogesterone group were shorter than those before treatment, and the menstrual volume decreased (P<0.05); but there was no significant change in the above indexes of control group (P>0.05). After 3 menstrual cycles, the incidence of adverse drug events and adverse reactions in dydrogesterone group was 32.69%(17/52)and 28.85%(15/52); no serious adverse drug events or adverse reactions such as thrombosis occurred in both groups. CONCLUSIONS Dydrogesterone can effectively reduce the VAS score,also relieve dysmenorrhea-related symptoms,and improve the quality of life. The efficacy of dydrogesterone is superior than that of Guizhi fuling capsule in treatment for dysmenorrheal, without serious adverse reactions. It is well tolerated.
KEYWORDS dydrogesterone; dysmenorrhea; effectiveness; safety; visual analogue scale; COX menstrual symptom scale
痛经主要指与月经相关的、发生于行经前后或经期的下腹部疼痛、坠胀,部分患者伴有严重的背痛和(或)大腿痛,也可伴有恶心、腹泻、疲乏、头痛等症状[1]。痛经可分为原发性痛经和继发性痛经,原发性痛经是生殖器无器质性病变引起的疼痛,而继发性痛经是与子宫内膜异位症、盆腔炎、平滑肌瘤和间质性膀胱炎等盆腔器质性疾病相关的疼痛。痛经作为女性特有的病理现象,发病率为41.7%~77.4%[2-3],严重影响女性的生活和工作质量[4-5]。
痛经的治疗药物包括非甾体类抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)、复方口服避孕药(combined oral contraceptives,COC)、高效孕激素、促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist,GnRH-a)、左炔诺孕酮宫内缓释系统、中成药等[1,6]。NSAIDs为治疗痛经的一线药物,可通过环氧合酶抑制外周前列腺素的产生,缓解痛经疗效确切,但长期使用会对胃黏膜造成损伤,引起胃糜烂、胃溃疡、胃肠道出血,易引起恶心、消化不良、头痛、头晕、嗜睡或口干等症状[7]。激素类药物治疗痛经的机制主要与抑制子宫内膜增生、抑制排卵、减少前列腺素和白三烯的产生有关,但长期使用GnRH-a、COC、高效孕激素等激素类药物可增加血栓、骨质丢失等的发生风险[1]。
在痛经的长期管理中,需兼顾药物的有效性、近期和远期安全性。地屈孕酮是孕酮的立体异构体,其最接近天然孕酮的分子结构,具有单纯孕激素活性,无雌激素、雄激素或盐皮质激素活性,长期用药发生血栓的风险低,不影响骨代谢[8]。中医药是中国医学的瑰宝,在长期没有现代医学参与的临床实践中,古人积累了丰富的对抗各种疾病行之有效的临床经验。痛经在古代医疗过程中也是特别常见的疾病,属于妇科“经带胎产”四大证之一,各种中医药疗法非常丰富。目前,我国地屈孕酮治疗痛经的有效性研究较少,尚缺乏随机对照研究,亦缺乏地屈孕酮与中成药治疗痛经疗效差异的对照研究[9-10]。为评价地屈孕酮治疗痛经的有效性及安全性,本研究将临床上痛经治疗常用的中成药桂枝茯苓胶囊作为阳性对照药物,开展了1项前瞻性、随机对照、开放标签、多中心的临床研究,现报道如下。
1 资料与方法
1.1 一般资料
1.1.1 研究对象 选择2020年12月至2021年7月因痛经就诊治疗的116例患者为研究对象,其中广州医科大学附属广东省妇幼保健院52例,深圳市龙岗区第七人民医院26例,深圳市龙岗区第二人民医院38例。本研究方案获得广州医科大学附属广东省妇幼保健院伦理委员会批准,伦理批件号为广东省妇幼保健院医伦第[202101007]号,遵循赫尔辛基宣言和药物临床试验质量管理规范指导原则;受试者均签署知情同意书。本研究在中国临床试验注册中心注册,注册号ChiCTR- 2100043308。
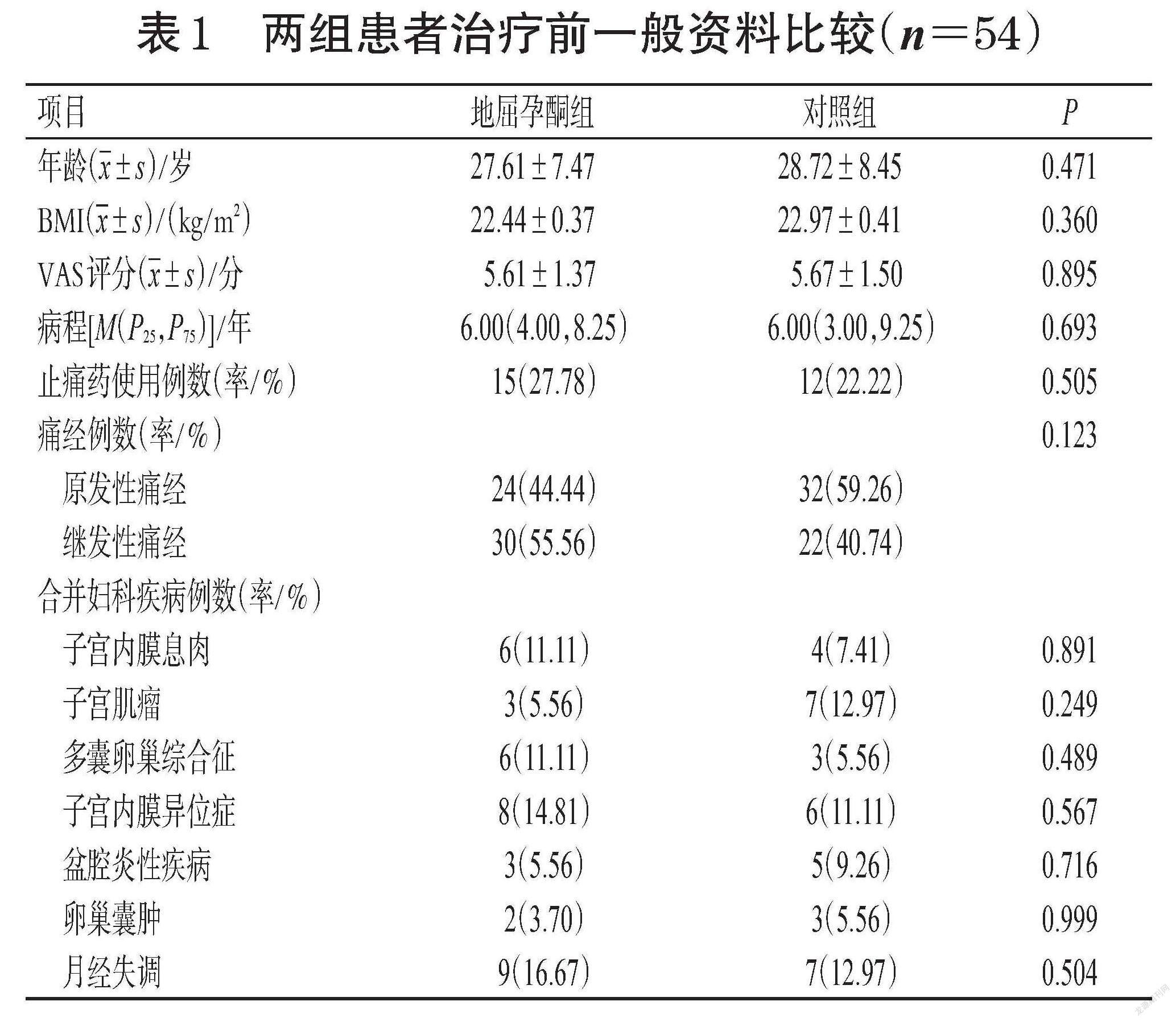
116例痛经患者中有8例患者根据退出标准被剔除,剩余108例患者按照1 ∶ 1比例随机分配到地屈孕酮组和对照组,每组54例。地屈孕酮组完成1、2、3个月经周期治疗的患者分别为52、48、44例;对照组完成1、2、3个月经周期治疗的患者分别为51、46、40例。108例痛经患者年龄为14~48岁,地屈孕酮组、对照组患者的平均年龄分别为(27.61±7.47)、(28.72±8.45)岁。两组患者的年龄、体质量指数(body mass index,BMI)、病程、视觉模拟评分量表(visual analogue scale,VAS)评分、止痛药使用率、原发性痛经发生率、合并妇科疾病等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。两组患者治疗前一般资料比较见表1。
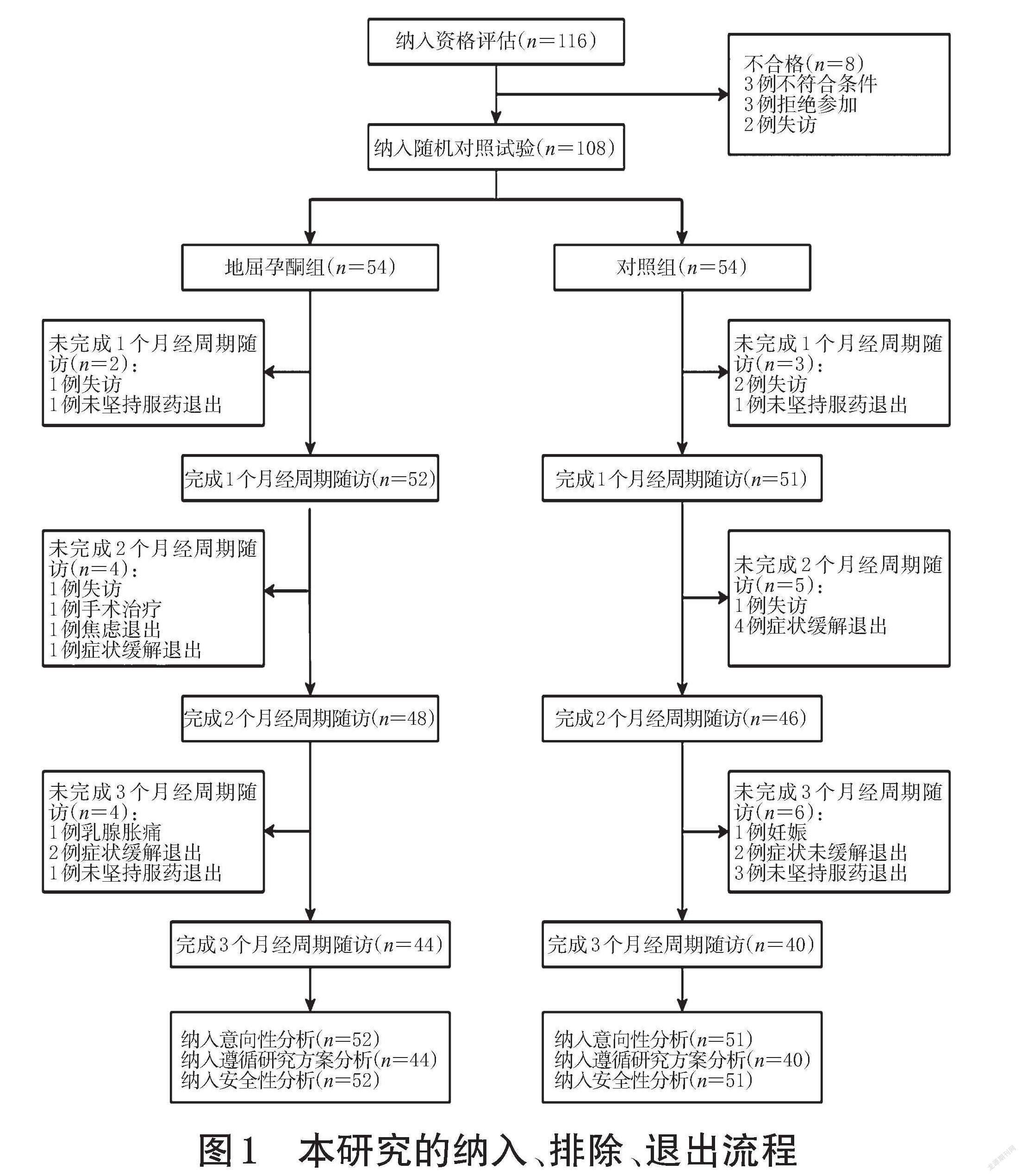
1.1.2 纳入、排除与退出标准 本研究纳入标准为经期第1~5天或经期前1天出现痛经症状且符合以下条件者:(1)年龄12~50岁;(2)VAS评分≥3分;(3)治疗前3个月经周期内未使用COC、孕激素类药物、GnRH-a、左炔诺孕酮宫内缓释系统、雄激素衍生物、中草药,治疗前1个月内未使用镇静剂或镇痛剂;(4)愿意并能遵守本研究方案,具有清楚判断疼痛强度的能力;(5)所有子宫内膜异位症继发痛经患者均无手术指征或拒绝手术治疗,强烈要求使用药物治疗疼痛。本研究排除标准包括:(1)严重肝、肾疾病者;(2)对研究药物的任何成分过敏者;(3)严重心血管疾病者;(4)卟啉症患者;(5)合并激素依赖性肿瘤患者;(6)脑膜瘤患者;(7)有血栓性疾病病史者[11]。本研究退出标准包括:(1)发生无法耐受的药物不良事件者;(2)研究过程中不愿意继续进行临床研究者;(3)不明原因退出研究者;(4)随访期间失访者。本研究的纳入、排除、退出流程见图1。
1.2 方法
1.2.1 研究方法 本研究为前瞻性、随机对照、开放标签、多中心临床研究,采用优效性平行对照试验,VAS评分界值为0.5分。样本量的确定参考文献[12]:地屈孕酮治疗痛经3个月经周期VAS评分下降3.7分,桂枝茯苓胶囊治疗3个月经周期VAS评分下降1.5分,在检验水准α=0.05条件下,若取80%的检验把握度,考虑20%的脱落率,试验与对照样本量比值为1,确定本研究的样本量为116例,根据退出标准剔除8例,最终108例痛经患者纳入研究。采用信封隐蔽分组法,将研究对象进行随机分组。研究开始前由统计师制定一张分配序列表,列表分为3行,第1行为研究对象序号,第2行为随机数字,第3行为药物名称。在108个不透光的信封內分别保存每个随机分组方案,按受试者入组先后顺序依次拆开信封。
1.2.2 治疗方法 参考文献[13]确定地屈孕酮和桂枝茯苓胶囊的治疗剂量。(1)地屈孕酮组:于月经周期第5~25天,口服地屈孕酮10 mg,每天2次,治疗3个月经周期。地屈孕酮(进口药物H20170221)购自雅培贸易(上海)有限公司,商品名达芙通,规格为每片10 mg。(2)对照组:于月经干净开始持续至下次月经第3天,口服桂枝茯苓胶囊0.93 g,每天3次,治疗3个月经周期。桂枝茯苓胶囊(国药准字Z10950005)购自江苏康缘药业股份有限公司,商品名康缘,规格为每片0.31 g。
1.3 结果判断
1.3.1 主要研究结果 本研究的主要研究结果为治疗3个月经周期后痛经VAS评分较治疗前的变化。VAS评分使用的游标卡尺由一条10 cm的直线组成,该直线的一端表示“完全无痛”,另一端表示“能够想象到的最剧烈的疼痛”或“疼痛到极点”[14-15]。 在游标卡尺上,患者面对无刻度一侧指出最能代表疼痛程度的位置,医生面对有刻度的一侧记录疼痛分数。在治疗前及治疗1、2、3个月经周期后,分别记录VAS评分。受试者入组后至少服用1个月经周期的研究药物,即使后期由于不良反应或其他原因等退出试验,仅经历部分试验过程,仍纳入意向性分析数据集[16],共103例患者;受试者入组后严格按照方案执行试验全过程用药,纳入遵循研究方案分析数据集[17],共84例患者。
1.3.2 次要研究结果 本研究的次要研究结果包括治疗3个月经周期后COX痛经症状评分(COX dysmenorrhea symptom score,CMSS)、生活质量健康调查简表(36-item short form,SF-36)评分、糖类抗原125(carbohydrate antigen 125,CA125)水平、白细胞介素6(interleukin 6,IL-6)水平较治疗前的变化。(1)CMSS[18]:修订版的CMSS量表包括小腹部疼痛、恶心、呕吐、食欲不振、头痛、腰骶部疼痛、腿痛、眩晕、乏力、腹泻、面色改变、胃痛、面红、全身疼痛、抑郁、易激惹、神经质、失眠共18个条目,所有条目均采用5级计分法。所有条目按照严重程度和持续时间2个维度分别计算总分[19],在治疗前、治疗3个月经周期后分别记錄CMSS的严重程度和持续时间评分。严重程度维度计分:0分表示患者无不适,1分表示患者感到轻度不适,2分表示患者感到中度不适,3分表示患者感到重度不适,4分表示患者感到非常严重的不适。持续时间维度计分:0分表示无症状,1分表示症状持续<3 h,2分表示症状持续3~<7 h,3分表示症状持续7~24 h,4分表示症状持续>24 h。(2)生活质量SF-36评分[20]:该简表包含生理机能、生理职能、躯体疼痛、情感职能、社会功能、一般健康状况、精神健康、精力共8个维度,适用于普通人群及特定疾病人群(如子宫内膜异位症患者)[21]。在治疗前、治疗3个月经周期后分别记录SF-36评分。(3)生化指标:在治疗前、治疗3个月经周期后,抽取所有研究对象月经期晨起静脉血5 mL,采用化学发光法检测CA125、IL-6水平。
1.3.3 额外获益 本研究的额外获益是指地屈孕酮治疗痛经的同时,患者的月经周期、经期趋于规律,经量趋于正常。按照月经失血图计算月经量[22],在治疗前、治疗3个月经周期后分别记录患者月经周期、经期、经量。
1.3.4 药物安全性 本研究的药物安全性指标包括治疗过程中研究对象的体质量变化、药物不良事件、不良反应等。在整个研究过程中,按类型、严重程度和发生率分别记录药物不良事件、不良反应。
1.4 统计学方法
采用SPSS 25.0软件进行统计学分析。计量资料满足正态分布时以x±s表示,组间比较采用两独立样本t检验,组内治疗前和治疗3个月经周期后两组比较采用配对t检验,不同时间点VAS评分比较采用重复测量方差分析;不满足正态分布时以M(P25,P75)表示,采用非参数秩和检验。计数资料以率或构成比表示,组间比较采用χ2检验。检验水准α=0.05。
2 结果
2.1 疗效结果
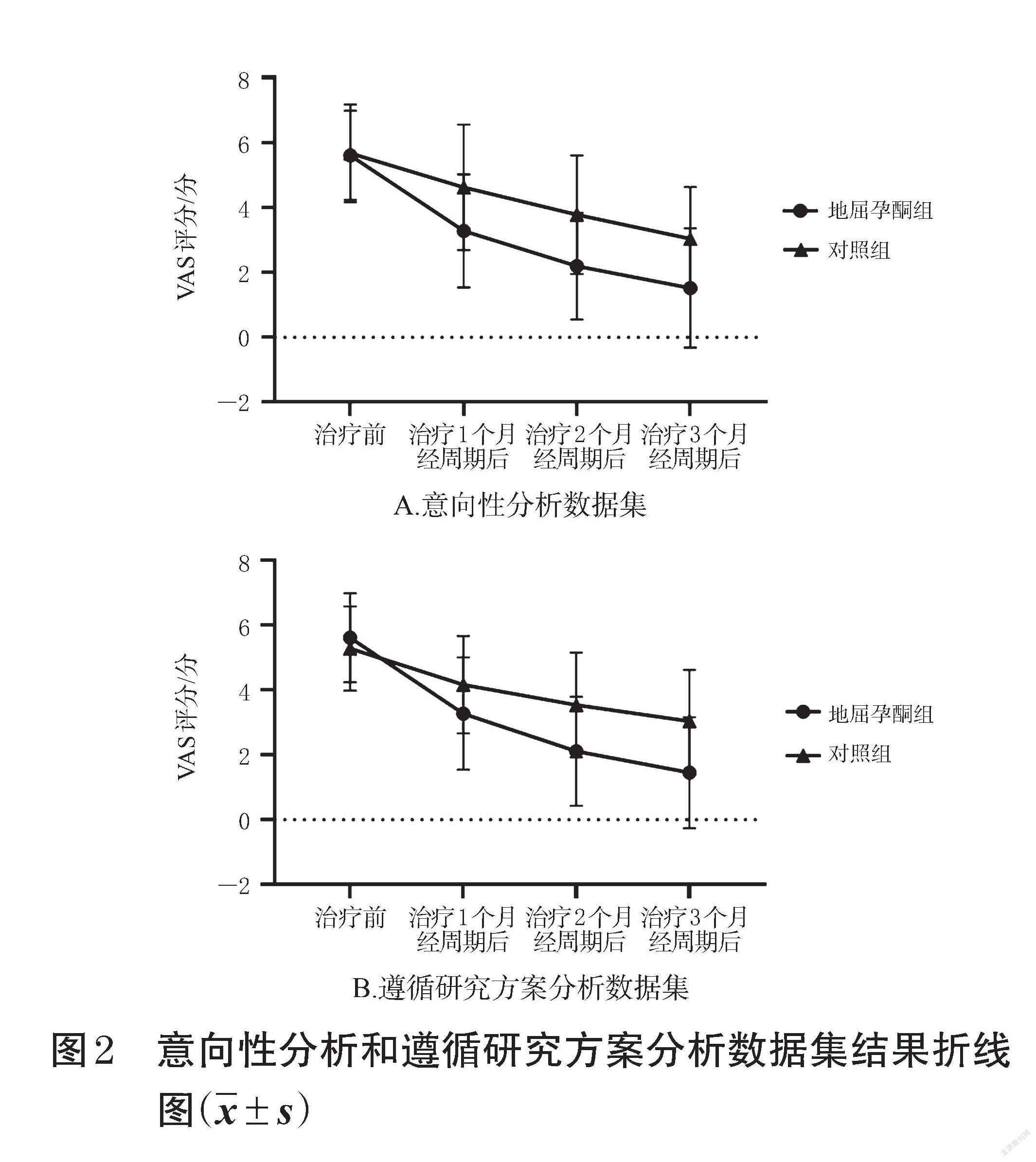
2.1.1 VAS评分比较 意向性分析数据集结果显示,地屈孕酮组在治疗前和治疗1、2、3个月经周期后,VAS评分分别为(5.60±1.36)、(3.28±1.74)、(2.20±1.64)、(1.52±1.84)分,对照组VAS评分分别为(5.67±1.50)、(4.61±1.93)、(3.78±1.82)、(3.04±1.59)分。遵循研究方案分析数据集结果显示,地屈孕酮组在治疗前和治疗1、2、3个月经周期后,VAS评分分别为(5.61±1.37)、(3.27±1.73)、(2.11±1.68)、(1.45±1.71)分,对照组VAS评分分别为(5.28±1.30)、(4.16±1.50)、(3.54±1.61)、(3.04±1.58)分。重复测量方差分析结果显示,采用意向性分析和遵循研究方案分析两种数据集,两组患者组内比较,治疗1、2、3个月经周期后的VAS评分与治疗前比较均明显降低,且后一时间点VAS评分均较前一时间点显著降低(P<0.05);组间比较,治疗1、2、3个月经周期后,地屈孕酮组VAS评分在同时间点均较对照组显著降低(P<0.05)。两组不同时间点VAS评分的意向性分析与遵循研究方案分析数据集结果见图2。
2.1.2 CMSS比较 治疗前,两组患者CMSS的严重程度、持续时间基线评分差异无统计学意义(P>0.05)。治疗3个月经周期后,两组患者CMSS的严重程度、持续时间评分均较治疗前显著降低(P<0.05),且地屈孕酮组CMSS的严重程度、持续时间评分均较对照组降低更显著(P<0.05)。两组患者CMSS的严重程度和持续时间评分见表2。
2.1.3 生活质量SF-36评分比较 治疗前,两组患者生活质量SF-36量表的8个维度评分比较,差异无统计学意义(P>0.05)。组内比较,治疗3个月经周期后,地屈孕酮组的生理机能、生理职能、躯体疼痛、情感职能、社会功能、一般健康状况、精力7个维度评分均较治疗前显著升高(P<0.05),且以躯体疼痛评分改变最明显;对照组的生理机能、生理职能、躯体疼痛、精力4个维度评分均较治疗前显著升高(P<0.05)。组间比较,治疗3个月经周期后,地屈孕酮组躯体疼痛、社会功能、一般健康状况、精力4个维度评分升高程度均显著大于对照组(P<0.05)。两组患者生活质量SF-36评分见表3。
2.1.4 CA125、IL-6水平比较 治疗3个月经周期后,两组患者CA125、IL-6水平与治疗前比较,差异无统计学意义(P>0.05)。两组患者CA125、IL-6水平见表4。
2.2 额外获益结果
治疗3个月经周期后,地屈孕酮组月经周期、经期较治疗前显著缩短(P<0.05),经量较治疗前显著下降(P<0.05);而对照组月经周期、经期、经量与治疗前比较,差异无统计学意义(P>0.05)。两组患者月经周期、经期、经量见表5。
2.3 药物安全性结果
两组患者治疗3个月经周期后,平均体质量与治疗前比较,差异均无统计学意义(P<0.05)。
地屈孕酮组(n=52)发生药物不良事件共17例(32.69%),类型包括:乳房胀痛7例(13.46%),其中1例因乳腺胀痛停药,该例患者治疗前乳腺超声提示乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)分级为3 级,乳腺良性结节,治疗3个月经周期后复查彩超并未增加BI-RADS分级;不规则出血5例(9.62%);嗜睡或头晕2例(3.85%);皮疹或皮肤瘙痒2例(3.85%),其中1例在治疗3个月经周期后出现皮疹,与药物不一定存在因果关系;焦虑或抑郁1例(1.92%),该例患者因焦虑或抑郁停药,经评估,患者治疗前可能存在焦虑或抑郁倾向,与所用药物不一定存在因果关系。地屈孕酮组(n=52)发生药物不良反应共15例(28.85%),类型包括:乳房胀痛7例(13.46%),随用药时间延长,乳房胀痛逐渐减轻,患者均可耐受;不规则出血5例(9.62%);嗜睡或头晕2例(3.85%);皮疹或皮肤瘙痒1例(1.92%)。
对照组(n=51)发生不良反应5例(9.80%),均为因服用药物而出现的恶心,未发生其他药物不良事件。
地屈孕酮组和对照组均未发生血栓等严重药物不良事件或不良反应。
3 讨论
本研究意向性分析与遵循研究方案分析数据集结果均显示,地屈孕酮和桂枝茯苓胶囊能降低VAS评分,说明两组药物治疗痛经均有效;重复测量方差分析结果显示,地屈孕酮治疗痛经在降低VAS评分方面优于桂枝茯苓胶囊,并且治疗时间越长,治疗效果越佳,与以往国内外文献研究结果基本一致[9-10,23]。地屈孕酮治疗痛经的机制包括:(1)前列腺素F2α具有刺激子宮收缩、增加子宫张力、降低血流量的作用,也会引发呕吐、耳鸣、恶心和头痛等症状,而孕激素可抑制前列腺素F2α的产生,降低子宫平滑肌收缩活性,通过促进血液循环、缓解子宫平滑肌痉挛、刺激镇痛物质的合成与释放,减轻痛经程度[24-25];(2)缩宫素及血管加压素可直接作用于非妊娠子宫,使子宫收缩而致痛,而孕激素能抑制雌二醇对缩宫素及加压素的诱导和释放作用[26];(3)一氧化碳可通过子宫中的一氧化碳-环磷鸟苷系统调节子宫收缩性,而孕激素可通过激活一氧化碳系统,下调细胞间隙蛋白、钙通道及缩宫素受体的表达,调节子宫收缩[23,26];(4)钙超载加剧血管和子宫肌膜的收缩,镁含量的减少可能是引起痛经的原因之一,而孕激素可降低子宫平滑肌细胞膜对Ca+、Na+、K+的通透性,通过介导环磷酸腺苷信号通路使平滑肌松弛,进而缓解痛经[25]。
本研究意向性分析数据集结果显示,地屈孕酮组在治疗前、治疗3个月经周期后VAS评分分别为(5.60±1.36)、(1.52±1.84)分;遵循研究方案分析数据集结果显示,地屈孕酮组在治疗前、治疗3个月经周期后VAS评分分别为(5.61±1.37)、(1.45±1.71)分。有临床研究发现,地屈孕酮治疗前、治疗3个月经周期后VAS评分分别为(7.22±2.02)、(1.85±1.42)分[9]。Osuga等[12]研究显示,治疗痛经患者12周后,1、2 mg/d剂量的地诺孕素可使VAS评分下降(4.43±2.71)、(5.08±2.13)分,炔雌醇屈螺酮可使VAS评分下降(3.73±2.77)分。Uysal等[27]研究显示,治疗痛经3个月经周期后,炔雌醇屈螺酮可使VAS评分下降4分。这提示地屈孕酮20 mg/d全周期方案治疗痛经有效,其疗效与地诺孕素1 mg/d、COC效果相当。多项研究发现,患者在月经周期第5~25天服用≤30 mg/d的地屈孕酮后,在月经周期第21天,腹腔镜手术可见黄体,基础体温呈双相型,证实在常规剂量下使用地屈孕酮不抑制排卵,不影响月经周期[23,28-29]。因此,地屈孕酮适用于青少年及有生育需求的痛经患者。既往研究表明,使用地屈孕酮治疗痛经发生血栓和乳腺癌的风险低[8,30];地屈孕酮在青春期痛经、有生育要求及围绝经期子宫内膜异位症患者的疼痛治疗方面具有独特优势,特别是对于有生育要求的患者,在治疗的同时不影响受孕[8]。
CMSS用于评价痛经症状的严重程度和持续时间,现已广泛用于痛经的疗效评价[30]。 本研究发现,地屈孕酮和桂枝茯苓胶囊治疗3个月经周期后,CMSS的严重程度和持续时间评分组内及组间比较,差异均有统计学意义(P<0.05),说明地屈孕酮在治疗痛经的同时,可有效缓解痛经伴随症状的严重程度,缩短症状持续时间,效果优于桂枝茯苓胶囊。Taniguchi等[23]研究显示,地屈孕酮治疗痛经的同时,月经相关的下腹痛、腰骶部疼痛等症状严重程度随时间的推移而降低,痛经强度评分在治疗第2个月经周期随时间的推移而下降,此后基本保持不变(P<0.001)。曲灵菊等[10]研究显示,地屈孕酮治疗痛经3个月经周期后,疼痛缓解率和疼痛消失率分别为100%和73.33%,其疼痛缓解率与布洛芬接近,疼痛消失率较布洛芬更优。这进一步说明地屈孕酮治疗痛经可以缓解痛经伴随症状,进而达到缓解痛经的目的。
本研究结果显示,地屈孕酮可提高生活质量SF-36量表中生理机能、生理职能、躯体疼痛、情感职能、社会功能、一般健康状况、精力7个维度(除外精神健康维度)。躯体疼痛评分主要是评估身体疼痛的强度和疼痛干扰正常工作生活的程度。在SF-36量表所有维度中,地屈孕酮组患者躯体疼痛的治疗前评分最低[(46.79±10.27)分],治疗3个月经周期后躯体疼痛评分改变最明显[(81.74±18.73)分],说明痛经与生活质量的躯体疼痛维度关系最密切,治疗痛经主要通过改善躯体疼痛,进而影响生理机能、生理职能、精力等,最终改善整体的生活质量。但地屈孕酮治疗后对精神健康改善不明显,这可能是因为患者精神健康与精神心理状况、其他社会因素等关系更密切。本研究组内、组间比较表明,地屈孕酮可提高痛经患者生活质量SF-36量表的多个维度,且在躯体疼痛、社会功能、一般健康状况、精力方面的改善程度优于桂枝茯苓胶囊。国外1项前瞻性横断面研究发现,炔雌醇屈螺酮片Ⅱ治疗痛经6~8周,患者生活质量SF-36量表所有维度均有所改善,其中躯体疼痛改善最明显[31]。1项针对美国女退伍军人(n=1 744)的研究发现,有经期症状的女性和无经期症状的女性之间生活质量得分差异,与有心绞痛、关节炎的患者和无心绞痛、关节炎的患者之间差异相似[32],说明对于某些妇女来说,痛经对日常生活的影响与其他主要疾病相当。这提示临床医师应重视痛经患者的生活质量。
痛经的机制尚未完全明确。吴珂[33]的研究显示,原发性痛经患者CA125水平也会相应升高,降低CA125水平可在一定程度上反映药物对原发性痛经的治疗效果。炎症因子IL-6的主要作用是使子宫平滑肌收缩,体内IL-6水平持续增高易引起痛经[34-35]。本研究发现,地屈孕酮和桂枝茯苓胶囊分别治疗痛经,治疗前与治疗3个月经周期后比较,患者CA125、IL-6水平无明显变化。Kitawaki等[13]研究显示,地屈孕酮可降低VAS评分,但治疗后患者CA125水平与治疗前无明显差异。这提示地屈孕酮治疗痛经的机制是否与CA125、IL-6相关,需谨慎解释。
本研究还发现,地屈孕酮治疗痛经的同时,可诱导规律的月经周期及经期,减少经量,使月经趋于正常,与Taniguchi等[23]的研究结论一致。这提示对月经异常的痛经患者,地屈孕酮可有双重获益。
本研究中,地屈孕酮药物不良事件发生率为32.69%,不良反应发生率为28.85%,最常见不良反应为乳房胀痛,其次为不规则出血。国外1项针对地屈孕酮治疗痛经患者的开放性临床研究表明,药物不良事件和不良反应的发生率分别为40.9%、31.8%,最常见的不良反应为子宫异常出血(9.5%)[23]。另一项关于地屈孕酮治疗卵巢子宫内膜异位囊肿的研究表明,药物不良事件和不良反应的发生率分别为13.6%和11.9%,最常见的不良反应为子宫异常出血(5.1%)[13] 。以上研究与本研究结果存在差异,可能原因为各个研究不良事件记录方法不一致,但均得出一致结果,即未发现患者体质量增加,未发生血栓等严重药物不良事件或不良反应,说明地屈孕酮耐受性好。
本研究的局限性为:采用开放标签而非盲法设计,药物干预后VAS评分可能因患者得知服用药物类型而产生偏差;评估近期疗效,缺乏远期疗效及复发率的评估,缺乏针对分子机制的研究,对药物作用机制的解释存在局限性。未来将采用单盲设计,设置专人进行疗效评价,对疗效评价者设盲;进一步对痛经患者进行年龄分层,评估地屈孕酮对青少年痛经的有效性及安全性;进一步增加样本量,延长随访时间,评估地屈孕酮治疗痛经患者的远期疗效,评估药物对患者代谢及对育龄期女性排卵的影响等,同时开展动物模型及细胞实验进行相关机制的研究。
综上所述,地屈孕酮可改善患者VAS评分,缓解痛经伴随症状,缩短症状持续时间,提高整体生活质量,治疗效果优于桂枝茯苓胶囊;地屈孕酮治疗痛经的同时,可规律月经周期,缩短经期,减少经量,此为额外获益;地屈孕酮最常见的不良反应为乳房胀痛,但随时间延长逐渐缓解,且不影响患者体质量,未引起血栓等严重药物不良事件或不良反应。
参考文献
[ 1 ] 张巧利,马骁,邓燕,等. 2018美国妇产科医师学会委员会意见:青少年痛经和子宫内膜异位症(No.760)的解读[J].中华生殖与避孕杂志,2020,40(2):170-175.
[ 2 ] 孙艳明,王玲,李戈. 1 800名女大学生痛经影响因素调查分析[J].天津中医药,2009,26(5):367-369.
[ 3 ] HU Z,TANG L,CHEN L,et al. Prevalence and risk fac- tors associated with primary dysmenorrhea among Chinese female university students:a cross-sectional study[J]. J Pediatr Adolesc Gynecol,2020,33(1):15-22.
[ 4 ] BARCIKOWSKA Z,RAJKOWSKA-LABON E,GRZYBOWSKA M E,et al. Inflammatory markers in dysmenorrhea and therapeutic options[J]. Int J Environ Res Public Health,2020,17(4):E1191.
[ 5 ] IACOVIDES S,AVIDON I,BAKER F C. What we know about primary dysmenorrhea today:a critical review[J]. Hum Reprod Update,2015,21(6):762-778.
[ 6 ] 郎景和,崔恒,戴毅,等. 2015年子宮内膜异位症的诊治指南专家解读[J].中华妇产科杂志,2017,52(12):857- 861.
[ 7 ] MARJORIBANKS J,AYELEKE R O,FARQUHAR C,et al. Nonsteroidal anti-inflammatory drugs for dysmenor- rhoea[J]. Cochrane Database Syst Rev,2015(7):CD001751.
[ 8 ] 彭超,周应芳.药物治疗在子宫内膜异位症长期管理中的应用和选择[J].中国实用妇科与产科杂志,2021,37(3):303-308.
[ 9 ] 仰少君,支云清.地屈孕酮治疗痛经的临床效果观察[J]. 临床药物治疗杂志,2017,15(5):39-42.
[10] 曲灵菊,王艳香.地屈孕酮与布洛芬对原发性痛经的治疗效果观察[J].中国继续医学教育,2016,8(7):169-170.
[11] 王亚平,邓珊,王阳,等.性激素类药物在妇科内分泌疾病中的临床应用推荐:孕激素篇[J/OL].实用妇科内分泌电子杂志,2015,2(1):1-7[2021-07-15]. https://d.wanfangdata.com.cn/periodical/syfknfm-e201501001. DOI:10. 16484/j.cnki.issn2095-8803.2015.01.001.
[12] OSUGA Y,HAYASHI K,KANDA S. Evaluation of the efficacy,safety,and clinically recommended dose of dieno- gest in the treatment of primary dysmenorrhea:a rando- mized,double-blind,multicenter,placebo-controlled study [J]. Fertil Steril,2020,113(1):167-175.
[13] KITAWAKI J,KOGA K,KANZO T,et al. An assessment of the efficacy and safety of dydrogesterone in women with ovarian endometrioma:an open-label multicenter clinical study[J]. Reprod Med Biol,2021,20(3):345- 351.
[14] 万丽,赵晴,陈军,等.疼痛评估量表应用的中国专家共识:2020版[J].中华疼痛学杂志,2020,16(3):177-187.
[15] ALFONSIN M M,CHAPON R,DE SOUZA C A B,et al. Correlations among algometry,the visual analogue scale,and the numeric rating scale to assess chronic pelvic pain in women[J]. Eur J Obstet Gynecol Reprod Biol X,2019,3:100037.
[16] 黄丽红,王陵,言方荣,等.新视角解读临床试验中的意向性原则[J].中国临床药理学与治疗学,2021,26(4):449- 453.
[17] HERN?N M A,ROBINS J M. Per-protocol analyses of pragmatic trials[J]. N Engl J Med,2017,377(14):1391- 1398.
[18] COX D J,MEYER R G. Behavioral treatment parameters with primary dysmenorrhea[J]. J Behav Med,1978,1(3):297-310.
[19] 马玉侠,马海洋,陈少宗,等.中文版COX痛经症状量表的信效度检验[J].山东中医药大学学报,2015,39(1):5-7.
[20] LINS L,CARVALHO F M. SF-36 total score as a single measure of health-related quality of life:scoping review
[J]. SAGE Open Med,2016,4:1-12.
[21] STULL D E,WASIAK R,KREIF N,et al. Validation of the SF-36 in patients with endometriosis[J]. Qual Life Res,2014,23(1):103-117.
[22] LEVY-ZAUBERMAN Y,POURCELOT A G,CAPMAS P,et al. Update on the management of abnormal uterine bleeding[J]. J Gynecol Obstet Hum Reprod,2017,46(8):613-622.
[23] TANIGUCHI F,OTA I,IBA Y,et al. The efficacy and safety of dydrogesterone for treatment of dysmenorrhea:an open-label multicenter clinical study[J]. J Obstet Gynaecol Res,2019,45(1):168-175.
[24] 蒲寶婵,姜国云,方玲.原发性痛经疼痛因子及其关联性研究[J].中华中医药学刊,2014,32(6):1368-1370.
[25] MESIANO S. Myometrial progesterone responsiveness[J]. Semin Reprod Med,2007,25(1):5-13.
[26] YASUDA K,SUMI G I,MURATA H,et al. The steroid hormone dydrogesterone inhibits myometrial contraction independently of the progesterone/progesterone receptor pathway[J]. Life Sci,2018,207:508-515.
[27] UYSAL G,AKKAYA H,CAGLI F,et al. A comparison of two different oral contraceptives in patients with severe primary dysmenorrhoea[J]. J Obstet Gynaecol,2018,38(6):828-832.
[28] SCHINDLER A E,CAMPAGNOLI C,DRUCKMANN R,et al. Classification and pharmacology of progestins[J]. Maturitas,2008,61(1/2):171-180.
[29] CROMER B A,STAGER M,BONNY A,et al. Depot medroxyprogesterone acetate,oral contraceptives and bone mineral density in a cohort of adolescent girls[J]. J Adolesc Health,2004,35(6):434-441.
[30] 马玉侠,衣华强,孙玉国,等.痛经相关测评量表与评估方法研究进展[J].山东中医药大学学报,2009,33(4):347- 348.
[31] MOMOEDA M,AKIYAMA S,TANAKA K,et al. Quality of life in Japanese patients with dysmenorrhea treated with ethinylestradiol 20 μg/drospirenone 3 mg in a real- world setting:an observational study[J]. Int J Womens Health,2020,12:327-338.
[32] FOURNIER A,BERRINO F,CLAVEL-CHAPELON F. Unequal risks for breast cancer associated with different hormone replacement therapies:results from the E3N cohort study[J]. Breast Cancer Res Treat,2008,107(1):103-111.
[33] 吴珂.温针灸联合痛经宁颗粒治疗原发性痛经效果及對血清CA125及子宫动脉血流动力学的影响[J].光明中医,2021,36(13):2178-2180.
[34] 张卫平.艾芪汤治疗原发性痛经的疗效观察及对血清PGF2α、IL-6含量的影响[J].中国中医药科技,2021,28(1):63-64.
[35] VELASCO I,ACI?N P,CAMPOS A,et al. Interleukin-6 and other soluble factors in peritoneal fluid and endometrio- mas and their relation to pain and aromatase expression [J]. J Reprod Immunol,2010,84(2):199-205.
(来稿日期:2021-08-25 修回日期:2021-10-27)
(编辑:舒安琴)
基金项目:广东省基础与应用研究基金自然科学基金项目(No.2021A1515010763);广东省中医药局科研项目(重点项目)(No.20184005);广州市科学研究计划项目(No.2060404)
主治医师,硕士研究生。研究方向:妇产科学。电话:0755- 28747201。E-mail:122741314@qq.com
通信作者:主任医师,博士生导师,博士。研究方向:生殖内分泌学。电话:020-61118531。E-mail:lili-1406@163.com
