氟烷基化杂环化合物的合成研究进展
2022-02-19魏一飞童菁荟罗人仕廖建华
魏一飞,童菁荟,罗人仕,廖建华
(1.赣南医学院化学与药学实验室;2.赣南医学院2021级硕士研究生,江西 赣州 341000;3.韶关学院化学与土木工程学院,广东 韶关 512000;4.赣南医学院有机化学教研室,江西 赣州 341000)
氟烷基杂环是一类非常重要的杂环化合物,广泛应用于药物化学和临床治疗领域。含氟药物分子几乎涵盖了所有的疾病治疗领域,如消炎、镇静、抗肿瘤和抗病毒等领域[1]。例如用于治疗偏头痛的5-HT1D受体配体,用作DNA合成抑制剂的吉西他滨(Gemcitabine),可治疗麻痹的氟喹酮(afloquanone)和治疗纯合性家族性高胆固醇血症的洛美他派(Lomitapide)等(图1)。由此可见,含氟杂环化合物是众多药物及生物活性分子的重要结构部分。但在自然界中天然的含氟杂环化合物屈指可数,因此,研究氟烷基杂环化合物,特别是手性氟烷基杂环化合物的高效构建,不仅是有机化学的重要研究内容,也是推动有机化学发展的主要动力和平台。
目前,氟烷基杂环化合物的合成已取得了许多优秀的研究成果,其主要采取以下几种合成策略。
1 杂环参与的氟烷基杂环合成
该方法直接以杂环化合物作为底物参与反应,是一种最为直接的合成策略。在钯、铜、钌等过渡金属催化作用下,以富电子的杂环芳烃作为亲核试剂,如(苯并)呋喃、吲哚、噻吩等,通过直接碳-氢活化与氟试剂反应获得含氟杂环分子[2]。但该方法的化学选择性和区域选择性一般较差,需要预先制备特定的杂环分子,且部分杂环分子的制备条件较为繁琐,导致该策略步骤经济性差(图2)。
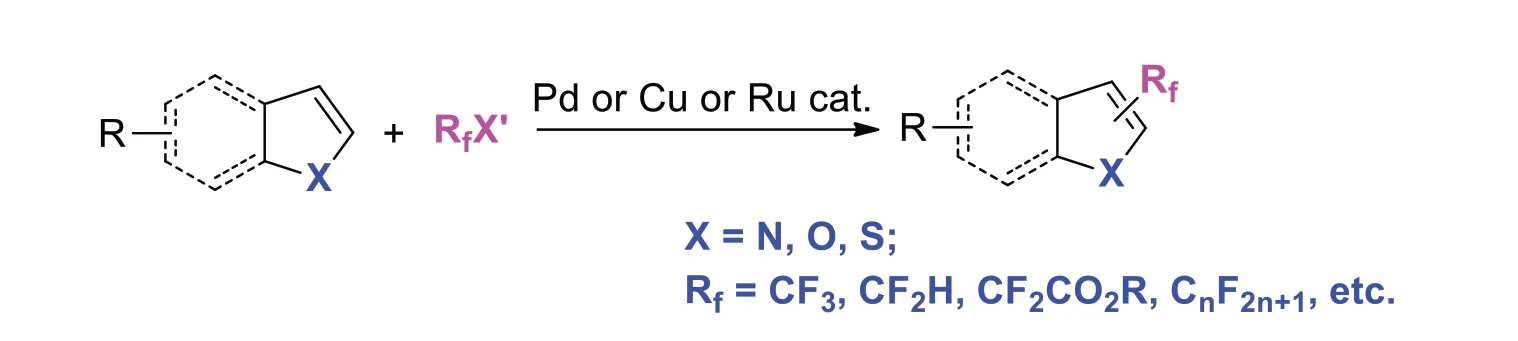
图2 常见含氟杂环的合成方法
2020年,WANG L等[3]开发了一种在室温下铁催化C-H/N-H环化来构建吡咯吲哚骨架的方法。该策略使用廉价且易得的原料,反应条件温和,为一锅快速合成各种不同官能的吡咯并[1,2-α]吲哚提供了一种绿色实用的方法。该方案的底物适应性强,对吲哚苯环不同位置上的各种烷基取代基,且产率可高达91%。但对于苯并吲哚的研究,仅得到了N-羟烷基化产物3(图3)。
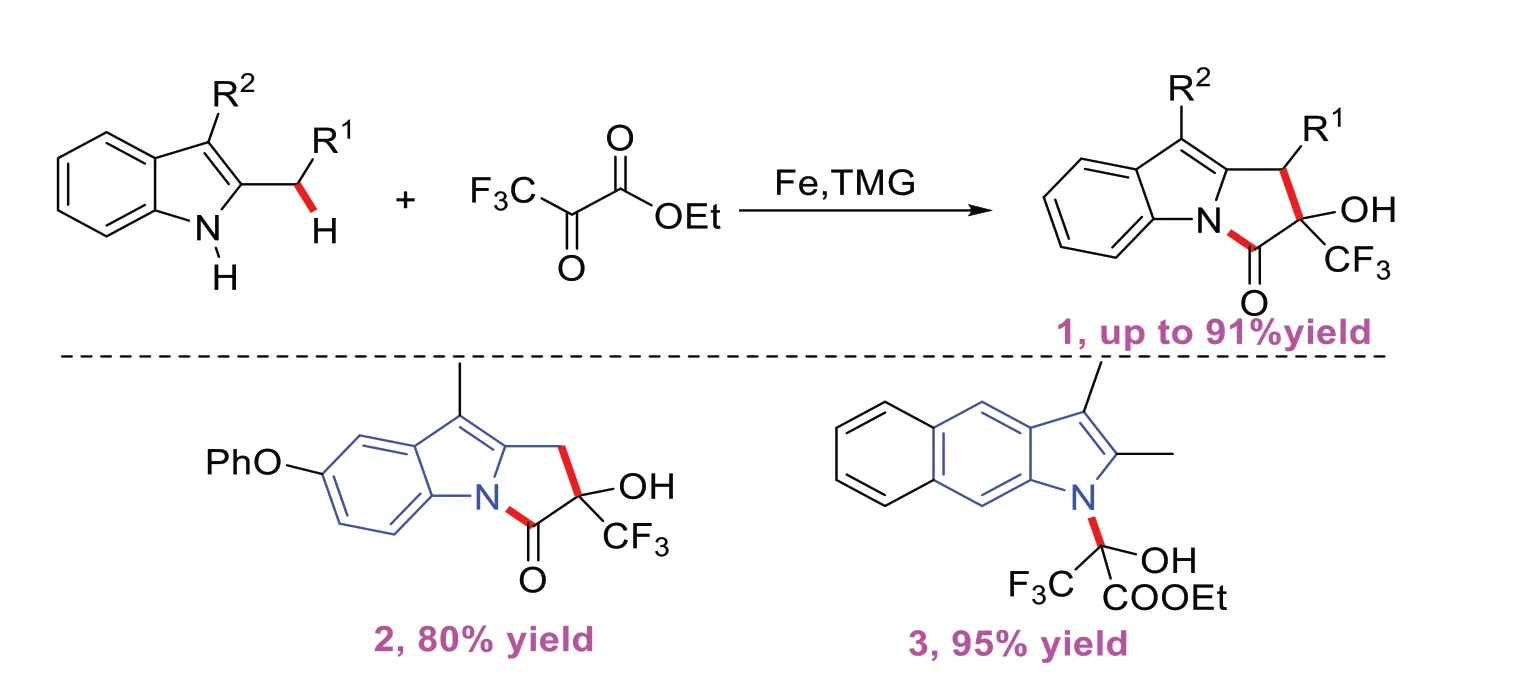
图3 铁催化的氟烷基串联环化反应
2021年,TANG L等[4]开发了一种用于烯烃与2-氨基-1,4-萘醌和全氟烷基碘化物的分子间全氟烷基-烯基化的光化学策略(图4)。其中,既作为底物又作为光敏剂的2-氨基-1,4-萘醌通过氧化还原过程激活全氟烷基碘化物来提供氟烷基自由基。该方法无需额外的过渡金属及光催化剂。该策略通过一系列的机理验证实验得出可能的机理如下:2-氨基-1,4-萘醌4在可见光下产生激发态6中间体,6再经过单电子转移过程将全氟烷基碘化物7活化成全氟烷基自由基,生成中间体A。全氟烷基自由基与烯烃加成得到碳烷基自由基B,自由基中间体A和自由基B通过偶联得到C,C在碱环境中去质子化转化成产物8。
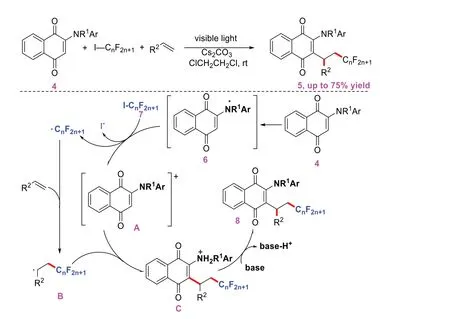
图4 氨基-1,4-萘醌与烯烃的全氟烷基化-烯基化反应
2021年,ZHANG X等[5]开发了一组稳定的氟烷基膦,将吡啶结构单元、药物样的片段和药物中的C-H键直接转化为氟烷基衍生物,无需预先官能团化(图5)。对于药物样中间体和先导化合物分子等结构来说,它们包含多个可能干扰C-P和C-C键形成过程的官能团,且通常没有用于交叉偶联反应的官能团或偏向于基于自由基氟烷基化反应的选择性位点,因此反应难度大。ZHANG X等[5]设计的氟烷基膦反应合成子能够耐受不同取代基的吡啶,并且在大多数情况下仅对4位具有选择性,为合成氟烷基杂环化合物开辟了新方法。
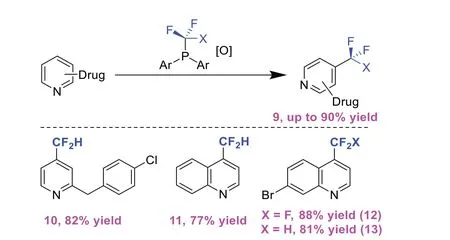
图5 磷介导的sp2-sp3偶联用于氮杂苯类的C-H氟烷基化
2022年,REN X X等[6]报道了一种由蓝光对烷基锆茂烯光解产生的Zr(Ⅲ)物种诱导SET途径促进的氟烷基化反应(图6)。该方案在没有催化剂的可见光照射下,实现了二氟烷基、三氟甲基、全氟烷基、一氟烷基和非氟化烷基卤化物的活化,并且,得到了一系列较高产率的氟烷基杂环化合物,为获取氟烷基杂环化合物提供了可控的通用方法(图7)。且反应通过一系列的控制实验发现烷基锆茂烯对于促进反应至关重要。
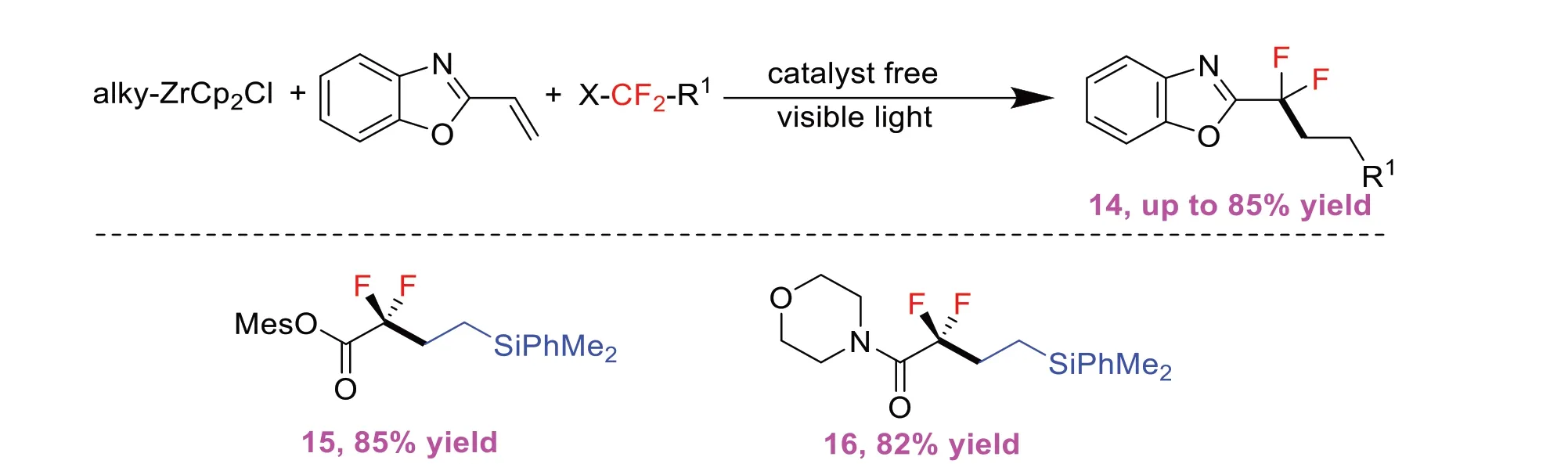
图6 烷基锆茂烯促进的氟烷基杂环合成
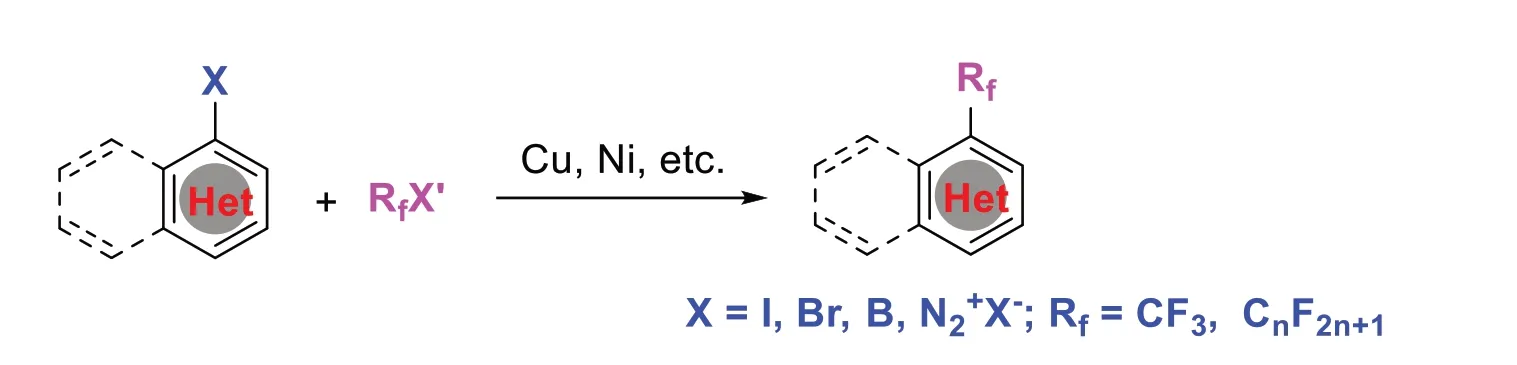
图7 常见含氟杂环的合成方法
2 卤代杂环合成氟烷基杂环
在过渡金属催化作用下,通过碳-氢活化、氧化加成、转金属化实现卤代杂环与氟试剂的交叉偶联反应[7-8]。在这过程中,卤代杂环化合物脱去卤原子后与氟化试剂通过交叉偶联反应得到含氟的杂环化合物。此策略无需预先制备亲核试剂,而是直接使用卤代杂环作为亲电试剂与氟化试剂交叉偶联反应而具有条件温和及原子经济性等特点。如2016年,NAGASE M等[8]首次发展了六元杂环化合物的C-4位碳-氢全氟烷基化反应。
2021年,MIN Y等[9]首次通过在对映选择性氟烷基化中利用还原性交叉耦合实现镍催化芳基碘化物的不对称三氟烷基化(图8)。这种新颖的方法具有高效、温和的条件和优异的官能团耐受性等特性,特别是对于含有多种药物和生物活性分子部分的底物同样有用。在研究过程中发现该催化体系对多种杂环能够良好地相容,如吲哚、吡啶和喹啉,且能达到良好至优秀的产率及光学纯度。该策略为手性含氟杂环化合物的合成提供了新思路。
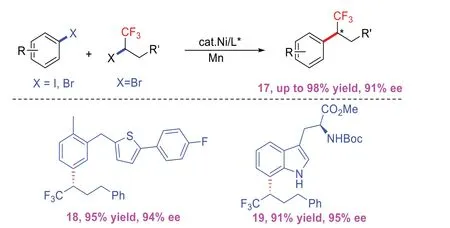
图8 镍催化芳基卤化物的不对称三氟烷基化
3 氟烷基取代杂环参与的交叉偶联反应
该策略需要对杂环化合物预先氟化官能团化,再与另一分子底物进行偶联反应[10]。该方法能准确合成目标产物,减少不良反应发生(图9)。
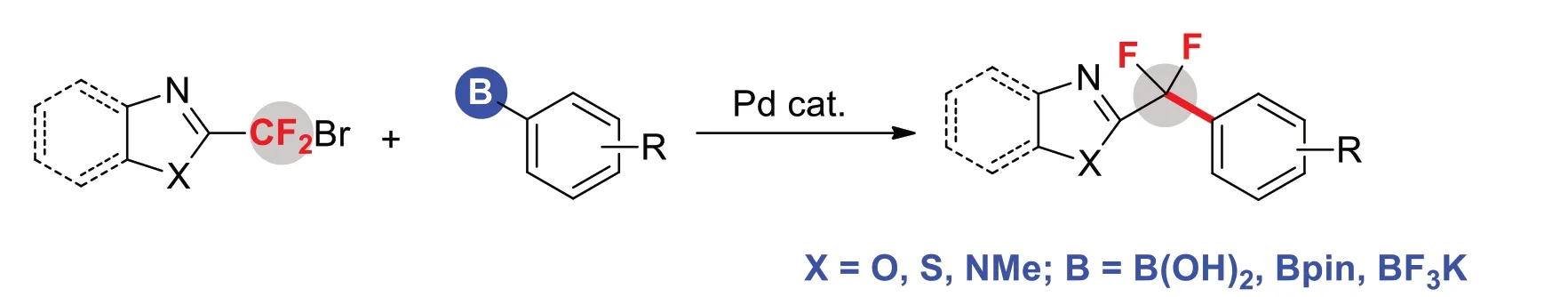
图9 常见含氟杂环的合成方法
2020年,ZHANG P B等[10]建立了一种通过钯催化1,6-烯炔与二氟碘乙酸乙酯和芳基硼酸的芳基二氟烷基化反应来合成二氟烷基化的苯并呋喃,苯并噻吩和吲哚衍生物的方法(图10)。该方案的特点是反应效率高、条件温和、底物范围广,以及官能团耐受性好。通过Fe(OTf)3催化异构化的过程,所得产物可以顺利地转化成含氟的苯并呋喃、苯并噻吩和吲哚。通过控制实验提出该方案可能的反应机理如下:首先,由Pd(Ⅱ)还原生成的Pd(0)与二氟碘乙酸乙酯反应生成Pd(Ⅰ)和二氟烷基自由基D,D攻击芳基硼酸中的碳碳双键形成烷基自由基中间体E,随后环化得到乙烯基自由基F,F或G与钯进一步氧化加成得到烯基钯中间体H,然后中间体H和芳基硼酸在碱的作用下通过金属转移过程生成Pd(Ⅱ)和芳基络合物I,最后I通过还原消除过程得到产物20。
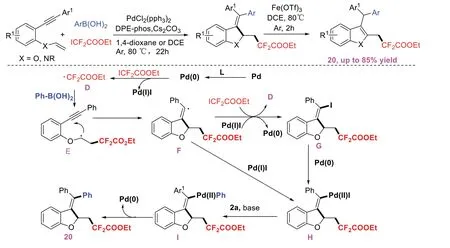
图10 钯催化1,6-烯炔和芳基硼酸的芳基二氟烷基化反应
4 烯烃参与的串联环化构建氟烷基杂环
烯烃是一类构建各种复杂分子的常见化学原料,价廉易得。直接以具有碳亲核基团的烯烃作为底物,与各类氟化试剂通过串联环化反应构建含氟杂环化合物,具有简单、高效、步骤经济性和原子经济性等特点。
电化学氟烷基化反应避免了使用昂贵、危险和有害的试剂,是一种制备有机氟化合物的环境友好的方法。如2020年,LIN L等[11]开发了一种用于乙烯基叠氮化物的自由基氟烷基化的无过渡金属和无氧化剂的电化学策略(图11)。该方法通过使用廉价且稳定的RfSO2Na(Rf=CF3,CF2H)作为氟化试剂,在温和的条件下进行反应,且根据原料的不同,可以获得电化学自由基环化和脱芳构化产物,为合成氟化氮杂环提供了一种绿色安全的方法,无需催化剂和氧化剂来合成含氟杂环化合物也是该方法的一大亮点。
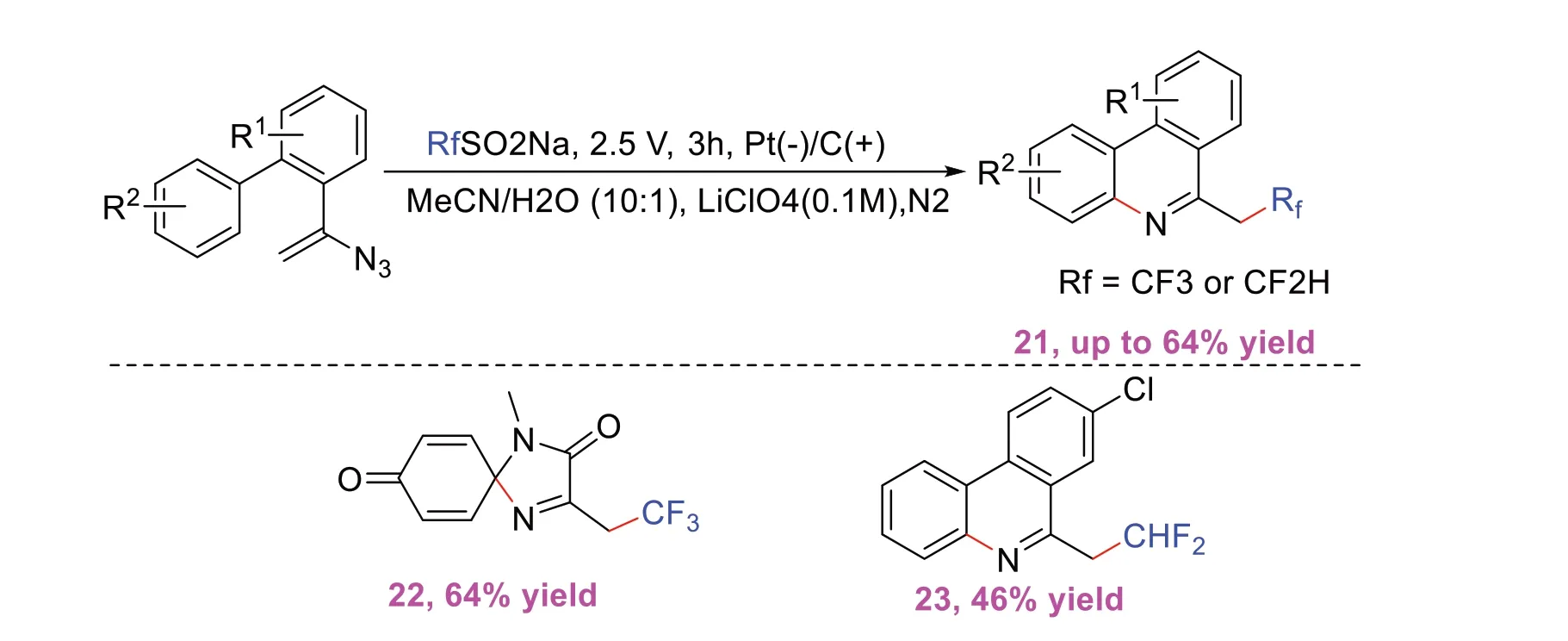
图11 自由基氟烷基串联环化的电化学策略
同年,WORP B等[12]实现了可见光诱导腙的氟烷基化反应(图12)。反应使用4-全氟吡啶硫化物作为氟烷基源,根据起始底物的结构和反应条件不同,该反应过程可以分别以中性和还原模式进行,得到氟烷基化的腙或肼。该策略的中性方案对腙和富电子及缺电子芳环都具有广泛的底物耐受性,且产物产率可高达91%;而在还原方案中,抗坏血酸被用作末端还原剂,可用于回收光催化剂。
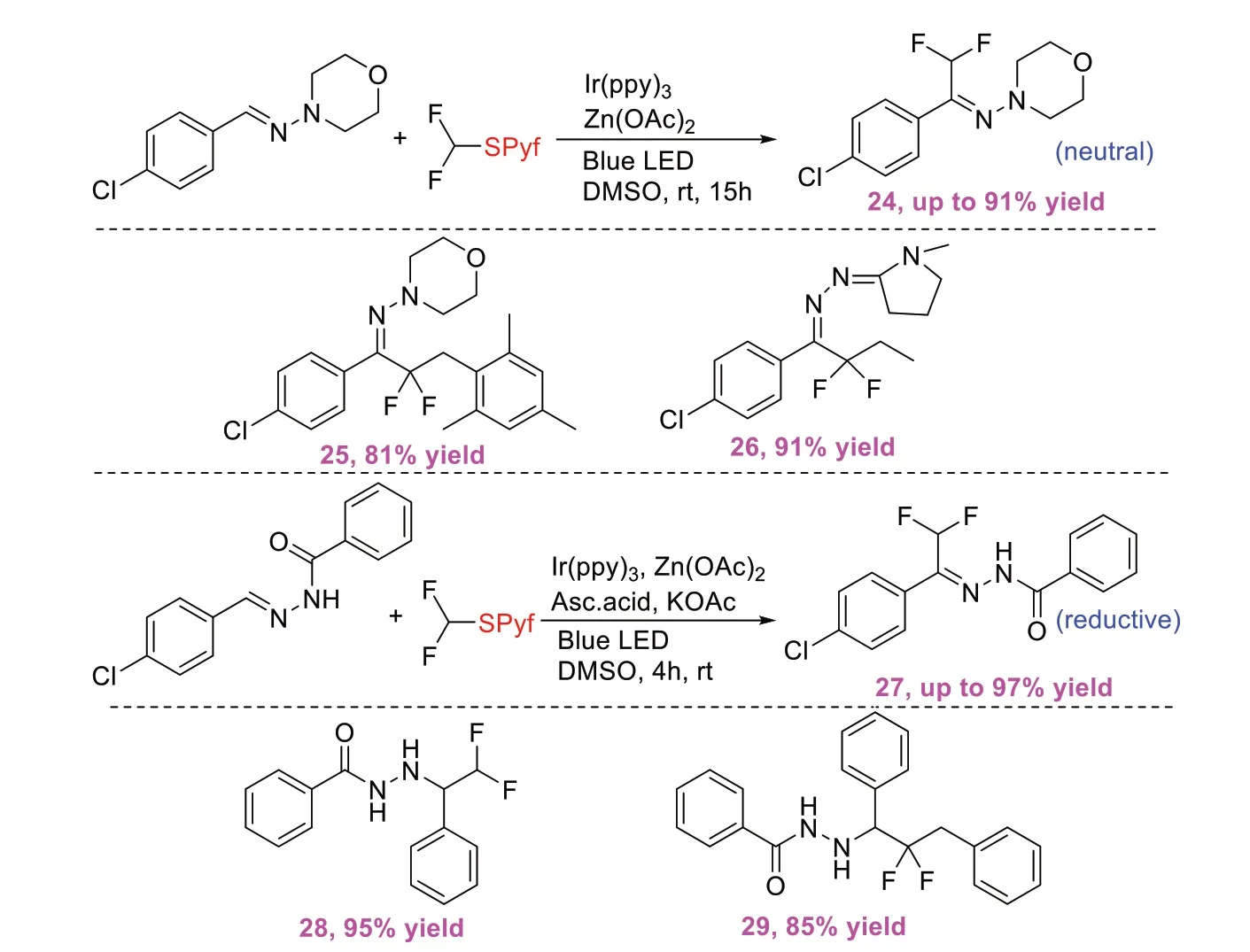
图12 可见光诱导腙的氟烷基化反应
喹唑啉酮是许多药物和具有生物活性的天然产物中的关键核心骨架,而含氟官能团可以显著提高分子母体的构象稳定性、亲脂性和生物活性,因此,研究合成氟烷基化喹唑啉酮具有重要临床意义。2021年,ZHANG P B等[13]开发出一种新型的光诱导催化的氟代烷基化/环化反应,该反应使用非活化烯烃与各种卤代氟烷基试剂进行自由基氟烷基串联环化反应(图13)。该策略具有反应条件温和、无需添加剂以及底物范围广等优点。此外,该方法对官能团具有广泛的耐受性,且操作简单,使其可用于合成含氟环稠喹唑啉酮。
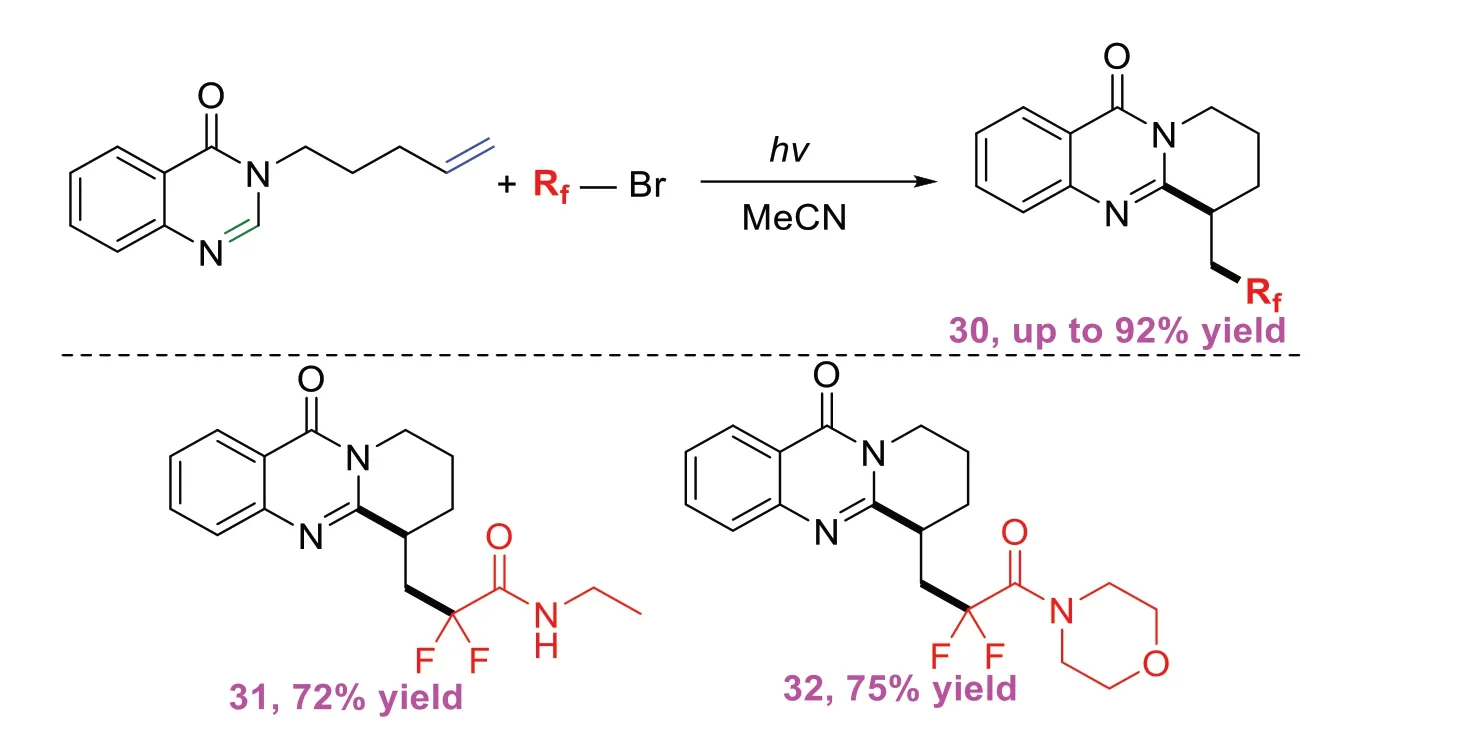
图13 喹唑啉酮与卤代二氟试剂的自由基串联环化反应
2021年,YANG J等[14]开发了2-乙烯基氧基芳基炔烃与二氟碘乙酸乙酯和二芳基膦氧化物的Pd催化二氟烷基化/环化/膦基化(图14)。该反应可一步构建Csp3-CF2,Csp3-Csp2和Csp2-P(O)键,为在温和条件下具有完全立体选择性的含二氟烷基四取代烯基膦氧化物提供了直接途径。其课题组还对该方案做了一个合成应用,即通过使用HSiCl3作为还原剂还原氧化膦产物33,可产生相应的膦36,且产率可达75%,这为丰富膦配体的结构多样性提供了可能。
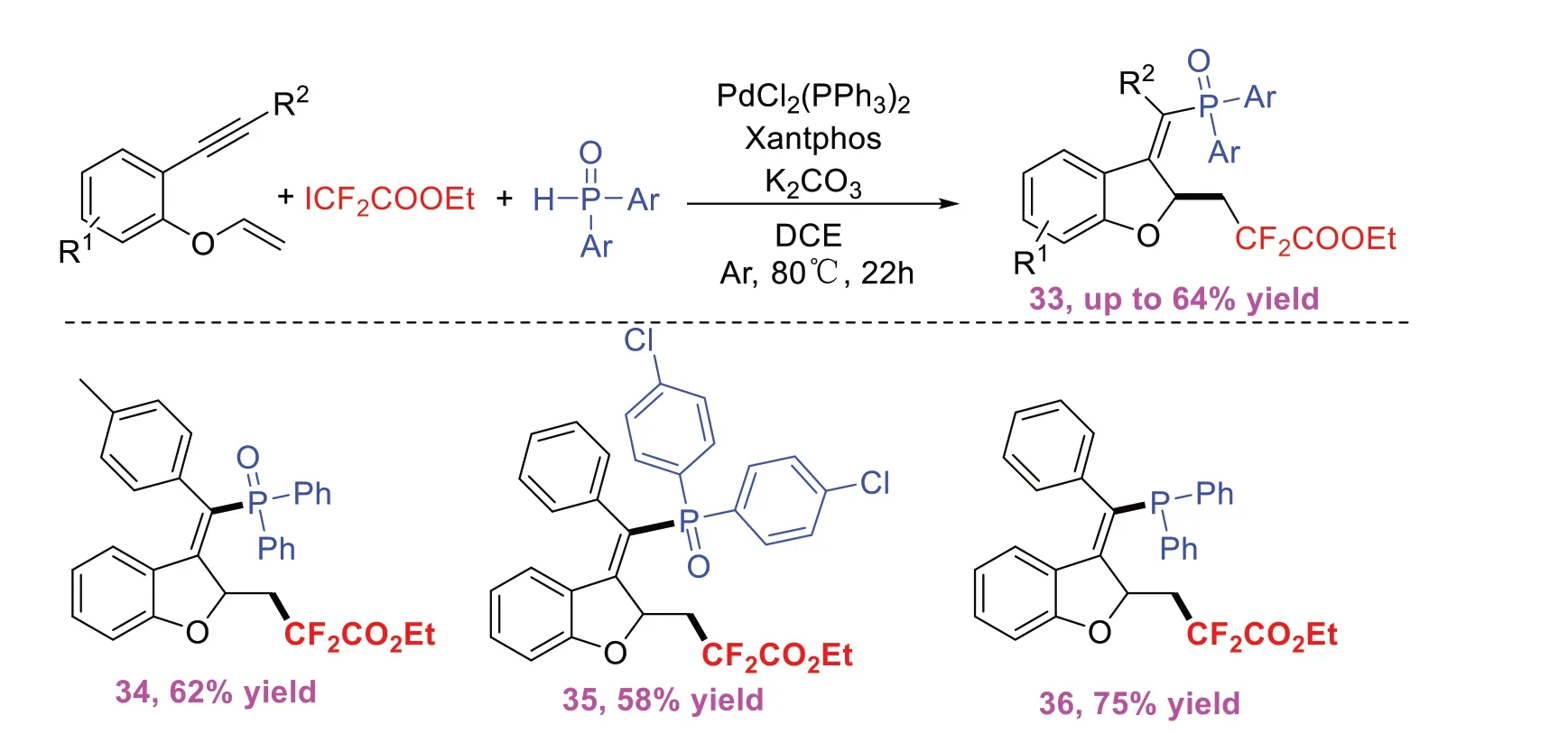
图14 钯催化烯炔参与的自由基串联环化反应
2021年,CHENG J等[15]报道了一种钯催化非活化烯烃与多种官能化的二氟甲基和全氟烷基卤化物的自由基串联环化反应构建多种氟烷基化吡咯并[1,2]吲哚衍生物(图15)。反应具有高区域选择性和广泛的底物耐受性。该反应通过一系列的控制实验提出了一个可能的反应机理是:首先,氟烷基卤化物在Pd(0)Ln的作用下发生单电子转移产生全氟烷基自由基中间体,随后亲电子全氟烷基自由基攻击37的C=C双键得到碳烷基自由基中间体J,J与吲哚环的双键进行串联环化形成自由基中间体K,K再与Pd(Ⅰ)相互作用生成中间体M后在碱的作用下通过还原消除生成产物39,并再生成Pd(0)催化剂。然而,另一种可能的反应过程是在Pd(Ⅰ)的作用下苄基自由基K通过SET氧化也可产生碳正离子中间体L,最后再去质子化生成产物39。
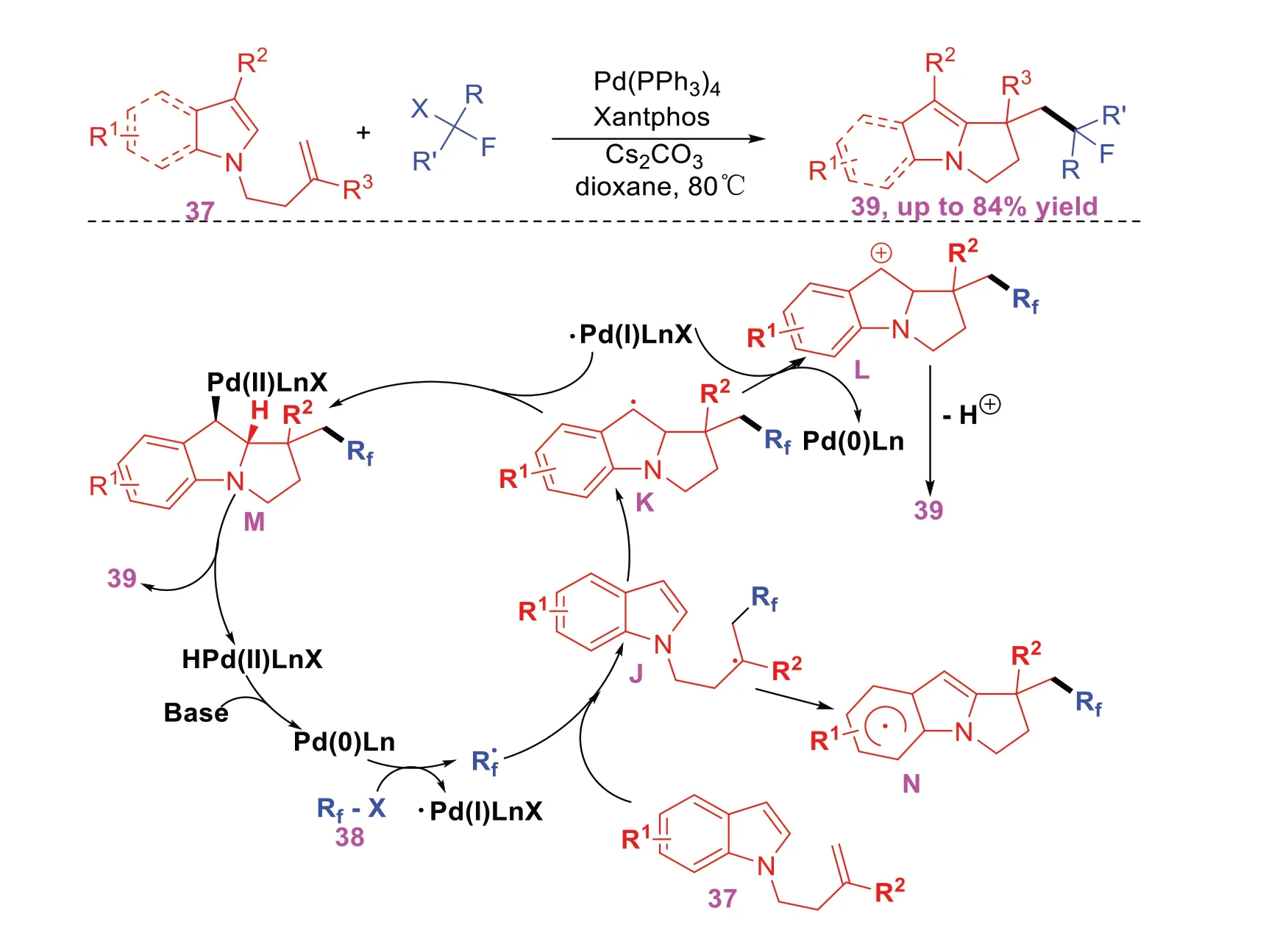
图15 钯催化非活化烯烃的自由基串联环化反应
2022年,YANG Z Q等[16]报道了一种通过四羟基二硼和氯化镍共催化非活化烯烃与氟烷基试剂的串联环化反应构建含氟氮杂环的方法(图16)。该方法具有广泛的底物范围及超短的反应时间等特性,为合成含氟多元杂环提供了新方法。对该方法的机理探索证明B2(OH)4/NiCl2的催化体系作为有机转化中简单有效的催化剂具有很大的潜力。
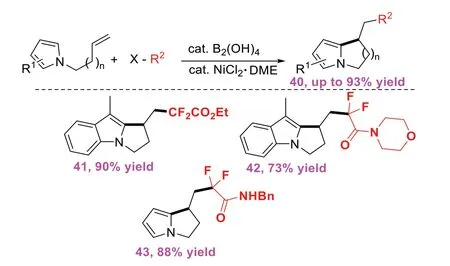
图16 四羟基二硼和氯化镍共催化非活化烯烃参与的自由基串联环化反应
综上所述,这些合成策略中的电化学以及光催化等方法具有条件温和、绿色环保的优点,对如何更加高效、低毒以及环境友好地构建含氟杂环化合物具有积极意义。上述合成策略中通过自由基氟烷基串联环化反应来构建含氟杂环化合物的方法也是目前研究的热点之一,其具有良好的化学选择性、区域选择性及原子经济性。尽管氟烷基取代杂环化合物的合成已经取得了不错的研究成果,但报道的反应底物类型并不丰富,或多为富电子的杂芳烃;或需要对杂环底物进行预先官能团化化;或需要预先引入含氟基团,且已获得的多为非手性氟烷基取代杂环化合物。因此,如何简单、高效和高原子经济性合成氟烷基取代杂环手性化合物仍是未来具有挑战性的研究。
