血清甘胆酸、甲胎蛋白联合乙型肝炎病毒前C区/BCP区突变检测在肝细胞肝癌中的临床价值
2022-02-19王晓玲钟田雨
赖 蜜,胡 蝶,王晓玲,钟田雨
(赣南医学院第一附属医院检验科,江西 赣州 341000)
肝细胞肝癌(Hepatocellular carcinoma,HCC)是我国常见恶性肿瘤之一,也是第三大癌症死亡原因[1]。HCC的高致死率与HCC的高恶性程度和发病隐匿有关,大部分患者确诊时已为晚期,错过了最佳治疗时机。目前,HCC的诊断依赖于血清学检查、影像学检查和病理学检查,但都无法对早期HCC进行诊断。甲胎蛋白(α-fetoprotein,AFP)是一种针对肝癌的肿瘤标记物,临床上被广泛用于肝癌的辅助诊断和术后复发的监测[2]。但是AFP的检测也被证明缺乏灵敏性和特异性,多达40%的HCC患者血清AFP处于正常水平,尤其多见于早期HCC患者[3]。然而在一些慢性乙型肝炎和肝硬化患者上又见显著升高[4-5]。肝脏作为人体重要的代谢器官,组织代谢组学方法是研究肝癌代谢异常的重要手段。甘胆酸是胆酸与甘氨酸结合形成的一种结合型胆酸,甘胆酸作为肝脏代谢产物,其水平可以动态反映肝脏损伤过程。相比较谷丙转氨酶、谷草转氨酶等常规肝功能检测指标,甘胆酸更敏感且能对早期肝炎、肝硬化进行疗效评估和早期诊断[6]。一项百人的队列研究表明,HCC患者血清甘胆酸水平显著高于健康人群[7]。因此,甘胆酸在监测和诊断HCC方面具有潜在价值。
据估计,全球约有47%肝细胞癌病例发生在中国,其中>70%的HCC患者为乙肝相关性HCC[8-9]。乙型肝炎病毒(Hepatitis B virus,HBV)DNA的变异被认为是HCC的危险因素。由于HBV逆转录酶缺乏校对功能,HBV DNA容易出现突变,且突变率是其他DNA病毒的10倍[10-11]。其中与HCC相关的BCP区(Basal core promoter,BCP)和前C区(Precore,C)的突变最为常见。HBV BCP区主要突变包括A1762T/G1764A。研究表明,这种双突变可提高HBV的复制率[12]。多项队列研究表明,BCP双突变与HCC进展具有紧密相关性[13-14]。伴随BCP区双突变的乙肝携带者在术后也更容易发生转移[15]。HBV前C区常见G1896A突变,其突变也与HBV的复制程度相关[16]。前C区突变多见于慢性乙肝患者,其突变造成终止密码子形成,影响HBeAg的表达并引起HBV免疫逃逸[17]。这对疾病判断和疾病干预带来严峻挑战。因此,准确判断HBV是否突变及突变类型对肝癌诊断、治疗和预后具有重要意义。
目前,已有大量关于单独甘胆酸、AFP和乙型肝炎病毒前C区/BCP区突变在HCC诊断中的意义的研究。但很少有关于三者潜在联系在HCC诊断的报道。本研究收集了200例肝癌患者,包括100例乙肝肝癌患者和100例非乙肝肝癌患者。通过对血清甘胆酸、AFP和乙型肝炎病毒前C区/BCP区突变的联合检测,探讨甘胆酸、AFP和乙型肝炎病毒前C区/BCP区突变在HCC之间的关联,以及三者联合检测在HCC临床诊断中的价值。
1 材料和方法
1.1 研究对象 选取2020年12月—2022年2月在本院就诊的HCC患者血清200例,其中100例肝细胞癌患者经化学发光法检测HBV病毒表面抗原阳性(HBsAg≥0.05 IU·mL-1),100例肝细胞癌患者HBV病毒表面抗原阴性(HBsAg<0.05 IU·mL-1)。将200例患者分为乙肝肝癌组和非乙肝肝癌组。
1.2 纳入和排除标准 纳入标准:HCC患者均经影像学和病理学诊断明确,符合《原发性肝癌的临床诊断与分期标准》[18]。患者及其家属对此次研究内容知情并签署知情同意书。
排除标准:(1)患者合并其他恶性肿瘤;(2)患者有严重凝血功能障碍。
1.3 仪器与试剂
1.3.1 仪器 迈瑞BS-820M生化仪、罗氏Elecsys e602全自动电化学发光仪,ABI2720PCR扩增仪。
1.3.2 试剂 甘胆酸试剂盒购于美康生物科技有限公司,AFP试剂盒购于罗氏制药有限公司,乙型肝炎病毒前C区/BCP区突变检测试剂购于达安基因有限公司。
1.4 检测方法
1.4.1 血清甘胆酸的检测 取入组患者外周血3~5 mL,收集于含分离胶的真空采血管中。接收样本后,放入离心机1 600 g离心10 min及时分离血清用于后续项目检测或-70 ℃保存待检。使用迈瑞BS-820M生化仪,在质控标准下按照说明书进行操作。检测方法为胶乳增强免疫比浊法,检测线性范围为0.5~80 mg·L-1。
1.4.2 血清AFP的检测 收集入组患者血清,使用罗氏Elecsys e602全自动电化学发光仪,在质控标准下按照说明书进行操作。检测方法为电化学发光法,检测范围0.5~1 000 ng·mL-1。
1.4.3 乙型肝炎病毒前C区/BCP区突变检测 按照说明书操作取入组患者血浆,加入引物在ABI2720中进行PCR扩增,按比例(HBV preC/BCP突变PCR反应液42 μL/人份+HBV preC/BCP突变酶系3 μL/人份)取相应量的PCR反应液及酶系,充分混匀后按45 μL/管分装至0.2 mL离心管中,然后分别取处理后样品、阳阴性质控品5 μL,加入到0.2 mL离心管中,6 000 rpm 瞬时(3 s)离心,将各反应管放入PCR仪。50 ℃→3 min;93 ℃→5 min;(93 ℃ 30 s→54 ℃ 45 s→72 ℃ 30 s)×45 个循环,最后72 ℃保温7 min后再进行杂交显色。杂交显色具体步骤如下:杂交液Ⅰ与杂交液Ⅱ预热至42 ℃,备用;杂交液Ⅰ(完全浸没膜条),备用;将PCR产物加入对应的杂交显色液离心管中,使得膜条在杂交过程中低速转动(100~150 转·min-1),杂交45 min;放入水浴水槽(42 ℃),100转·min-1,水浴5 min,弃杂交液Ⅱ。加入20 mL结合液,放置于20~30 ℃脱色摇床上摇摆(30~50 转·min-1),避光反应10 min。弃结合液,弃杂交液Ⅰ。再将50 mL离心管倒置于吸水纸上,吸干管底液体。加入相应量的显色液,避光反应5~10 min;当显色弱时,可适当延长显色时间。显色反应结束后,立即弃显色液,加入20 mL溶液Ⅱ,脱色摇床上摇摆2 min。弃溶液Ⅱ,加入20 mL去离子水,轻摇2~3 min取出。用吸水纸吸去膜条表面水分,尽快在扫描仪上扫描膜条[若不能立即进行扫描,请冻存于(-20±5) ℃]。参照达安膜条斑点识别分析系统操作说明书的要求,使用扫描仪扫描膜条,设定相应的参数并输出扫描结果,然后进行数据分析HBV前C区ntA1896(nt1896G-A)、ntA1899(nt1899G-A)突变,BCP区nt1762/A1764(nt1762AT、nt1764G-A)联合突变情况。
1.5 统计学方法 数据采用SPSS 22.0统计软件进行处理。计数资料以n(%)表示,计量资料以±s表示,组间比较采用独立样本t检验;P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 乙肝肝癌组共100例患者,化学发光法检测血清HBsAg均为阳性(HBsAg≥0.05 IU·mL-1),其中男性90例,女性10例,平均年龄(55.00±10.72)岁。非乙肝肝癌组100例患者,化学发光法检测血清HBsAg均为阴性(HBsAg<0.05 IU·mL-1),其中男性69例,女性31例,平均年龄(61.94±11.76)岁。
2.2 乙肝肝癌组和非乙肝肝癌组血清甘胆酸、AFP及HBV突变类型比较 非乙肝肝癌组与乙肝肝癌组的血清甘胆酸水平差异无统计学意义,乙肝肝癌组血清AFP水平显著高于非乙肝肝癌组(表1)。
乙肝肝癌组BCP区突变率为14%,前C区突变率为23%,其中部分病例存在BCP区和前C区的混合突变,突变率为10%。非乙肝肝癌组也可见1例前C区突变(见表1)和1例HBV DNA突变野生型,这是由于检测方法的局限性造成乙肝突变患者的漏检。

表1 两组患者血清甘胆酸、AFP比较
2.3 HCC患者HBV突变类型与血清甘胆酸、AFP的关系 为了探究HCC患者HBV前C区/BCP区基因突变与血清甘胆酸、AFP之间的潜在关系,我们对100例HBV阳性的HCC患者血清甘胆酸、AFP进行了分类比较。结果表明,HCC患者基因突变组血清AFP显著高于无基因突变组,差异有统计学意义(P=0.003 5),而血清甘胆酸在HCC患者基因突变组与无基因突变组的差异无统计学意义(P=0.528 5)(表2)。为了探究是哪一种突变造成血清AFP水平的改变,分别对BCP区突变和前C区突变分类统计,结果表明,AFP的差异仅在BCP区1762/1764位点有统计学意义(P=0.031 5),在前C区1896/1899位点差异无统计学意义(P=0.092 2)(表2)。
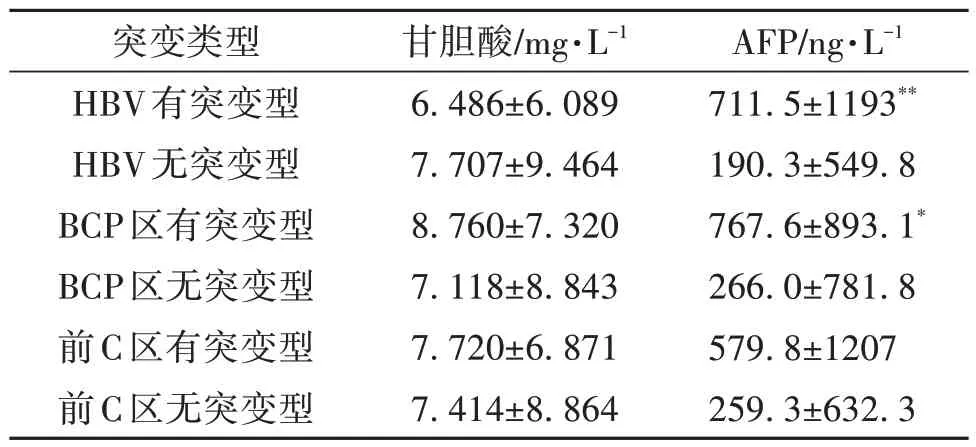
表2 HBV突变类型与血清甘胆酸、AFP的关系
3 讨 论
慢性乙肝病毒感染是个全球卫生问题,如果治疗不及时,将从肝炎进展到肝硬化甚至肝癌。研究发现,HBsAg阳性者的肝癌发生风险是HBsAg阴性者的12倍[19]。对HCC患者做到准确判断、及时治疗和有效监测是HCC治疗的一大难点和重点。
甘胆酸被广泛用于肝性疾病的诊断,血清甘胆酸水平的变化反映出肝损伤的动态过程,因此,甘胆酸在HCC诊断中具有潜在价值。遗憾的是,在本研究中,尚未发现甘胆酸在诊断HCC类型和HBV突变之间的相关性。AFP是一种对肝癌敏感的肿瘤标志物,在临床上被广泛用于肝癌的诊断及术后的检测,但AFP的升高不只见于肝癌患者。我们的结果表明,AFP与HCC类型具有潜在相关性,乙肝HCC患者AFP水平显著高于非乙肝HCC患者。在对乙肝HCC患者突变类型进行深入研究,我们发现,前C区突变比例明显高于BCP区突变比例。2012年一项关于西南地区HBV DNA突变的研究表示,在500多份HBV血清标志物阳性的血清中,BCP区突变率和前C区突变率分别为34.1%和39.7%,同期,河北正定县前C区突变为18.1%[20]。本研究样本的BCP区突变和前C区突变比例均低于西南地区水平,这不仅可能与地域、突变检测试剂盒的敏感性相关,还可能与HBV基因型有关,不同突变类型的比例在不同HBV类型中也有不同。其次,本研究发现HBV突变的HCC患者血清AFP水平更高,这种差异在BCP区突变组中有统计学意义。BCP区在结构上与HBVx基因有部分重叠,其A/T的突变使得HBVx基因结构更为稳定,这也是突变携带者更易恶化和HCC患者转移的重要因素。值得注意的是,BCP区突变可以增强HBV复制,高水平的血清AFP也反映出肿瘤细胞处于活跃期,两种检测手段是否可以联合应用于HCC的早期诊断还需要后续实验。其次,HBsAg是目前临床上被用来判断HBV感染的重要标志物,也是WHO公认的关键指标[21]。免疫学方法是目前临床常用HBsAg筛查的检测方法,具有高灵敏和高特异性。然而HBV基因的突变会影响HBsAg的表达或改变其抗原性,造成一定的漏检风险。一项研究发现,中国隐匿性乙肝患者HBsAg的亲水区突变率高达55.7%[22]。本研究数据表明,HBsAg阴性的乙肝携带者比例有2%之高。其次,HBV BCP区/前C区作为HBV的高突变区,对HCC进展具有密切关系,因此,临床上是否有必要加强对HBV突变类型的检测值得深入探究。
