印度洋深海沉积物可培养放线菌分离样品预处理条件的优化
2022-02-19张卫花
姜 钊,张卫花*
(1.藏药检测技术教育部工程研究中心,陕西 咸阳 712082;2.西藏民族大学 西藏高原相关疾病分子遗传机制与干预研究省级重点实验室,陕西 咸阳 712082)
复杂的海洋环境造就了海洋微生物的多样性。海洋微生物包括细菌域、古菌域、真菌域以及病毒等各个类群,估计物种超过2亿种,生物碳总量达到9 000万t[1],仅沉积环境原核微生物就达到1030个细胞[2]。与其极端环境相适应的生理特征和代谢机制,是生命起源与演化研究的重要基础。因此,海洋微生物的纯培养分离和功能探索十分迫切。
数据显示,被描述的海洋来源微生物物种只占全球全部已描述微生物的9.7%,增加速率每年仅为0.93%,在细菌域100多个门中,70多个处于未培养状态,大多数微生物还没有实现实验室的纯培养[3-4],而实验室的研究条件是这些微生物能否被培养的决定因素。自19世纪科赫(Koch)创立微生物纯培养技术以来[5],科学家们不断探索和设计纯培养的分离培养基,发现了一系列诸如真菌、乳酸菌、放线菌分离的选择培养基[6-8],然而,同一份环境样品中可培养微生物的多样性和出菌率不仅受分离培养基的影响,也与样品分离时的预处理方法息息相关[9]。SCHUT等[10]研究发现,将样品进行稀释后可使寡营养微生物不受少数优势类群竞争作用的干扰,从而使其被培养的可能性提高;新鲜湿样经过自然风干再稀释后,进行瞬时湿热处理,适合放线菌类群的分离培养[11];用不同的辐射方法处理样品悬液,能提高部分类群的培养率,如紫外线辐射能够有效地分离Nocardiopsis、Nocardia和Pseudonocardiaspp.[12];利用原位富集-扩散盒培养法及微囊包埋技术能较大程度地模拟微生物所处的自然环境,提高微生物可培养性[13-14];添加海盐可以模拟天然海水条件,适合海洋菌的分离[15];部分抑制剂的添加可以抑制某类微生物的生长,从而降低竞争生长[15]。随着分离方法的不断探索,实验中也将多种预处理方法结合使用,然而不同实验因素在实验中存在交互作用,很难找到每个因素的最佳实验水平。因此需进一步优化组合预处理方法,获得更好的分离效果。
Box-Behnken方法又称响应面法(Response Surface Method,RSM),是通过对实验结果进行二维及三维图形展示,利用响应面分析(Response Surface Analysis,RSA)确定最优实验参数,采用多元二次回归方程及方差分析拟合响应值与因素之间函数关系的一种多因素、多水平的优化方法[16],可利用图形分析、函数求导等手段来优化实验设计中的最佳条件。本文利用响应面优化的方法针对采自印度洋深海沉积物中的1个样品进行该样品纯培养放线菌分离条件优化,从而摸索出最佳的分离条件,以期达到最大程度分离出放线菌的目的,为后续大批样本纯培养放线菌的分离提供指导。
1 材料及培养基
1.1 样品来源
实验样品选自中国科学院南海海洋研究所印度洋调查航次(2013年)采集的12个海洋沉积物样品之一,样品采集后用无菌袋包装,于4℃冰库保存。根据采样深度,选取深度为中等深度、编号为17号的样品进行实验,该样品取样位置为(89°7′42″E,9°15′43″N),取样深度为3 437 m。
1.2 分离培养基
实验分离培养基选用改良ISP2培养基:酵母粉4 g、葡萄糖4 g、麦芽粉4 g、复合维生素1 m L(维生素B1、维生素B2、烟酸、维生素B、泛酸钙、肌醇、对氨基苯甲酸0.5 g、维生素H 0.25 g)、琼脂15 g,根据优化设计添加不同百分比的海盐及不同浓度的抑制剂,双蒸水定容至1 L,p H调至7.2,121℃灭菌30 min。菌株纯化培养基为TSA培养基,121℃灭菌30 min。
2 优化设计及菌株分离鉴定
2.1 菌株分离方法
样品分离采用经典的热处理方法[11]:①在无菌条件下取1 g样品,按优化设计时间放入无菌培养皿中风干;②将风干样品置于有10 m L 0.8%生理盐水的无菌试管中稀释至0.1 g/m L,在室温振荡器中以170 r/min的速度震荡1 h;③按照实验设计利用水浴锅进行湿热处理;④湿热处理后的样品梯度稀释至0.001 g/m L,吸取100μL样品稀释液涂布于含改良ISP2分离培养基的平板上(分离培养基中按照优化设计加入不同浓度的抑制剂和不同体积比海盐),每个实验组设置3个重复,涂布完成后,分离平板置于28℃培养箱中培养1个月;⑤培养完成后,将各实验组平板生长菌落进行划线分离,纯化培养并收集菌体。
2.2 菌株鉴定
利用酶解法提取各菌株基因组DNA[17],采用16S r RNA基因的通用引物[18]进行PCR扩增(PA:5′-CAGAGTTTGATCCTGGCT-3′;PB:5′-AGGAGGTGATCCAGCCGCA-3′),引物由生工生物工程(上海)股份有限公司合成。PCR扩增体系:10×Buffer(Mg2+2.5 mmol/L)5μL,正向引物PA(0.25μmol/L)1 μL,反向引物PB(0.25μmol/L)1μL,d NTP 1μL,DNA 1μL,Taq DNA聚合酶0.3 U,用dd H2O补至50 μL。PCR扩增反应条件:95℃预变性4 min;95℃变性1 min,55℃退火1 min,72℃延伸1 min,30个循环;72℃延伸10 min。PCR产物用0.8%琼脂糖凝胶进行电泳检测,用λ-Eco T14 Idigest DNA Marker作为对照,产物检测回收后送昆明泊尚生物有限公司进行双端测序。测序完成的16S r RNA序列利用序列拼接软件DNAstar[19]对正反向测序结果进行拼接,之后用原核微生物比对数据库EzBioCloud(http:∥eztaxon-e.ezbiocloud.net/)中的BLAST功能[20]进行16S rRNA序列相似性分析,确定分离菌株的细菌分类学位置,统计每组实验培养的不同微生物种类数(Operational Taxonomic Units,OTU)作为响应面优化的响应值,OTU以16S rRNA相似性98%为阈值[21],比对大于98%的菌株合并为1个种。
2.3 优化因素选择及优化设计
2.3.1 优化因素及水平选择
优化实验中主要选取热处理温度(A)、热处理时间(B)、抑制剂浓度倍数(C)、海盐添加量(D)和样品风干时间(E)五个因素,经前期单因素实验,每个因素筛选低、中、高三个水平设计后续实验。其中抑制剂1倍浓度组合为50 mg/L制霉菌素及25 mg/L萘啶酮酸,实验因素及水平设计见表1。
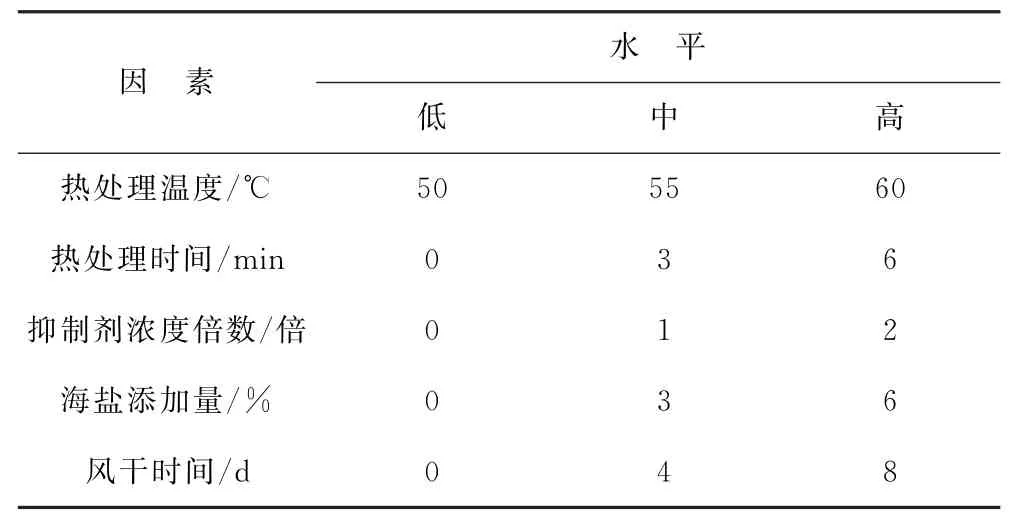
表1 Box-Behnken实验因素及水平Table 1 Factors and levels of Box-Behnken experiment
2.3.2 Box-Behnken实验设计
根据中心组合原理,基于选取的5因素3水平,利用Minitab 16软件设计Box-Behnken实验[22],根据每组实验5因素的不同水平搭配展开分菌实验,每组实验设置3个重复。分离平板于28℃培养箱培养1月后,利用划线分离法进行纯化,纯化菌株收取菌体后提取DNA,再进行16S r RNA基因测序鉴定。序列拼接结果经EzBioCloud数据库相似性比对分析后,计算每个平板的微生物种类数,最终以每组实验3个重复平板鉴定的微生物种类数(OTU)的平均值作为该组实验的响应值。
3 结 果
3.1 菌株分离结果
经纯化、测序分析后,本次优化实验共分离得到17个不同物种(species):其中14个种分布于放线菌门下的3个目、4个科,分别为迪茨氏菌科(Dietziaceae)3个种、微杆菌科(Microbacteriaceae)7个种、微球菌科(Micrococcaceae)1个种和诺卡氏菌科(Nocardiaceae)3个种;另外3个种分布于厚壁菌门,其中芽孢杆科(Bacillaceae)2个种、假单胞菌科(Pseudomonadaceae)1个种。同时,确定了每组优化实验最终培养出的放线菌种类数(表2),优化前利用ISP2培养基直接稀释涂布的方法几乎很难分离到放线菌,只能分离到芽孢杆菌、葡萄球菌、假单胞菌等少数细菌类群,而优化实验后共分离到17个物种,个别组可分离纯化到6种放线菌,优化效果明显。

表2 Box-Behnken实验结果Table 2 The results of Box-Behnken experiments

续表
3.2 二次回归拟合及方差分析
Box-Behnken实验结果经响应面优化分析,得出估计回归系数(表3)和方差分析(表4)结果,可以看出:一次项A和二次项A2、B2、C2、D2、E2均表现为极显著,交互作用BD表现为显著,说明各具体实验因素对响应值的影响不是简单的线性关系,并且处理时间和海盐添加量之间交互作用明显。方差分析显示(表4),失拟显著性参数P=0.240>0.05,说明失拟不显著,说明实验误差很数据中没有异常点,不需要引入更高次数的项,模型适当。

表3 菌株的估计回归系数Table 3 The estimated regression coefficients of bacteria strains

表4 方差分析及显著性检验结果Table 4 The analysis of variance and significance test
根据一次项、二次项和交互作用的显著性参数(P)用Minitab 16软件进行回归拟合后得到未编码回归方程:

编码回归方程为:

式中Y为OTU数。
3.3 响应面及RSA分析
为进一步确定各因素之间的交互作用,同时找到最佳实验条件,利用响应曲面图分析热处理温度、热处理时间、抑制剂浓度倍数、海盐添加量和样品风干时间5个因素对细菌分离OUT数的影响情况(图1)。由图1可见,每个三维图形成较好曲面,说明各因素对响应值的影响是非线性的,各因素拟合良好,交互作用明显,在曲面图中也能直观地了解到两两因素影响下的最佳响应值。
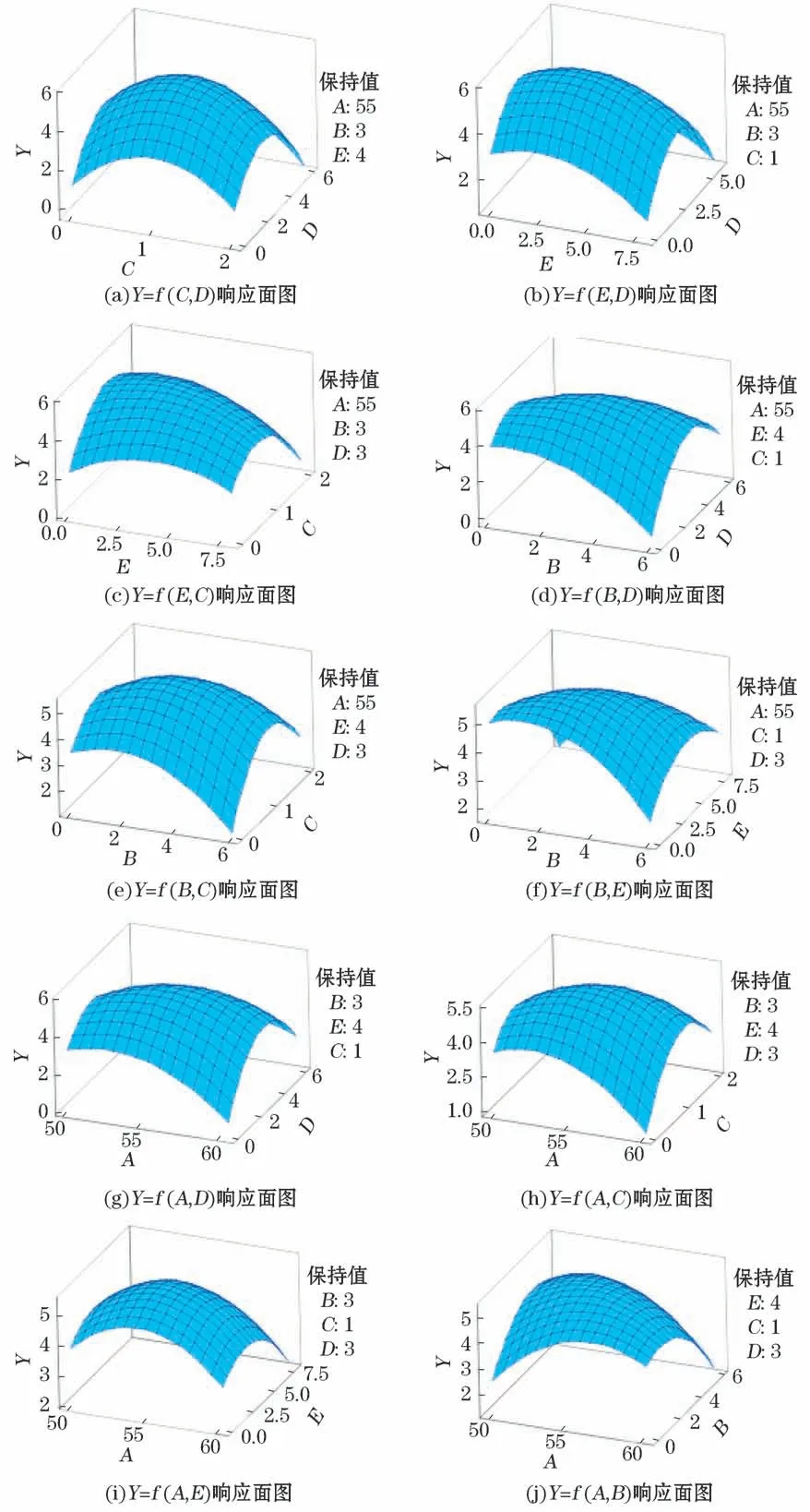
图1 响应面立体分析图Fig.1 Three-dimensional analysis of response surface
为进一步确定最佳实验条件,结合响应面图和回归方程,运用Minitab16软件中的RSA分析(响应优化图)模块拟合每个因素的最佳水平(图2)。可以看出每个因子(列)对响应或复合合意性的影响。优化的最终结果为:湿热处理温度55℃、湿热处理时间1.272 7 min、风干时间1.697 0 d、抑制剂浓度倍数0.969 7倍、海盐添加量为2.121 2%。在优化条件搭配下可以培养出的微生物种类数,即可培养最大菌种数为5.680 3。整体优化程度评估中,复合合意性(0.936 1)接近1,表明总体设置能够获得一个较好的响应结果。

图2 响应优化分析图Fig.2 Analysis of response conditions optimization
3.4 优化验证
为检测RSA法分析的可靠性,利用优化后的分离条件,分别选用4种分离培养基对该样品进行纯培养放线菌菌株分离。放线菌分离培养基:酪蛋白胨1 g、天冬酰胺0.1 g、丙酸钠4 g、K2HPO40.5 g、MgSO4·7 H2O 0.1 g、FeSO4·7 H2O 1 mg、甘油1 m L、琼脂15 g、双蒸水定容至1 L,p H调至7.2~7.4,121℃灭菌30 min;营养琼脂培养基:酪蛋白胨0.3 g、酵母提取物0.1 g、葡萄糖0.01 g、琼脂15 g、双蒸水定容至1 L,p H调至7.2~7.4,121℃灭菌30 min;海洋2216培养基:蛋白胨1 g、酵母提取物2 g、柠檬酸铁0.1 g、Na2CO30.16 g、硅酸钠4 mg、(NH4)NO31.6 mg、双蒸水定容至1 L,p H调至7.2,121℃灭菌30 min;R2A培养基:酵母提取物0.5 g、眎蛋白胨0.5 g、酪氨酸0.5 g、葡萄糖0.5 g、可溶性淀粉0.5 g、丙酮酸钠0.3 g、K2HPO40.3 g、MgSO4·7 H2O 0.05 g、双蒸水定容至1 L,p H调至7.2,121℃灭菌30 min。经分离纯化及测序鉴定,最终分离得到27个不同物种(表5)。分布于芽孢杆菌属(Bacillus)、迪茨氏菌属(Dietzia)、成对杆菌属(Dyadobacter)、赤杆菌属(Erythrobacter)、花蕾杆菌属(Gemmobacter)、两面神菌属(Janibacter)、小单孢菌属(Microbacterium)、微球菌属(Micrococcus)、诺卡氏菌属(Nocardiopsis)、根瘤菌属(Rhizobium)、红球菌属(Rhodococcus)、含鞘氨醇盒菌属(Sphingopyxis)、葡萄球菌属(Staphylococcus)、链霉菌属(Streptomyces)及刘志恒菌属(Zhihengliuella),其中16S r RNA相似性在98%以下可能的潜在新分类单元2个(表5)。相较于ISP2培养基,又新分离到成对杆菌属、赤杆菌属、花蕾杆菌属、两面神菌属、小单孢菌属、根瘤菌属等多个菌属,其中小单孢菌属,链霉菌属,含鞘氨醇盒菌属都为海洋优势放线菌类群。与张偲等[23]、Goodfellow和Fiedler[24]在海洋环境中发现的放线菌属类群相比,成对杆菌属、赤杆菌属、花蕾杆菌属、两面神菌属等在以前的海洋样品中均较少被发现,也间接反映了该实验优化方法的优越性,同时说明不同培养基的选择在纯培养分离中尤为重要。
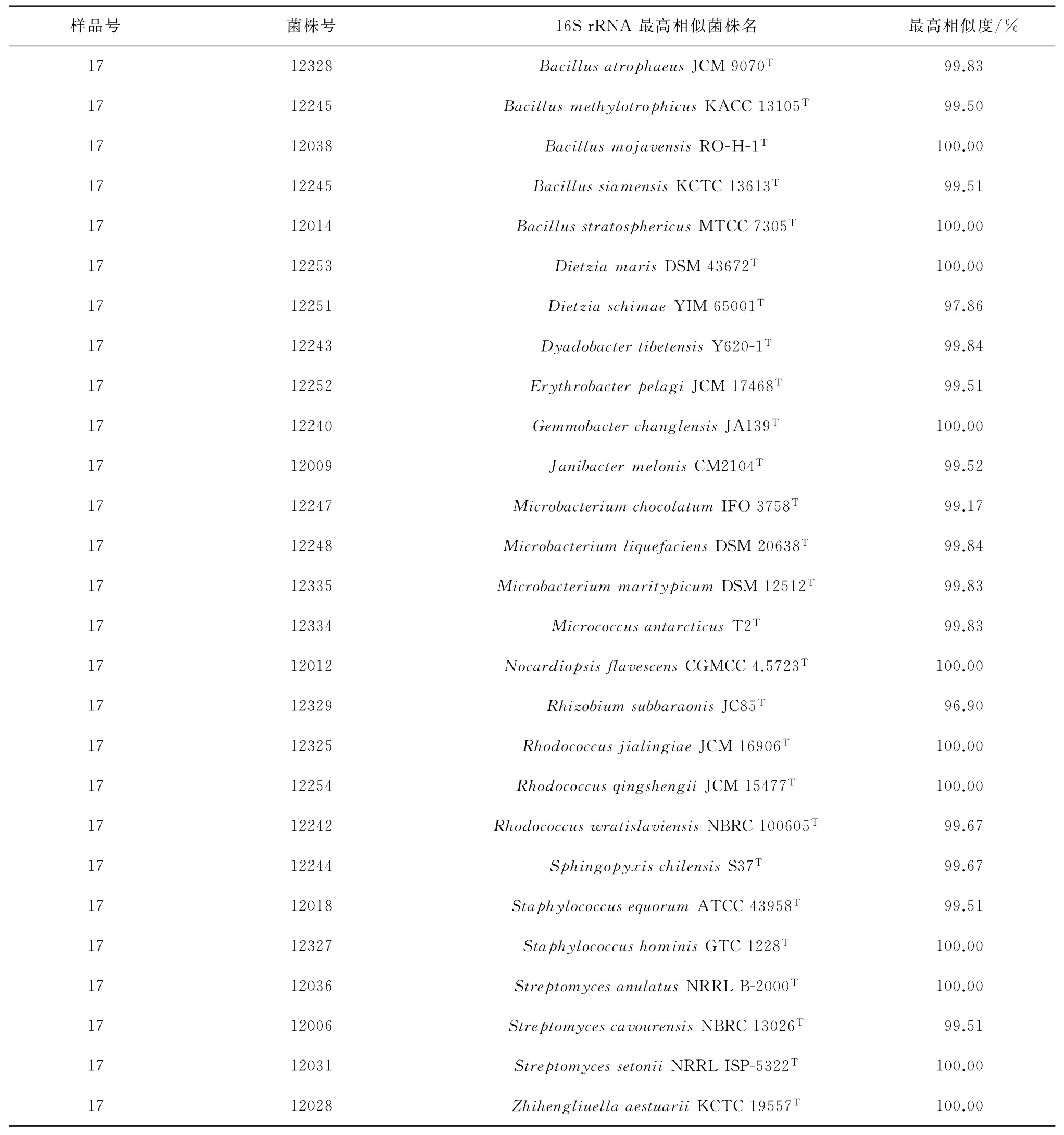
表5 27个细菌物种16S r RNA基因序列BLAST比对结果Table 5 BLAST results of 16S r RNA gene sequences of 27 bacterial species
4 结 语
深海极端环境原核微生物的纯培养一直以来都是个难题,其中放线菌的培养更艰难,分离的结果受到培养基以及预处理条件等多因素的影响。本文选取样品风干时间、湿热处理温度、湿热处理时间、培养基中抑制剂浓度倍数、培养基中海盐添加量五个因素,根据前期单因素实验每个因素各取低、中、高三个水平,利用Minitab软件中的Box-Behnken方法设计实验,并以每组实验分离的菌株数为该组实验的响应值。实验结果经过回归及方差分析,得到回归方程,之后利用响应曲面及RSA分析得到每个因素的最优水平:湿热处理温度55℃、湿热处理时间1.272 7 min、风干时间1.697 d、抑制剂浓度倍数0.969 7倍、海盐添加量为2.121 2%。最后,选取4种培养基进行菌种分离验证,最终得到27个不同物种,2个潜在新分类单元,在分离菌株中有链霉菌属,小单胞菌属等海洋优势菌群,还有部分前期未曾分到的稀有菌属,如成对杆菌属、赤杆菌属、花蕾杆菌属和两面神菌属等。实验证明,分离条件的优化有利于可培养微生物的多样性和出菌率的提高。该分菌条件的确定为本实验后续采自印度洋样点其他样品的可培养放线菌的多样性分析提供了保证,同时也为微生物纯培养预处理方法的优化奠定了一定的基础。
