地塞米松治疗重度新生儿急性呼吸窘迫综合征临床疗效研究
2022-02-19白瑞苗李清红李占魁郭金珍曾军安
白瑞苗,杨 冬,李清红,柯 华,李占魁,郭金珍,曾军安
(西北妇女儿童医院,陕西 西安 710061)
新生儿急性呼吸窘迫综合征(Neonate acute respiratory distress syndrome,NARDS)是由多种因素引起的一种严重威胁新生儿生命的呼吸危重症,其起病的临床损伤因素包括[1]:直接肺损伤因素、间接肺损伤因素。直接肺损伤因素:严重肺部感染,肺出血,呼吸机高压力高容量通气,低氧血症,氧中毒,胎粪、消化液、血性羊水吸人,呛奶,溺水,有毒气体吸人和肺部挫伤等;间接肺损伤因素:新生儿败血症,坏死性小肠结肠炎,窒息,寒冷损伤,脑损伤,低血压,输血、换血,体外循环,弥漫性血管内凝血,频繁呼吸暂停,心胸外科手术等。其主要临床表现为不同程度的低氧血症、双肺弥漫性透光度下降、严重肺水肿、炎性渗出伴肺顺应性下降[2]。国际多中心NARDS研究报告,NARDS总体病死率在20%左右[3]。国内重庆医科大学附属儿童医院单中心报道NARDS病死率为9.6%[4],NARDS蒙特勒标准(2017年版)[5]根据氧合指数(Oxygenation Index,OI)进行氧合障碍严重程度分度,OI≥16诊断为重度。NARDS病死主要发生在重度氧合障碍患者,治疗重度NARDS主要方法有高频震荡通气(High-frequency oscillatory ventilation,HFOV)、一氧化氮吸入(inhalation nitrogen oxygen ,iNO)、肺泡表面活性物质(PS)肺内滴入以及治疗原发病等;尹晓娟等[6]报道糖皮质激素(布地奈德)肺内滴入联合上述综合疗法治疗重度NARDS能够减少气漏及气道高反应的发生。因重度NARDS绝大部分合并肺水肿,刘斌等[7]报道全身应用糖皮质激素(地塞米松)治疗高原性肺水肿可明显加速肺水肿吸收时间,改善预后;2015版《新生儿机械通气常规》[8]建议对于有脱机困难的患儿可以短疗程使用地塞米松,我院自2018年起,使用地塞米松干预重度NARDS,现报告如下。
1 资料与方法
1.1 一般资料 回顾 2018 年 1 月至 2020 年12月于我院新生儿科病房住院的全部NARDS患儿的临床资料,依据NARDS蒙特勒标准(2017年版本)[5]诊断为 NARDS患儿列为观察对象,依据该标准分度为重度NARDS患者纳入研究。病例纳入标准:①明确或可疑临床损伤后出现了急性呼吸窘迫症状(呼吸急促、呼吸困难、呻吟)、低氧血症及肺残气量下降,需要呼吸机辅助呼吸以利于肺复张;②排除与NARDS 有不同的病理生理基础的原发性新生儿呼吸窘迫综合征、新生儿湿肺以及PS合成相关基因缺陷所致急性呼吸窘迫;③肺部影像学示双侧弥漫性不规则的透光度下降、渗出或白肺,这些改变不能被局部积液、肺不张、新生儿原发性呼吸窘迫综合征、新生儿湿肺等病因解释;④肺水肿引起的呼吸衰竭排除由心力衰竭引起;⑤OI≥16诊断为重度NARDS;⑥均在干预治疗前经床旁超声检查诊断为肺水肿,超声诊断肺水肿依据中国医师协会新生儿科医师分会超声专业委员会颁布的“新生儿肺脏疾病超声诊断指南”[9]。排除标准:中度以下NARDS患者(OI<16)、24 h内放弃治疗、有先天畸形及青紫型先天性心脏病者,肺脏超声排除肺水肿者,以及在干预前出现气胸、肺出血、多脏器功能障碍患者。所有入组患儿均接受了HFOV、PS肺内滴入及iNO联合治疗,同时积极治疗原发病,根据是否全身用地塞米松分为干预组(地塞米松治疗组)及对照组(非地塞米松治疗组)。两组患儿一般资料比较差异无统计学意义(均P>0.05),见表1。本研究经患儿父母签署知情同意书、西北妇女儿童医院伦理委员会批准。
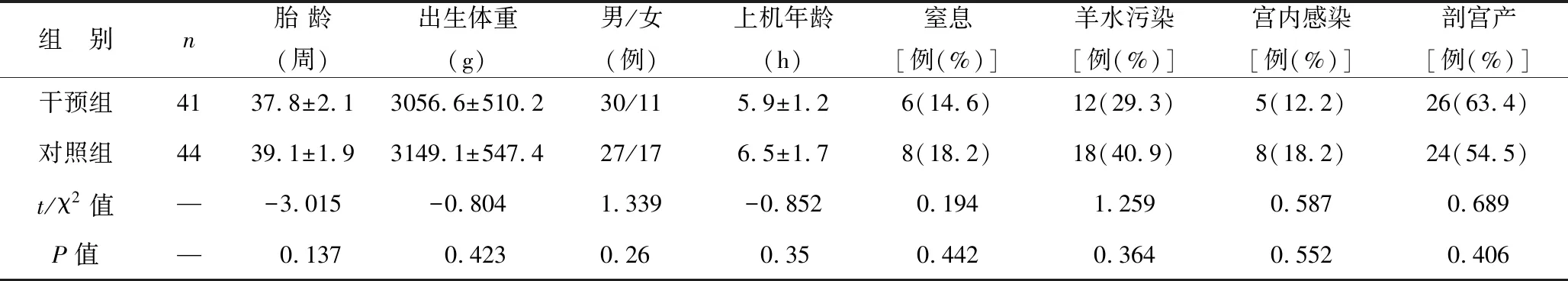
表1 两组患儿一般资料比较
1.2 研究方法
1.2.1 干预方法。干预组:地塞米松磷酸钠注射液0.125 mg/kg+5%葡萄糖注射液5 ml,1次/12 h,经静脉30 min推注,连用48~72 h停药;对照组:未使用地塞米松磷酸钠注射液,其余治疗同干预组。
1.2.2 其他治疗。肺泡表面活性物质治疗:猪肺磷脂注射液(生产批号1096363,注册证号H20181201),每次200 mg/kg 气管插管导管内滴入。 抗感染治疗:根据血白细胞、血小板、C反应蛋白、 降钙素原、痰(或血、脑脊液)培养及药敏试验选用敏感抗生素给予治疗。呼吸支持:HFOV使用指征: 常频通气条件动脉血气分析不能维持正常,PaO2<55 mmHg,PaCO2>60 mmHg、且pH值<7.20。血管活性药物治疗:①低血压,多巴胺5~15 μg/(kg·min);②低血压伴肺动脉高压/心功能不全,多巴酚丁胺5~15 μg/(kg·min)+米力农[负荷量 30 μg/kg,30 min,维持量 0.5~0.75 μg/(kg·min)]+ iNO。
1.3 观察指标 机械通气时间、干预前后血气分析、OI、气胸、肺出血发生率、病死率、住院时间,存活患儿随访异常发生率等。
2 结 果
2.1 两组患儿用药前后动脉血气结果及OI比较 用药之前两组动脉血气分析pH值、PCO2、PO2及OI指数等比较差异均无统计学差异(均P>0.05)。用药之后两组比较干预组血气pH值、PCO2、PO2改善更明显,但差异无统计学差异(P>0.05),但干预组OI指数下降更快,差异有统计学差异(P<0.05)。见表2。
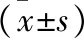
表2 两组患儿用药前后动脉血气及OI指数比较
2.2 两组患儿并发症及临床结局比较 干预组病死率低于对照组,两组比较差异有统计学差异(P<0.05)。两组存活患儿并发症比较:干预组气漏发生率、肺出血发生率、总机械通气(CMV)时间、一氧化氮吸入时间及住院时间与对照组比较,差异无统计学意义(均P>0.05)。见表3。

表3 两组患儿并发症及临床结局比较
3 讨 论
3.1 NARDS发病机制 新生儿肺发育成熟度低,免疫功能发育不成熟,在感染、窒息缺氧、胎粪吸入以及人工正压通气等过程中极易受到各种损伤而产生炎性因子,炎性因子在NARDS发生发展过程中起重要作用,在多种致病因素的共同作用下,引起肺部炎性反应、肺泡表面活性物质继发性减少和(或)灭活、使新生儿肺泡上皮细胞及肺泡毛细血管内皮细胞受损及通透性增加,影响细胞间质及钠水转运系统,大量富含蛋白液体进入肺泡组织形成急性肺水肿,而后形成透明膜,导致肺不张,临床上出现严重缺氧、高碳酸血症、气道痉挛、肺动脉高压等导致低氧血症加重形成恶性循环、最终导致多脏器衰竭及死亡[10-12]。
3.2 糖皮质激素治疗NARDS及肺水肿的价值 国内外近期研究报道“布地奈德”联合PS治疗NARDS能够能够减少气胸,以及气道高反应的发生,且无高血压、电解质紊乱以及水肿等不良反应[13-14];尹晓娟等[6]报道布地奈德干预治疗重度NARDS能够减少气胸及气道高反应,但未降低病死率及体外膜肺(ECMO)使用比例;地塞米松作为一种长效糖皮质激素,具有强大的抗炎、抗过敏、抗休克作用,能减轻和防止组织对炎症的反应,并能够抑制炎性细胞在炎症部位的集聚,抑制炎症化学介物的合成和释放,从而减轻炎症的表现,还可以阻断引起Ⅲ型超敏反应的病理生理环节,而且能降低肺微血管壁的通透性,阻止血浆成分向肺泡腔渗出,增加肺泡腔内液体的回吸收,其治疗成人ARDS历史较长[15];林彦等[16]动物实验报道地塞米松对大鼠急性肺损伤有一定改善作用,李素芝等[17]报道地塞米松联合吸氧以及氨茶碱等治疗可快速改善高原型肺水肿症状及体征,改善缺氧症状,但地塞米松在治疗新生儿NARDS及肺水肿方面鲜有报道。关于地塞米松在新生儿的应用,国内有两部指南[8,18]建议在超过1周机械通气难以撤机以及确诊早产儿支气管肺发育不良难以脱氧情况下使用,其他呼吸系统疾病未推荐使用;对于重度NARDS几乎都合并有肺水肿,本研究在使用地塞米松之前全部完成肺部超声检查确诊为存在肺水肿才建议家属使用地塞米松进行干预治疗,部分重度NARDS患者通过传统的HFOV辅助通气,PS替代治疗,iNO治疗以及其他综合治疗后低氧血症依然严重,中国新生儿呼吸衰竭体外膜肺支持指南[19]建议当积极呼吸支持下,病情仍迅速恶化,严重的低氧血症(PaO2<40 mmHg)或者OI>20超过24 h可考虑使用ECMO,但ECMO治疗技术难度要求较高,花费巨大,全国能开展的医院寥寥无几,大部分家长经济条件难以承受,使用地塞米松治疗目的是减轻肺部炎性反应以及肺水肿,改善通气换气功能,降低呼吸机支持力度,避免病情发展到需要使用ECMO地步,而且本研究通过临床观察的确起到快速改善血气结果的目的,干预组与对照组相比OI下降更明显,需要iNO吸入时间更短,住院时间也更短,尽管差异无统计学意义,但临床指标明显好转,干预组与对照组相比,病死率更低,而且差异有统计学意义,虽然样本量较少,且为单中心研究,证据力度有限,但有一定临床推广价值;早产儿在生后14 d之内使用糖皮质激素可导致远期体格生长发育迟缓及神经系统发育异常概率增加[20],本研究绝大部分患儿为足月儿,使用激素之前已做详细风险告知,并且出院后进行了长期门诊随访,目前存活患儿体格及神经系统发育评估均无异常。
通过本研究,对于重度NARDS合并肺水肿患者,如果高频震荡通气、PS替代治疗、iNO治疗情况下,OI短期内没有改善趋势,可尝试使用地塞米松治疗以达到减轻肺水肿,迅速改善氧合的作用,降低病死率,无不良近远期并发症发生。
