瘤背石磺体腔细胞分类、免疫相关酶特性及初步转录组学分析
2022-02-18吕庭莉杲绍强张虎张易婵陈鹏王嘉伟乔帼杨伯平张明明
吕庭莉 ,杲绍强,张虎,张易婵,陈鹏 ,王嘉伟,乔帼,杨伯平,张明明*
(1.大连海洋大学 水产与生命学院,辽宁 大连 116023;2.盐城工学院 海洋与生物工程学院,江苏 盐城 224051;3.邳州市新河镇农业技术推广服务中心,江苏 徐州 221313;4.江苏省海洋水产研究所,江苏 南通 226007;5.盐城工学院 电气工程学院,江苏 盐城 224051)
1 引言
瘤背石磺(Onchidium struma)隶属软体动物门(Mollusca)、腹足纲(Gastropoda)、石磺科(Onchidiidae),俗称土海参,又名海赖子,具有丰富的营养价值和药用价值[1]。主要生长在潮间带滩涂中,其背部表皮角质层厚,温度适应性强,适应陆栖生活[2],因有自由生活幼虫期而被认为是海洋生物向陆地生物辐射进化的重要代表物种[3]。此外,瘤背石磺属于海洋滩涂底栖动物,其早期发育对各种环境因子的变化尤为敏感,且因其幼虫易于采集和培育,常被用于评价海洋污染物的毒性,也可被作为海洋生态环境监测的指示生物[4]。
近年来,瘤背石磺作为一种具有较高经济和营养价值的海产珍品,日益受到人们的青睐,但由于环境污染、滥采滥捕或过度采捕等因素,其自然资源量已急剧减少。人们已经对瘤背石磺的人工养殖进行了研究[5],但是尚未突破其规模化养殖技术。因此,研究瘤背石磺基础免疫学将对其生长、发育、繁殖和物种保护具有重要意义。
目前人们普遍认为,包括软体动物在内的无脊椎动物缺乏适应性免疫,完全依赖于先天性免疫应答[6]。牡蛎和贻贝等双壳类通过血细胞吞噬侵入的微生物、促进伤口愈合、消化食物和运输营养[7-8];体腔液及其体腔细胞是海参先天性免疫防御的重要组成部分,发挥着重要的免疫防御作用,具有氧化杀灭、吞噬清除、凝集和创伤修复等多种防御功能[9-10]。近年来,随着科学技术的不断发展,国内外学者相继利用单克隆抗体、荧光标记及分子生物学技术对海参(Holothurioidea)、海胆(Echinoidea)和海星(Asteroidea)等棘皮动物体腔细胞的形态、功能和发生进行了深入研究,进一步揭示了棘皮动物体腔细胞在免疫系统中的重要作用[11-13]。但人们对瘤背石磺体腔细胞的特点及其在免疫防御中的作用知之甚少。
转录组学是一门基于整体转录水平来研究基因转录图谱并揭示生物学通路和性状调控网络分子机制的学科,近年来被广泛应用于生物学研究中[14-15]。高通量RNA-Seq 测序技术是目前广泛应用的第二代检测技术,具有高通量、高准确性、成本低等优点[16],基于此技术,不仅转录组本身及其调控复杂性的认知被大大拓展,有关生物体的功能基因组学研究也被深入推进[17],如刺参(Apostichopus japonicus)[18]和太平洋牡蛎(Crassostrea gigas)等[19]。藉此,本研究利用RNA-Seq 测序技术对来自健康瘤背石磺的体腔细胞进行转录组学分析,丰富其遗传信息;此外,本文研究了瘤背石磺体腔细胞的免疫相关酶和抗氧化酶活性,统计了体腔细胞中各主要类型体腔细胞的密度,研究结果将为今后进一步研究瘤背石磺的基础免疫学提供宝贵的基础数据,对于提高人工繁育的效率和质量、遗传图谱的建立和物种保护提供有价值的参考。
2 实验材料与方法
2.1 材料
健康瘤背石磺(平均体质量:(8.3±0.5)g)采自江苏省射阳县新洋港潮间带,带泥运回实验室后,在塑料饲养箱内(70 cm × 50 cm × 40 cm,90 头/箱)暂养3 d。塑料桶内铺上8~12 cm 厚的海泥,再铺上半圆形瓦片供瘤背石磺隐藏和附着。每个饲养箱用网纱覆盖,用于通风、观察和防止瘤背石磺逃生。饲养箱内的相对湿度通过喷洒人工海水保持在80%左右,与自然生活潮间带湿度相近[20],室温保持在(26±1)℃。暂养期间,投喂螺旋藻(粗蛋白57.64%、粗脂肪2.73%、灰分7.53%、钙0.2%、磷0.79%和水分8.28%),日投喂量为体质量的2%,将螺旋藻涂抹于无菌玻璃上,并在饲喂2 h 后清理干净,防止藻类腐败发臭以保持良好的养殖环境。
2.2 实验方法
2.2.1 瘤背石磺体腔液的采集
暂养3 d 后,将瘤背石磺随机分到3 个饲养箱中,每箱放置15 头。从每箱中随机选取3 头瘤背石磺,用无菌海水冲洗体表海泥后,解剖纸吸干水分,用无菌手术剪沿瘤背石磺腹部纵向解剖,并用50 mL 离心管收集体腔液。记录体腔液体积后,取100 μL 体腔液与等体积的抗凝剂(葡萄糖:20.8 g/L、柠檬酸钠:8 g/L、EDTA :3.36 g/L、氯化钠:22.5 g/L,pH:7.5)混匀,进行体腔细胞计数。剩余体腔液于4℃、3 000 r/min离心30 min,分别收集上清液和底层细胞沉淀,每3 头瘤背石磺的上清液混合作为一个平行样本,-80℃保存,用于免疫相关酶和抗氧化酶活性测定;底层细胞加入RNA 保护剂以防止RNA 降解,立即放于液氮中速冻,然后转移至-80℃冰箱保存备用,用于转录组学分析。
2.2.2 瘤背石磺体腔细胞的分类和数量分析
将处理获得的体腔液制作细胞涂片,在40 倍光学显微镜(Olympus,PH100-3B41L-IPL)下观察体腔细胞并依据形态、大小和核质比进行细胞分类。
将体腔液滴于血球计数板(25×16)上,并在光学显微镜下测定总体腔细胞密度(Total Coelomocytes Density,TCD)和不同类型体腔细胞密度(Different Coelomocytes Density,DCD)。计算公式为
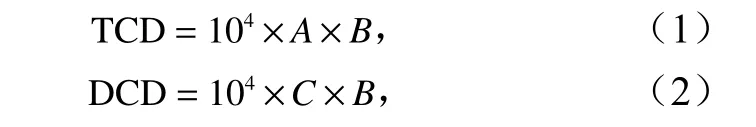
式中,A为25 中方格内总体腔细胞数之和(单位:cells/mL);B为稀释倍数;C为25 中方格中某类型体腔细胞数之和(单位:cells/mL)。细胞计数重复3 次。
2.2.3 瘤背石磺体腔液中免疫相关指标活性测定
通过试剂盒测定体腔液中酸性磷酸酶(Acid Phosphatase,ACP)、碱性磷酸酶(Alkaline Phosphatase,AKP)、超氧化物歧化酶(Superoxide Dismutase,SOD)和酚氧化酶(Phenoloxidase,PO)活力及总抗氧化能力(Total Antioxidant Capacity,T-AOC),试剂盒均购自南京建成生物工程研究所,根据说明书进行操作和活力计算。
2.2.4 瘤背石磺体腔细胞转录组学分析
2.2.4.1 总RNA 提取和cDNA 文库的构建
cDNA 文库的构建及测序在北京诺禾致源生物信息科技有限公司进行。根据使用说明书从体腔细胞中提取总RNA,RNA 的质量经Agilent 2100 生物分析仪检测合格后用于cDNA 文库构建。根据RNA 质量筛选获得6 个样品的RNA,纯化后,使用fragment buffer 将包含Poly(A)的mRNA 片段分成200~250 bp 的短片段。使用N6 引物将片段化的RNA 转录入第一链cDNA,随后合成第二链cDNA。用QIA quick PCR 试剂盒纯化双链cDNA,之后通过2%琼脂糖凝胶电泳回收目的大小片段。使用PCR primer cocktail 和PCR master mix 进行PCR 扩增来富集合适的衔接子连接的片段。PCR 产物经ampureXP 珠纯化后使用Illumina HiSeq™ 3000 平台进行测序。
2.2.4.2 Unigenes 功能注释与分类
获得原始片段后,使用FastQC(http://www.bioinformatics.babraham.ac.uk//projects/fastqc/)软件进行质量分析,去除带有接头、低质量和N(表示无法确定碱基信息)比例大于10%的序列,获得过滤后数据。将过滤后的数据用Trinity(http://trinityrnaseq.sourceforge.net/)组装出全长转录本序列。在已知的核苷酸和蛋白质数据库中,将所有组装的Unigenes 通过BLASTX进行比对,去掉E-value 值大于10-5的比对序列。数据库包括:NCBI 核酸数据库(Nt:https://www.ncbi.nlm.nih.gov)、NCBI 冗余蛋白质数据库(Nr:http://www.ncbi.nlm.nih.gov)、PFAM(HMMER3.0package)、Swiss-Prot 数据库(http://www.uniprot.org)、COG 数据库(http://www.ncbi.nlm.nih.gov/COG/)和KEGG 数据库(http://www.genome.jp/kegg)。
2.3 数据处理
3 结果
3.1 瘤背石磺体腔细胞的分类和数量
根据细胞形态、大小、核质比、颜色和相关研究报道[21],将瘤背石磺的体腔细胞分为变形细胞(图1a)、球形细胞(图1b)和色素细胞(图1c)。变形细胞类似海参中的变形细胞,细胞形状各异,大小不一,细胞核呈圆形,胞质中含有大量的丝状伪足,呈花瓣状[22];球形细胞静止时呈球形,内部均匀充满了小球状颗粒,大小不一;色素细胞的形状各异,大小不一,呈黄色或棕色。在瘤背石磺体腔液中,3 类细胞的密度由多到少依次为球形细胞((6.17±0.14)×106cells/mL)、变形细胞((1.40±0.30)×105cells/mL)、色素细胞((7.00±0.40)×104cells/mL)(图2)。
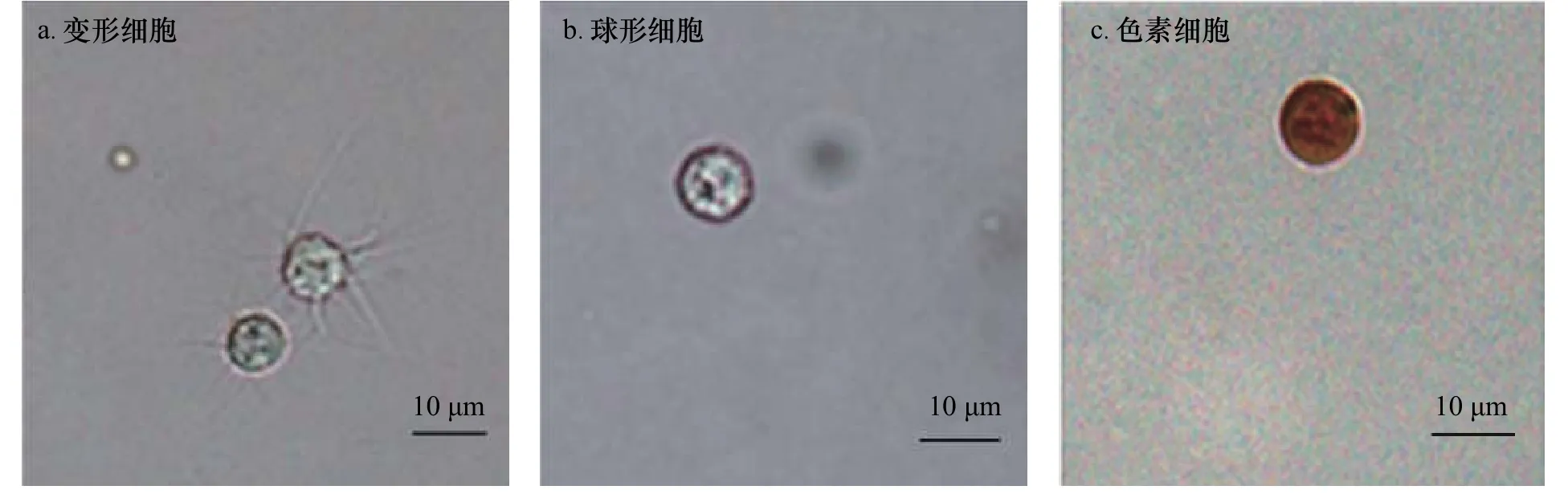
图1 瘤背石磺体腔液中不同类型体腔细胞的显微形态(×40)Fig.1 The micro-morphology of different coelomocytes in coelomic fluid of Onchidium struma (×40)
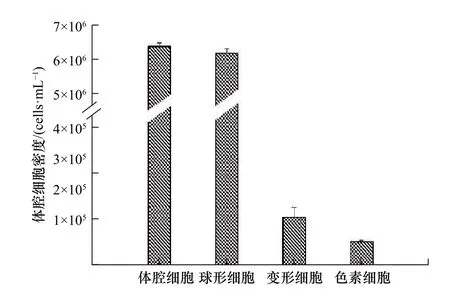
图2 瘤背石磺体腔液中不同类型体腔细胞的密度Fig.2 Density of different coelomocytes in coelomic fluid of Onchidium struma
3.2 瘤背石磺体腔液免疫相关酶活性分析
无外源刺激下瘤背石磺体腔液中ACP、AKP、TAOC、SOD 和PO 均有活力,ACP、AKP、T-AOC、SOD 和PO 活性分别为(0.98±0.60)U/mL、(4.68±0.98)U/mL、(0.01±0)U/mL、(21.59±1.33)U/mL 和(180.34±2.85)U/mL,其中,PO 活性最高。
3.3 瘤背石磺体腔细胞高通量测序与序列拼接
瘤背石磺体腔细胞6 个文库的序列统计见表1。原始序列过滤后,共获得328 759 318 条原始测序数据和318 727 812 条过滤后数据,过滤后数据比例为96%。在这些过滤后数据中,Q20 值为97.51%,Q30 值为92.91%,GC 含量为40.66%,这表明测序质量较好,可用于后续分析。
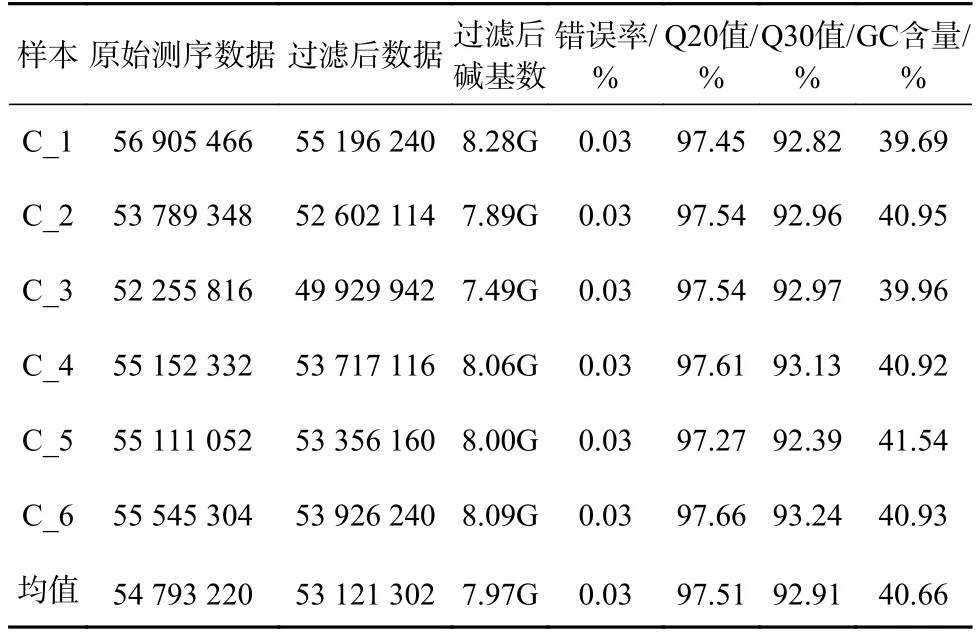
表1 瘤背石磺体腔细胞6 个文库的序列统计Table 1 Statistics of transcriptomic sequences from six libraries formed from coelomocytes of Onchidium struma
将来自6 个文库的过滤后数据使用Trinity 软件进一步组装得到63 097 个Unigenes,其平均长度、最长长度和最短长度分别为1 520 bp、29 277 bp 和301 bp。此外,过滤后数据被组装成124 853 个转录本,它们的平均长度、最长长度和最短长度分别为1 974 bp、29 277 bp和301 bp(图3)。瘤背石磺体腔细胞转录本测序原始数据在NCBI 中的登录号分别为:SRR6118632、SRR6118633、SRR6118634、SRR6118635、SRR6118636和SRR6118637。
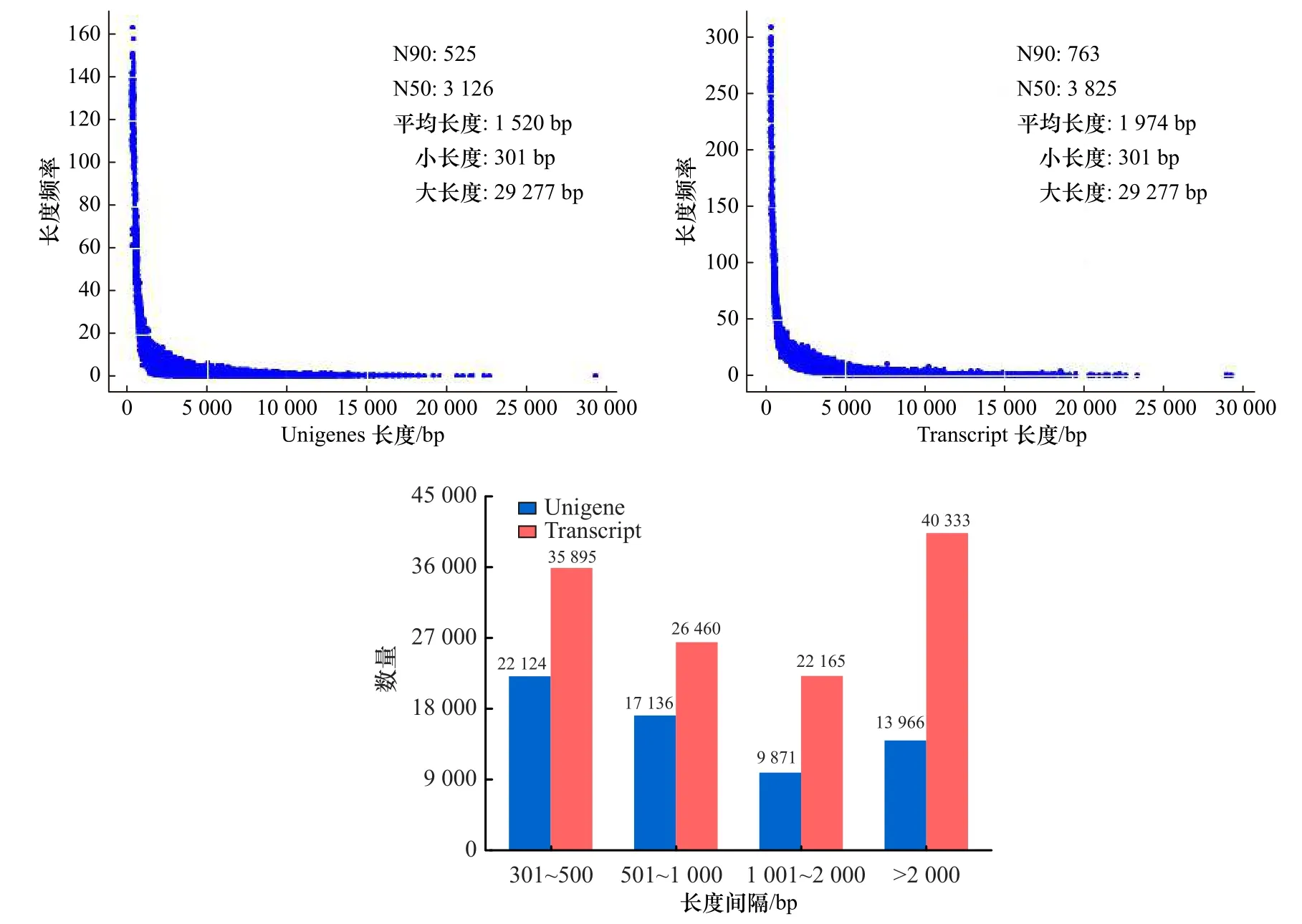
图3 瘤背石磺体腔细胞Unigenes 和Transcript 长度分布Fig.3 Length distribution of all Unigenes and Transcript from coelomocytes in Onchidium struma
3.4 Unigenes 功能注释与分类
63 097 个Unigenes 在GO、KO、KOG、NR、NT、PFAM 和SwissProt 数据库中成功注释的比例分别为33.33%、11.5%、11.55%、30.64%、9.45%、33.33%和20.85%。
在这些Unigenes 中,99%以上的Unigenes 与NCBI数据库中的注释序列的相似性大于40%(图4a),18.4%的Unigenes 的E值大于10-15(图4b)。这些非重复序列基因比对分析表明,与瘤背石磺转录本具有最高相似度的是海蜗牛(Aplysia californica)(47.1%),其次是光滑双脐螺(Biomphalaria glabrata)(27.8%)、棒络新妇蜘蛛(Nephila clavipes)(3.1%)、仿刺参(1.7%)和青螺(Lottia gigantea)(1.4%)(图4c)。

图4 瘤背石磺体腔细胞转录本序列与数据库中已知序列比对结果Fig.4 Comparison of transcriptomic sequences from coelomocytes in Onchidium struma with the known sequences from different species in database
在GO 功能注释中,21 036 个Unigenes 被注释到3 个功能类别,分别为:分子功能、生物过程和细胞组成,并被进一步注释为55 个子类。在这3 大功能类别中,得到注释最多的子类是细胞过程、结合、单生物过程、代谢过程、催化活性、细胞、细胞组分和膜(图5)。
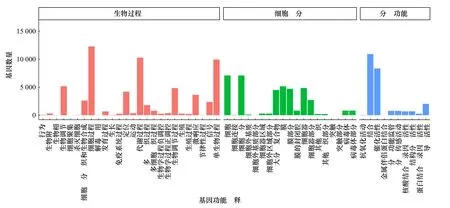
图5 瘤背石磺体腔细Unigenes 的GO 功能注释Fig.5 Gene ontology (GO) functional annotation of Unigenes from coelomocytes in Onchidium struma
COG 数据库比对结果显示,共有7 294 个Unigenes 被注释到26 个功能类别中(图6)。其中,优势类群为:“一般功能预测” “信号转导机制” “翻译后修饰、蛋白质折叠、分子伴侣” “未知功能” “转录、核糖体结构和发生” “胞内运输分泌和囊泡转运”和“转录”。在这些Unigenes 中,有302 个Unigenes 与“复制、复合、修复”和“防御机制”有关。

图6 瘤背石磺体腔细胞Unigenes 的COG 统计图Fig.6 Cluster of orthologous group (COG) functional annotation of Unigenes from coelomocytes in Onchidium struma
基于KEGG 数据库,共有7 258 个Unigenes 被划分为5 个类别:细胞过程、遗传信息处理、环境信息处理、代谢和生物系统,共涉及32 个KEGG 注释分类,得到最多注释的为“信号转导” “运输和分解代谢”“内分泌系统” “翻译” “折叠、分选和降解” “碳水化合物代谢” “消化系统” “细胞交流” “脂类代谢”和“免疫系统”,参与免疫系统的Unigenes 共有309 个(图7)。
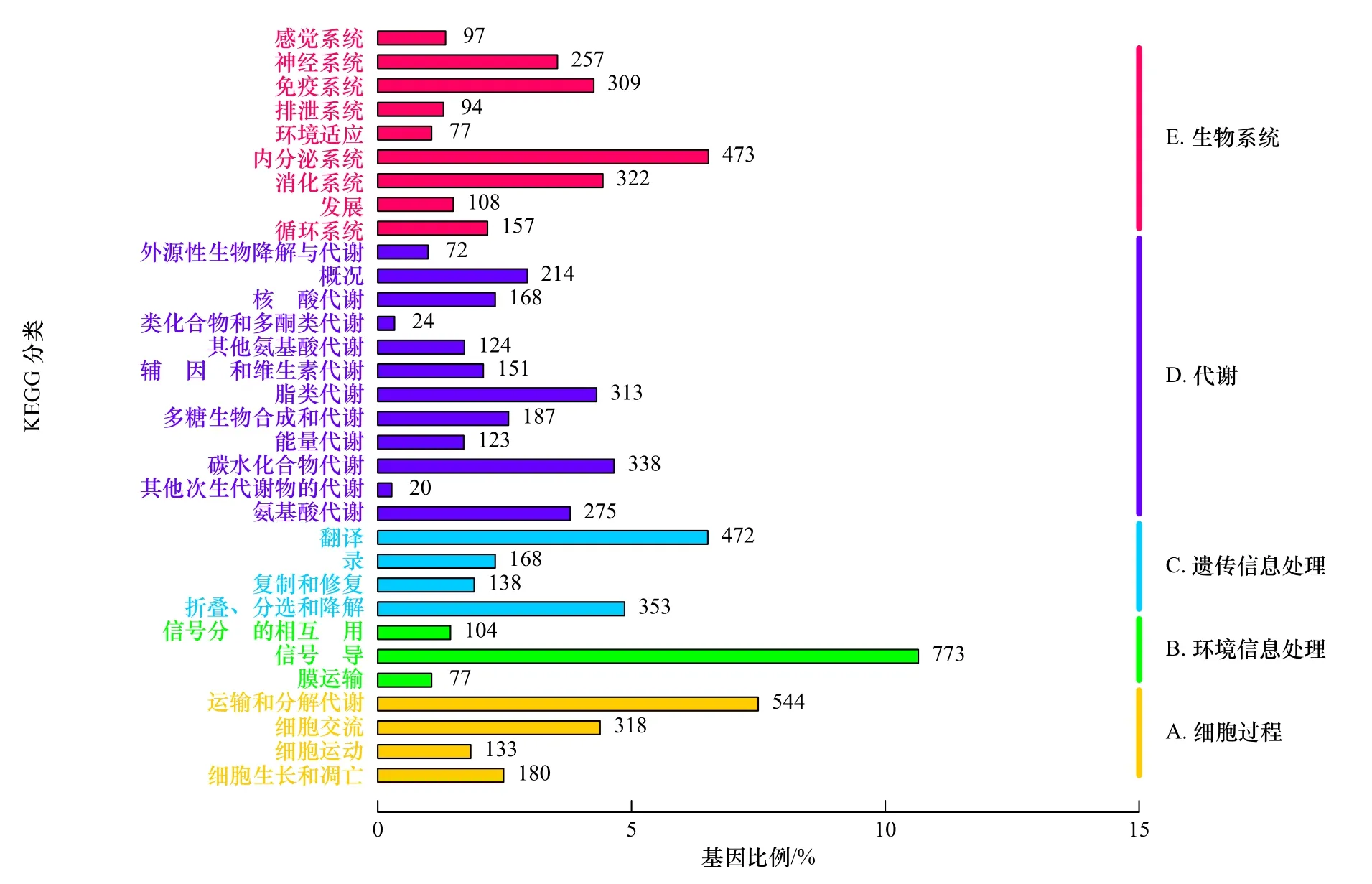
图7 瘤背石磺体腔细胞Unigenes 的KEGG 注释分类Fig.7 KEGG annotation of the assembled Unigenes from coelomocytes in Onchidium struma
4 讨论
国内外对石磺科的研究起步较晚,目前的研究主要集中在繁殖生物学和生态学这两个方面,而关于免疫学方面的研究甚少[23-24]。与其他海洋无脊椎动物一样,体腔液是瘤背石磺进行病原防御的重要体液,其经离心后大致可分为由各类体腔细胞组成的底部沉淀和由多种免疫相关酶、补体因子和凝集素等体液免疫因子组成的体腔上清液两部分[25]。本研究中,我们观察到了3 种不同类型的体腔细胞,分别是变形细胞、球形细胞和色素细胞,这与海参体腔液中体腔细胞组成相类似[21]。在十足目甲壳动物和双壳类软体动物中,已鉴定出3 种主要的血细胞类型,即透明细胞、半颗粒细胞和颗粒细胞[26-27]。其中,透明细胞多呈规则圆形,且胞内不含颗粒,在海洋无脊椎动物的大部分种类中均有发现,包括香港牡蛎(Crassostrea hongkongensis)[28]、三角帆蚌(Hyriopsis cumingii Lea)[29]、西施舌(Coelomactra antiquata)、波纹巴非蛤(Paphia undulata)、双线紫蛤(Sanguinolaria diphos)[30]和橄榄蛏蚌(Solenaia oleivora)[31]等,除此之外,有人在虾夷马粪海胆(Strongylocrntrotus intermedius)[32]和紫海胆(Anthocidaris crassispina)[33]中发现了一类无色球形细胞,其细胞特征与透明细胞基本类似,因此也可归为一类细胞进行命名划分。San Miguel-Ruiz 和García-Arrarás[34]在褐石海参(Holothuria glaberrima)体壁上人工创伤进行研究,发现体壁创伤后,球形细胞和桑椹细胞的数量会逐渐增加,并且不断迁移至伤口附近,重构细胞基质,进而促进伤口愈合。色素细胞来源于外胚层中被称为神经嵴细胞的特化细胞,是两栖动物、鱼类、爬行动物、甲壳动物和头足纲动物中含有生物色素的一类细胞[35]。色素细胞是调控动物体色的关键,与生物生存和繁殖活动密切相关[36]。在鱼类中共报道6 种色素细胞,包括虹彩色素细胞、黄色素细胞、黑色素细胞、白色素细胞、红色素细胞和蓝色素细胞,但是色素细胞的组成因物种而异[37]。徐伟等[38]研究了几种不同鲤鲫的鳞片色素细胞发现,组成鳞片的色素细胞有4 种:红色素细胞、黄色素细胞、黑色素细胞和鸟粪素细胞,鸟粪素细胞又可被分为虹彩色素细胞和白色素细胞。在瘤背石磺体内,我们观察到了黄棕色的色素细胞,推测其可能类似于鱼类中的黄色素细胞,使瘤背石磺外观呈土黄色,便于其藏匿于滩涂中,具有一定的保护作用。目前,不同类型的体腔细胞在瘤背石磺免疫系统中的具体作用尚不清楚,有待深入研究。
体腔液是低等水生动物的重要体液之一,含有凝集素、溶血素、酶、类补体物质等大量免疫因子[39]。酶是由活细胞产生的,对其底物具有高度特异性和高度催化效能的蛋白质或RNA,是机体非特异性免疫的重要组成部分,动物体内酶水平可间接反应机体免疫能力[40]。在健康瘤背石磺体腔液内,各种酶均保持活性,并发挥各自的作用来维持机体的稳态。超氧阴离子()是好氧生物机体代谢过程中必不可少的物质,在正常状态下,自由基的产生和消除维持着动态平衡。当机体受到外来病原如细菌、病毒侵害时,机体会产生应激反应从而释放大量活性氧,最终使机体发生细胞凋亡或坏死等损伤[41]。T-AOC、SOD 是机体重要的抗氧化酶,T-AOC 反映机体的总抗氧化能力;SOD 可以和过氧化氢酶(Catalase,CAT)协同作用,减少机体的氧化损伤[42]。PO 是一种重要的免疫相关酶,参与无脊椎动物的体液免疫防御过程,与黑色素产生、细胞黏附、包裹和吞噬有关[43]。磷酸酶根据最适pH 的不同,分为碱性磷酸酶AKP 和酸性磷酸酶ACP,它们是溶酶体酶的重要组成部分,具有水解、清除、消化异物的作用,从而达到免疫防御;并与生物的DNA、RNA、脂质和蛋白质的代谢有关,可以促进机体生长和提高免疫力[44-45]。在健康瘤背石磺体内,ACP 和AKP 以酶原的形式存在于体腔液中,ACP 的活性可以代表体腔液清除异物的能力[45]。本实验揭示,自然状态下瘤背石磺体腔液中存在的多种抗氧化及免疫相关酶的活性,这不仅为进一步检测瘤背石磺在应激状态下的免疫应答能力提供了对比,也为瘤背石磺抗氧化系统和免疫系统的研究提供了基础数据。
杨铁柱[46]在2020 年利用RNA-Seq 技术筛选出与瘤背石磺归巢行为相关联的生物节律性和环境感知性基因,为探讨瘤背石磺在潮间带滩涂区域适应性进化提供基础数据。对于瘤背石磺而言,体腔细胞是其发挥非特异性免疫的重要载体,为了进一步剖析瘤背石磺体腔细胞的免疫防御分子机制,本实验通过Illumina 平台对瘤背石磺的体腔细胞进行测序与功能注释,共获得63 097 个Unigenes,数据含量大,基因信息丰富,可为未来瘤背石磺的研究奠定基础。通过GO 功能注释,有21 036 个Unigenes 被注释到分子功能、生物过程和细胞组成3 个功能类别中,这与刺参体腔细胞转录组的数据高度相似[47]。基于Nr 数据库对比,海蜗牛与瘤背石磺序列同源性最高,与Oskars等[48]的报道相似,其次是光滑双脐螺、棒络新妇蜘蛛、刺参和青螺,分别属于软体动物门、节肢动物门和棘皮动物门,瘤背石磺与不同物种间的同源性也证明了其独特的进化地位。基于通路的分析有助于进一步阐明基因的生物学功能和相互作用机制,KEGG注释表明,这些Unigenes 参与了机体的信号转导、蛋白质翻译、蛋白质转换、免疫防御等各个过程,这将为进一步筛选免疫相关基因和信号通路提供指引。
5 结论
瘤背石磺体腔液内主要含有变形细胞、球形细胞和色素细胞3 种不同类型的体腔细胞,其中,球形细胞最多。此外,瘤背石磺的体腔液内含有多种抗氧化酶和免疫相关酶,它们发挥着各自的作用,共同维护机体健康。RNA-Seq 测序表明,从瘤背石磺体腔细胞中共组装出63 097 个Unigenes,这些Unigenes 被成功注释到GO、COG 和KEGG 数据库中。如上结果为深入了解瘤背石磺进化地位及其免疫系统奠定理论基础,为发展瘤背石磺人工养殖提供理论指导。
