鼠尾藻(Sargassum thunbergii)固碳能力对流速的响应
2022-02-18赵志方秦松刘正一唐君玮肖圣志钟志海
赵志方 ,秦松 ,刘正一 ,唐君玮,肖圣志,钟志海*
(1.中国科学院烟台海岸带研究所 海岸带生物学与生物资源利用重点实验室,山东 烟台 264003;2.中国科学院海洋大科学研究中心,山东 青岛 266071;3.中国科学院大学 资源与环境学院,北京 101407;4.长岛综合试验区海洋经济促进中心,山东 烟台 264003;5.长岛东源海产有限公司,山东 烟台 264003)
1 引言
为了减缓全球变暖的趋势,各国都在采取以“碳减排和碳吸收”为基础的碳中和策略[1]。习近平总书记提出我国碳排放力争于2030 年前达到峰值,2060年前实现碳中和的目标。自工业革命以来,人类活动所释放的CO2大约有48%被海洋吸收[2]。因此,海洋是全球气候变化的一个巨大“缓冲带”[3],也是迄今为止最大的碳库[4]。据报道[5],海洋碳库约是大气碳库的50 倍,陆地碳库的20 倍。我国是同时拥有红树林、盐沼、海草床和海藻场的国家之一,其中海藻场是近海的主要初级生产力贡献者。全球海藻场面积高达3.5×106km2,净初级生产力(以碳计,下同)约1 521×106t/a[6]。全球陆架区大型海藻的固碳潜力为0.7×109t/a,约占全球海洋年均净固碳量的35%[7]。对于生长在松软沉积物上的大型海藻来说,净初级生产力的0.4%(6.2×106t/a)被直接埋藏在生境中[8],而43%则从海藻床中以颗粒有机碳(Particulate Organic Carbon,POC)和可溶性有机碳(Dissolved Organic Carbon,DOC)的形式输出[9],其全球通量(以碳计,下同)约为679×106t/a[8]。综上,大型海藻对于实现碳中和目标具有重要意义。
大型海藻的光合速率通常通过测定单位时间测量瓶内O2或无机碳(Dissolved Inorganic Carbon,DIC)浓度的变化来计算。在测量过程中,由于藻体体积较大,通常使用打孔器或者刀片获取藻体的一小部分来测量光合速率[10-11]。然而,大型海藻的不同部位常表现出不同的光合活性,且切割会提高藻体的呼吸速率,降低光合速率[12]。另外,研究发现,藻体的创伤组织也会导致DOC 的释放量在短时期内急剧增加[13]。因此,使用部分藻体代替整株藻体的方法不能准确地计算藻体的光合速率。此外,光合速率的测定通常在封闭的狭小系统(测量瓶)内进行,这种传统的方法常常忽略了流速的影响。Schumacher 和Whitford[14]认为,流速的增加能够刺激大型植物初级生产力的提高。进一步研究发现,由驱动桨产生水流的测量系统[15]和流通式藻类固碳测量系统测得的光合速率[16]均比静置状态下要高,且流速对DIC 的摄取有显著影响[17],也对无机氮(Dissolved Inorganic Nitrogen,DIN)的吸收以及藻体的生长有显著影响[18]。另外,在测量过程中,封闭的狭小系统内O2在短时间内可迅速积累,产生的光呼吸会降低其光合速率和固碳能力[19]。Weigel 和Pfister[20]在大型海藻光合固碳速率的测量过程中选择了体积较大的封闭透明圆柱体(体积:2.6 L),利用同位素13C 或14C 测定细胞同化DIC 的量,推算光合速率,但没有考虑流速的影响。另外,同位素示踪法只能测定总光合速率,不能测定呼吸速率,所以具有一定局限性。测定单位时间内培养系统中DIC 浓度的变化也可以推算出光合固碳速率,基本方法是用20%的盐酸将水体酸化,将所有形式的DIC 转化成CO2,然后用N2将其排出,利用红外线气体分析法测定释放出的CO2[21]。该方法比直接测量水体溶解O2浓度的变化更加复杂,而且CO2易扩散,导致结果准确性较低。Bao 等[22]根据海水pH 和总碱度(Total Alkalinity,TA),利用CO2SYS 计算总DIC 变化量来计算海藻的光合固碳能力,但35 mL的石英管并没有摆脱狭小系统的制约。
鼠尾藻(Sargassum thunbergii)是一种广泛分布于西北太平洋潮间带的大型褐藻,具有重要的生态和经济价值[23]。在海洋生态方面,鼠尾藻是修复或者重建海藻场的建群种,具有重要的生态功能[24]。鼠尾藻不仅为海洋生物提供食物来源和栖息场所[25],也可通过吸收氮磷等净化水质,对维持物种丰富度具有重要意义[26]。在水产养殖方面,鼠尾藻是海参、鲍鱼等的天然优质饵料。本研究设计了一种可调控流速的大型海藻固碳能力测量系统,总体积为3.5 L,并选择完整的鼠尾藻藻体作为研究对象,避免了创伤带来的负面影响。研究了流速对鼠尾藻的净光合速率、呼吸速率、净初级生产力、DOC 释放以及对DIN、无机磷(Dissolved Inorganic Phosphorus,DIP)吸收能力的影响,为大型海藻固碳能力的研究提供切实可行的参考。
2 材料与方法
2.1 鼠尾藻的采集与培养
鼠尾藻于2021 年5 月27 日采自山东省烟台市养马岛潮间带(37°27'49''N,121°35'54''E),采集过程中保持藻体的完整性,在1 h 内运回实验室。挑选色泽发亮、大小均一的藻体作为实验材料。去除表面附着的小动物和泥土等,按1 g/L 的密度暂养于过滤、灭菌的天然海水(pH 为8.2,盐度为32)中,暂养温度为19℃,连续充气培养。暂养的时间为晚上,黑暗恢复12 h 进行后续实验。
2.2 装置介绍与实验设计
本研究设计了一种大型海藻固碳能力测量系统,包括透明的圆柱管道(材质为亚克力,透光性好)、流量计、荧光光纤氧气测量仪(Fiber-Optic Oxygen Meter)和循环水泵(图1)。圆柱管道长为40 cm,直径为10 cm,连接的透明水管的直径为19 mm。测量系统的总体积为3.5 L,圆柱管道内鼠尾藻质量(g)与测量系统内海水的体积(L)的比例约为8.57。圆柱管道的进水口一端放置一个十字支架,将鼠尾藻的分枝放在支架的4 个空隙中,使其随水流能自由舒展。通过圆柱管道两端的控制阀和循环水泵控制系统内水的流量和流向,通过流量计进行流量的检测。本研究设计了3 种流速,分别是静止(0 m/s)、中流速(0.033 m/s)和高流速(0.094 m/s)。圆柱管道上方的两个带塞子的圆柱小孔(高度为2 cm,直径为1 cm)可以进行水样的注入和采集,进行pH、DOC、DIN 和DIP 等的测量。荧光光纤氧气测量仪可以实时测量系统内的温度和溶解氧浓度。

图1 大型海藻固碳能力测量系统示意图Fig.1 Schematic diagram of carbon sequestration capacity measurement system of macroalgae
2.3 鼠尾藻净光合速率、呼吸速率的测量以及净初级生产力的计算
本实验所用材料均为长势健康的整株鼠尾藻,鲜重为(30±2)g。在图1 装置内灌满过滤、灭菌的天然海水,并置于装有海水的透明帆布池中控温(19℃)。调整好控制阀后,打开循环水泵,使系统内的海水循环流动。在光强(以光子计,下同)为150 μmol/(m2·s)(白天)和0 μmol/(m2·s)(黑夜)条件下,用荧光光纤氧气测量仪分别测定3 种流速下的净光合速率(Pn)和呼吸速率(Rd),测量时间为20 min。按照光合作用熵(Photosynthetic Quotient,PQ)为1,将Pn(单位鲜重释放的O2量,μmol/(g·h))转化为光合固碳速率(Cn)(单位鲜重固定的CO2量,μmol/(g·h)),即Pn与Cn在数值上是相等的。Pn、Rd和净初级生产力的计算公式如下:
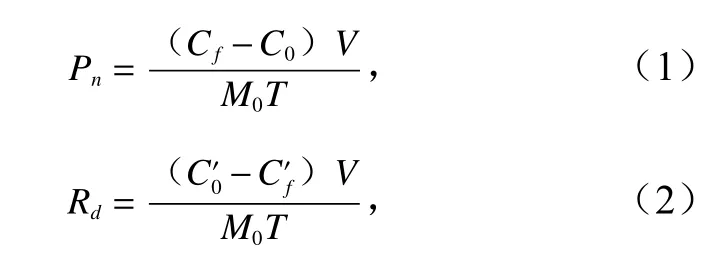
净初级生产力(单位鲜重生产的碳量,

式中,C0和Cf分别是测量Pn时的初始和最终O2浓度(单位:μmol/L);和分别是测量Rd时的初始和最终O2浓度;V为系统的总体积(单位:L);M0为鼠尾藻的鲜重(单位:g);T为测量时间(单位:h)。
2.4 鼠尾藻DOC 释放速率的测量
用图1 装置在3 种流速和2 种光强下分别培养鼠尾藻20 min。培养前后,分别取10 mL 水样,所取水样均在黑暗、4℃下保存。用总有机碳分析仪(TOCVCPH)测量DOC 的浓度,DOC 释放速率的计算公式为

式中,DOC0和DOCf分别为初始和最终DOC 浓度(以碳计,单位:mg/L);V为系统的总体积(单位:L);M0为鼠尾藻的鲜重(单位:g);T为培养时间(单位:h)。
2.5 鼠尾藻对DIN 和DIP 的吸收速率的测量
用图1 装置在3 种流速下分别培养鼠尾藻20 min,培养光强为150 μmol/(m2·s)。培养前后,分别取15 mL水样,所取水样均在4℃下保存。用续流动分析仪(Bran-Lubee AAA3)测量的浓度。DIN 浓度为浓度之和,其计算公式为
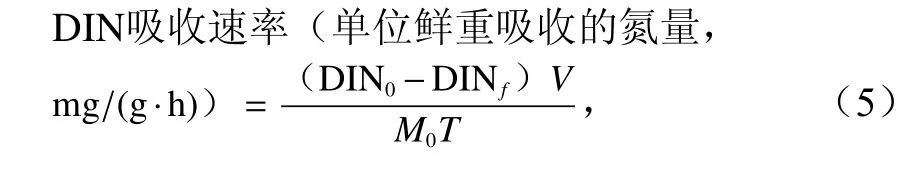
式中,DIN0和DINf分别为初始和最终DIN 浓度(以氮计,单位:mg/L);V为系统的总体积(单位:L);M0为鼠尾藻的鲜重(单位:g);T为培养时间(单位:h)。DIP 吸收速率计算公式与DIN 相同。
2.6 大型海藻固碳能力测量系统准确性检测
将图1 装置两端外接一个海水槽形成一个开放式大型海藻固碳能力测量系统(图2),测量系统内装50 L 过滤、灭菌的人工海水,圆柱管道内鼠尾藻质量(g)与测量系统内海水的体积(L)的比例约为0.6。调整好控制阀后,打开循环水泵,使系统内的海水循环流动。鼠尾藻在中流速(0.033 m/s)下培养24 h,白天和黑夜各培养12 h,培养温度为19℃。测量培养24 h前后鼠尾藻的鲜重(培养前:30.52 g、31.73 g 和31.96 g;培养后:30.81 g、31.87 g 和32.34 g),同时将培养后的鼠尾藻置于80℃烘箱中48 h,确认烘干后测量干重(4.91 g、5.25 g 和5.21 g)并研磨,通过比例计算培养24 h 后鼠尾藻增加的干重,记作ΔW1。培养24 h 后,收集整个系统中鼠尾藻的残枝碎屑,烘干(80℃,48 h),记作ΔW2(0.16 g、0.21 g 和0.12 g)。用小进样量元素分析仪(Elementar Vario Micro)测量(ΔW1+ΔW2)中所含有的POC 量(记作POC1)。培养24 h 结束时,将测量系统中的50 L 水样用孔径为0.45 μm 的玻璃纤维膜过滤,测量膜上的POC 量(记作POC2)。另外,培养前后分别取10 mL 水样用总有机碳分析仪测量CDOC浓度(单位:mg/L),并计算培养前DOC 量(记作DOC0)和培养后DOC 量(记作DOC1),则DOC 量(24 h释放)为二者之差。鼠尾藻24 h 的净固碳量(C净)公式为

图2 开放式大型海藻固碳能力测量系统示意图Fig.2 Schematic diagram of open carbon sequestration capacity measurement system of macroalgae

2.7 数据分析
使用SPSS 24.0,Oringin 9.0 软件进行数据处理及统计分析。用One-Way ANOVA 进行显著性差异分析,设置显著水平为p<0.05,重复组n≥3。
3 结果与分析
3.1 大型海藻固碳能力测量系统的准确性检测
如表1 所示,3 个平行系统内藻体的C净均大于POC1、POC2和DOC 的总和,C差分别为1.01 mg、0.89 mg和1.39 mg,平均值为(1.10±0.26)mg。3 个系统内C差/C净分别为2.08%、1.88%和2.18%。

表1 鼠尾藻在中流速培养24 h 的各项有机碳量Table 1 The organic carbon content of Sargassum thunbergii cultured at a medium flow rate for 24 h
3.2 系统内pH 的变化
如图3 所示,在中流速和高流速情况下,装置内pH 的变化幅度要大于静止下的变化幅度,但是3 种情况下的pH 变化幅度均不明显。流速由低到高,在20 min 内pH 分别仅增加了0.007、0.017 和0.020。

图3 不同流速下测量系统内pH 随时间的变化Fig.3 The change of pH in the measurement system with time under different flow rates
3.3 不同流速对鼠尾藻净光合速率和呼吸速率的影响
如图4 所示,随着流速的增加,鼠尾藻的净光合速率逐步升高。在静止情况下,鼠尾藻的净光合速率仅为高流速下的76.90%(p<0.05)。在中流速和高流速情况下,鼠尾藻的呼吸速率显著低于静止下的呼吸速率(p<0.05),分别为静止的43.08%和62.01%。

图4 不同流速下鼠尾藻的净光合速率和呼吸速率Fig.4 The net photosynthetic rate and respiration rate of Sargassum thunbergii under different flow rates
3.4 不同流速对鼠尾藻净初级生产力和DOC 释放速率的影响
在中流速和高流速情况下,鼠尾藻的净初级生产力分别为静止下的1.87 倍和2.12 倍(图5)。鼠尾藻DOC 的释放速率与昼夜变化有关(图6),白天DOC释放速率显著高于夜间的释放速率(p<0.05)。流速由低到高,白天DOC 的释放速率分别为夜间的2.70 倍、2.68 倍和2.63 倍。在静止情况下,鼠尾藻的DOC 释放速率显著低于中流速和高流速下的释放速率(p<0.05)。静止情况下,白天DOC 释放速率仅为高流速下的43.64%,而在黑夜这个比例则降至42.44%。
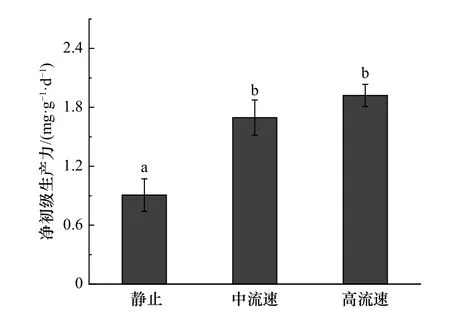
图5 不同流速下鼠尾藻的净初级生产力Fig.5 The net primary productivity of Sargassum thunbergii under different flow rates
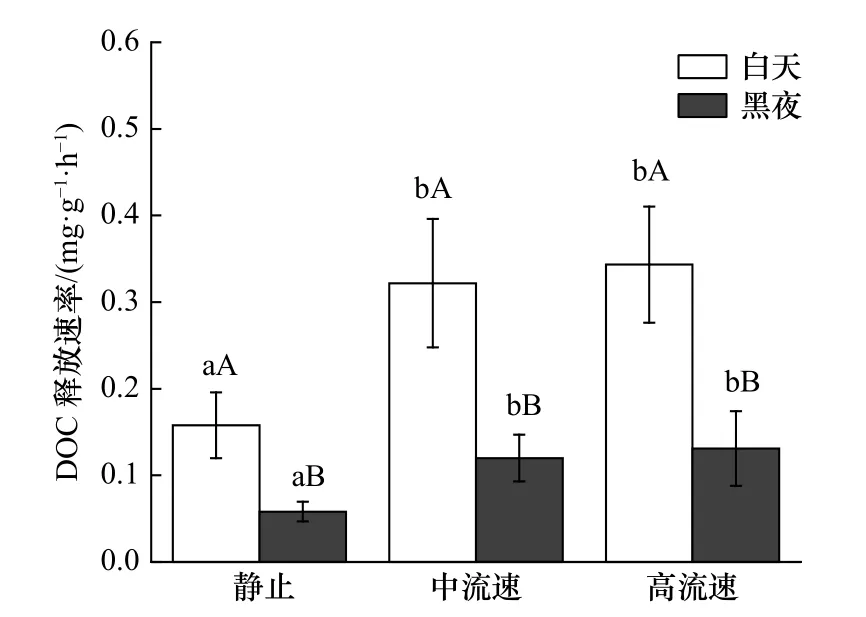
图6 不同流速下鼠尾藻的可溶性有机碳(DOC)释放速率Fig.6 The dissolved organic carbon (DOC) release rate of Sargassum thunbergii under different flow rates
3.5 不同流速对DIN 和DIP 吸收速率的影响
如图7 所示,鼠尾藻对DIN 和DIP 的吸收速率均随流速的升高而升高。在中流速和高流速情况下,鼠尾藻DIN 的吸收速率分别为静止下的1.97 倍和4.02 倍,DIP 的吸收速率分别为静止下的1.61 倍和2.14 倍。

图7 不同流速下鼠尾藻对可溶性有机氮(DIN)和可溶性有机磷(DIP)的吸收速率Fig.7 The absorption rates of dissolved inorganic nitrogen (DIN) and dissolved inorganic (DIP) phosphorus by Sargassum thunbergii under different flow rates
4 讨论
在封闭系统内,随着海藻光合作用的进行,海水的碳酸盐系统会发生改变,如pH 增加,而碳酸盐系统的稳定对于维持光合速率至关重要[28]。本研究发现,在3 种流速下,装置内的pH 在20 min 内分别仅增加了0.007(静止)、0.017(中流速)和0.020(高流速),说明装置内的碳酸盐系统具有一定的稳定性,不会对光合作用造成负面影响。
在开放式大型海藻固碳能力测量系统中,中流速培养鼠尾藻24 h 后,C差分别为1.01 mg、0.89 mg 和1.39 mg,C差/C净分别为2.08%、1.88%和2.18%(表1)。C差的形成可能是由于DOC 的性质不稳定造成的,在有光的条件下DOC 容易降解[29]。虽然在保存水样的时候,用锡箔纸对样品进行了遮光,但是在培养和取样过程中,还是会短时间暴露于光照下,部分DOC 因此降解。研究表明,光化学反应产生的DOC 中有12%~48%会被太阳光所降解[30]。综上分析,公式(7)的左右两边基本成立,说明该测量系统是可靠的。
本研究发现,在设置的流速范围内,鼠尾藻的净光合速率随流速的增加而增加,这与Carpenter 等[31]的研究结果基本一致。他们发现红藻刺状鱼栖苔(Acanthophora spicifera)和不规则腔腺藻(Coelothrix irregularis)在0~0.25 m/s 的流速范围内,净光合速率随着流速的增加而增加。水生植物的净光合速率与植物表面的边界层扩散有关,营养物质和气体通过边界层输送到植物表面的速率取决于该层的厚度和横跨该层的浓度梯度[32],随着流速的增加,边界层厚度减小[18],导致运输CO2的量增加,从而提高净光合速率[17]。然而,净光合速率的升高是具有一定限度的,因为边界层的厚度不会一直降低[33]。有研究发现,巨藻(Macrocystis pyrifera)在流速为0.04 m/s 时,其净光合速率达到最大。与此同时,其边界层厚度达到最小(1 mm)[34],超过该流速,比如碳酸酐酶的活性,会成为限制光合速率的因素[35]。Gao[36]研究发现,在960 μmol/(m2·s)光强下,鼠尾藻的净光合速率随着水流速度(0.5~1.2 cm/s)的增加而增加,在流速为1.2 cm/s 时,鼠尾藻的净光合速率为38 μmol/(g·h),而本研究的最大净光合速率为16 μmol/(g·h),仅为其42.1%,差异的主要原因可能是单位水体体积含有的藻体接收的光强不同所致:Gao[36]研究中单位水体体积含有的藻体接收的平均光强是本研究的2.3 倍。此外,随着流速增加导致的碳酸酐酶活性的降低也可能影响净光合速率[35]。另外,大型海藻藻体表面微生物群落也与流速有关,大型海藻释放的DOC 和POC 可以促进附着在其表面的异养微生物的生长[37],而静止的水流使微生物更容易附着或停留在海藻周围,更易摄取这些有机物质,促进其丰度的增加,从而可能导致呼吸速率的升高。本研究中,鼠尾藻在静止时的呼吸速率要高于中流速(0.033 m/s)和高流速(0.094 m/s)下的呼吸速率,这可能是藻体与微生物相互作用的结果。
在生长阶段,大型海藻会持续以DOC 的形式释放出一定比例的光合产物[38]。DOC 的释放可归因于细胞生长和裂解过程中小分子化合物的被动泄漏或光合产物的主动渗出[39]。水生光合生物产生的DOC改变了全球海洋环境的碳动力学[40-41],加速了微生物的分解转化过程[42]。最近几年,科学家提倡把大型海藻列入“蓝碳”的范畴,使之成为继红树林、海草床和盐沼之后的第4 类“蓝碳”[9]。虽然DOC 的输出被认为是大型海藻进行碳储存的主要路径[9],但关于光合固碳能力的计算并没有考虑生长过程中大型海藻DOC 的释放[43]。所以厘清光合固碳能力和DOC 释放之间的关系对于计算大型海藻的固碳能力十分重要。本研究发现,随着流速的增加,鼠尾藻的净初级生产力和DOC 释放速率均有所提高,支持了光合产物的扩散假说—DOC 的释放速率与净初级生产力呈正相关,即DOC 的释放速率会随净初级生产力的增加而增加[44]。光合产物以DOC 的形式进行释放时,无论是被动的还是主动,在一定程度上均依赖于细胞内碳池的浓度[45],碳池浓度越大,DOC 扩散速率就越快,目前已在淡水和海洋浮游植物中得到验证[44,46]。另外,在静止、中流速和高流速下,白天鼠尾藻DOC的释放速率分别为夜间的2.70 倍、2.68 倍和2.63倍。而Weigel 和Pfister[20]发现,两种褐藻Nereocystis luetkeana和巨藻白天DOC 的释放速率分别是夜间的3.5 倍和4.7 倍。也有研究发现,有些大型褐藻白天DOC 的释放速率一般为夜间的1.3~2 倍[47-48]。夜间DOC 释放速率较白天明显减少,可能是大型海藻在夜间无法进行光合作用所导致,而释放的DOC 只能来源于白天积累的光合产物。
N 和P 是藻类生长的重要营养元素,是叶绿素、蛋白质、酶等的重要组成部分[49],营养物质的可利用性直接影响藻体内物质的积累和元素的比例[50]。本研究发现,鼠尾藻对DIN 和DIP 的吸收速率均随着流速的增加而增加。扩散边界层的厚度是影响营养盐吸收的关键因素,边界层厚度越厚,无机盐离子需要移动的距离就越大[51]。有研究表明,巨藻对DIN 和DIP 的吸收速率均随流速的增加而增加,在流速为0.025 m/s 时达到最大值,随后呈下降趋势[52]。营养盐吸收速率随着流速的增加是扩散边界层厚度下降引起的,直到接近最小边界层厚度0.3 mm[34],达到这个厚度,其他因素,例如硝酸还原酶等的活性,将成为限制无机盐吸收的因素[51,53]。与巨藻不同的是,Macrocystis integrifolia在流速为0.04~0.06 m/s 之间才能达到最大值[54]。所以,大型海藻在不同流速下对营养盐的吸收能力具有物种特异性,对于群落的形成至关重要。研究表明,流速影响了海草床的生态过程,包括光合作用和营养盐吸收等[55]。在0.02~0.18 m/s 的流速范围内,流速提高了泰来草(Thalassia hemprichii)对N、P 等物质的吸收速率[51]。此外,高流速下大型海藻净初级生产力的提高,也可能是DIN 和DIP 吸收速率提高的一个重要原因。在高流速情况下,初级生产力的提高会促进组织中的C 积累,而在外界环境营养物质稳定的情况下,组织中的C、N 和P 含量会保持在一个稳定的比例[56],比如著名的雷德菲尔德比例(C∶N∶P=106∶16∶1)[57]。当组织内C 含量升高时,为了维持C、N 和P 的比例,便会提高对DIN 和DIP的吸收速率。
5 结论
本大型海藻固碳能力测量系统对于评估流速对大型海藻净光合速率、净初级生产力、DOC 的释放速率以及对营养盐吸收能力的影响是可行的。与静止(0 m/s)相比,中流速(0.033 m/s)和高流速(0.094 m/s)均能提高鼠尾藻的净光合速率、净初级生产力、DOC 释放速率以及对DIN、DIP 的吸收速率,且最大值均出现在高流速(0.094 m/s)状态下。此外,鼠尾藻DOC 释放速率随净初级生产力的提高而提高。“蓝碳”植物的固碳能力评估一直是海洋碳汇研究的热点和难点之一,关于大型海藻固碳能力的评估并未有统一的标准。大型海藻作为“蓝碳”新成员,其固碳量的准确测定更具难度。基于上述结果,本测量系统对大型海藻固碳能力的测定有重要的参考意义。
