基于转录组测序技术对调控毕加索小丑鱼(Picasso clownfish)白化体征关键基因的研究
2022-02-18何丽斌黄镇吴水清郑乐云
何丽斌 ,黄镇, ,吴水清,郑乐云
(1.福建省水产研究所,福建 厦门 361013;2.福建师范大学 生命科学学院,福建 福州 350117;3.福建省特色海洋生物资源可持续利用重点实验室,福建 福州 350117)
1 引言
海洋观赏鱼类的体色多彩多样,是脊椎动物最丰富的形态特征之一,对于动物生存、进化具有重要的意义。体色及其形状、纹路等不同色素模式是鱼类最直观的适应性状之一,影响着鱼类的聚集、躲避敌害、警告猎食者或竞争者及性选择,且对鱼类的识别具有重要的意义[1-2]。
小丑鱼属于雀鲷科(Pomacentridae),海葵鱼亚科(Amphiprioninae)[3]。小丑鱼在世界范围内共有20 多种,是重要的海洋观赏鱼类[4]。其中,毕加索小丑鱼是黑背心小丑鱼(Amphiprion percula)自交产生的后代中出现的品种[5],由于其皮肤组织具有不规则的白色、黄色和黑色斑块与纹路,因而具有较高的观赏性与商品价值。由于黑色或者黄色个体的皮肤组织发生白化现象,最后导致其出现不规则的白色斑块皮肤。白化的特征表现为皮肤、头发和眼睛中缺乏黑色素,是自然界中常见的体色变异[6]。已有研究表明[7],白化的表型在不同种类的动物中受到不同的基因表达调控,因此,白化表型产生的分子机制因物种而异。已有的研究表明[8],白化现象与溶酶体途径在遗传上有关,并与人类疾病相关。在渔业生产中,体色也是一个重要的价值特征,例如白化海参的市场价值明显高于正常颜色的海参(黑褐色、灰褐色或者黄褐色)[9]。因此,阐明白化产生的分子机制不仅有益于人体健康,而且为体色育种提供重要线索。
2 材料与方法
2.1 材料采集
实验用毕加索小丑鱼取自福建省水产研究所生态实验室,为同一亲本产生的后代。根据《ARRIVE 2.0 指南》和美国国立卫生研究院《实验动物护理和使用指南》(NIH 出版物编号8023,1978 年修订)进行动物样品采集工作和实验方案制定。排除性别差异和体型相似(体长为(35.2±1.5)mm),实验随机挑选了9 尾的亚成鱼个体,包括3 尾白化鱼、3 尾黄色鱼(以下简称黄鱼)和3 尾黑色鱼(以下简称黑鱼)(图1a),3 种鱼在胸鳍与臀鳍身体两侧之间相同部位分别呈现白色、黄色、黑色的皮肤组织。在本研究中,将白化样本编号为A_1、A_2 和A_3,黄色样本编号为Y_1、Y_2 和Y_3,黑色样本编号为B_1、B_2 和B_3。实验剥取了鱼的皮肤组织后将组织切成小块并在磷酸盐缓冲盐溶液(Phosphate Buffered Saline,PBS)中洗涤3 次。实验将每份样品的皮肤组织均分为两份,将一份储存在液氮中备用,另一份用于提取总RNA。
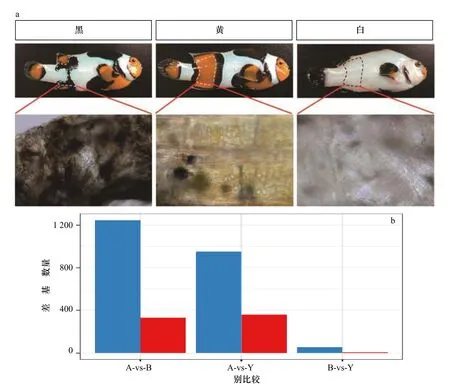
图1 3 种小丑鱼皮肤组织的表型差异以及基因表达差异Fig.1 Phenotypic differences and gene expression differences in skin tissues from three species of Picasso clownfish
2.2 转录组测序
使用TRIzol 试剂(Invitrogen,加拿大)从皮肤组织中提取总RNA 后通过Agilent 2 100 方法检测 RNA 样品纯度、浓度和完整性。质量控制后,使用oligo(dT)磁珠从每个样品的 1 μg 总RNA 中分离带poly(A)的mRNA,随后采用超声处理成随机片段。使用TruSeq RNA 文库制备试剂盒v2(Illumina,美国)构建cDNA文库,基于Illumina HiSeqTM2500 高通量平台,以Pair-end 150 bp 双端测序模式对cDNA 文库进行转录组测序。
2.3 序列比对
为了获得高质量的数据,使用SolexaQA 软件从原始读数数据中修剪接头和低质量读数[10]。以眼斑双锯鱼(Amphiprion ocellaris)(GenBank:NXFZ00000000.1)为参考基因组,利用HISAT2 软件,将过滤后的转录组数据使用默认参数与参考基因组进行比对。通过Burrows Wheeler(BWA)软件将过滤后的基因组测序数据与参考基因组进行比对[11-12]。
2.4 差异表达基因分析
使用 Hisat2-build v 21.0[13]软件构建参考基因组的索引,使用HISAT v 2.1.0[13]将转录组数据比对至参考基因组。基于基因长度计算每个基因的表达量(FPKM),并使用StringTie[14]v1.3.5 软件计算基因的读数计数。本研究中的差异表达基因(Differentially Expressed Genes,DEGs)分析采用BH 法校正的p值(p<0.05)为标准阈值。
2.5 GO 功能富集和KEGG 通路富集分析
以p<0.05 为阈值,分别使用GOseq R Bioconductor 包和KOBAS 2.0 对差异基因进行GO 功能富集和KEGG 通路富集分析[14-15]。
2.6 qPCR 验证
通过Primer Premier 5.0 软件设计靶基因(adcy5、akdp7、crabp1、creb3l2、ednrb、flt4、fzd2、gng10、ivns1abp、nkiras1、robo4、ssbp2、tfpi2、wnt11、zdhhc2)的引物(表S1),所设计的引物均在不同的外显子上,在qPCR 检测中能避免基因组DNA 污染。使用Promega公司的GoScript™ Reverse Transcriptase System试剂盒将总RNA 逆转录合成cDNA。使用Maxima SYBR Green qPCR Mix(2X)进行qRT-PCR,总反应体积为20 μL,包括10 μL SYBR qPCR Mix、0.8 μL 正向引物、0.8 μL 反向引物、2 μL cDNA 和6.4 μL 无RNase 的水。PCR 扩增程序:95°C 30 s、95°C 5 s、59°C 10 s、72°C 15 s 共40 个循环。通过Bio-Rad 公司的iQ5 软件检测荧光信号并计算熔解温度。以β-actin 为对照,采用2-ΔΔCt法分析各靶基因的相对表达量[16]。本实验对转录组测序样本的所有3 个生物学重复均使用3 个技术重复进行基因表达量验证。
3 结果
3.1 转录组测序
通过样品取样、RNA 提取、文库构建和上机测序,本实验9 份样品获得的原始读数数量在450×104~650×104之间,数据质控后93%~98%的读数为可用读数。每个样品与参考基因组的比对率均大于75%。通过FPKM 值估计皮肤组织中基因的表达水平,结果显示,所有样品中基因表达的分布相似,表明没有系统性的基因表达差异。样本间的相关系数结果显示,所有样本都表现出良好的相关性,且同一组的样本表现出更强的相关性水平,表明每组都有良好的生物学重复。
3.2 差异表达基因的鉴定
本实验通过进一步比较3 组样品之间的转录组表达量来分析DEGs。结果显示,与黄色皮肤样品相比,白色皮肤样品中有1 312 个DEGs,其中包括359 个上调基因和953 个下调基因(表S2)。与黑色皮肤样本相比,白色皮肤样本中总共有1 578 个DEGs,包括331 个上调基因和1 247 个下调基因(表S3)。此外,黑色皮肤与黄皮肤样本相比存在65 个DEGs,其中9 个下调基因,56 个上调基因(表S4,图1b)。基于组间的DEGs,利用基因的表达值对样本进行聚类,结果显示,所有样品表现出与肤色一致的聚类模式(图2)。本实验发现基于DEGs 比基于全基因组表达数据有更好的聚类结果,表明DEGs 能够反映组间的核心差异。
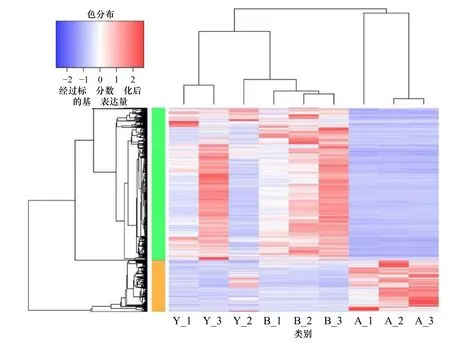
图2 基于差异表达基因对3 种样本和基因进行层次聚类Fig.2 Hierarchical clustering of 3 samples and genes using differentially expressed genes
3.3 差异表达基因在与黑色素生成相关的生物过程中的功能作用
为了进一步解析毕加索小丑鱼白色皮肤中特异性DEGs 的功能,我们对白色和黄色相比(标记为Avs-Y)的DEGs、白色和黑色相比(标记为A-vs-B)的DEGs 分别进行了GO 功能富集和分析(图3)。结果显示,A-vs-Y 和A-vs-B 的差异基因集均在蛋白质结合(如细胞黏附和趋化因子受体结合)、蛋白质转运(如核转运)、蛋白质入细胞核和调控信号(如生长调节和酶调节活性)这些GO 生物学过程中存在显著的富集水平(表S5,表S6)。我们也对这些差异基因进行了KEGG 通路富集,结果显示,存在7 条富集显著的信号通路(p<0.05),包括细胞外基质-受体互作黏着斑、细胞黏附分子、紧密连接、细胞因子-细胞因子受体相互作用、钙信号通路和酪氨酸代谢(表S7)。同时,我们还发现许多DEGs 参与Wnt 信号通路、Hedgehog 信号通路、苯丙氨酸代谢和黑色素合成通路。虽然这些通路在KEGG 富集分析中不显著,但它们与色素细胞分化和皮肤颜色密切相关。
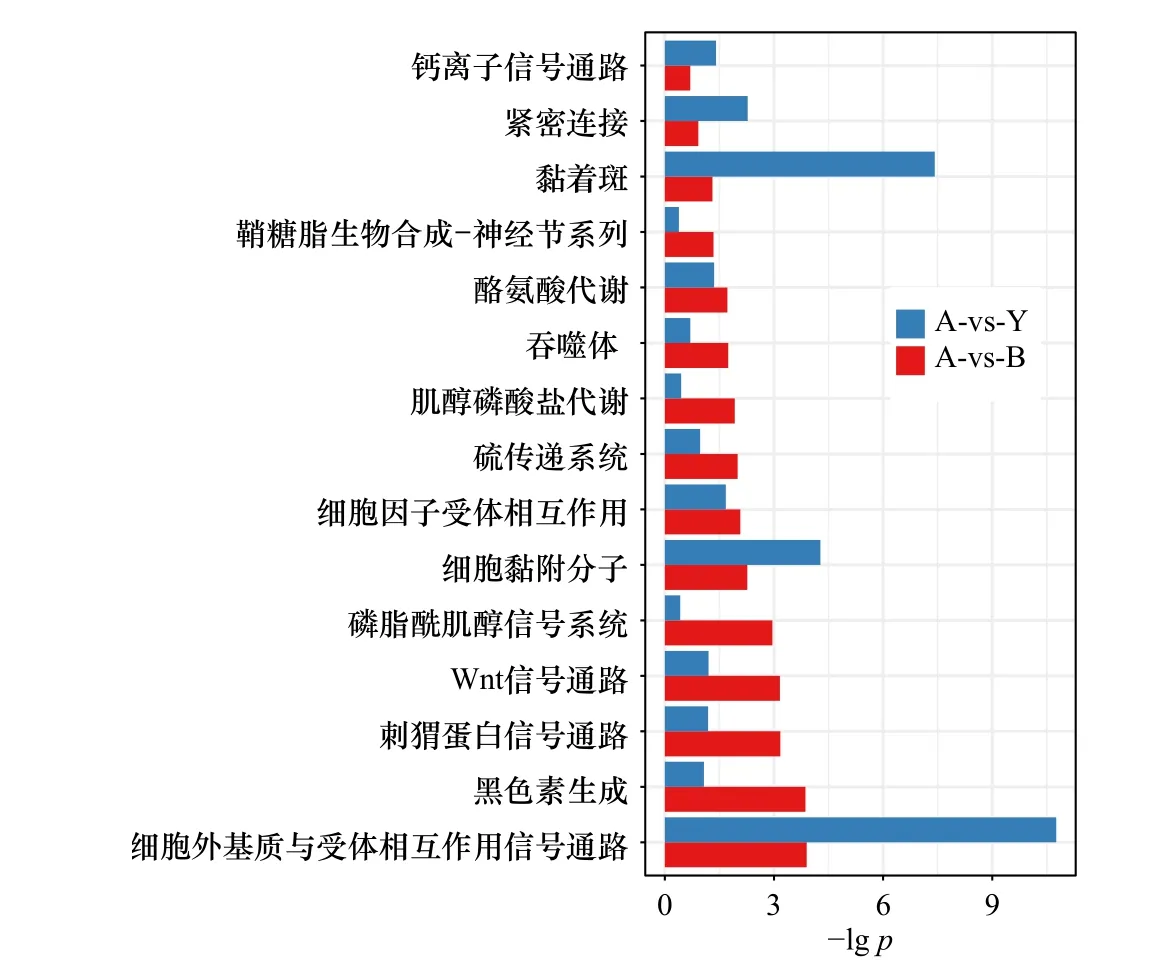
图3 基于白色-黄色(A-vs-Y)和白色-黑色(A-vs-B)皮肤组织的组间差异表达基因生物学功能富集Fig.3 Biological function enrichment of intergroup differentially expressed genes based on white-yellow (A-vs-Y) and white-black (A-vs-B) skin tissues
我们将黑色与白色皮肤的转录组数据进行相比,发现在白色皮肤样品中涉及黑色素生成的基因存在下调趋势(例如ednrb、ednra、tyr、mitfa和dct)。结果显示,虽然多数基因表达水平没有出现显著下调,但参与黑色素合成的25 个基因在白化皮肤中的表达水平出现了明显的降低(图4)。此外,我们还发现了在Hedgehog 信号通路和Wnt 信号通路中的DEGs(包括wnt9b、wnt5b、wnt11和wnt3a),显示出从黑色到黄色到白化样本其表达水平逐渐降低的现象。以上结果表明,这些基因在黄色和白化皮肤组织中的抑制表达可能会阻断信号传导过程和下游生物合成途径(包括黑色素生物合成)。因此,通过多个信号通路的基因表达水平研究表明,毕加索小丑鱼的白色皮肤的产生可能是由多个信号通路上的异常基因表达共同引起的。
3.4 使用实时荧光定量PCR 进行差异表达基因验证
为了验证以上分析结果,我们使用黑色素生物合成通路中5个核心的DEGs(adcy5、creb3l2、ednrb、fzd2、wnt11)以及在A-vs-Y 和A-vs-B 比较之间随机选择了10 个DEGs(akap7、crabp1、flt4、gng10、ivns1abp、nkiras1、robo4、ssbp2、tfpi2、zdhhc2)设计引物,通过荧光定量PCR 相对定量法检测这些基因的表达情况,并与转录组分析结果进行比较。得到的基因表达量的结果与转录组测序所得结果趋势一致(图5)。5 个DEGs 的表达水平(例如ednrb)均显示出一致的变化趋势(图5),证实了转录组分析结果的可靠性。
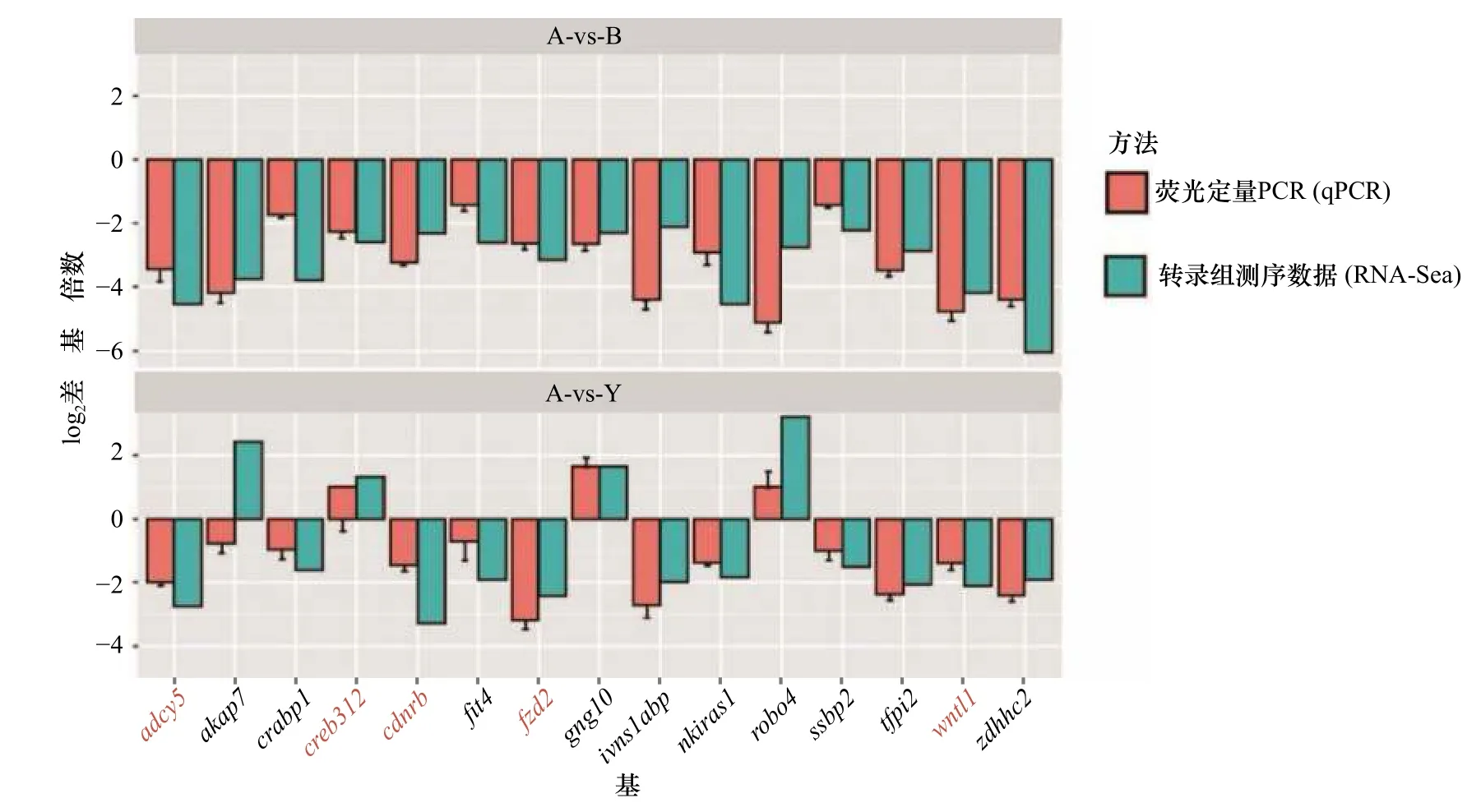
图5 参与黑色素生成的关键功能基因的验证Fig.5 Validation of key functional genes involved in melanin production
4 讨论
毕加索小丑鱼为黑背心公子小丑鱼(Amphiprion percula)的遗传变异体[5],以其不规则的条纹图案和体色深受广大消费者的喜爱,而在养殖过程中产生的白色皮肤花纹杂乱无章的毕加索小丑鱼极为珍贵,但其皮肤产生白色皮肤的遗传机制目前仍然未知[5]。已有研究结果表明[17-18],关键基因的异常表达(例如tyr)与白化现象密切相关。在本研究中,我们对毕加索小丑鱼的同一部位,但是不同颜色的皮肤组织进行了转录组测序,确定了小丑鱼不同颜色皮肤组织的DEGs,并分析了白色皮肤组织中DEGs 的生物学功能。
在3 种皮肤组织两两比对的差异基因数目中,白色与黑色相比的差异基因数目最多,白色与黄色相比的次之,而黑色与黄色相比的差异基因数目最少,提示在皮肤组织从黑色到黄色再到白色中,存在许多基因的表达受到逐层抑制现象。我们对白色与黑色、白色与黄色相比得到的DEGs 进行了KEGG 通路的功能富集分析,结果表明,这些DEGs 参与了细胞外基质受体相互作用、黑色素生成、Hedgehog 信号通路和 Wnt 信号通路的调控。许多参与细胞外基质受体相互作用的膜受体的基因(如lama2/3/4、thbs1b/2a/3a/4a、vtna和argn)在白色皮肤组织中表达水平出现显著下调(表1)。有研究结果表明,许多细胞外基质受体相互作用基因可能影响早期色素细胞增殖或分化,进而影响黑色素细胞对肤色的调控[19]。Wnt 信号通路也与黑色素合成有关,已有研究表明[20],抑制Wnt/β-catenin 信号通路会抑制黑色素生成。有研究报道[21]称,wnt1在调节黑色素细胞的分化方面发挥重要作用,并且wnt1基因在Wnt 信号通路和Hedgehog 信号通路中都起调控作用,本研究发现,毕加索小丑鱼白色皮肤的wnt1基因表达量明显低于黑色皮肤,表明wnt1基因在调控小丑鱼皮肤中的黑色素生成方面发挥重要作用。
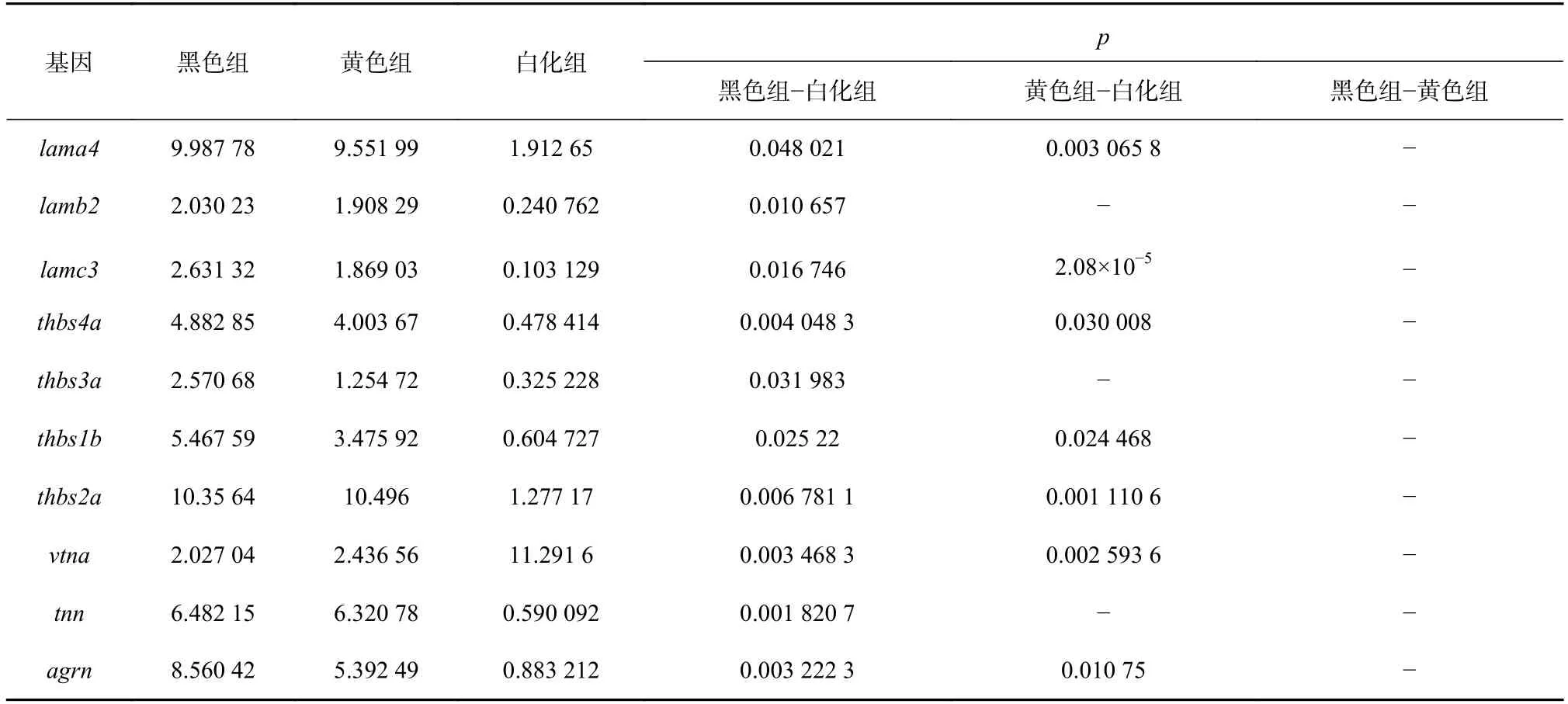
表1 参与 ECM 受体相互作用的基因表达量Table 1 Expressions for genes involved in the ECM-receptor interactions
我们还分析了其他色素细胞中涉及基因的表达水平(包括黄素、红素、虹色素、白细胞和氰基),发现这些基因在黄色和黑色样本之间存在显着的表达差异(表2)。而已有研究显示[22],Sox5作为Pax7a的下游基因发挥作用,控制叶黄素的分化和发育。本实验发现,参与叶黄素分化的Sox5基因(表S2,表S3)在白色-黄色和白色-黑色比较中均表现出显著的基因表达差异,这可解释黄色和白化皮肤之间的颜色差异。
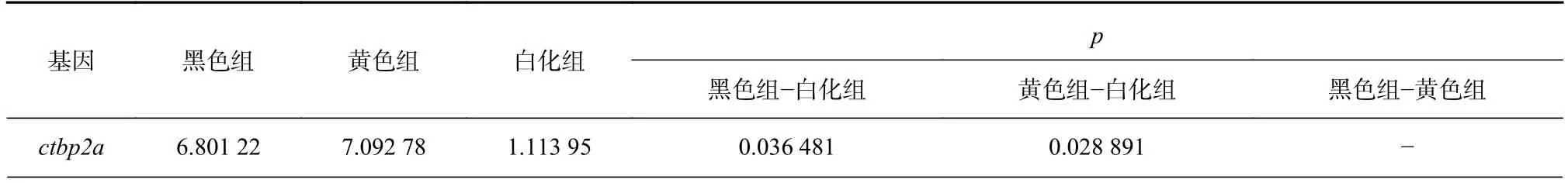
表2 参与色素沉积过程的基因表达量Table 2 Expressions for genes involved in the pigmentation process
续表 2
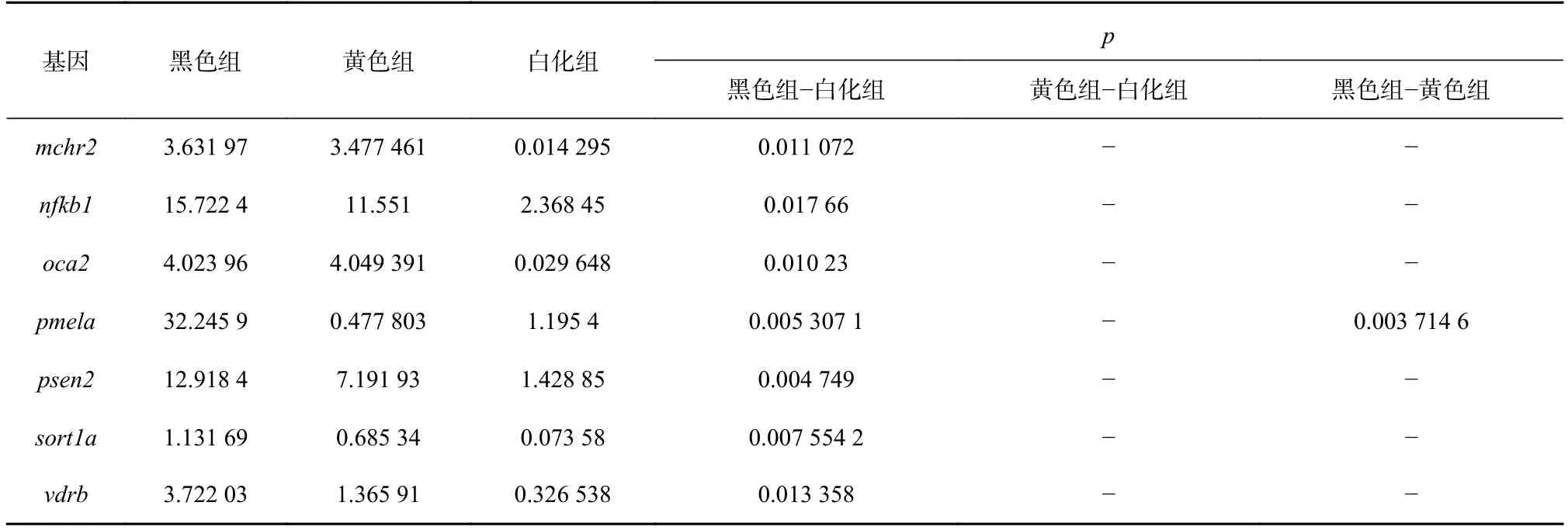
有研究显示[6,10],黑色素合成中的核心功能基因出现基因突变是导致许多物种白化现象的重要原因。研究结果显示,多数基因在黑色和白化样本之间表现出差异表达,并且表现出从黑色到黄色再到白化样本逐层递减表达的现象,并观察到参与黑色素合成的3 个核心基因(tyr、tyrp1b和dct)在白色皮肤样本中均出现基因表达量急剧下降现象。我们还发现,大多数差异表达的基因均表现出从黑色到黄色再到白化样品逐渐降低的表达,与许多参与黑色素生成的重要基因显示出一致的表达模式。如图4 所示,我们发现有11 个基因(ednrba、calm1b、adcy5/9、kitlga、kitb、wnt、fzd2/9a、mitfa、tyr、tyrp1b和dct基因)的表达水平在黑色样品中最高,但却在黄色和白化样本出现下调。其中,tyr基因负责编码酪氨酸酶,该酶有研究报道是黑色素合成的限速酶[23];tyrp1基因是一种酪氨酸酶相关蛋白,特异性位于黑色素细胞中,参与黑色素合成[24];而kitlga基因是编码KIT 的配体[25],在调节酪氨酸酶基因家族的转录和黑色素合成中发挥作用[26-27];MITF基因的突变与人类的白化病有关[28],并且有研究表明,MITF基因表达量差异会影响黑色素合成和黑色素细胞存活[29]。综上所述,我们解析了毕加索小丑鱼不同颜色皮肤组织的转录水平差异基因,发现了一批与黑色素生成密切相关的基因在白色皮肤组织中表达量明显下调的现象,为研究小丑鱼白色皮肤发生机理提供了理论基础,并为今后人为干扰基因表达从而达到调控小丑鱼体色提供理论依据。

图4 参与黑色素生成的关键功能基因的表达Fig.4 Gene expression for key functional genes involved in the melanogenesis
补充材料
表S1 验证黑色素生成关键功能基因表达的荧光定量PCR 引物
表S2 白化与黄色皮肤之间的差异基因
表S3 白化与黑色皮肤之间的差异基因
表S4 黄色与黑色皮肤之间的差异基因
表S5 白色与黑色皮肤之间的差异基因的功能富集分析结果
表S6 白色与黄色皮肤之间的差异基因的功能富集分析结果
表S7 不同皮肤之间的差异基因的信号通路富集分析结果
补充材料可通过https://www.hyxbocean.cn/获取。补充材料未进行排版和编辑,内容的准确性和科学性由作者承担。
