UTEVA 树脂分离纯化珊瑚中铀、钍的改进研究
2022-02-18汤震宇瞿建国张安余李秀保杜金洲
汤震宇,瞿建国*,张安余,李秀保,杜金洲
(1.华东师范大学 河口海岸学国家重点实验室,上海 200241;2.赛默飞世尔科技(中国)有限公司,上海 200125;3.海南大学 海洋学院 南海海洋资源利用国家重点实验室,海南 海口 570228)
1 引言
政府间气候变化专门委员会(IPCC)发布的报告指出,由于全球气候持续变暖,极端气候事件发生频率将增加[1-3];海洋作为全球水汽、热量储存与输送关键的组成部分,对全球气候起到了调节作用[4]。因此,海洋环境变化历史信息可为气候变化的预测提供依据。珊瑚生长具有连续性,其骨骼元素含量及同位素比值记录了海洋环境变化的信息,是研究海洋环境的优良载体;例如珊瑚的U/Ca 比值可用于重建古海水温度及pH 值[5-8],234U/238U、230Th/238U、232Th/238U 同位素比值可以计算珊瑚的年龄用于重建海平面高度[9-10]、反演风暴潮及厄尔尼诺-南方涛动(ENSO)气候变化事件[11-16],也可以推测珊瑚白化时间[17]等。珊瑚中U、Th 含量及同位素比值的准确测定是提取其记载的海洋环境变化信息的前提条件。
钙(Ca)是珊瑚最主要的基体元素,含量为亚g/g,而U、Th 属于痕量元素,因此在准确测定U、Th 含量或同位素比值前需经分离柱进行样品前处理过程,将其与Ca 等基体元素分离纯化,以消除基体效应;另外,由于U、Th 含量低,为获取稳定准确的数据,需对其富集。目前,分离富集珊瑚等碳酸盐类样品中的U、Th 有两种方法:一是采用Fe(OH)3共沉淀结合AG 1-X8 阴离子交换树脂,该方法先用Fe(OH)3共沉淀吸附U、Th,虽然去除了Ca 基体,但引入了大量的Fe 离子,在柱分离清洗Fe 时U 存在流失的风险[18],此方法耗时长、试剂消耗量大、洗脱酸浓度高,U、Th 全流程空白值较高(U、Th 全流程空白值分别为4.8~25 pg、0.5~150 pg[9,19-20]);二是采用UTEVA 特效树脂,该方法基于U、Th 在HNO3、HCl 介质中及其不同浓度下的吸附系数KdU、KdTh差异(表1)进行富集和分离[21-22],由于该流程无需进行共沉淀步骤,操作相对简单,此方法已应用于珊瑚、石笋等碳酸盐样品中U、Th 的分离纯化[23-25]。
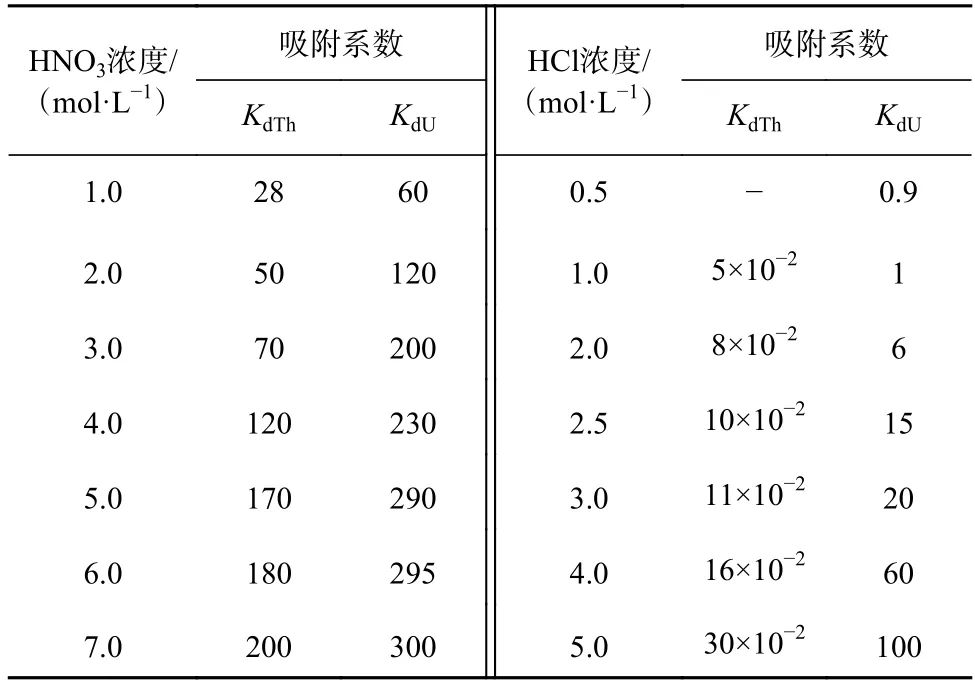
表1 不同浓度HNO3、HCl 介质中U 和Th 在UTEVA 树脂上的吸附系数Table 1 Absorption coefficient of U and Th on UTEVA resin with different concentrations of HNO3 and HCl
目前,文献报道采用UTEVA 树脂进行U、Th 分离的条件存在较大差异。例如,Douville 等[23]和廖泽波等[24]分别采用3.0 mol/L 和7.0 mol/L 的HNO3介质进行上样,分别用1.0 mol/L 和0.50 mol/L 的HCl 介质洗脱U。由于分离富集条件不同,最终得到的U、Th回收率存在较大差异。珊瑚等碳酸盐类样品中U、Th 含量低,且易受全流程空白的影响,样品前处理极具挑战性。前处理方法不统一,获得的实验结果缺乏可比性。
本研究基于前人工作,细致对比了U、Th 上样介质HNO3浓度和分步洗脱HCl 浓度对回收率以及流程空白值的影响,进一步完善了采用UTEVA 树脂一步分离富集珊瑚等碳酸盐类样品中U、Th 的前处理技术,结合高分辨电感耦合等离子体质谱仪测定,为开展珊瑚中U、Th 地球化学循环和U-Th 定年提供一定的技术支持。
2 实验方法
2.1 实验器材与试剂
本研究涉及的器材见表2。其中PFA 微型柱和PFA 溶样杯先用2%清洁剂浸泡2 d,然后用50%王水于室温浸泡12 h 后再100℃煮12 h,用Milli-Q水冲洗干净于2%的HNO3溶液中保存,临用前用Milli-Q 水冲洗干净;FEP 瓶用浓HNO3浸泡7 d,Milli-Q水冲洗干净,100 级洁净台中吹干备用;LDPE 瓶用2 mol/L HCl 室温浸泡2 周以上,用Milli-Q 水冲洗干净后于2%的HNO3保存,临用前用Milli-Q 水冲洗干净。
表2 实验器材Table 2 Experimental equipment
本研究涉及的试剂见表3。其中高纯浓HNO3:采用市售HNO3(AR,国药化学试剂公司)经二次石英亚沸蒸馏纯化制得;高纯HCl:采用市售HCl(AR,国药化学试剂公司)经PFA 等温扩散平衡装置纯化制得;HF、HClO4(浓度>99.999%,美国Sigma 公司)直接使用;UTEVA 树脂(50~100 μm、100~150 μm,法国TRIS KEM International 公司):用0.02 mol/L HCl 浸洗12 h,重复3 次,于0.02 mol/L HCl 中保存备用[27]。
表3 实验试剂Table 3 Experimental reagent
2.2 样品前处理
2.2.1 珊瑚样品预处理
本研究所用珊瑚样品为采自海南省文昌市五龙港的滨珊瑚,清洗方法参考文献[28],首先将珊瑚破碎至粒径小于5 mm 的颗粒,用0.20 mol/L NaOH 和30% H2O2(体积比为1∶1)溶液浸泡,将珊瑚颗粒表面漂白,Milli-Q 水冲洗干净,风干;然后用玛瑙研钵研磨先后过24 目和50 目尼龙筛,筛取粒径为0.28~0.70 mm 的珊瑚颗粒,再用0.20 mol/L NaOH 和30%H2O2(体积比为1∶1)溶液浸泡,直到不产生气泡为止;倾倒出上述溶液后用Milli-Q 水浸没摇晃并超声15 min,静置待珊瑚颗粒沉降,然后将水溶液倒出,重复多次直到清洗后的水溶液清澈透明,放于100 级洁净台中吹干,备用。
2.2.2 珊瑚样品消解
称取50.0 mg 预处理后的珊瑚样品于PFA 溶样杯中,加入1.0 mL 2.0 mol/L HNO3加热溶解后蒸发至100 μL 左右,稍冷后加入30 μL HClO4于130℃密闭消解6 h,进一步去除珊瑚颗粒中的有机质[9,29-30],蒸至近干,用1.0 mL 2.0 mol/L HNO3溶解后过柱。
2.2.3 U、Th 的分离纯化
移取约0.5 mL 左右UETVA 树脂装入PFA 微型柱(高:4 cm,内径:4 mm)中,经Milli-Q 水清洗后用2.0 mol/L HNO3条件化;将上述珊瑚样品溶液加载于UTEVA 树脂上,经2.0 mol/L HNO3清洗后分别用3.0 mol/L HCl 和Milli-Q 水洗脱Th 和U。全流程流速约为200 μL/min。本研究经参数优化后最终详细操作流程如图1 所示。
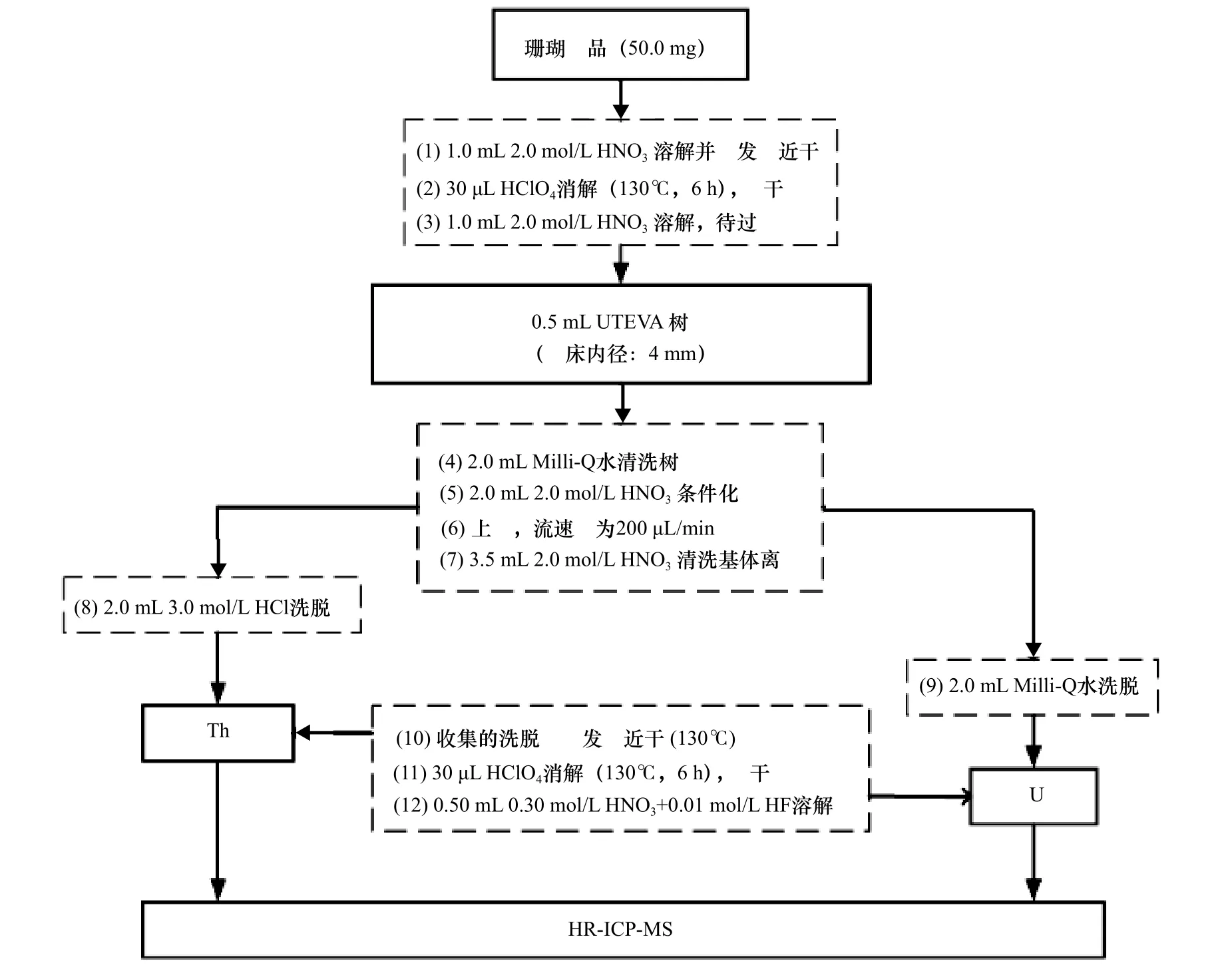
图1 珊瑚样品中U、Th 分离纯化流程Fig.1 The flow of U,Th separation and purification in coral sample
2.3 样品测定
每次测定前先用10.0 ng/L U 标准溶液优化仪器工作参数(表4),以获得最佳灵敏度和信号稳定性;利用1 000 μg/mL U、Th 母液逐级稀释并配制成浓度分别为10.0 μg/L、5.00 μg/L、1.00 μg/L、0.100 μg/L、0.010 μg/L混合标准溶液(1.00 μg/L Tl 作为内标),建立标准曲线(线性相关系数R2≥0.999 9),采用外标和Tl 内标校正法测定U、Th 含量。
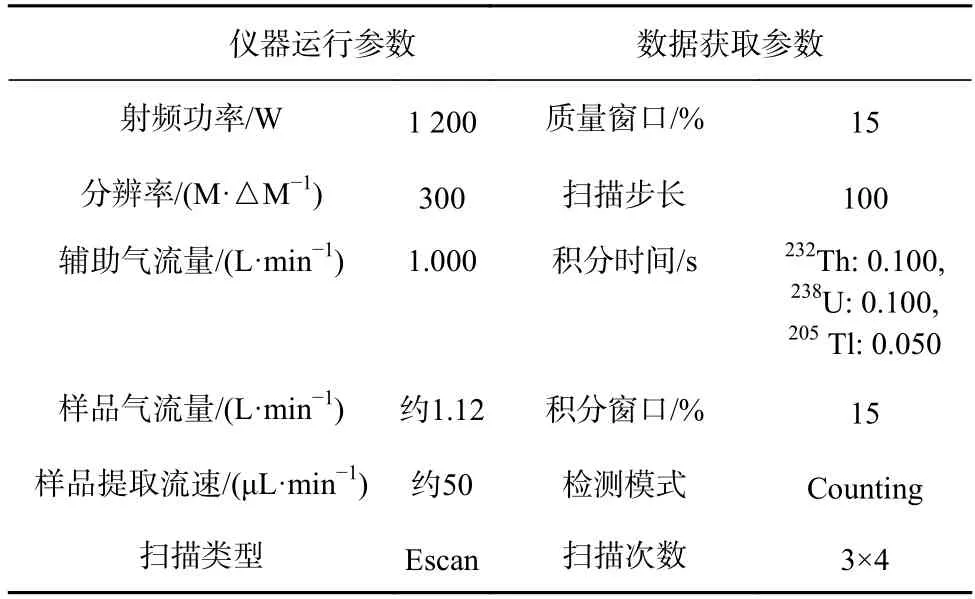
表4 Element 2 最佳工作参数Table 4 Optimized operational parameters of Element 2
将上述收集的U、Th 洗脱液加热蒸至近干,加入30.0 μL HClO4于130℃密闭消解6 h,去除UTEVA 树脂上引入的有机质[25],蒸干,用0.50 mL 0.30 mol/L HNO3+0.01 mol/L HF 溶解后按上述方法上机测定U、Th 含量。
3 结果与讨论
3.1 柱化学参数优化
由于前人研究[22-24,31]报道UTEVA 树脂分离纯化碳酸盐样品中U、Th 的柱化学参数有较大差异,不利于其对比选择。因此,本研究选用2.0 mL 50.0 μg/L U+0.300 μg/L Th 混合标准溶液对UTEVA 树脂粒径、上样HNO3介质浓度、U 和Th 洗脱液HCl 浓度等柱化学参数逐一进行优化。
3.1.1 树脂粒径比选
当树脂用量一定时,粒径的大小会直接影响富集分离的效率和速度。因此,本研究比较了50~100 μm、100~150 μm 两种粒径的UTEVA 树脂对U、Th 的分离效果(表5)。由表5 可知,从回收率看两种粒径的UTEVA 树脂对U、Th 分离效果没有显著性差别,均与文献[22,24,31]报道的U、Th 回收率在一致水平,但从试验耗时角度比较,粒径为100~150 μm 的UTEVA树脂从上样到洗脱全流程耗时仅约为1.5 h,与粒径为50~100 μm 的树脂相比,全流程耗时可减少一半,显著地提高了样品前处理效率。因此,本研究选用的UTEVA 树脂粒径为100~150 μm。
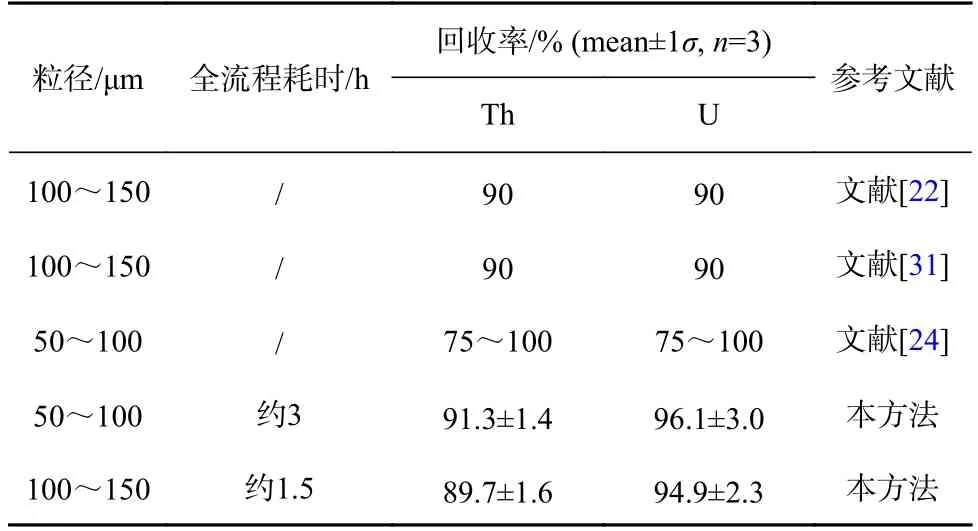
表5 不同粒径的UTEVA 对U、Th 的分离效果Table 5 Different particle size of UTEVA resin on U,Th separation efficiency
3.1.2 上样介质HNO3浓度对U、Th 吸附效率的影响
在HNO3介质中,U、Th 在UTEVA 树脂上的吸附系数远高于HCl 介质中的吸附系数,且随着HNO3介质浓度的增加而增大(表1)。因此,上样介质选用较高浓度的HNO3介质更有利于U、Th 吸附在UTEVA 树脂上,达到较高的富集效率。Douville 等[23]采用3.0 mol/L HNO3作为上样介质,U、Th 回收率分别为100%、90%;廖泽波等[24]采用7.0 mol/L HNO3作为上样介质,U、Th回收率为75%~100%。从这两篇文献报道结果看,上样介质HNO3浓度从3.0 mol/L 提高至7.0 mol/L,UTEVA 树脂对U、Th 的吸附效果未见明显改善,另外增加上样介质HNO3浓度不利于降低全流程空白。因此,本研究系统地比较上样介质HNO3浓度为1.0~7.0 mol/L 时对U、Th 吸附效率的影响(上样和清洗阶段HNO3浓度相同,U、Th 洗脱阶段HCl 介质浓度暂与文献[23-24]一致),结果如图2 所示。
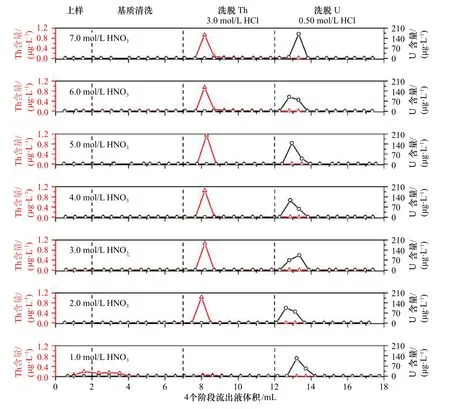
图2 HNO3 浓度对U、Th 吸附效率的影响Fig.2 The effect of HNO3 concentration on U,Th absorption efficiency
由图2 可以看出,当上样介质HNO3浓度为1.0 mol/L 时,在上样过程中已有部分Th 流失,且随着基质清洗过程进行,Th 继续流失,大约70% Th(0.400 ng)在这两个过程中流出;而在此上样介质HNO3浓度时U 没有流失,几乎被UTEVA 树脂完全吸附。当上样介质HNO3浓度为1.0 mol/L 时,Th、U 在UTEVA 树脂的吸附系数分别约为28 和60(表1)。由此推断,当Th 在UTEVA 树脂上的吸附系数提高到接近60 时,Th 也可被UTEVA 树脂完全吸附;而上样介质HNO3浓度从1.0 mol/L 增加到2.0 mol/L,Th 在UTEVA 树脂上的吸附系数从28 增加到50(表1),约增加了1 倍,接近U 被UTEVA 树脂完全吸附时的吸附系数60,认为此时Th 可被UTEVA 树脂完全吸附。图2 结果证明,当上样介质HNO3浓度为2.0 mol/L 时,在上样和清洗过程中Th 均未流失,几乎被UTEVA 树脂完全吸附。由此可见,当上样介质HNO3浓度不小于2.0 mol/L 时,U、Th 均可被UTEVA 树脂完全吸附,其回收率分别在92.5%~97.9%、92.0%~98.6%范围内,不再随着上样介质HNO3浓度的继续增加而进一步提高。因此,从吸附效果和控制全流程空白两方面综合考虑,本研究选取上样和清洗过程中HNO3浓度为2.0 mol/L。
3.1.3 HCl 浓度对U、Th 洗脱效率的影响
在HCl 介质中,U、Th 在UTEVA 树脂上的吸附系数KdU和KdTh差别很大,KdTh远小于KdU,且HCl 浓度在1.0~5.0 mol/L 范围内时,KdTh小于1,而KdU随着HCl 浓度的增加而显著增大,KdU/KdTh从20 逐渐增大至330(表1)。因此,采用HCl 浓度为1.0~5.0 mol/L的溶液均可将Th 解吸下来,而选用适当浓度的HCl溶液可将Th 和U 分步解吸。Douville 等[23]采用3.0 mol/L HCl 洗脱Th,1.0 mol/L HCl 洗脱U;廖泽波等[24]采用3.0 mol/L HCl 洗脱Th,0.50 mol/L HCl 洗脱U。但未见对比不同HCl 浓度对Th 和U 分步洗脱效果的相关报道。因此,本研究系统地比较了HCl 浓度为3.0 mol/L、2.5 mol/L、2.0 mol/L 时对Th 和U 分步洗脱效果的影响(图3)。
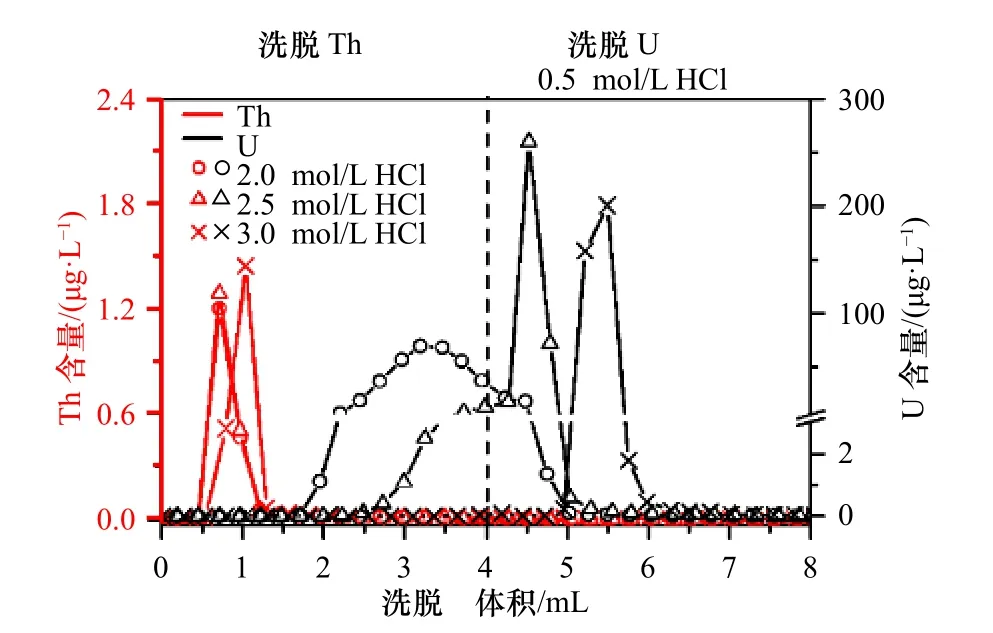
图3 HCl 浓度对U、Th 洗脱效率的影响Fig.3 The effect of HCl concentration on the U,Th elution efficiency
如图3 所示,洗脱液HCl 浓度为3.0 mol/L、2.5 mol/L、2.0 mol/L 时均能快速将Th 洗脱下来,且当洗脱液用量不小于1.5 mL 时均能将Th 洗脱完全,这与在该HCl 浓度范围内KdTh小于1 且基本不变的理论依据相吻合[21]。但在Th 洗脱阶段,随着HCl 浓度降,低洗脱液用量的增加,可明显观察到U 有流出现象,即当洗脱液HCl 浓度为3.0 mol/L 时,其用量达到4.0 mL未见U 被洗脱,而当洗脱液HCl 浓度降为2.5 mol/L时其用量达到2.5 mL U 开始被洗脱,当洗脱液HCl浓度继续降为2.0 mol/L 时其用量达到1.7 mL U 开始被洗脱。这是由于洗脱液HCl 浓度从3.0 mol/L 分别降低至2.5 mol/L、2.0 mol/L 时,U 在UTEVA 树脂上的吸附系数KdU从20 分别降到了15 和6(表1),在2.0 mol/L HCl 介质中的KdU值降到了3.0 mol/L HCl 介质中的3/10,使得U 在UTEVA 柱上的亲和力明显降低,致使U 的流出速度加快,最终导致Th 还未被洗脱完全U 已开始流出。由此可见,KdU值的下降会制约Th 洗脱液HCl 浓度的进一步降低。因此,为了确保达到U、Th 完全分离的目的,本研究采用2.0 mL 3.0 mol/L HCl 溶液洗脱Th,与文献[23-24]报道一致。
Douville 等[23]报道了采用4.0 mL 1 mol/L HCl 洗脱U,而廖泽波等[24]采用4.0 mL 0.50 mol/L HCl 洗脱U,其回收率分别为100%、75%~100%,两者对U 均有很好的洗脱效果。由于在HCl 介质中U 在UTEVA树脂上的吸附系数KdU随着HCl 浓度的降低而显著减小(表1)。由此可见,降低洗脱液HCl 浓度有利于U 在UTEVA 柱上的解吸,同时考虑减小试剂浓度有利于降低全流程空白。因此,本研究系统地比较了HCl 浓度为0~0.50 mol/L 时对U 洗脱效率的影响(图4)。从图4 可见,当洗脱液HCl 浓度为0~0.50 mol/L 时,U 均能从UTEVA 树脂上快速洗脱,且当洗脱液用量达到3.0 mL 时均能将U 洗脱完全,回收率均达到95%以上。且随着洗脱液HCl 浓度逐步降低,U 洗脱曲线峰形逐渐变窄,拖尾现象也随之逐渐减弱,当洗脱液HCl 浓度降低为0,即采用Milli-Q水洗脱时,几乎无拖尾现象,且当Milli-Q 水用量达到1.5 mL 时几乎可将U 完全洗脱。因此,本研究选用2.0 mL Milli-Q 水洗脱U,回收率为95.5%,与文献报道方法对比不仅降低了洗脱液HCl 的浓度,而且大大减少了洗脱液用量,缩短了实验耗时。
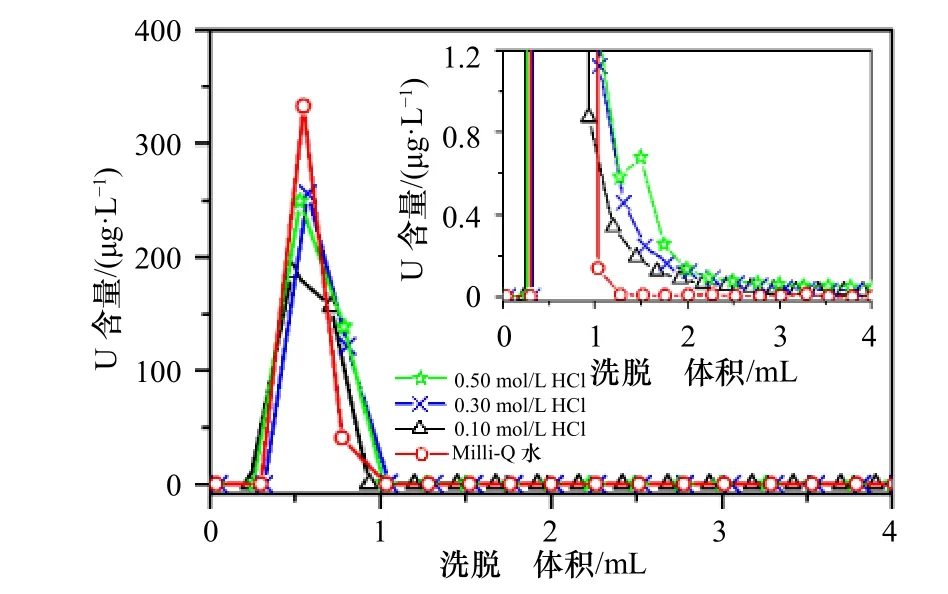
图4 HCl 浓度对U 洗脱效率的影响Fig.4 The effect of HCl concentration on U elution efficiency
3.1.4 基体的分离
珊瑚中主要成分为CaCO3,其Ca 含量高达亚g/g级,而U、Th 为痕量元素,其含量与Ca 相比至少相差105倍,为了准确测定珊瑚中U、Th 含量和同位素比值就必须去除Ca 等元素引起的基体效应。根据文献[8,23,32-35]报道的珊瑚中Ca、Sr 和Mg 的含量范围,结合本实验方法,取Ca、Sr 和Mg 高值制备了珊瑚模拟样品溶液(其中Ca、Sr、Mg、U、Th 含量分别为34 g/L、0.73 g/L、0.10 g/L、38.5 μg/L、0.25 μg/L),并在上述优化好的柱化学参数条件下考察了该模拟样品溶液中Ca、Sr 和Mg 主要基体元素的分离效果(图5)。
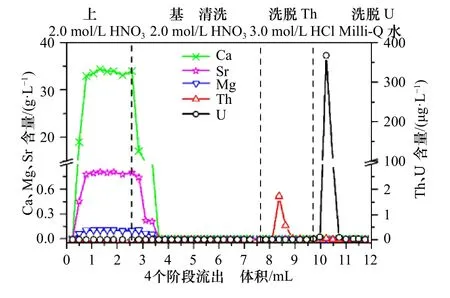
图5 基体元素的清洗及分离效果Fig.5 The efficiency of matrix elements washing and separation
如图5 所示,随着样品溶液不断加载,其流出液中Ca、Sr 和Mg 的含量急剧升高,并稳定在上样溶液中的各基体元素的原始含量值;上样结束后用与上样相同介质和浓度的2.0 mol/L HNO3溶液清洗Ca 等基体元素,随着清洗溶液不断加载,其流出液中Ca、Sr和Mg 的含量急剧下降,当清洗液用量达到3.0 mL 时,流出液中Ca、Sr 和Mg 含量分别降到380 μg/L、14 μg/L和37 μg/L。因此,本研究选用3.5 mL 2.0 mol/L HNO3溶液清洗残留在柱床上的基体元素,以消除Ca 等基体元素对测定U、Th 产生的基体效应。经过UTEVA树脂分离和清洗过程几乎将珊瑚模拟样品溶液中的Ca、Sr 和Mg 完全分离去除,最终测定Th 和U 洗脱液中残留的Ca、Sr、Mg 含量分别约为123 μg/L、5.00 μg/L、35.0 μg/L,实际珊瑚样品分离纯化U、Th 时,收集的U、Th 洗脱液中残留的Ca、Sr、Mg 含量分别约为97.0 μg/L、1.00 μg/L、4.30 μg/L;与珊瑚模拟样品溶液上柱清洗后残留的Ca、Sr、Mg 基体离子含量结果一致,且残留的Ca 含量均相对略高于Sr 和Mg。因此,本研究在2.00 μg/L U 和20.0 ng/L Th 混合标准溶液中掺入100~1 000 μg/L Ca 基体,进一步考察残留的Ca 基体对U、Th 测定的影响(图6)。
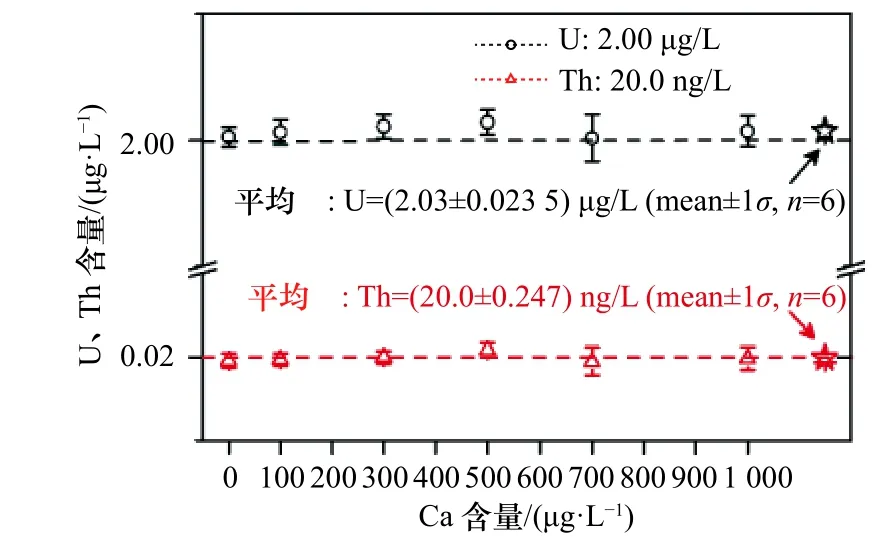
图6 Ca 基体对U、Th 测定的影响Fig.6 The effect of residue Ca matrix on U,Th measurement
从图6可以看出,当2.00μg/LU和20.0μg/LTh混合标准溶液中存在100~1000μg/LCa基体时,U、Th测定值均在配制的标准值上下波动,U、Th 均值分别为(2.03±0.023 5)μg/L、(20.0±0.247)ng/L,相对标准偏差分别为1.16%、1.24%,误差分别为1.50%和0;经单样本T检验显示,U、Th 测定结果无显著性差异(p>0.05),说明当基体元素Ca 含量不小于1 000 μg/L时,对U、Th 的准确测定不会造成影响。
综上所述,本研究所优化后的UTEVA 树脂一步分离纯化珊瑚中U、Th 的流程能达到试验目的,而且快速有效。
3.2 全流程空白
按照上述优化后的UTEVA 树脂一步分离纯化珊瑚中U、Th 的流程重复进行全流程空白试验,本方法U、Th 全流程空白值分别为(1.32±0.65)pg、(2.05±0.63)pg(表6),经分析和实验验证,本方法U、Th 空白值来自试剂空白(分别为0.34 pg、0.64 pg)和树脂空白(分别为0.98 pg、1.41 pg),其中树脂空白为全流程空白值的主要贡献者。由表6 可知,本方法Th 的空白值与Shao 等[36]报道一致,均远低于Pons-Branchu 等[20]的报道值,仅占其1.4%左右,而U 的空白值与Shao等[36]、Pons-Branchu 等[20]的报道相比降低了87%以上。
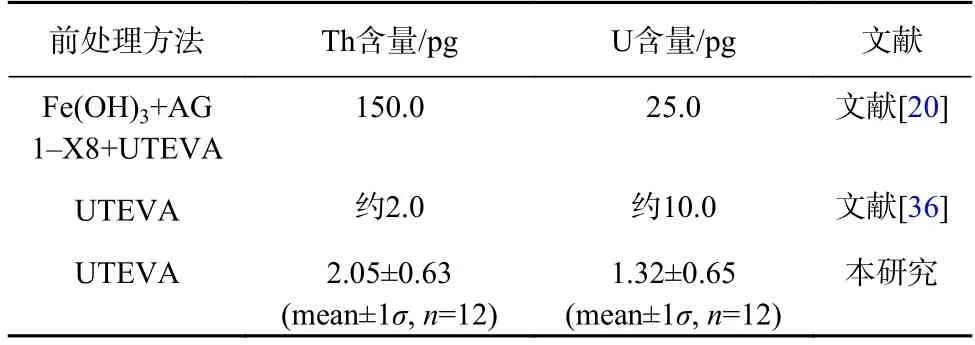
表6 U、Th 全流程空白值Table 6 Procedure blank of U,Th
3.3 准确度与精密度
按本研究优化后的UTEVA 树脂一步分离纯化珊瑚中U、Th 的全流程,选用2.0 mL 50.00 μg/L U+0.300 μg/L Th 混合标准溶液(100.0 ng U 和0.600 ng Th)进行重复试验,测定结果如表7 所示。U、Th 测定值分别为(95.5±1.6)ng、(0.554±0.016)ng,相对标准误差分别为1.7%、3.0%,平均回收率分别为95.5%、92.3%,与Douville等[23]和廖泽波等[24]分别报道的回收率为90%~100%、75%~100%相当。
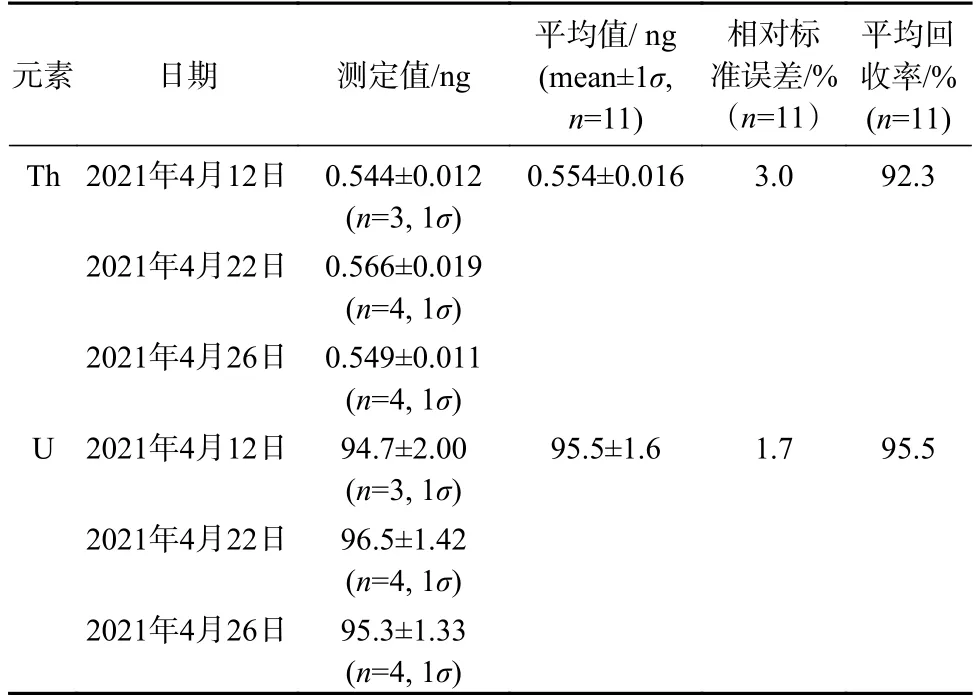
表7 U、Th 回收率与相对标准误差Table 7 U,Th recovery and relative standard error
3.4 方法应用
应用本研究改进的方法重复测定了3 个海南滨珊瑚样品中U、Th 含量(表8)。U 含量分别为(3.46±0.02)μg/g、(2.67±0.05)μg/g、(2.15±0.07)μg/g,Th含量分别为(10.12±0.24)ng/g、(4.82±0.10)ng/g、(5.62±0.12)ng/g,3 个海南滨珊瑚样品U、Th 测定结果均落在文献[20,29,37]报道珊瑚中U(2.14~3.52 μg/g)、Th(0.029~64.7 ng/g)含量范围内,结果可信;方法测定精度在3.3%以下,全流程U、Th 加标回收率分别在97.9%~100.9%,97.3%~99.7%范围内,准确度高。
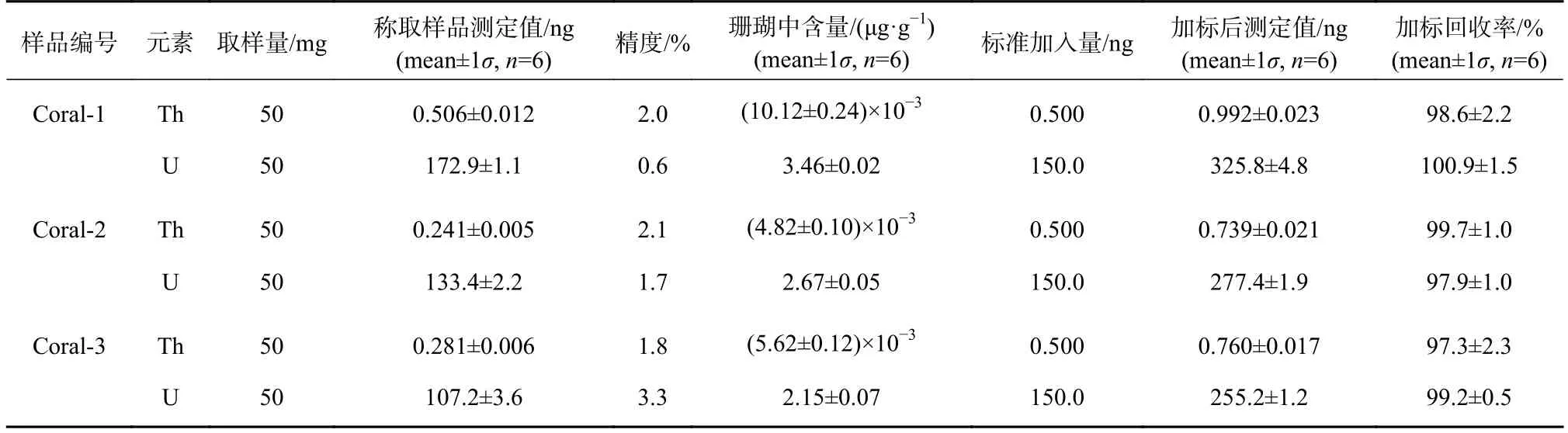
表8 海南滨珊瑚样品中U、Th 含量Table 8 U,Th contents in Hainan coral samples
4 结论
本研究通过对比UTEVA 树脂粒径和优化柱化学参数完善了UTEVA 树脂柱一步分离纯化珊瑚中U、Th 的样品前处理方法,与文献对比降低了上样HNO3浓度与U 洗脱液HCl 浓度,降低了U 的全流程空白值,全流程分离纯化耗时缩短一半,增加了样品前处理通量。将此方法应用至3 个海南滨珊瑚样品中U、Th 的分析测定,结果显示,U、Th 含量分别为2.15~3.46 μg/g、4.82~10.12 ng/g,全流程U、Th 加标回收率为97.9%~100.9%、97.3%~99.7%,测定精度在3.3%以下,准确度高,精密度好。本研究所改进的UTEVA柱一步分离纯化U、Th 的样品前处理技术不仅可以准确测定珊瑚等碳酸盐类样品中U、Th 含量,而且还可用于U、Th 同位素分析,可为后续海洋学领域U、Th 地球化学循环和定年相关研究提供技术支持。
