海州湾秋季鱼类β 多样性组分分析及其与环境因子的关系
2022-02-18李雪童徐宾铎薛莹任一平张崇良
李雪童 ,徐宾铎 ,薛莹 ,任一平,,张崇良*
(1.中国海洋大学 水产学院,山东 青岛 266003;2.海州湾渔业生态系统教育部野外科学观测研究站,山东 青岛 266003;3.青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237)
1 引言
1960 年,Whittaker 首次将β多样性定义为群落组成的变化幅度,是衡量某一地理区域内物种组成、群落结构变化的重要指标,它将α多样性和γ多样性联系起来,是生物群落的重要特征之一[1-2]。β多样性在生物多样性保护中具有重要应用,能考虑到保护区域选择与面积规划中的互补性、灵活性和不可替代性,实现设计方案的优化以及保护效果的最大化[3-5]。但自β多样性提出以来,关于其定义和度量方法存在较多争议,从而未能受到广泛关注[5]。目前,β多样性研究仍集中在陆地和淡水领域[6-8],有关海洋生态系统的研究大多围绕浮游动物展开,如戴美霞等[9]通过研究象山港浮游动物β多样性与环境因子的关系发现,水温、溶解氧浓度和水深是最重要的影响因子;朱艺峰等[10]对国华电厂温排水海域浮游动物进行了β多样性研究,也得出了类似结论。目前,针对海洋生态系统中鱼类β多样性开展的研究较少,未对β多样性与环境因子的关系进行深入探讨。
海州湾地处黄海中南部[11],曾是多种重要经济鱼类的产卵场、育幼场和索饵场,但近年来受到过度捕捞、环境污染等因素的干扰,海州湾渔业资源衰退,个体小型化、低质化趋势显著[12-13]。目前,该海域鱼类群落多样性研究多集中于α多样性,β多样性与环境因子关系的相关研究罕见。本研究基于广义非相似性模型(Generalized Dissimilarity Modelling,GDM)分析β多样性与环境因子的关系,预测区域群落组成变化(β多样性)[14]。该方法是矩阵回归的一种扩展,用于处理群落组成差异与生态距离以及环境梯度的非线性生态关系[14]。该模型可用于多种研究,包括群落物种组成的空间格局可视化、物种分布模型、评估气候变化对群落的影响等[14-17]。
本研究根据2013-2017 年秋季海州湾渔业资源底拖网调查数据,对不同调查站位间和海州湾整体海域的鱼类β多样性进行度量,并分解为相应的周转组分和嵌套组分进行分析。根据计算结果,结合环境监测数据,构建相应的GDM,探究环境因子对β多样性及其组分的影响,以期为渔业资源的管理与可持续利用、海洋保护区的规划等提供科学依据。
2 材料与方法
2.1 数据来源
研究数据来源于2013-2017 年秋季在海州湾及其邻近海域(34°20′~35°40′N,119°20′~121°10′E)进行的渔业资源调查。调查站位采用分层随机取样的方法进行设计[18],根据水深、底质类型等环境因子将调查海域划分为5 个区域,并规划调查站位共76 个(图1),每个航次在各区域随机选择一定数量的站位进行调查,其中A 区选取2 个站位(图中字处站位,后同),B 区4 个,C 区2 个,D 区7 个,E 区3 个。该站位选取方法经证实科学有效[18]。
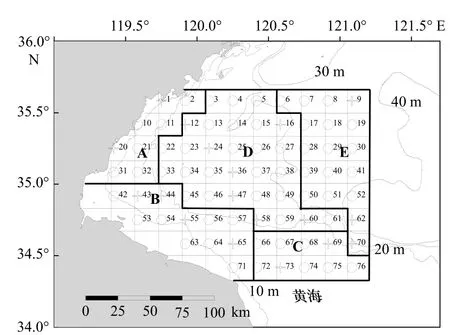
图1 海州湾及其邻近海域渔业资源调查站位Fig.1 Sampling stations of the fishery resource surveys in the Haizhou Bay and its adjacent waters
调查船为单拖渔船,功率为220 kW。采用底拖网方式进行调查作业,拖网时网口高度约为6 m,宽约为25 m,网囊网目约为17 mm,各调查航次使用的网具一致。渔获物样品的采集与处理均按照《海洋调查规范第6 部分:海洋生物调查》(GB/T 12763.6-2007)[19]进行,样品分析鉴定到种。
研究涉及的环境因子包括调查海域水深、水温、海水盐度以及叶绿素a浓度。其中,水深、温度和盐度均提取自FVCOM(Finite-Volume Community Ocean Model),该模型是一种无结构网格、有限体积、自由表面三维原始方程的海洋环流模型[20]。相关研究表明,该数据准确可靠[21]。叶绿素浓度数据来源于NOAA/STAR海岸监测及海洋监测遥感数据(https://coastwatch.pfeg.noaa.gov/data.html),使用克里金插值法匹配调查数据的空间分辨率[22](表1)。采用Pearson 相关系数检验环境因子间的相关性(表2)。
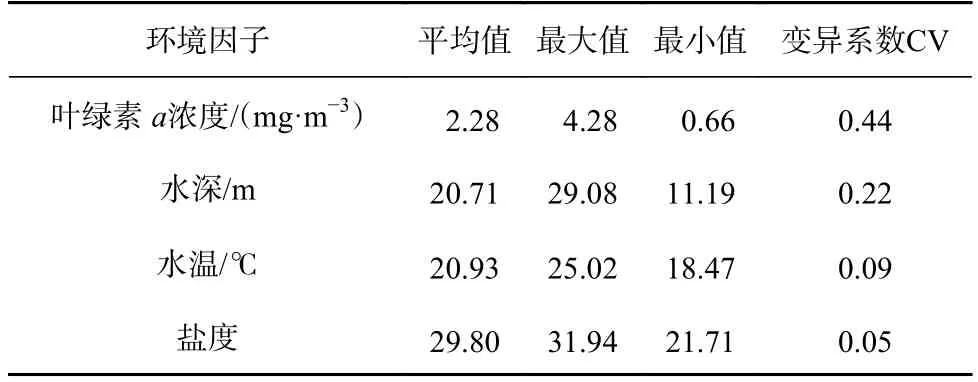
表1 海州湾及其邻近海域环境因子监测结果Table 1 Monitoring results of environmental factors in the Haizhou Bay and its adjacent waters
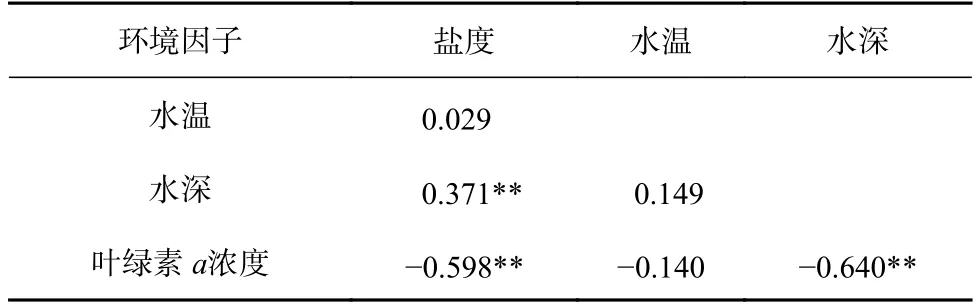
表2 环境因子的Pearson 相关系数Table 2 Pearson correlation coefficients between environmental factors
2.2 β 多样性的组分分析
β多样性可以分解为两部分,即周转组分和嵌套组分[23-25]。周转组分源于群落间物种的替代,即从一个群落到另一个群落的物种组成变化,同时包含物种丢失和物种获得两个过程;嵌套组分源于群落间物种的非随机丢失过程,即一个群落包含的物种是另一个群落的子集[25]。
根据Baselga[25]提出的β多样性分解方式,采用多站位方法计算调查海域的总β多样性及其周转、嵌套组分(表3),总β多样性(βSOR)及其周转组分(βSIM)和嵌套组分(βNES)的关系[25]为
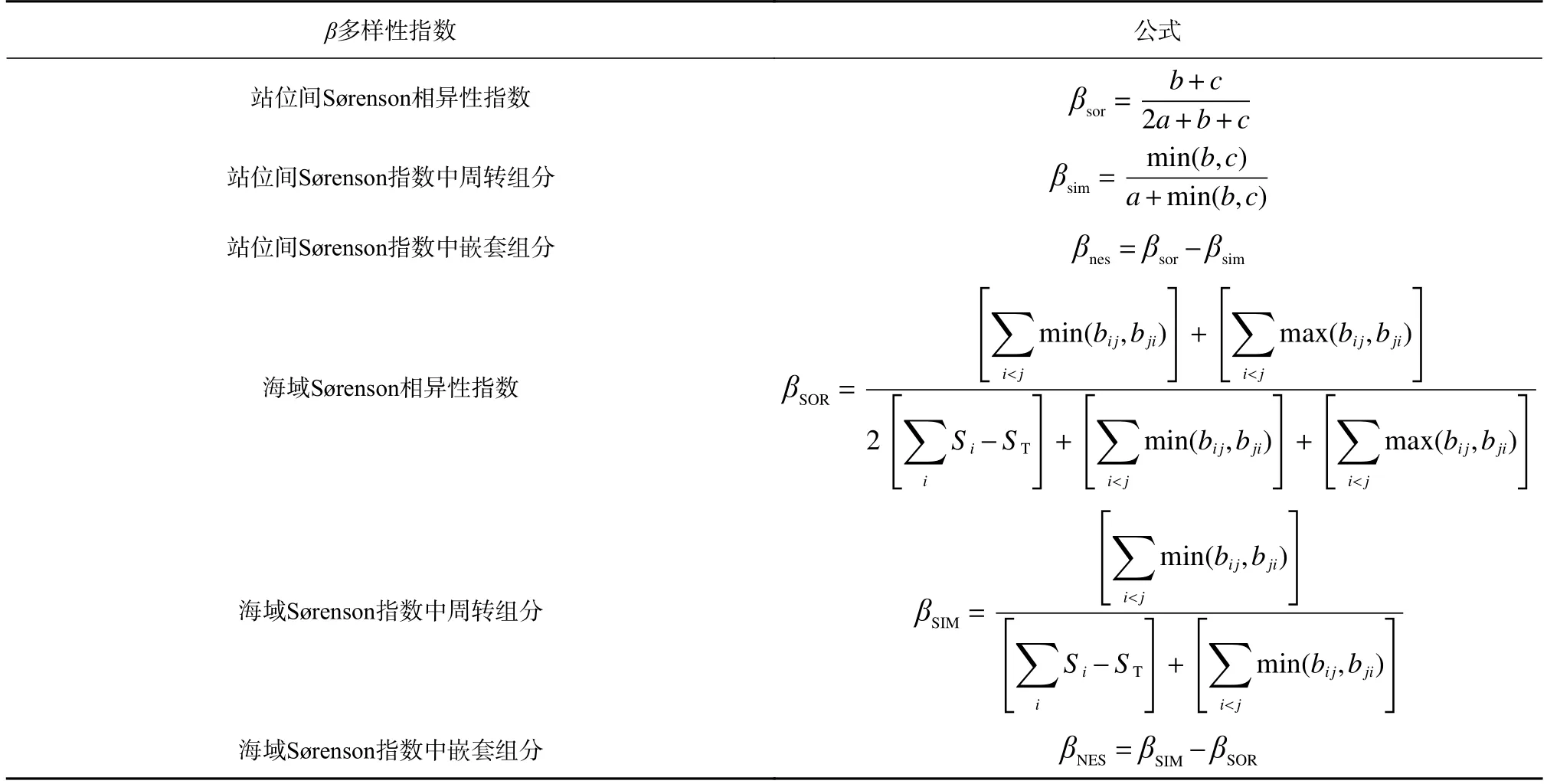
表3 β 多样性指数及其计算公式Table 3 Calculation formulas of β diversity indices
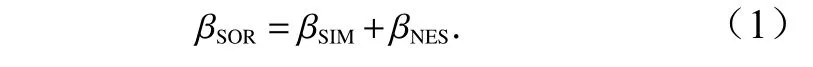
研究分别计算了全调查海域的β多样性以及深水区和浅水区的β多样性。深水区和浅水区的划分是根据渔业资源调查的20 m 等深数据,结合相关研究中群落结构的K均值聚类分析得出[26-27]。
采用配对方法计算站位间的β多样性βsor[28]及其周转组分βsim[29]和嵌套组分βnes[25](表3),公式为

并采用小提琴图[30]分析海州湾整体海域及其深水区和浅水区的βsor、βsim和βnes度量值及其分布范围、分布密度和年际波动等。
2.3 广义非相似性模型(GDM)
本研究建立的GDM 以站位间群落组成的非相似性βsor及其周转组分βsim、嵌套组分βnes作为响应变量,以经由样条函数变换和计算后的地理距离、环境变量的差值作为预测变量,并以指数函数的形式进行连接,对数变换后得[31]:
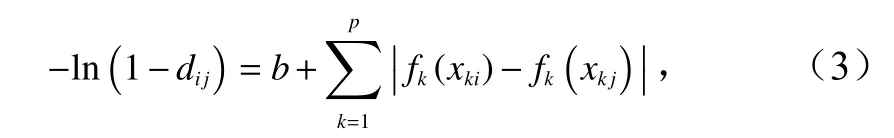
式中,dij为 站位i与站位j间群落组成的非相似性;b为截距项;k为预测变量(k=1,2,···,P);xki和xk j分别为预测变量k在站位i和j的观测值;fk(xk)为样条转换函数,fk(xk)=a×(I-spline),其中,a为常数,Ispline 为样条函数,其形式为平滑单调增加,以满足群落组成的非相似性随生态距离的增加而增大的特点[14]。本研究使用3 个样条函数,并以预测变量的0、50%和100%分位数作为节点进行样条函数的分段拟合,避免模型的过度拟合问题[14]。
GDM 能够自动筛选预测变量,故预测变量间通常不进行共线性诊断[32]。若某变量对β多样性及其组分产生影响,表明该变量对模型拟合有效。模型拟合后有偏响应图输出[33],可以通过响应曲线的形状直观展示不同变量的影响程度:曲线在y轴的变化幅度指示该变量对响应变量影响程度的大小;曲线在某处的斜率指示该环境梯度下响应变量的变化速率[34]。为排除对β多样性及其组分影响程度较小的环境因子,预先对预测变量进行逐步筛选和拟合,运用累计偏差解释率判断模型的拟合效果,将贡献率低于0.50%的因子排除,其不参与最终的模型构建。
本研究中的统计分析、模型构建等均使用R 4.0.2软件完成。
3 结果
3.1 β 多样性及其组分的时空特征
海州湾整体海域鱼类β多样性βSOR及其周转组分βSIM在2013-2017 年间均维持在较为稳定的状态(βSOR:0.842~0.853;βSIM:0.773~0.808);浅水区和深水区的βSOR和βSIM均呈波动态势,且浅水区变化较为明显;深水区的βSOR和βSIM均高于浅水区,但低于海州湾整体海域。浅水区总β多样性βSOR在2013 年最高,为0.729,2017 年最低,仅为0.530;深水区在2014 年达到峰值,为0.792,2013 年取得最低值,为0.742。浅水区周转组分βSIM于2016 年达到最高值为0.606,2014 年最低为0.483;深水区在2014 年和2013 年取得最高值和最低值,分别为0.732 和0.625。对于嵌套组分βNES,浅水区的波动程度最大(0.022~0.180),其次为深水区(0.048~0.130),海州湾整体海域βNES的波动最小(0.038~0.075)(图2)。
海州湾整体海域以及深水区、浅水区,其周转组分βSIM在β多样性中所占比例均大于嵌套组分βNES,基本维持在80%以上。周转组分远大于嵌套组分,表明海州湾鱼类群落组成以周转模式变化。除2017 年外,浅水区的βNES及其在β多样性中所占比例均高于海州湾整体海域及深水区(图2)。
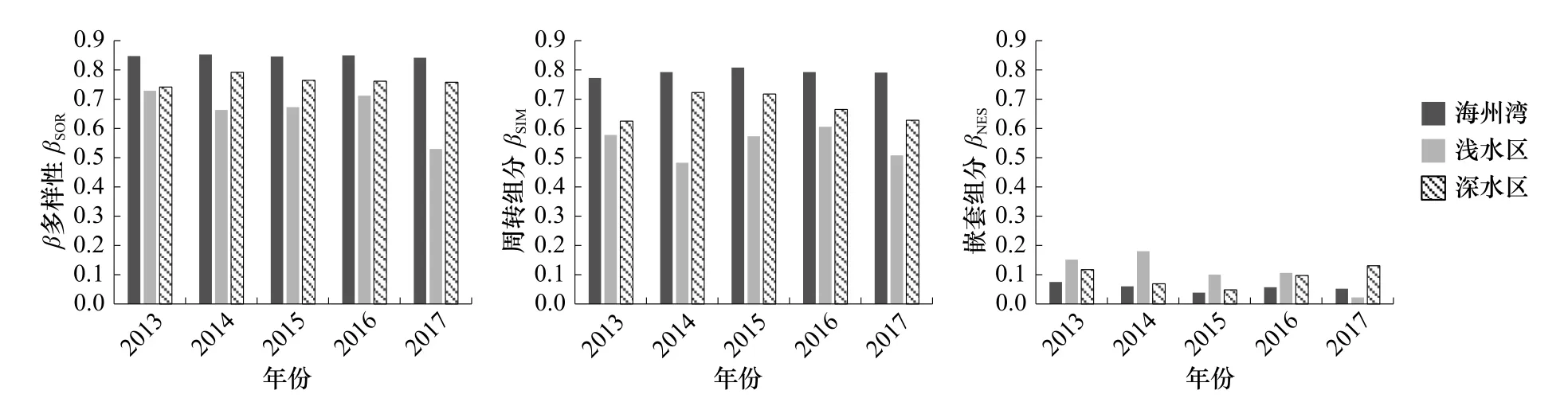
图2 海州湾鱼类β 多样性及其组分Fig.2 β diversity and its components of fish species in the Haizhou Bay
3.2 β 多样性及其组分的时空分布
海州湾整体海域及浅水区、深水区鱼类β多样性及其周转和嵌套组分的分布特征不同。采用配对方法计算的β多样性指数,除个别年份外,调查海域整体的βsor及βsim分布接近正态分布,其值大多分布在中位数附近,并向两端逐渐递减;嵌套指数βnes则为单峰分布形式,其值向高值端递减,超过0.50 的值很少(图3)。βsor、βsim和βnes的分布在年际间变化不大,其最高值、最低值以及中位数的波动,均维持在较稳定的范围内(图3)。
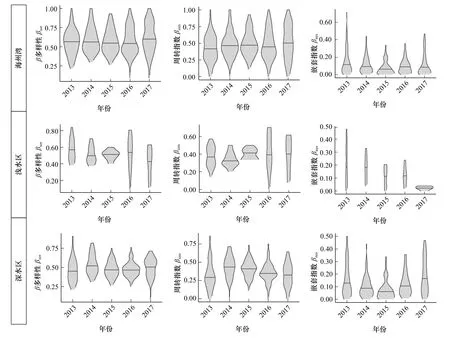
图3 海州湾鱼类β 多样性及其组分分布Fig.3 Distributions of β diversity and its components of fish species in the Haizhou Bay
浅水区βsor、βsim和βnes的分布形式与整体海域和深水区均差异较大,且分布形式在年际间具有显著差异。深水区β多样性及其组分的分布与海州湾整体类似,除2017 年βsor的度量值多分布在中位数以上外,深水区βsor和βsim的值均集中分布在中位数附近或呈均匀分布;βnes呈单峰分布,其值集中在中位数以下(图3)。
3.3 广义非相似性模型(GDM)分析
通过预测变量筛选,排除贡献率低于0.50%的变量,最终选择地理距离、叶绿素a浓度、水温和盐度4个预测变量,构建了β多样性βsor模型Model-βsor;选择地理距离、叶绿素a浓度和盐度3 个变量,构建了周转组分βsim模型Model-βsim;选择水温和盐度,构建了嵌套组分βnes模型Model-βnes(表4)。
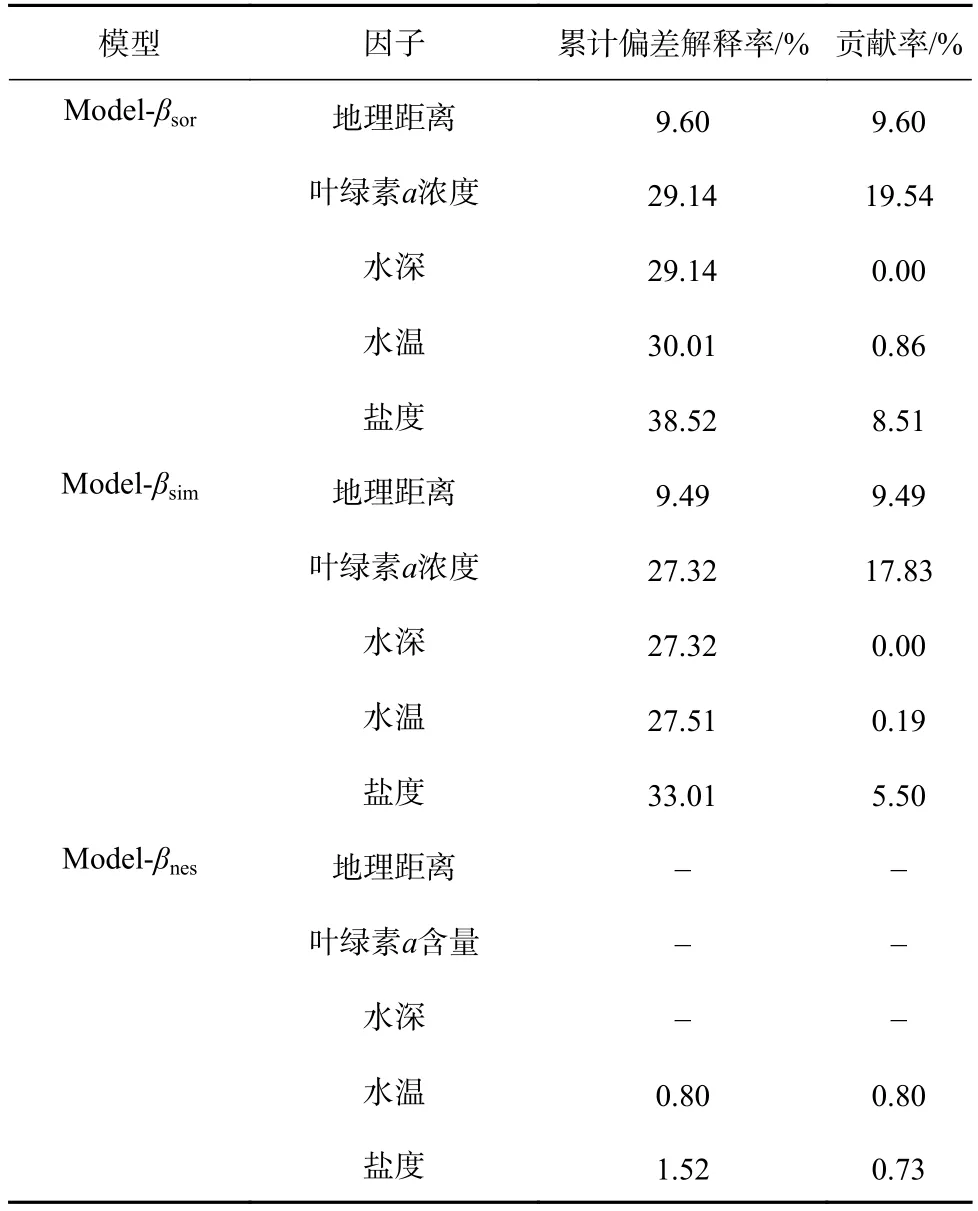
表4 预测变量筛选结果Table 4 Screening results of predictors
拟合的GDM 结果表明,海州湾鱼类站位间β多样性及其周转和嵌套组分均随环境异质性的增加而增大,但嵌套组分的变化程度相对较小。相应的预测变量可解释海州湾鱼类β多样性βsor的比例为38.52%,其中盐度和叶绿素a浓度的影响程度最大,其相对贡献比例分别为48.19%和43.70%;其他预测变量的累计相对贡献比例仅为8.09%。预测变量可解释周转组分βsim的比例为32.83%,其中叶绿素a浓度对βsim的影响程度最大,其相对贡献比例超过50%。相应预测变量可解释嵌套组分βnes的比例仅为1.52%,其中水温的影响较大(图4)。
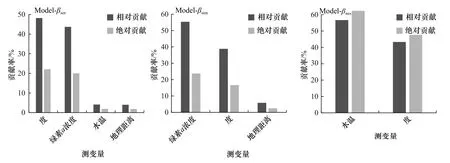
图4 预测变量对β 多样性及其组分的贡献Fig.4 Contributions of predictors to β diversity and its components
3.4 β 多样性与环境因子的关系
Model-βsor输出的偏响应图表明,盐度对海州湾鱼类β多样性的影响最大,在海水盐度低于30 时,βsor随海水盐度的增长迅速上升;盐度超过30 后稍有减缓趋势。β多样性的增长速度随叶绿素a浓度的增加先升高后降低,且变化幅度相对较大;地理距离对海州湾鱼类β多样性的影响与叶绿素a浓度类似,但影响程度较小。海水温度在20℃以下时,β多样性受水温影响不大;超过21℃时出现较明显的上升趋势(图5)。
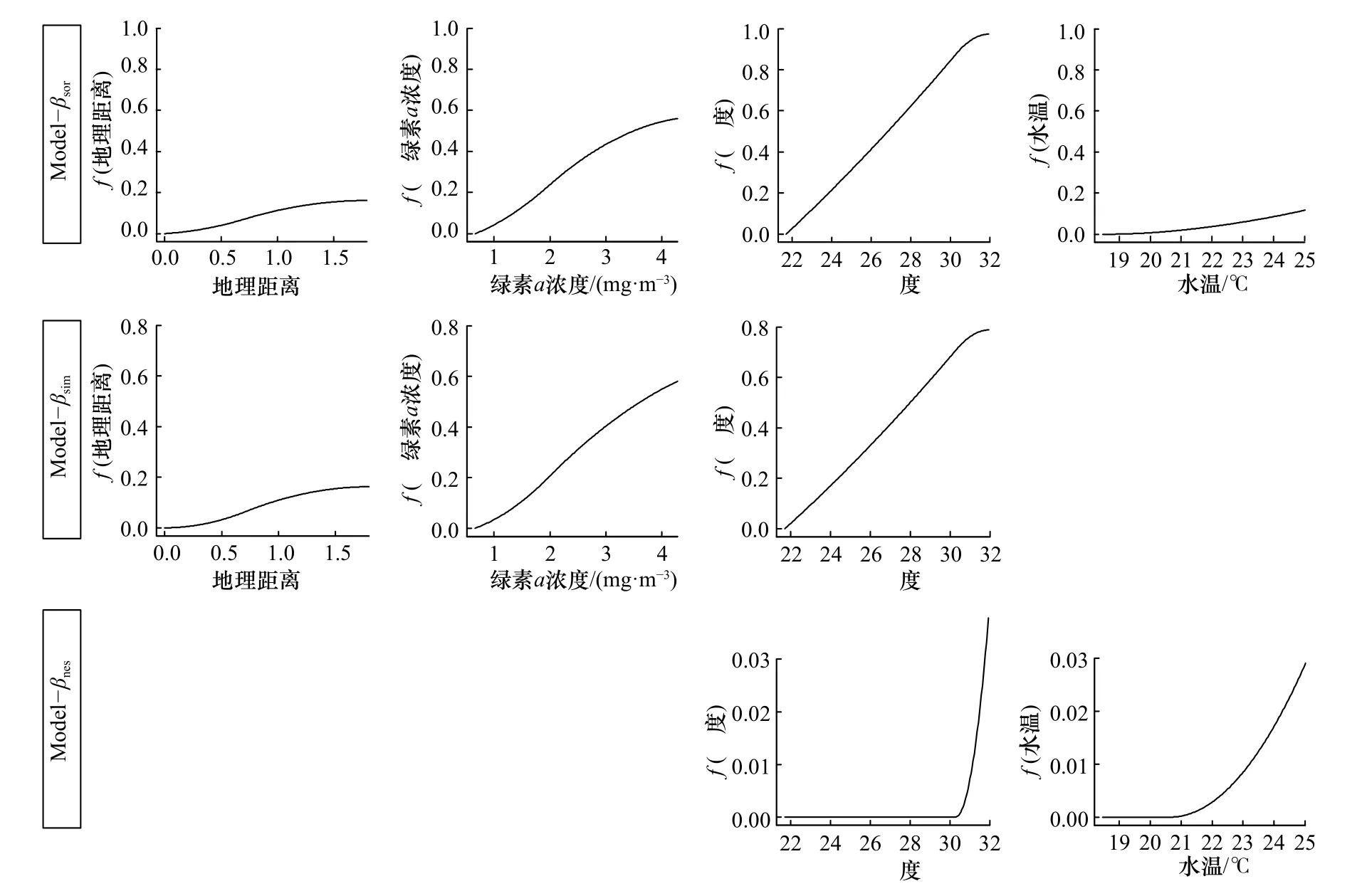
图5 广义非相似性模型分析β 多样性的偏响应图Fig.5 Partial response graphs of generalized dissimilarity modelling for analyzing β diversity
Model-βsim表明,盐度对海州湾鱼类β多样性周转组分βsim的影响与βsor接近一致,随海水盐度的增长以近似直线的趋势上升。随海水叶绿素a浓度和地理距离的增加,βsim的变化趋势与βsor类似,其变化速度均表现为先升高随后降低(图5)。
与上述模型输出的偏响应图不同,βnes在海水盐度和温度较低时保持稳定;在盐度达到30、水温达到21℃时迅速上升(图5)。
4 讨论
4.1 β 多样性及其组分的时空变动
作为度量群落物种组成变化的重要指标,β多样性与许多生物学、生态学的热点问题紧密相关,其分布特征、时空变动信息可为海洋保护区的选址等提供重要指导[5]。本研究中,β多样性及其组分在调查年际间均呈现不同程度的波动,但其分布特征基本一致,反映出区域的环境条件特征以及鱼类的适应性分布。相对于远岸深水海域,水深20 m 以浅的近岸海域,鱼类β多样性以及周转组分较低、嵌套组分较高,且在年际间的波动程度均相对较大。造成该差异的原因,一方面是由于浅水区的环境条件在站位间相差不大,使得鱼类群落的组成与结构在站位间较为接近,βsor和βsim均较低;另一方面,本研究浅水区可能易于嵌套结构的形成。Patterson 和Brown[35]研究提出共同的生物地理历史、相似的栖息地环境和物种间的生态等级关系是嵌套式群落结构的形成条件,相对于深水区,本研究划分浅水区更符合嵌套结构的形成条件,使得该区域嵌套组分βnes相对较高。
本研究表明,海州湾鱼类群落组成多以周转模式变化,βnes的比例较低。Oikonomou 和Stefanidis[36]及Lansac-Tôha 等[37]研究表明,鱼类群落的β多样性主要由物种更替产生,嵌套组分的比例极低,与本文结果相吻合。因此,有效的、可持续的海州湾及其临近海域鱼类保护策略,应该包括多物种、多区域[36],从海域整体出发,以适应周转模式的特点。深入开展β多样性及其组分分配的相关研究,有助于了解鱼类群落的变化特征及其产生机制,从而为建立海洋保护区、优化海洋保护策略提供科学依据。
4.2 广义非相似性模型(GDM)拟合效果分析
广义非相似性模型不需要广泛的生物学数据,仅使用两个地点的相对位置和相应的环境预测变量便可对两点间群落组成差异,即β多样性进行计算[14]。该模型应用广泛,可用于评估气候变化对β多样性产生的影响[14,16]。例如,长期环境监测显示,全球海洋由于吸收了超过90%累积温室气体的能量,水温正在显著升高[38],这将对海洋生态系统产生巨大影响[39],鱼类群落的稳定将会受到严重冲击。通过对海州湾GDM预测结果进行稳定性分析,选择适当的模型,有望对海州湾鱼类β多样性对气候变化的响应进行预测,从而为渔业资源的管理与养护提供合理建议。
水生生物GDM 的偏差解释率差异较大[9,31,36,40],如Oikonomou 和Stefanidis[36]对巴尔干半岛南部自然湖泊鱼类构建的GDM 偏差解释率为10.91%,而戴美霞等[9]对象山港浮游动物构建的GDM 解释率高达75.20%。本研究构建的β多样性模型Model-βsor及其周转组分模型Model-βsim的偏差解释率分别为38.52%和32.83%,处于中等水平。该结果表明,用于构建模型的预测变量可在一定程度上反映出环境因子对βsor和βsim的影响。嵌套组分模型Model-βnes,其偏差解释率仅为1.52%,表明研究调查的环境变量对β多样性中的嵌套组分可能不具有显著影响,对βnes产生影响的环境因子还需要进一步研究。需要注意的是,GDM 构建过程中不能完全以偏差解释率衡量模型的优劣。模型的偏差解释率往往与预测因子的数量有关,对于是否需要排除相关的预测因子,目前仍存在较多争议[32]。由于各因子的独立效应难以解释,历史文献多保留所有的预测变量进行模型构建,而这容易造成过拟合现象,从而对部分变量的预测效果产生错误的估计。如相关研究将悬浮颗粒物浓度和水体透明度、水温和水温增温等同时纳入模型中,其模型偏差解释率均达到65%以上[9-10],模型是否存在过拟合的现象还待进一步检验。本研究选取的预测变量较少,各变量的预测效果相对更加独立,利用该模型探究环境因子对β多样性及其组分的影响时,所得结果更加稳健。此外,该模型自身的局限性可能限制了嵌套组分研究[14],鱼类β多样性的产生与变化均为十分复杂的过程,除环境因子外,还取决于该群落的发展历史、生物和生态学特征以及其中每个生物群体对不同环境梯度的响应[41]。对鱼类β多样性开展后续研究时,还需从多方面进行考虑,如结合生物群体自身特点和相关生活史参数,了解其组分变动的驱动因子,以采取更具适应性的方法。
4.3 环境因子对β 多样性及其组分的影响
本研究所应用的环境数据源自FVCOM 与海洋监测遥感数据,相比于传统的环境调查数据,该模型数据具有覆盖范围广、分辨率高等优点[42-43],目前已被广泛用于海洋环境预测与渔业资源的相关研究[42-47],如张云雷等[47]将FVCOM 数据应用于海州湾皮氏叫姑鱼栖息地适宜性研究等。
GDM 的偏响应图不仅能鉴别对β多样性及其周转和嵌套组分产生影响的环境因子,还能进一步识别环境梯度相应的影响速率[34]。本研究表明,海水盐度和叶绿素a浓度是驱动海州湾鱼类β多样性及其周转组分变化的主要因素,这与鱼类的食物来源、饵料密度等影响其生长发育的关键因素有关。徐兆礼[48]研究发现,盐度是驱动中国近海浮游生物空间分布的重要因素之一;水体叶绿素浓度对光合作用产生直接影响,从而影响海水溶氧量和浮游生物密度。而浮游生物作为海州湾鱼类最主要的食物来源,其密度制约了鱼类的分布,从而成为β多样性的主要影响因子。本研究对环境因子进行相关性检验发现,盐度、叶绿素a浓度均与水深呈现显著的相关关系,说明盐度和叶绿素a浓度对β多样性产生的影响,部分由水深变化引起,即水深对β多样性造成的影响被明显低估;而水深作为一个综合性的环境因子[49-50],是β多样性的重要影响因素之一[9,27],与本研究的推论相吻合。此外,地理距离是影响β多样性及其周转组分的另一重要因素,该现象反映出群落组成的差异随地理距离的增加而增大的特点[51]。本研究表明,地理距离对β多样性的影响较弱。造成该现象的原因,可能与地理距离对β多样性的影响程度以及研究尺度有关[52-53]。本研究涉及的海州湾海域空间尺度较小,栖息地的联通性以及鱼类自身对环境的适应性使其在研究海域具有相对较强的分散能力,导致该尺度上地理距离对β多样性的影响不明显。但涉及大尺度研究,尤其探究人类活动对β多样性的影响时[9],将地理因素纳入模型在未来的研究中十分必要。
很多研究表明,水温是影响鱼类群落结构和β多样性最关键的因素之一[53-58],而本研究中水温并未对结果造成显著差异,这可能与海域生态系统特征以及采样调查的时间有关。一方面,目前关于鱼类β多样性的研究,多围绕淡水鱼类展开[8,57-58];相比于海洋生态系统,淡水生态系统封闭性较强,鱼类的适应能力和分散能力较弱,水温等环境变化对其影响可能更为明显。另一方面,本研究侧重比较鱼类β多样性在年际间的变化,开展的相关渔业资源调查均于秋季进行;相比于侧重季节性差异或环境变化影响的相关研究,水温的变化幅度较小,从而在结果中表现出对β多样性产生的影响较弱。因此,要阐明水温对鱼类β多样性的影响,还需针对不同生态系统类型以及时空尺度开展系统研究。在全球气候变化的影响下,海州湾等近岸海域的水温、溶氧量等理化环境条件有着显著的改变,这必然会对鱼类群落和海洋生态系统结构产生重要影响。如何科学评估和预测鱼类β多样性对气候变化和人力活动等外在胁迫的响应,将是今后研究需要重点探讨的问题。
