氟苯达唑对肝癌Huh7细胞活力、迁移、侵袭、凋亡及自噬的影响
2022-02-18董子慧余祖江
罗 霞,董子慧,余祖江
郑州大学第一附属医院感染科 郑州 450052
肝癌是目前世界范围内癌症相关死亡的第三大原因[1-2]。肝癌的发生经常伴随着慢性炎症性肝病,这使得其治疗比其他癌症更具挑战性[3]。尽管治疗策略(化疗、手术切除、肝移植和消融肝移植)已取得初步成功,但严重的毒副作用和进展迅速成为大多数晚期肝癌患者死亡的主要原因[4],因此,探索有效治疗肝癌的药物是当务之急。
之前的多项研究[5-7]发现寄生虫与癌细胞具有某些共同特性,如免疫逃避,多种信号通路失调,某些情况下具有共同抗原、能量和资源的转运等,由此抗寄生虫药物对肿瘤细胞的作用引发了人们的关注。苯并咪唑类驱虫药不仅有广谱驱除人畜寄生虫的作用,还有抑制细胞活力、迁移和侵袭,减少菌落形成,破坏微管蛋白聚合,诱导细胞凋亡和自噬,增加G2/M细胞周期阻滞,诱导分化和衰老,减少血管生成,抑制肿瘤细胞耐药性,降低葡萄糖利用等抗肿瘤作用;此外,苯并咪唑驱虫药对正常细胞的细胞毒性较小,但对肿瘤细胞毒性较高,对肿瘤细胞有特异选择性[8-10]。氟苯达唑是苯并咪唑类广谱抗寄生虫药物,诸多研究表明氟苯达唑对不同类型的恶性肿瘤有抑制作用,如前列腺癌[11]、三阴性乳腺癌[12-13]、黑色素瘤[14-15]、结直肠癌[16]、食管鳞癌[17]、胶质瘤[18]、HER2阳性乳腺癌[19]等。本研究通过体外实验,观察了氟苯达唑对肝癌Huh7细胞活力、迁移、侵袭、凋亡和自噬的影响,为氟苯达唑用于肝癌新药开发及临床应用提供依据。
1 材料与方法
1.1 材料Huh7细胞购自中国科学院上海细胞库,氟苯达唑购自Sigma-Aldrich公司,细胞增殖毒性检测试剂盒(CCK-8)购自日本同仁化学研究所,Transwell小室、基质胶及Annexin V-FITC/PI细胞凋亡双染试剂盒购自美国BD公司,一抗LC3、P62、Bax、Bcl-2、GAPDH抗体及二抗均购于武汉三鹰生物技术公司,蛋白酶抑制剂购于美国罗氏公司,RIPA蛋白裂解液、BCA蛋白浓度测定试剂盒、结晶紫均购于上海碧云天生物科技有限公司,Genshare CFAS anyKDPAGE蛋白电泳试剂盒Ⅰ型购于晶彩生物公司,DMEM培养基、标准胎牛血清购自美国Gibco公司。
1.2 细胞培养及分组Huh7细胞复苏后用含体积分数10%胎牛血清的DMEM完全培养基,于37 ℃、体积分数5%CO2的培养箱中培养。将处于对数生长期的Huh7细胞分为4组,空白对照组和氟苯达唑低、中、高浓度组,分别用含氟苯达唑终浓度为0、2、4、8 μmol/L的DMSO处理。
1.3 细胞增殖能力的检测取对数生长期的Huh7细胞,经消化离心、细胞计数后,以5 000个/孔接种于96孔板,按1.2分4组培养,设只含培养基的空白调零孔,均设5个复孔。继续孵育24、48、72 h后每孔加入10 μL CCK-8溶液,避光混匀后继续孵育2 h,用酶标仪检测各孔在450 nm处的吸光度(A)。细胞活力(%)=(A实验孔-A空白调零孔)/(A对照孔-A空白调零孔)×100%。实验重复3次。
1.4 细胞迁移能力的检测Huh7细胞消化离心后铺于6孔板中,置于培养箱中继续培养至细胞基本长满,在每孔底部划出2条均匀竖线,PBS洗涤2次,于倒置显微镜(×200)下观察、拍照。按1.2分组培养24 h,倒置显微镜(×200)下观察、拍照,图片数据使用Image J软件进行分析。细胞迁移率=(加药前划痕宽度-加药后划痕宽度)/加药前划痕宽度×100%。实验重复3次。
1.5 细胞侵袭能力的检测将50 μL用DMEM培养基稀释、浓度为1 g/L的基质胶铺于Transwell小室的上室。下室中每孔加入600 μL含体积分数10%胎牛血清的DMEM培养基,上室加入100 μL含2×104个Huh7细胞的无血清培养基,同1.2分组处理。培养48 h后除去小室中的培养液,先用40 g/L多聚甲醛固定,再用结晶紫于室温下染色20 min,PBS洗3次,用棉签轻轻擦去小室中未侵袭的细胞,在倒置显微镜下选择5个视野(×200)拍照,计数穿膜细胞。实验重复3次。
1.6 细胞凋亡能力的检测将Huh7细胞以1×106个/孔接种于6孔板,培养24 h后弃培养基,按1.2分组继续培养48 h。用不含EDTA的胰蛋白酶消化并收集细胞,室温2 000 r/min离心5~10 min;用预冷的PBS(4 ℃)重悬细胞,室温2 000 r/min离心5~10 min;洗涤后加入300 μL结合缓冲液重悬细胞。加入5 μL的Annexin V-FITC混匀,避光室温孵育15 min,加入5 μL的PI染色5 min,上流式细胞仪检测,计算细胞凋亡率。实验重复3次。
1.7 细胞自噬和凋亡相关蛋白表达检测取对数生长期的Huh7细胞,按4×105个/孔接种于6孔板,按1.2分组培养48 h。每孔加入150 μL含蛋白酶抑制剂的RIPA蛋白裂解液提取细胞总蛋白,用BCA法测蛋白浓度。取40 μg蛋白上样,SDS-PAGE电泳、转膜。将膜置于用TBST配制的50 g/L脱脂奶粉溶液中室温封闭2 h。分别加入一抗(LC3、P62、Bcl-2抗体按1∶1 000稀释,Bax、GAPDH抗体按1∶5 000稀释),4 ℃孵育过夜。TBST充分洗膜3次,用辣根过氧化物酶标记的二抗于室温下孵育2 h,用TBST充分洗膜3次。ECL显影,凝胶成像分析系统扫描,用Image J软件对条带进行分析。目的蛋白条带和内参GAPDH条带灰度值的比值为目的蛋白的相对表达量。实验重复3次。
1.8 统计学处理采用SPSS 22.0处理数据。采用3×4析因设计的方差分析比较不同浓度氟苯达唑作用不同时间对Huh7细胞活力的影响,采用单因素方差分析比较4组细胞迁移率、侵袭细胞数、凋亡率及自噬和凋亡相关蛋白表达的差异,两两比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1 氟苯达唑对Huh7细胞活力的影响结果见表1。从表1可知,氟苯达唑可抑制Huh7细胞活力,呈浓度和时间依赖性;氟苯达唑给药48 h对Huh7细胞的抑制作用最强,故后续实验中除划痕实验外均选择作用时间为48 h。

表1 不同浓度氟苯达唑处理不同时间Huh7细胞活力的比较(n=3) %
2.2 氟苯达唑对Huh7细胞迁移、侵袭及凋亡的影响结果见图1和表2。结果显示:随氟苯达唑浓度的增加,细胞迁移率、侵袭细胞数下降,细胞凋亡率升高。
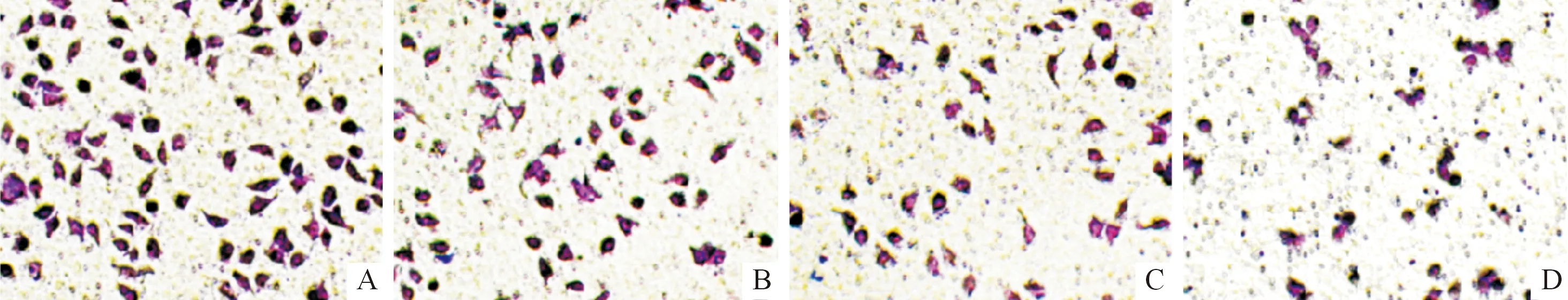
A、B、C、D:分别为空白对照组,氟苯达唑低、中、高浓度组
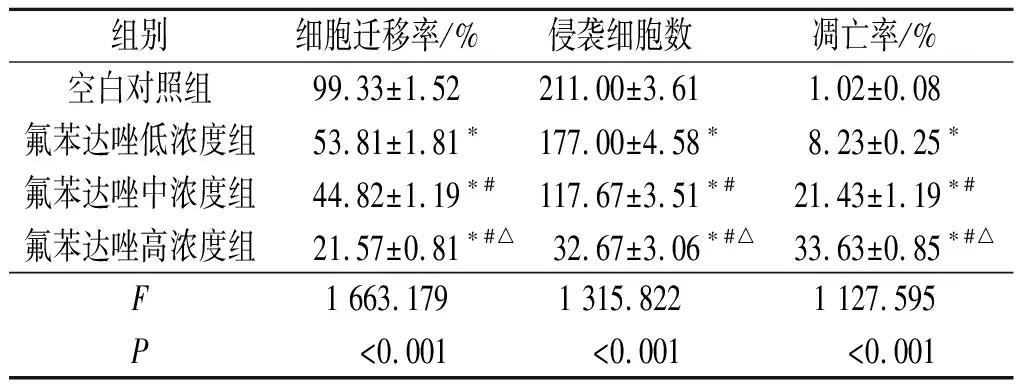
表2 各组细胞迁移率、侵袭细胞数及凋亡率的比较(n=3)
2.3 氟苯达唑对Huh7细胞自噬和凋亡相关蛋白表达的影响结果见图2和表3。由表3可知,随氟苯达唑浓度的增加,LC3-Ⅱ/LC3-Ⅰ比值升高,P62蛋白表达水平下降,Bax/Bcl-2升高。
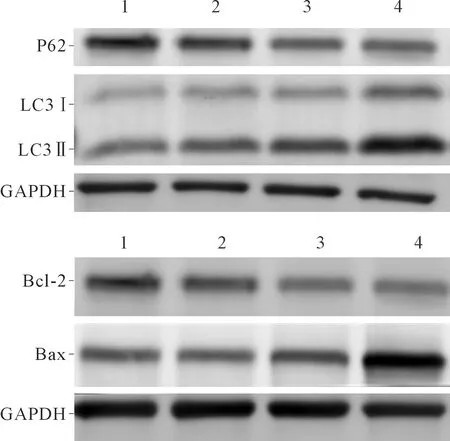
1~4:分别为空白对照组,氟苯达唑低、中、高浓度组
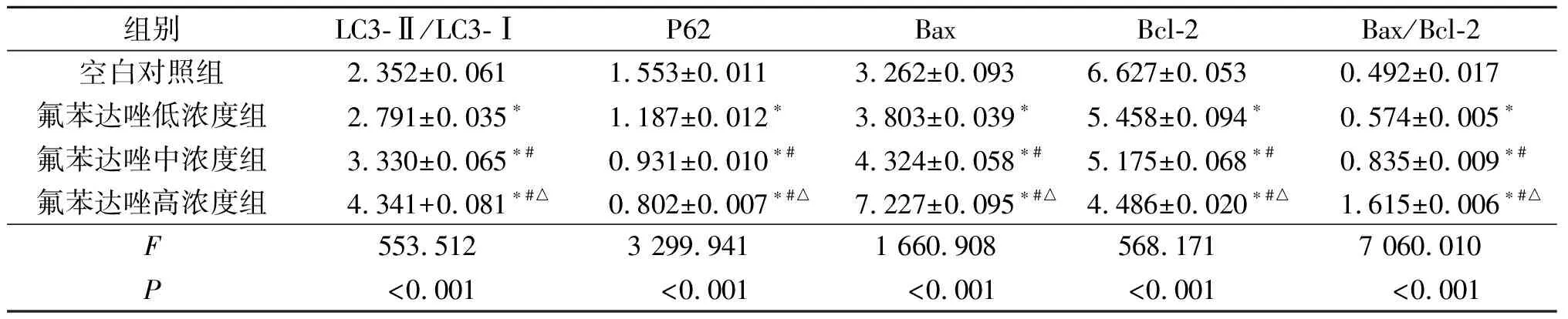
表3 各组Huh7细胞自噬和凋亡相关蛋白表达的比较(n=3)
3 讨论
肝癌是常见的侵袭性强的恶性实体肿瘤。尽管目前临床上有抗血管生成药物(如索拉非尼、仑伐替尼等酪氨酸激酶抑制剂)和免疫检查点抑制剂药物可有效改善晚期肝癌患者的预后,但患者的总体生存率仍较低,且远低于其他实体肿瘤[20-21]。
氟苯达唑是一种经FDA批准广泛用于治疗人类和家畜寄生虫感染的药物,由于其与微管蛋白结合良好且对癌细胞有特异性抑制作用,故被认为是一种潜在的抗肿瘤药物。已有大量的临床前研究评估了氟苯达唑对不同肿瘤的抗肿瘤作用。如氟苯达唑在三阴性乳腺癌中可通过抑制STAT3而抑制肿瘤转移[13]。另外,氟苯达唑通过靶向HER2阳性乳腺癌的肿瘤干细胞样特性和HER2信号通路,削弱了曲妥利珠单抗的耐药性[19]。在结肠癌中,氟苯达唑通过抑制STAT3和激活自噬发挥抗肿瘤作用[16]。有研究[15]表明,氟苯达唑可阻断黑色素瘤细胞的生长和转移,抑制程序性细胞死亡蛋白-1和骨髓源性抑制细胞的积累。氟苯达唑亦可靶向P53和促进前列腺癌的铁死亡,协同5-氟尿嘧啶发挥抗肿瘤作用[11]。氟苯达唑可单药使用,亦可联合化疗药物协同使用,是一种很有前景的低成本治疗和新辅助治疗的候选药物。
本研究结果表明氟苯达唑可抑制Huh7细胞的活力,且抑制作用随作用时间延长和药物浓度的增加而增强;此外,氟苯达唑可抑制Huh7细胞迁移和侵袭,诱导细胞凋亡。进一步分析发现,随氟苯达唑浓度的增加,Huh7细胞中Bcl-2蛋白表达水平降低,Bax/Bcl-2比值则增大。Bcl-2是一种抗凋亡蛋白,通过与促凋亡蛋白Bax、Bad或Bcl-xl结合来调控细胞凋亡,Bax/Bcl-2被认为是影响细胞存活或死亡的关键因素[22],这一比值增大表明氟苯达唑对Huh7细胞的促凋亡作用大于抗凋亡作用。自噬在调节癌细胞死亡过程中也起着重要作用。自噬发生过程中,细胞内的物质和细胞器形成自噬体[23]。自噬体可以降解错误折叠的蛋白质或损伤细胞器,有益于癌细胞存活;它也可能介导自噬死亡,以防止恶性细胞转化[24]。自噬是多种自噬相关因子参与的代谢过程,其中LC3和P62是重要的自噬标志物。LC3表现为LC3-Ⅰ和LC3-Ⅱ两种形式,当自噬上调时,LC3-Ⅰ向 LC3-Ⅱ转化,LC3-Ⅱ/LC3-Ⅰ比值增高。P62在自噬溶酶体形成过程中可被降解,所以其表达量降低说明自噬溶酶体形成,自噬上调。本研究结果显示,随氟苯达唑浓度的增加,Huh7细胞中P62蛋白表达水平下降,LC3-Ⅱ/LC3-Ⅰ比值增加,说明氟苯达唑能够诱导Huh7细胞自噬。
综上所述,氟苯达唑能显著抑制肝癌Huh7细胞活力、迁移和侵袭,促进凋亡和自噬,为氟苯达唑用于新药开发及肝癌的临床治疗提供了一定的科学依据。然而,本研究中使用的细胞系有限,今后可将研究扩展到其他肝癌细胞系或来自肝癌患者的原代培养细胞。另外,氟苯达唑对Huh7细胞抗肿瘤作用的具体分子机制尚不明确。下一步我们将在探索其具体分子机制的同时进行动物实验和临床数据验证。
