六君子汤加减对晚期非小细胞肺癌GP 方案肺脾气虚型患者的作用机制研究*
2022-02-18孙连庆胡粒山
陈 艳,孙连庆,胡粒山
1 新疆生产建设兵团第九师医院,新疆 额敏 834601;2 西安交通大学第一附属医院
肺癌以咳嗽、胸闷反复发作为主要表现,部分患者还可出现反复肺部感染,是一种发病率较高的呼吸系统恶性肿瘤。肺癌好发于老年人,依据类型可分为小细胞肺癌及非小细胞肺癌,目前文献显示后者比例可达80%~85%,且近年来发病率逐渐升高[1]。肺癌病机复杂,目前认为与长期吸烟、环境污染、遗传背景等因素相关,大多于体检时发现,且多为晚期[2]。对于晚期肺癌患者而言GP 方案是目前治疗的主要化疗方案,在提高延长生存时间方面起重要作用,但不良反应大,部分患者可因严重不良反应而影响治疗[3]。研究表明肺癌细胞增殖有赖于血管供血,内皮生长因子(vascular endothelial growth factor,VEGF)可促进血管新生,肺癌患者VEGF 数值显著升高,通过抑制新生血管生成成为本病治疗的重要思路[4]。中医认为正气存内可有效抵御邪气外感,正虚是癌症发生的基础,常累及肺脾两脏,形成肺脾气虚证[5]。本研究探讨六君子汤在晚期非小细胞肺癌GP 方案患者治疗中的应用价值,现报道如下。
1 资料与方法
1.1 临床资料将2018 年4 月至2020 年1 月因肺脾气虚型晚期非小细胞肺癌于新疆生产建设兵团第九师医院就诊的患者98 例按随机数字表法分为两组各49 例。对照组中男28 例,女21 例;年龄45~73 岁,平均(58.14±5.63)岁;体质量56~86 kg,平均(70.25±4.67)kg;病程5~12 月,平均(7.92±1.63)月。观察组中男29 例,女20 例;年龄44~74岁,平均(57.43±5.39)岁;体质量55~87 kg,平均(69.81±4.59)kg;病程4~11年,平均(8.29±1.47)年。两组患者基线资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医学伦理委员会审核,编号:20180301。
1.2 诊断标准[6]1)患者咳嗽咳痰(干咳为主),胸闷,肺部感染反复发作;2)糖类抗原125(carbohydrate antigen 125,CA125),癌胚抗原(carcinoembryonic antigen,CEA)显著升高;3)经肺部CT增强及病理组织活检提示肺部占位病变。肺脾气虚型[7]:患者乏力,易感冒,面色萎黄,食欲减退,自汗出,气短,大便溏,舌淡白,脉沉细。
1.3 纳入标准1)符合晚期非小细胞肺癌诊断标准,要求化疗;2)KPS评分Kamofsky功能状态评分≥60分,且预计生存期≥6个月,纳入研究前告知研究风险并获得患者知情同意;3)中医证型属肺脾气虚型者;4)肿瘤分期Ⅲ期及Ⅲ~Ⅳ期;5)均为初次确诊且初次接受化疗。
1.4 排除标准1)受试药物过敏者;2)继发性肺癌者;3)妊娠期不便纳入者;4)合并肺部感染、肺纤维化、支气管哮喘等肺支气管疾病者;5)存在贫血、肝肾功能障碍不能耐受化疗者。
1.5 治疗方法
1.5.1 对照组 采用GP 方案,顺铂(齐鲁药业,批号:20171201、20180503、20190603)25 mg/m2+5%葡萄糖溶液250 mL(四川科伦,批号:20171102、20180603、20190903)静脉滴注,持续2 h,第1~3天。吉西他滨(ELI LILLY AND COMPANY,批号:20170903、20180602、20190903)1000 mg/m2+氯化钠注射液(四川科伦,批号20171105、20180504、20190804)100mL 静脉滴注,持续30 min,第1、8天,1个化疗周期为21天,共治疗2个周期。
1.5.2 观察组 在对照组基础上联合六君子汤加减口服,药物组成:炙黄芪20 g,人参10 g,茯苓15 g,法半夏10 g,炒白术15 g,陈皮10 g,炒白术15 g,白花蛇舌草30 g,生牡蛎15 g,山慈菇30 g,炙甘草3 g。由本院中药房统一提供,每日1 剂,每剂药标准煎煮法取汁300 mL,上、下午各口服150 mL,每个化疗周期首日开始同步使用,口服2周后休息1周,持续2个化疗周期。
1.6 观察指标1)抽取患者空腹静脉血,离心半径10 cm,3800 r/min 离心15 min,采用ELISA 法测定两组治疗前后血清CYFRA21-1、CA125、NSE(上海研卉生物公司提供)水平;2)离心半径10 cm,3500 r/min 离心15 min,比较两组治疗前后血清VEGF、基质金属蛋白酶9(Matrix metalloproteinase-9,MMP-9,武汉博士德公司)水平;3)ELISA法测定两组治疗前后血清碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、前列腺素E2(prostaglandin E2,PGE2,南京建成生物公司)水平;4)流式细胞仪测定两组治疗前后血清CD4+/CD8+、CD4+细胞水平;5)比较两组不良反应发生情况,包括肝肾功能损伤、胃肠道反应、骨髓抑制、周围神经损伤,出现化疗不良反应时应及时药物干预,经药物干预仍未改善影响化疗正常进行者退出研究,若研究已完成2/3,经研究者确认后数据可纳入统计分析;6)临床疗效,完全缓解[7](CR):治疗后患者肿瘤病灶消失;部分缓解(PR):治疗后肿瘤病灶体积降幅大于50%;稳定(SD):治疗后肿瘤病灶体积减少,但降幅<50%;进展(PD):治疗后肿瘤病灶体积未见减少或继续增大。
1.7 统计学方法采用SPSS 23.0 分析数据,进行双侧检验,计量资料以±s表示,采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤标志物与治疗前相比,治疗后两组NSE、CA125、CYFRA21-1 降低(P<0.05),观察组低于对照组(P<0.05)。见表1。
表1 两组患者治疗前后肿瘤标志物比较(±s)
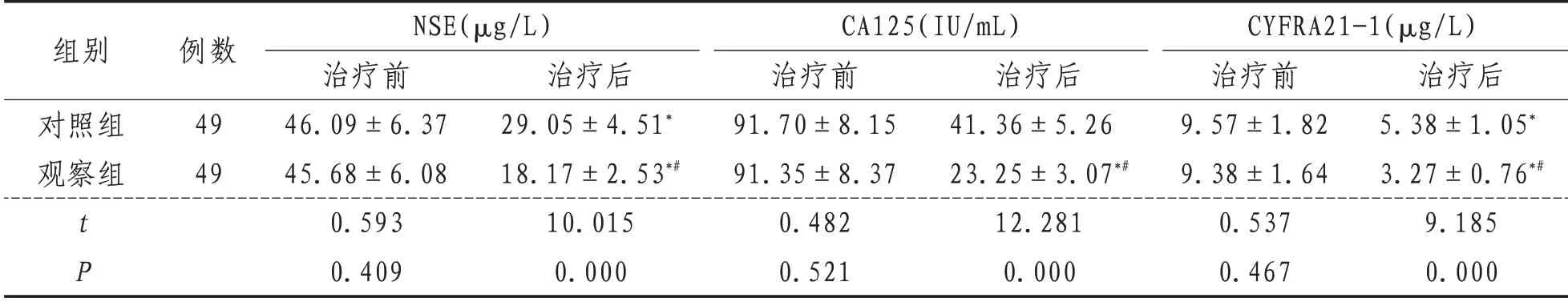
表1 两组患者治疗前后肿瘤标志物比较(±s)
注:*表示与治疗前比较,P<0.05;#表示与治疗后比较,P<0.05
组别对照组观察组tP例数49 49 NSE(μg/L)治疗前46.09±6.37 45.68±6.08 0.593 0.409治疗后29.05±4.51*18.17±2.53*#10.015 0.000 CA125(IU/mL)治疗前91.70±8.15 91.35±8.37 0.482 0.521治疗后41.36±5.26 23.25±3.07*#12.281 0.000 CYFRA21-1(μg/L)治疗前9.57±1.82 9.38±1.64 0.537 0.467治疗后5.38±1.05*3.27±0.76*#9.185 0.000
2.2 VEGF 与MMP-9与治疗前相比,治疗后两组VEGF 与MMP-9 降低(P<0.05),观察组低于对照组(P<0.05)。见表2。
表2 两组患者治疗前后VEGF与MMP-9比较(±s)
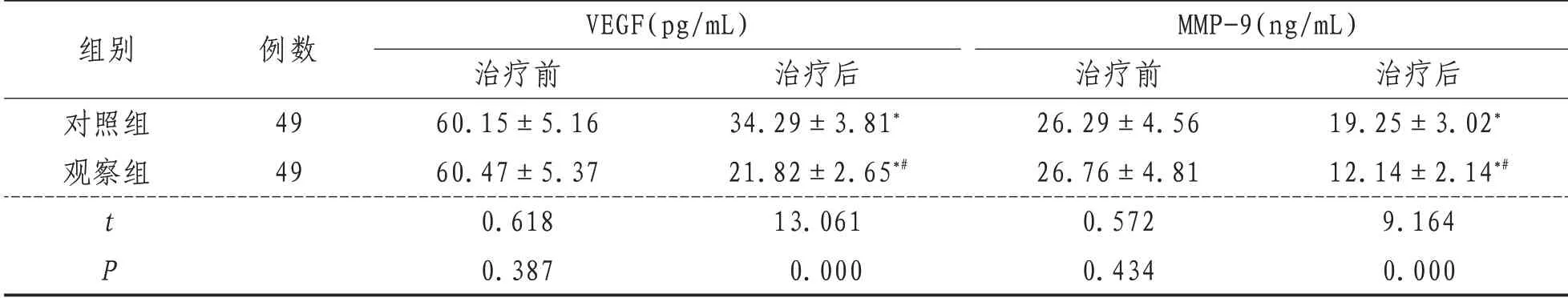
表2 两组患者治疗前后VEGF与MMP-9比较(±s)
注:*表示与治疗前比较,P<0.05;#表示与治疗后比较,P<0.05
组别对照组观察组tP例数49 49 VEGF(pg/mL)治疗前60.15±5.16 60.47±5.37 0.618 0.387治疗后34.29±3.81*21.82±2.65*#13.061 0.000 MMP-9(ng/mL)治疗前26.29±4.56 26.76±4.81 0.572 0.434治疗后19.25±3.02*12.14±2.14*#9.164 0.000
2.3 T 淋巴亚群与治疗前相比,治疗后两组CD4+、CD4+/CD8+升高(P<0.05),观察组高于对照组(P<0.05)。见表3。
表3 两组患者T淋巴亚群比较(±s)
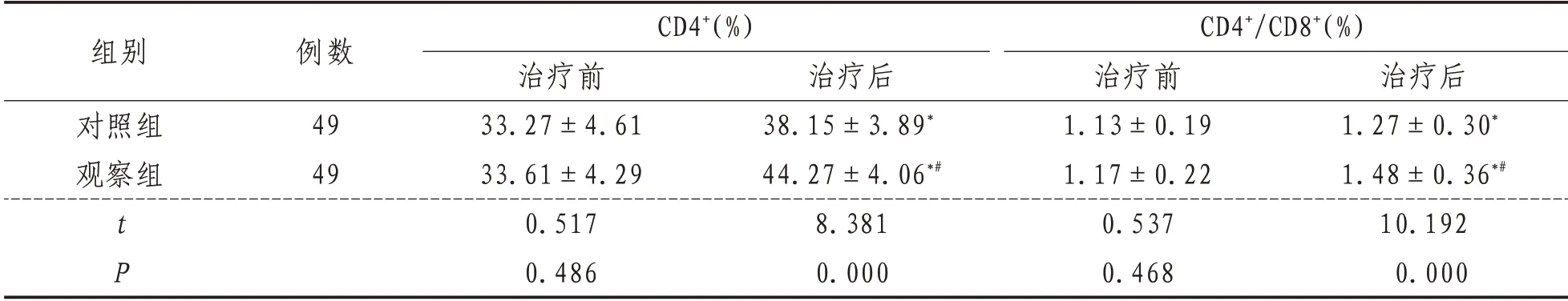
表3 两组患者T淋巴亚群比较(±s)
注:*表示与治疗前比较,P<0.05;#表示与治疗后比较,P<0.05
组别对照组观察组tP例数49 49 CD4+(%)治疗前33.27±4.61 33.61±4.29 0.517 0.486治疗后38.15±3.89*44.27±4.06*#8.381 0.000 CD4+/CD8+(%)治疗前1.13±0.19 1.17±0.22 0.537 0.468治疗后1.27±0.30*1.48±0.36*#10.192 0.000
2.4 bFGF与PGE2与治疗前相比,治疗后两组bFGF与PGE2降低(P<0.05),观察组低于对照组(P<0.05)。见表4。
表4 两组患者bFGF与PGE2比较(±s)
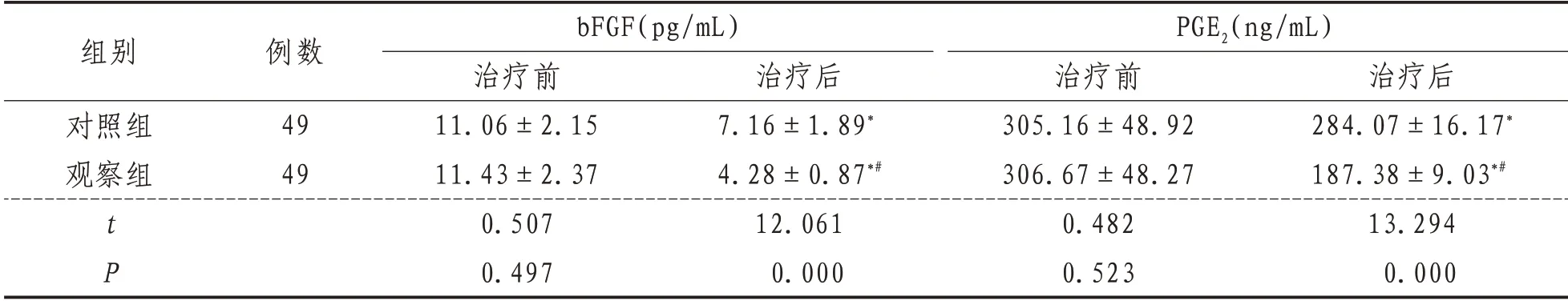
表4 两组患者bFGF与PGE2比较(±s)
注:*表示与治疗前比较,P<0.05;#表示与治疗后比较,P<0.05
组别对照组观察组tP例数49 49 bFGF(pg/mL)治疗前11.06±2.15 11.43±2.37 0.507 0.497治疗后7.16±1.89*4.28±0.87*#12.061 0.000 PGE2(ng/mL)治疗前305.16±48.92 306.67±48.27 0.482 0.523治疗后284.07±16.17*187.38±9.03*#13.294 0.000
2.5 临床疗效观察组CR 及PR 分别为2 例、28例,对照组CR及PR分别为0例、20例,观察组总有效率61.22%(30/49),对照组40.82%(21/49),差异有统计学意义(P<0.05)。见表5。
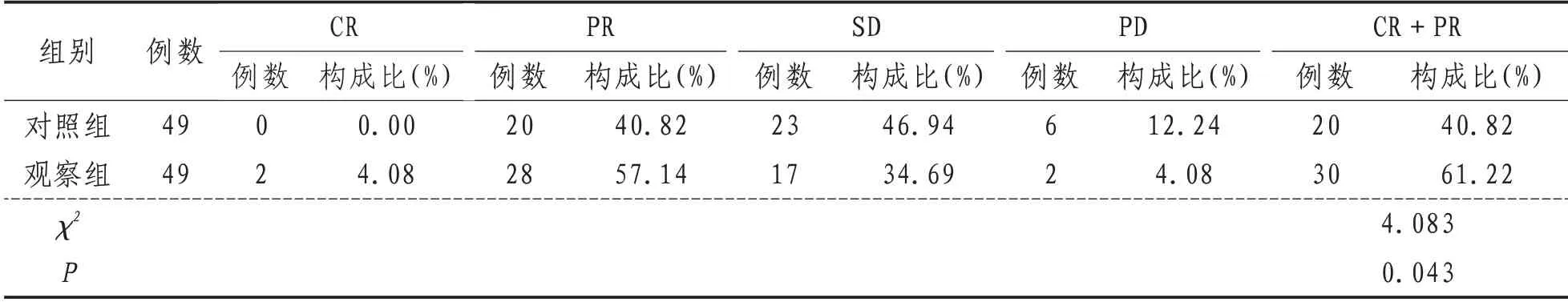
表5 两组患者临床疗效比较
2.6 不良反应观察组胃肠道反应、肝肾功能异常、骨髓抑制发生率低于对照组,差异有统计学意义(P<0.05);周围神经损伤两组比较差异无统计学意义(P>0.05)。见表6。
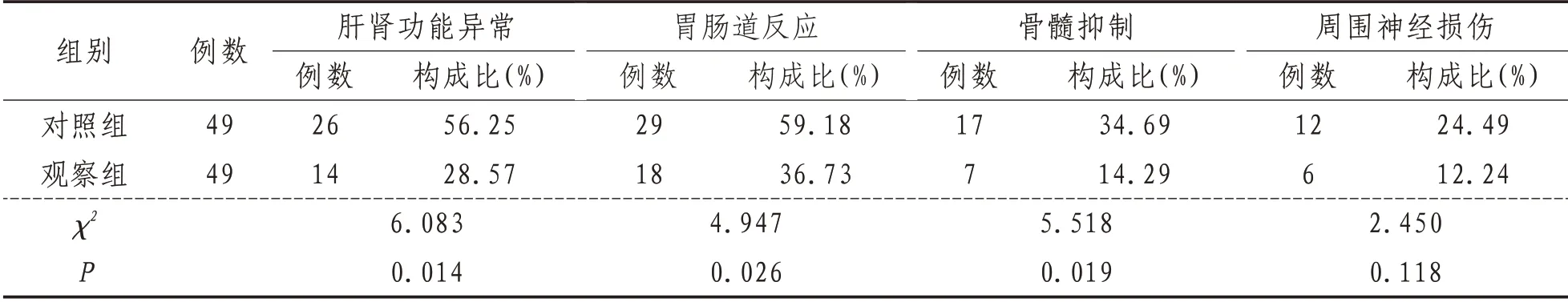
表6 两组患者不良反应比较
3 讨论
GP 方案是目前本病治疗的一线化疗手段,静脉滴注可使药物经血液循环到达靶病灶,但晚期肺癌患者易发生肿瘤转移且靶器官化疗药物浓度较低,化疗效果有限[8-9]。同时,化疗药物在抑制肿瘤细胞繁殖的同时会损伤机体正常细胞,从而发生免疫抑制及骨髓抑制等。
抑制新生血管形成已成为肺癌治疗的重要思路,抑制血管新生有助于抑制肿瘤细胞复制,从而缩小病灶体积[10]。VEGF 是临床关键的促血管新生物质,既往研究表明VEGF 高表达时有助于脑梗死患者侧枝循环形成,但可促进肿瘤患者血管新生,癌细胞有利于获得营养物质,为癌细胞增殖及扩散提供了保障[11]。
多项研究表明免疫功能失衡与肺癌发生关系密切,免疫力降低所致的癌细胞免疫逃逸是恶性肿瘤发病的重要因素,CD8+、CD3+T细胞均是T淋巴亚群指标,是评估机体免疫功能的重要指标[12]。CD3+T细胞含多种肽链,与CD4+T细胞均为辅助功能细胞,CD8+T 细胞具有抑制免疫作用,CD8+及CD4+T细胞水平稳定是维持正常免疫功能的保障[13]。研究表明恶性肿瘤患者由于存在肿瘤负荷可产生免疫抑制性因子,引起免疫力降低,随着病情改善CD4+T 水平可逐渐升高。张辉[14]研究发现肺癌患者CD4+、CD4+/CD8+明显降低,并指出随着肿瘤分期的增大患者血液中CD4+、CD4+/CD8+逐渐降低,并且与高分化肺癌患者比较,低分化肺癌CD4+/CD8+水平更低。本研究结果显示,治疗后观察组血清CD4+/CD8+、CD4+细胞等T淋巴亚群水平高于对照组。
CA125是癌细胞增殖过程中分泌的特有物质,CA125 主要分布于子宫内膜、宫颈上皮,是鉴别恶性及良性肿瘤的较敏感指标,肺癌早期患者血液中CA125 明显升高,其数值升幅与转移情况、瘤体大小及癌症分期等因素相关[15]。正常状态下CYFRA21-1 表达水平低下,对于肺癌有较高的敏感性,肺癌细胞体内细胞角蛋白19 降解加快,CYFRA21-1 表达活化,是诊断肺癌的重要指标[16]。NSE 是机体所需重要的烯醇化酶,既往研究多强调其与神经损伤的关系,脑卒中等因素引起脑部神经功能损伤时NSE 被大量释放至血液。随着恶性肿瘤机制研究的深入,NSE 与肺癌的关系逐渐得到重视,目前已成为肺癌诊断公认的较敏感指标[17]。王艳海[18]发现NSE 单用对于非小细胞肺癌诊断的特异性高达55.5%,联合检测时敏感度可进一步升高。本研究结果显示,治疗后观察组血清CYFRA21-1、CA125、NSE水平低于对照组。
MMP-9 与肺癌关系密切,在促进血管生成及肿瘤侵袭转移中发挥重要作用,可使癌细胞浸润至周围组织,为转移提供条件[19]。恶性肿瘤有转移、浸润的生物学特点,细胞外基质(ECM)降解在此过程中发挥关键作用,通过抑制ECM 降解可有效减轻浸润,延缓病情发展[20]。bFGF 是一种有广泛生物活性的多肽类物质,可促进胚层细胞分裂,加速新生血管生成,肺癌患者bFGF 可显著升高,对于评估此类患者的复发风险有积极意义[21]。PGE2参与炎症反应的发生,在炎症网络中发挥重要作用,是临床关键的致痛因子,可使5-羟色胺等致痛作用明显增强及延长[22]。研究表明,较正常组织而言恶性肿瘤分泌PGE2的能力更高,王洪[23]发现肺癌患者血液内PGE2显著升高,并认为PGE2参与了肺癌发病。本研究结果显示,治疗后观察组血清VEGF、MMP-9、bFGF、PGE2均低于对照组。
肺癌属中医“肺积”范畴,正虚是恶性肿瘤发生的基础,先天禀赋不足、饮食不节、湿热外感、情志内伤等因素均与本病相关。《外源医案》中说:“正气虚则成岩”,指出正虚是恶性肿瘤发生的基础。肺主皮毛,具有宣发肃降功能,是保持机体正常呼吸的重要器官,脾为后天之本,为气血生化之源,脾虚则痰浊内生,影响肺之宣降,且脾虚日久累及肺金,母病及子,最终形成肺脾气虚证。本研究采用六君子汤加减方中人参大补元气,补益脾肾,养血,为君药;炙黄芪补益肺脾,加强人参功效;茯苓与炒白术益气健脾,其中茯苓渗湿安神,白术燥湿固表,为臣药;姜半夏燥湿化痰;陈皮理气健脾化湿,与半夏合用则化痰之力增;生牡蛎软坚散结;白花蛇舌草、山慈菇清热解毒、散结消肿,为佐药;炙甘草调和药性为使药。
观察组总有效率为61.22%,对照组为40.82%,差异有统计学意义(P<0.05);观察组肝肾功能损伤、胃肠道反应、骨髓抑制等不良反应发生率低于对照组。六君子汤加减作用机制复杂[24-27]:1)六君子汤加减可降低VEGF、bFGF 水平,预防新生血管形成,抑制肿瘤细胞增殖;2)可提高免疫力,减轻肿瘤负荷,并可降低MMP-9水平,调节ECM代谢,从多靶点预防癌细胞转移。
综上所述,肺脾气虚型晚期非小细胞肺癌患者GP方案联合六君子汤加减具有重要意义。
