球形与立方体纳米银对斜生栅藻毒性差异研究
2022-02-17李海波邓宁灿
李海波, 柴 睿, 邓宁灿, 杨 悦
(东北大学资源与土木工程学院, 沈阳 110819)
金属及氧化物纳米材料一般都具有细胞毒性,毒性大小决定于纳米材料的质量浓度、形状、表面电荷性质等[1]。 纳米银(Nano Silver Particles,AgNPs)通过生产、处置和排放等各个过程进入环境而导致直接或潜在的生物毒性的情况已被大量报道[2]。
存在于水体中的AgNPs可能因物理、化学和生物等作用而转化/降解,并且纳米材料之间会发生团聚与分散的行为,甚至发生形貌转化,进而影响其环境归趋及迁移转化,并最终深刻影响其生物毒性[3]。而元素的不同形态在很大程度上影响着它们的毒性强弱,其形态的不同使机体对元素的吸收、分布、排泄产生很大差异,生物效应和致毒作用也不同[4]。大量研究表明:即使纳米材料的组成元素相同,但是其形貌、尺寸的差异也会对其生物学效应产生较大影响[5]:石墨烯纳米片的尺寸是影响其毒性的一个重要因素[6];三氧化钨(WO3)纳米棒的尺寸效应影响其对肝脏和肾脏的毒性效应[7];棒状纳米氧化铝对大鼠脑星形胶质细胞毒性的影响作用明显强于片状纳米氧化铝[8]。同时,制备所得的纳米银的形状、尺寸和聚集度等理化性质存在一定差异,不同的合成流程对纳米银的理化性质也有很大影响,而理化性质又直接影响其毒性[9-11]。虽然AgNPs可致生物毒性已获学界共识,如HE等[12]证实AgNPs会对藻类生长产生影响,DAVID和ABDALLAH[13]认为AgNPs抑制藻类的光合系统。但AgNPs形态与毒性效应之间的关系尚不十分清楚,其致毒的诱导途径、传递路径、分子过程及解毒机制均与其微观形态有关。
为此,本文拟对比球形AgNPs(Silver nanosphere,AgNSs)和立方体AgNPs(Silver nanoscube,AgNCs)对斜生栅藻(Scenedesmusobliquus)的毒性效应差异,包括对藻密度、叶绿素a(Chlorophyll a)的质量浓度、活性氧(ROS)含量、丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性的影响,以期为AgNPs排放控制提供基础数据。
1 材料与方法
1.1 实验材料
斜生栅藻(Scenedesmusobliquus):购自中国科学院淡水藻种库(FACHB),标号(FACHB-417)。在进行暴露实验前将斜生栅藻培育至对数生长期,并在培育过程中将其在680 nm处的UV-Vis的光密度值(A680)与对应的藻密度拟合得到关系曲线。
AgNPs:实验室自制。
1.2 实验方法
1.2.1 2种形貌的AgNPs的制备及表征 参考并改良刘锦涛等[14]的制备方法,得到AgNSs和AgNCs:以银氨溶液为前驱体、聚乙烯吡络烷酮(PVP)溶液为保护剂、葡萄糖溶液为还原剂,在一定条件下制备得到AgNSs;将硝酸银溶液为前驱体、PVP溶液为保护剂、葡萄糖溶液为还原剂,并以氯化镁溶液为刻蚀剂,利用氧化还原反应制备得到AgNCs。将制备所得的AgNSs和AgNCs在波长为200~600 nm的区间进行紫外-分光光度计(HACH DR6000,USA)分析,并通过场发射扫描电子显微镜(FE-SEM,Carl Zeiss AG,ULTRAPLUS)表征形貌和粒径。
1.2.2 暴露实验方法 KIM等[15]的研究表明AgNPs 能抑制大肠杆菌和枯草芽孢杆菌菌落的生长,且质量浓度为10 mg/L的AgNPs对大肠杆菌和枯草芽孢杆菌的菌落形成有明显抑制效应。因此,本次实验中的AgNPs的质量浓度梯度的中间值设为10 mg/L。
取处于对数增长期的斜生栅藻,在无菌环境下接种至BG-11培养基[16]中进行扩大培养; 然后参照OECD201藻类生长抑制实验方法[17],将同一批次的斜生栅藻等量接种在灭菌后的三角锥形瓶中;再分别加入定量AgNSs、AgNCs母液,使锥形瓶中的最终质量浓度分别为5、10、15、20 mg/L,且各质量浓度组设3个平行样,并设置对照组(0 mg/L);在温度为25 ℃、光暗周期比为12 h∶12 h的光照培养箱中暴露一定时间后,测定藻中叶绿素a的质量浓度、ROS含量、MDA含量和SOD活性,并分析这些指标随AgNPs剂量及暴露时间的变化,以探明AgNPs对斜生栅藻的毒性效应。
1.2.3 分析测定方法 藻密度测定:每24 h取一定量未受试藻液,先利用紫外分光光度计测定其在680 nm处的光密度值(A680),再用血球计数板进行计数(荧光显微镜,Olympus,BX53),建立此批次斜生栅藻的藻密度与光密度之间的线性关系;每12 h取一定量受试藻液并测定其A680,通过藻密度与吸光度之间的关系计算每个样品的藻密度。
叶绿素a 的质量浓度测定采用紫外-分光光度法[18],ROS含量的测定采用DCFH-DA法[19],MDA含量的测定采用过硫代巴比妥酸法[20],SOD活性的测定采用NBT光还原法[18]。
2 结果与讨论
2.1 AgNPs的结构表征
对制备得到的AgNPs进行UV-Vis分析及FE-SEM观察。由AgNSs、AgNCs的吸收光谱图(图1)可知:吸收曲线的最大吸收峰均在420 nm左右,证实了制备所得均为单质银溶液。由AgNSs、AgNCs的SEM照片(图2)可知:AgNSs的粒径约50 nm,呈球型;AgNCs粒径约1 μm,呈立方体型。
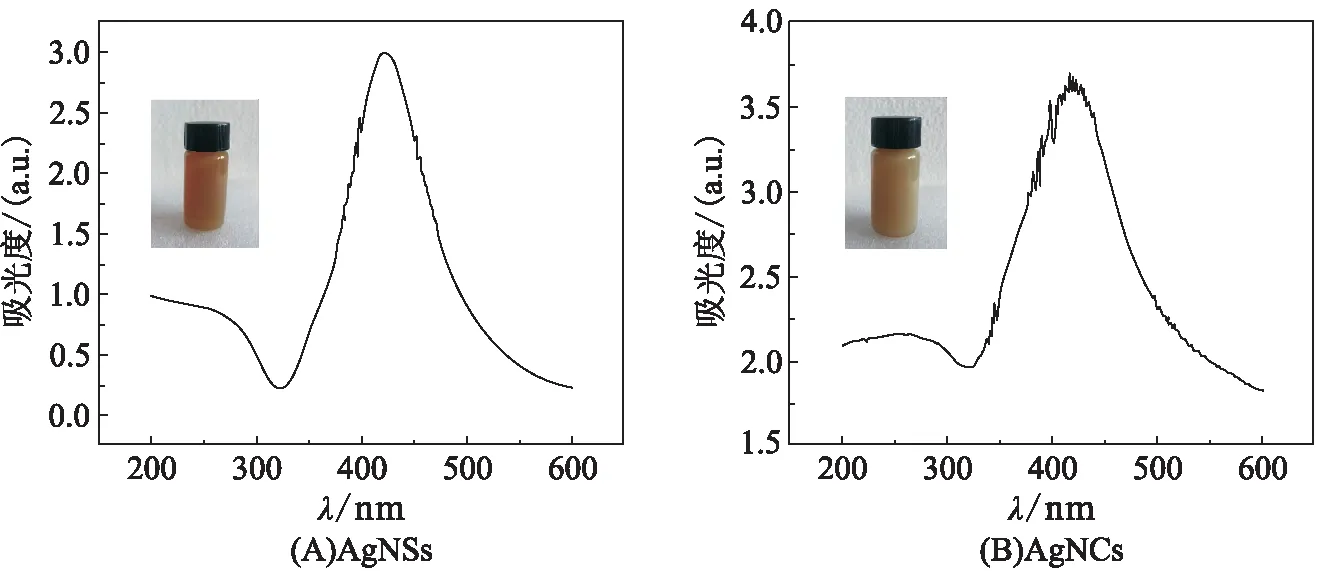
图1 AgNSs 和 AgNCs的紫外可见吸收光谱Figure 1 The UV-Vis absorption spectrogram of AgNSs and AgNCs

图2 AgNSs 和 AgNCs的SEM照片Figure 2 The SEM pictures of AgNSs and AgNCs
2.2 AgNPs对斜生栅藻的毒性效应
2.2.1 AgNPs对斜生栅藻的生长抑制效应 在不同质量浓度的AgNSs、AgNCs暴露处理下,观察同一批次的斜生栅藻密度的变化。由结果(图3)可知:AgNSs、AgNCs对斜生栅藻的生长均产生了一定的影响,但其影响效应存在差异。具体表述如下:
(1)由图3A可知,在不同暴露时间下,各实验组的藻密度均低于其相应对照组的藻密度。当斜生栅藻暴露于质量浓度为5 mg/L的AgNPs时,藻密度随暴露时间的增加而增加;当AgNSs的质量浓度分别为10、15、20 mg/L时,藻密度并未随着毒物浓度、暴露时间的变化而变化,即在宏观上可认为斜生栅藻在该条件下基本停止生长。AgNSs对斜生栅藻的长期作用表现出毒物兴奋效应:当化学品剂量较低时会对机体产生刺激作用(如生长、繁殖);当化学品剂量稍高时会产生毒性抑制作用[21]。
(2)由图3B可知,当暴露时间为12 h时,所有质量浓度组的藻密度相较于对照组均有所增加,且藻密度随着AgNPs的质量浓度的增大而增大。即在较短暴露时间下,AgNCs表现出的弱毒性会刺激斜生栅藻的生长。当暴露时间大于12 h后,AgNCs对斜生栅藻的生长有明显的抑制作用,藻在宏观上呈现停止生长的状态。AgNPs在水环境中所表现出的抑菌性主要由其游离出的Ag+决定[22]。有研究[11]表明,粒径>50 nm的AgNPs释放Ag+的速率低,但持续时间长,像稳定的Ag+排放源。因此,AgNCs可能在较短暴露时间(12 h)内所释放的Ag+的质量浓度较小,即使在20 mg/L下,所释放的Ag+的质量浓度仍在藻可抵抗的范围内。 藻受到毒性物质胁迫时,酶活性增强、代谢速率提高以抵抗毒物,从而导致繁殖速率加快,藻密度增大[23]。而随着暴露时间的增长(>12 h),因AgNCs的持续释放,Ag+的质量浓度超过了斜生栅藻所能承受的阈值,表现出生长抑制效应。

图3 不同质量浓度的AgNSs和AgNCs对斜生栅藻密度的影响Figure 3 The effects of different concentrations of AgNSs and AgNCs on the density of Scenedesmus obliquus
从研究结果来看,这2种形貌的AgNPs均影响藻类的生长:AgNSs对斜生栅藻的生长有毒物兴奋效应;AgNCs对藻类表现出暴露时间较短时促进生长、暴露时间较长时抑制生长的现象。这2种形貌的AgNPs在藻类生长上所表现出的差异性可能是其尺寸不同所导致的Ag+环境浓度差异引起的。
2.2.2 AgNPs对斜生栅藻叶绿素a的质量浓度的影响 叶绿素a在实验室培养条件下与藻细胞生物量有着显著的正相关关系,可间接反映生物量指标[23]。在本研究中,叶绿素a的质量浓度除了能体现宏观生物量的变化趋势外,也能反映AgNPs对斜生栅藻光合系统的影响。
在不同质量浓度的AgNSs、AgNCs暴露下,观察斜生栅藻中叶绿素a的质量浓度的变化情况。由结果(图4)可知:所有实验组的叶绿素a的质量浓度与其对应的对照组相比均显著降低,但也存在较大差异。说明AgNPs严重影响了斜生栅藻的光合作用,体现出毒性抑制效应。且如图3和图4所示,各实验组斜生栅藻的藻密度与叶绿素a的质量浓度间具有明显的同步增减关系,究其原因为:藻类依赖光合作用摄取生长代谢所需物质,叶绿素a的质量浓度高则藻细胞密度大,反之亦然,因此,AgNPs胁迫对叶绿素a的质量浓度所造成的影响,必然会在藻细胞密度的变化上得到对应体现。
由图4A可知:在质量浓度为5 mg/L的AgNSs的胁迫下,叶绿素a的质量浓度随暴露时间的增长而增加,在宏观生物量上呈现毒物兴奋效应;当AgNSs的质量浓度为10、15、20 mg/L时,叶绿素a的质量浓度一直保持较低水平,叶绿体处于不活跃状态,以致在宏观上体现出藻密度基本不变的情况。由图4B可知:实验组叶绿素a的质量浓度均低于相应对照组的。AgNCs的质量浓度仅为5 mg/L时就能显著抑制叶绿素a;而在20 mg/L的质量浓度下,抑制效应有所缓解,此现象的产生是由于更高浓度的毒物刺激使藻细胞做出了更激烈的应激反应。虽然粒径>50 nm 的AgNPs缓慢释放的Ag+会随时间积累,但这种毒性的积累仍在细胞可抵御的范围内,即叶绿素a的质量浓度在较高浓度的毒物胁迫下有上升趋势。这种暴露时间所表现出的环境毒性差异比在藻密度上的体现更明显。
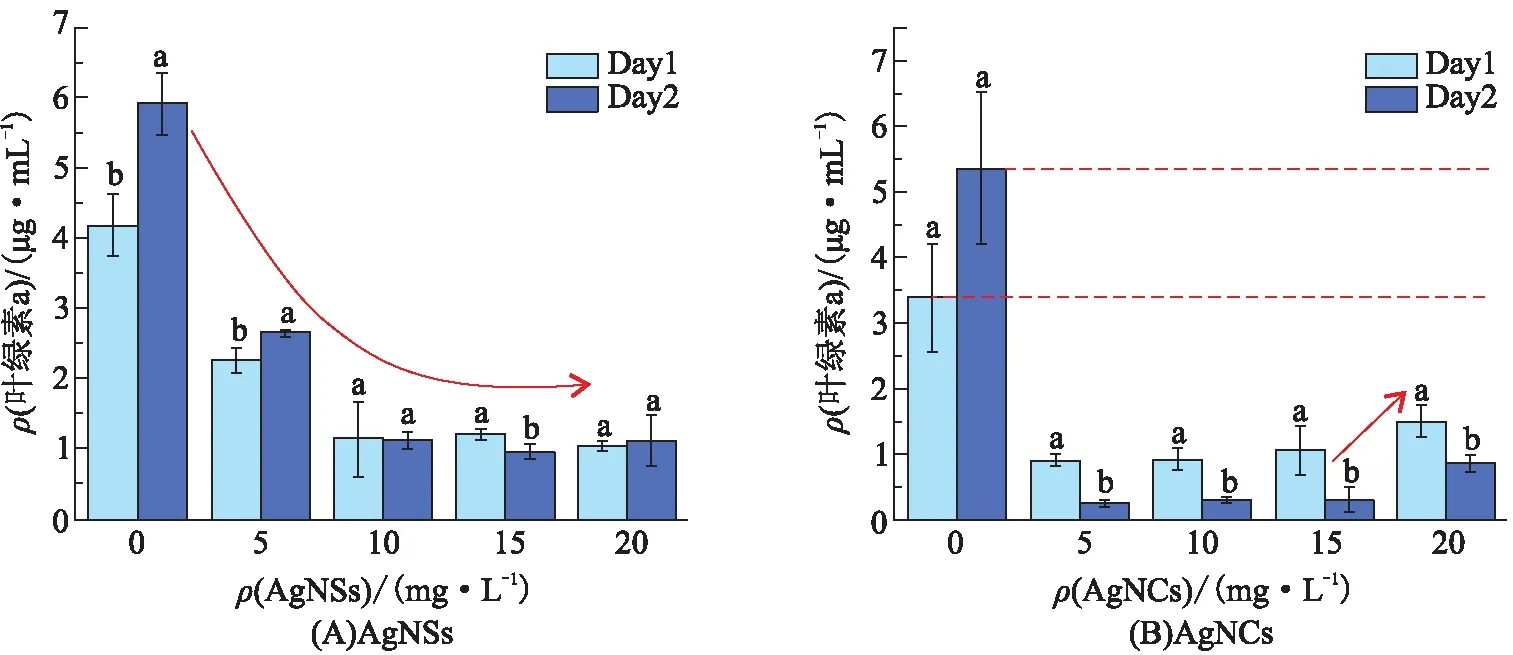
图4 不同质量浓度的AgNSs和AgNCs 对斜生栅藻中叶绿素a质量浓度的影响Figure 4 The effects of different concentrations of AgNSs and AgNCs on Chlorophyll-a content in Scenedesmus obliquus
综上分析,2种形貌的AgNPs均导致了叶绿素a质量浓度的下降,说明藻细胞的色素分子因受损或其合成代谢受到抑制,影响了藻类的光合系统。当毒物胁迫时的质量浓度进一步增加时,可能会形成大量活性氧(ROS),从而进一步破坏色素的结构和功能[23]。但AgNSs和AgNCs在尺寸上的差异性使其对叶绿素a的抑制程度不同,这在藻密度上也有对应体现。
2.2.3 典型酶应激反应
(1)AgNPs对ROS含量的影响。ROS是具有氧化性的含氧分子,具有很强的化学反应活性,可用于表征对生物体引起的化学损伤[24]。ROS的累积会抑制细胞生长,破坏细胞结构、脂质、蛋白质和核酸,最终导致细胞死亡[25]。但在污染物的质量浓度较低时,在污染物刺激下,ROS的产生会受到抑制,是一种环境胁迫下的自我保护反应[25]。暴露于不同质量浓度的AgNSs和AgNCs 48 h后,斜生栅藻中ROS含量的变化(图5)显示:
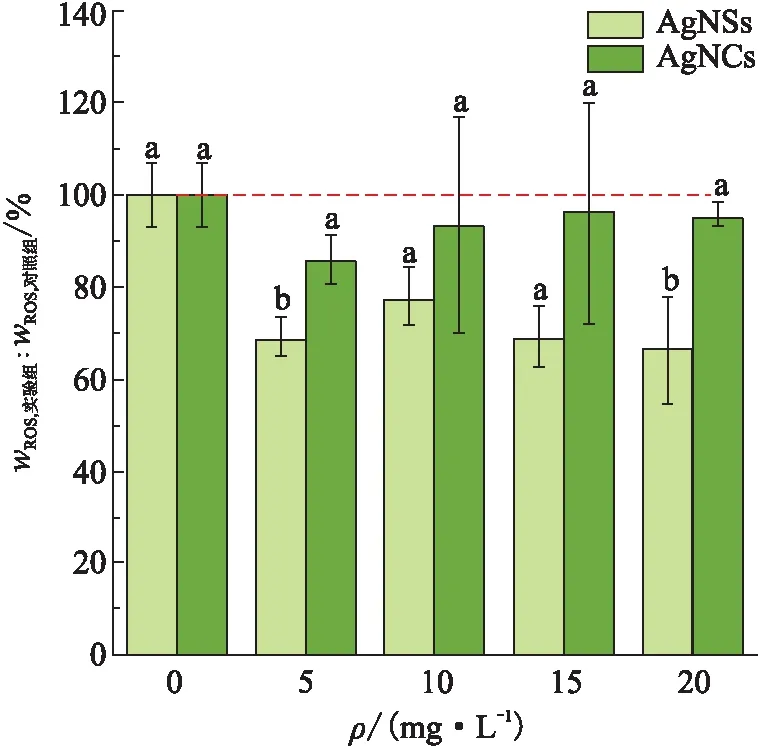
图5 不同质量浓度的AgNSs和AgNCs对斜生栅藻中ROS含量的影响Figure 5 The effects of different concentrations of AgNSs and AgNCs on ROS content in Scenedesmus obliquus
①各实验组的ROS含量均小于对照组的。正常情况下,藻细胞内ROS的产生和清除处于一个平衡状态,且为了防止因环境胁迫而打破这种平衡态,藻细胞的抗氧化系统介入,更多的抗氧化酶在胞内合成以抵制胁迫[23]。而本实验结果发现,在2种形貌的AgNPs胁迫下,藻细胞内ROS的清除较其产生更为活跃。这一结果说明斜生栅藻可能有其他的机制来耐受污染物[26],同时这种机制在作用的过程中会刺激细胞的抗氧化系统,而受刺激产生的抗氧化酶可能会参与或加速ROS的分解,以致ROS含量下降。
②同质量浓度下,AgNSs实验组的ROS含量均小于AgNCs实验组的。已有研究[27-28]表明,纳米ZnO的比表面积越高,粒径越小,其抗菌活性往往更强。而AgNSs的比表面积大于AgNCs的,且实验所用的AgNSs的粒径小于AgNCs的,由此推断AgNSs对藻细胞具有更强的刺激性,这种刺激表现为ROS含量的下降。
(2)AgNPs对MDA含量的影响。当藻类受到环境胁迫时,细胞内酶系统产生的ROS能够引发脂质过氧化,并促进合成脂质过氧化物,而MDA就是一种脂质过氧化物[24]。MDA含量可以反映机体脂质过氧化的程度,间接反映细胞的损伤程度[25]。暴露于不同质量浓度的AgNSs和AgNCs 48 h后,斜生栅藻中MDA含量的变化(图6)显示:
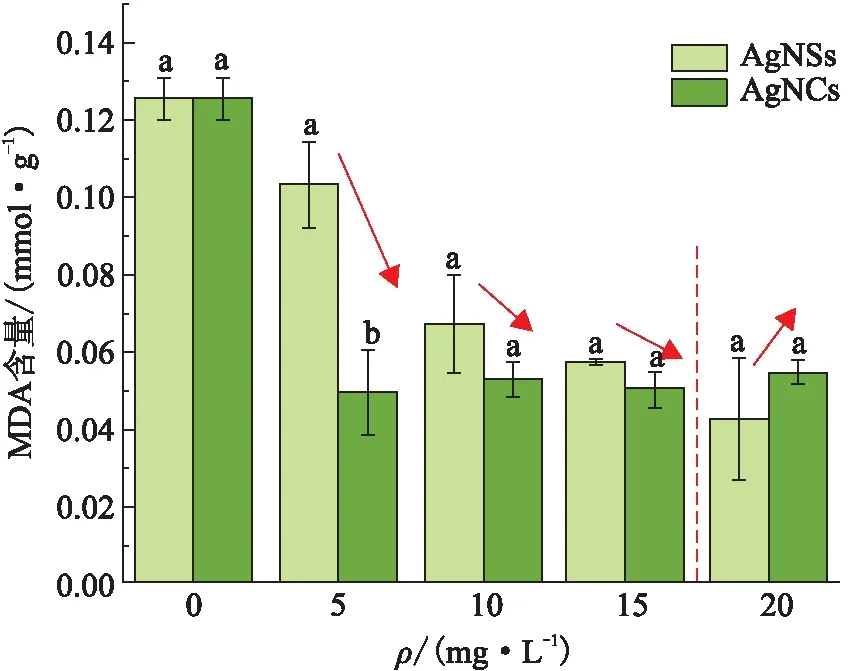
图6 不同质量浓度的AgNSs和AgNCs对斜生栅藻中MDA含量的影响Figure 6 The effects of different concentrations of AgNSs and AgNCs on MDA content in Scenedesmus obliquus
①与对照组相比,AgNPs对斜生栅藻中MDA的产生有明显的抑制作用。受AgNSs胁迫的实验组,MDA含量有明显的剂量-效应关系。对于经AgNCs处理的斜生栅藻而言,藻中MDA含量基本不随AgNCs的质量浓度的变化而改变。当斜生栅藻暴露于质量浓度为5、10、15 mg/L的AgNSs和AgNCs时,同质量浓度下经AgNSs处理的藻细胞中MDA含量高于AgNCs处理组的,而AgNPs的质量浓度为20 mg/L时的结果则相反。
②MDA作为ROS的反应产物,可能因ROS含量的减少而受到抑制。从ROS及MDA产生的抑制情况进一步说明斜生栅藻可能有其他机制来耐受污染物[26]。除此之外,对于晶体而言,尖锐顶点和边缘与酶表面的几何匹配更好[29],即AgNCs对MDA酶具有更显著的影响。 由于AgNCs的几何特性对MDA酶的抑制作用及毒物本身对氧化应激反应的抑制,AgNCs实验组的MDA含量一直处于稳定的较低水平。藻细胞在毒物的刺激作用下会出现MDA含量下降的现象,当毒物质量浓度大于15 mg/L后,受比表面积和粒径的影响,AgNSs呈现强于AgNCs的毒性效应。
③MDA含量的下降是ROS含量下降和MDA酶受到抑制的共同作用的结果。而ROS含量的变化主要是由藻细胞的应激反应引起,影响因素为AgNPs的比表面积和粒径大小;毒物对MDA的抑制作用主要受AgNPs几何形状的影响。
(3)AgNPs对SOD活性的影响。随着污染物质量浓度的升高,ROS含量并非是单调地升高或减少。在逆境条件下,植物体内ROS的生成和自我清除的平衡将被打破,同时也改变了SOD等抗氧化酶的活性[25]。为了保护自身免受氧化应激的损害,藻类细胞形成了高效的抗氧化机制,以中和逆境下细胞中累积的ROS,如SOD[25]。
暴露于不同质量浓度AgNSs和AgNCs 48 h后,斜生栅藻中SOD活性的变化(图7)显示:

图7 不同质量浓度的AgNSs和AgNCs对斜生栅藻中SOD活性的影响Figure 7 The effects of different concentrations of AgNSs and AgNCs on SOD activity in Scenedesmus obliquus
①AgNSs和AgNCs均使藻细胞产生应激反应而增强了SOD活性,且SOD活性在这2种形貌的毒物刺激下所达到的峰值无较大差异。
②在AgNSs的质量浓度大于10 mg/L后,实验组的SOD活性基本不变;在AgNCs的质量浓度大于5 mg/L后,实验组的SOD活性呈下降趋势,但其活性始终高于对照组。刘敏等[25]的研究表明,在高质量浓度的暴露下,SOD合成酶的活性并不能被成功激活,从而导致SOD的产生受到抑制。该结论与本实验结果一致。 AgNCs在高质量浓度所引起的SOD活性降低的现象,可能是因为立方体所具有的尖锐顶点和边缘与酶表面具有较好的几何匹配性,以致其对SOD的活性抑制更显著。
3 结论
本文制备得到2种形貌(球形、立方体)的AgNPs,即AgNSs及AgNCs,以斜生栅藻为受试生物,通过水环境暴露实验,观测了受试生物的生理生化响应,探讨了AgNPs的形貌与藻类表观毒性的相互关系。主要结果如下:
(1)从宏观生物量来看,2种形貌的AgNPs均影响藻类的生长:AgNSs对斜生栅藻的生长有毒物兴奋效应;AgNCs对藻类表现出暴露时间较短时促进生长、暴露时间较长时抑制生长的现象。AgNSs和AgNCs在藻类生长上所表现出的差异性,可能是其尺寸不同所导致的Ag+环境浓度差异引起的。
(2)2种形貌的AgNPs均对斜生栅藻的光合作用产生影响。相较而言,AgNCs能在更低浓度(5 mg/L)环境下对藻细胞的光合系统造成损伤。同时,叶绿素a的质量浓度在毒物胁迫下的变化与藻密度相对应,间接体现了AgNSs和AgNCs因尺寸不同所导致的毒性差异。
(3)本研究印证了斜生栅藻可能有其他机制来耐受污染物,但AgNPs仍会对抗氧化系统产生刺激作用,主要表现在ROS含量、MDA含量的下降和SOD活性的增强。但2种形貌的AgNPs引起的典型酶应激反应存在差异:AgNSs因具有较大比表面积和较小的粒径,而对细胞有更强的刺激性,因此对ROS的抑制作用更显著,且较高浓度的暴露使MDA含量处于较低水平;AgNCs因其几何形状而与酶具有更好的匹配性,以致其MDA含量一直处于较低且稳定的水平,且较高浓度的暴露使SOD活性有下降趋势。
