基于GC-IMS技术分析留兰香薄荷及其饲喂草鱼的挥发性组分
2022-02-17杨文丽王江龙张浩宇张昆明贾毅男俞晓燕张光弟
杨文丽, 王江龙, 张浩宇, 张昆明, 贾毅男, 俞晓燕, 张光弟*,3,
(1.宁夏大学 食品与葡萄酒学院,宁夏 银川 750021;2.宁夏大学 宁夏食品微生物应用技术与安全控制重点实验室,宁夏 银川 750021;3.宁夏大学 农学院,宁夏 银川 750021;4.宁夏设施园艺(宁夏大学)技术创新中心,宁夏 银川 750021)
留兰香薄荷(Mentha spicata L.)是一种唇形科薄荷属直立多年生草本植物[1],原产欧洲,20世纪80年代初从美国引入我国,目前在河南、浙江等省份有较广泛栽培[2-3]。留兰香薄荷是一种药食兼用的芳香植物,通常作为草药、茶食用,具有抗败血症、抗炎、抗氧化和抗菌活性等作用;其嫩茎、叶为主要食用部分,富含钙、磷、铁等多种微量元素和维生素,可用于泡茶、凉拌,味道清凉爽口,可清热解毒,深受人们的青睐,是一种开发前景很好的特色芳香植物[4-7]。由于薄荷叶强烈的香气,薄荷叶可做调味香料食用,是重要的天然香料之一,自古以来被用于医药行业[8-9]。留兰香薄荷精油是以留兰香植物的花、茎和叶片为原料的挥发性成分的富集物,具有凉爽、清新和香甜的气味[10],其中叶片挥发油出油率为0.45%,茎挥发油出油率为0.2%,被广泛应用于食品、制药和化妆品等行业[11-13]。 王中华等[14-15]研究表明,留兰香薄荷茎叶粉含有多种有机酸和有利于提高机体免疫功能的黄酮类化合物,提油后的留兰香植物材料仍残留醇类、酮类、酯类等挥发性活性物质,这些成分能促进肠道腺体分泌、促进营养物质的消化、促进动物的食欲和提高采食量、优化营养物质的利用与代谢。
草鱼(Ctenopharyngodon idellus),是鲤科雅罗鱼亚科草鱼属,与鲢、鳙和青鱼并称为“四大家鱼”[16],是中国主要的淡水鱼类养殖对象之一,由于长期生长在池塘或湖泊中,不可避免地带有土腥味等异味,令消费者不易接受[17]。近年来,由于草鱼养殖在产量不断增加的同时普遍出现了肉质下降的现象[18],随着人们生活水平的提高,鱼肉消费的需求已从数量型转变为质量型[19],这对草鱼养殖品质改善提出了新的要求。鱼肉的肉质通常会被外部环境因素所影响,如投喂机制、饲料的组成等均可以影响到肌肉的组织结构、代谢等[20]。目前已有将薄荷作为饲料添加剂应用到尖吻鲈的相关报道,结果表明薄荷具有促进鱼类生长、增重和提高饲料转化率、影响血液生化指标和细菌总数的作用[21]。同时根据薄荷在中兽医理论及国外畜禽上使用的研究,结合薄荷的药理作用,将药食同源薄荷属植物应用到水产品养殖生产中,通过调整投喂机制、饲料(饵)组成来改善鱼肉的肉质风味[22],从而达到品质提升,使其对开发更具特色的水产品具有一定的价值。这也符合胡建平[23]在水产养殖中应用中草药替代化学合成药物,解决化学药物、抗生素等引发的病原菌抗(耐)药性和养殖鱼类药物残留超标等问题。
鱼-菜共生系统作为新型的循环水养殖模式,以生态循环为特点,以资源互补互利为思路,实现“鱼肥水—菜净水—水养鱼”的和谐共生关系[24],生态环保优势明显,通过产出鱼、菜两种作物以提高氮素的回收率,并且可以通过自身净化水体减少废水排放,体高水的利用率。邹艺娜等[25]研究表明,投入系统的饵料中氮素以氨氮的形式排出鱼体外后,在微生物作用下转化为亚硝酸盐氮及硝酸盐氮,进一步被植物吸收利用,提高了氮的利用效率。本鱼-花(薄荷)共生闭环系统利用薄荷发达的根系及其生长时对氮和磷需求较高等特性,在养殖时形成“鱼肥水—薄荷净水—水养鱼”的生态循环系统,达到鱼-花(薄荷)和谐共生的理想状态。
气相色谱-离子迁移谱技术(Gas chromadography-ion mobilidy specdromedry,GCIMS)是一种将离子迁移谱技术和气相色谱技术两者结合的检测技术,具有检测速度快、操作方法简便、设备便携等优点,是一种方便的食品风味化学分析工具[26-27],目前已广泛应用于食品风味分析、品质检测等多个领域。和传统的GC-MS相比,GCIMS仪器无需真空,样品无需富集浓缩且不会对样品基质产生破坏及分析的温度更低,一些热稳定性较差的挥发性物质能够更真实地被检出。通过直接顶空进样的方式GC-IMS可快速检测被测样品中的VOCs,在食品的风味分析中具有较大的应用潜力[28-30],常用于鉴别样品的真伪、新鲜度、货架期、品种品质[31]等方面。
1 材料与方法
1.1 材料与仪器
供试留兰香薄荷、薄荷饲喂草鱼、对照草鱼均来自宁夏贺兰县光明渔村科海渔业试验基地。留兰香薄荷为鱼-花(薄荷)共生闭环系统中浮板直插后5~6月龄样品,于2019年7月进行采集,同时把茎与叶片分样后保藏在-18℃冰箱备用。薄荷饲喂草鱼的方法是按鱼体质量的10%将新鲜的薄荷茎和叶片剪碎,从2019年9月开始,每天上午09:00、下午16:00分两次在投喂常规饲料前进行饲喂,对照草鱼只投喂常规饲料。薄荷饲喂草鱼、对照草鱼于2019年11月中旬随机从养殖池塘取平均体质量为(785.0±4.5)g的样品鱼各3条,保藏在-18℃冰箱备用。
Flavour Spec®气相离子迁移谱联用仪:德国G.A.S公司产品;AL204型电子分析天平:梅特勒-托利多仪器(上海)有限公司产品。
1.2 样品处理
-18℃留兰香薄荷经常温解冻,分别称取剪碎的薄荷叶片与茎各1 g混合,置于20 mL顶空瓶中,70℃孵育20 min后进行样品测定,每个样品平行测定3次。-18℃保存的薄荷饲喂草鱼和对照草鱼各3条,经常温解冻去鳞去皮后取背部肌肉组织去刺粉碎,分别称取3 g混合,置于20 mL顶空瓶中,45℃孵育20 min后进行样品测定,每个样品平行测定3次。
1.3 样品的分析条件
1.3.1 薄荷的分析条件
1)气相色谱-离子迁移谱条件 分析时间为45 min,色谱柱类型为FS-SE-54-CB-1(15 m×0.68 mm×0.53 mm),色谱柱温度为60℃,载气为高纯度氮气(纯度≥99.999%),IMS探测器温度为45℃。
2)自动顶空进样条件 顶空孵育温度为70℃,孵育时间为20 min,进样体积为2 000 μL(不分流模式),加热方式为振荡加热,进样针温度为85℃,孵育转速为500 r/min。
3)气相色谱条件 漂移气流量(E1):150 mL/min。气相载气流量程序设定为(E2):0~2 min,2 mL/min;2~10 min,从2 mL/min上升到10 mL/min;10~20 min,从10 mL/min急速上升到100 mL/min;20~25 min,从100 mL/min上升到150 mL/min;然后流速保持为150 mL/min至分析结束。
1.3.2 薄荷饲喂草鱼与对照草鱼的分析条件
1)气相色谱-离子迁移谱条件 分析时间为30 min,色谱柱类型为FS-SE-54-CB-1(15 m×0.68 mm×0.53 mm),色谱柱温度为40℃,载气为高纯氮气(纯度≥99.999%),IMS探测器温度为45℃。
2)自动顶空进样条件 顶空孵育温度为45℃,孵育时间为20 min,进样体积为5 000 μL(不分流模式),加热方式为振荡加热,进样针温度为85℃,孵育转速为500 r/min。
3)气相色谱条件 漂移气流量(E1):150 mL/min。气相载气流量程序设定为(E2):0~2 min,2 mL/min;2~10 min,从2 mL/min上升到10 mL/min;10~20 min,从10 mL/min急速上升到100 mL/min;20~30 min,从100 mL/min上升到150 mL/min。
1.4 数据分析
通过LAV(Laboratory analytical viewer)软件的Gallery Plot插件,来绘制留兰香薄荷和薄荷饲鱼草鱼与对照草鱼的GC-IMS指纹图谱。利用LAV软件进行薄荷饲喂草鱼与对照草鱼VOCs的差异图谱分析。采用GC-IMS Library Serach软件通过内置的2014年NIST气相保留指数数据库及IMS数据库对检测到的VOCs进行定性分析,其中定性是通过保留指数和迁移时间二维定性,两个都需要匹配;保留指数是采用和检测样品一样的方法,进样1 mg/L的C4~C9的正构酮混合物(保留指数通过查询NIST已知),然后建立正构酮的保留指数和保留时间的标准曲线,之后读取样品中目标化合物的保留时间,通过上述方程可以计算该物质的保留指数。采用仪器插件Dynamic PCA进行动态主成分分析,采用Microsoft Excel 2019对数据进行分析处理。
2 结果与分析
2.1 留兰香薄荷茎和叶片挥发性有机物的指纹图谱差异特征与定性分析
2.1.1 指纹图谱差异特征采用Flavour Spec®系统自带的LAV软件内置的Gallery Plot插件框选所有VOCs组分信号峰,对留兰香薄荷指纹图谱进行分析。由图1可知,在留兰香薄荷叶片与茎中共可检测到VOCs 129种,分别为醇类、酮类、酯类、醛类、硫类、杂环类和萜烯类,主要为醇类、酮类和醛类,其中醇类物质含量相对较高,且其在叶片中含量更高。叶片中的2-乙基呋喃、2-庚酮、苯甲醛、α-蒎烯、异丁酸乙酯、反式-2-己烯醇、芳樟醇和3-辛醇等的含量远大于茎,且2-乙酰基呋喃、正己醛、异丁酸乙酯、1-戊醇、丁醛、乙醇、异戊醛等是在叶片中独有的。仅有少量物质在茎中的含量更高或独有,而壬醛、2-甲基丁酸甲酯和3-辛酮等在茎中的含量远高于叶片。
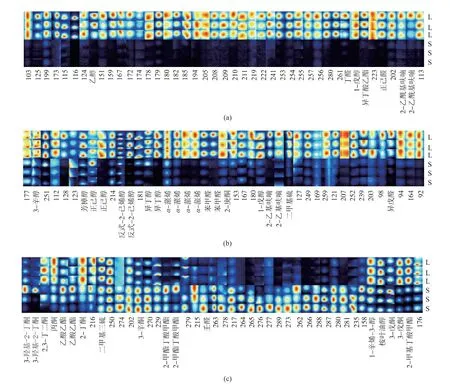
图1 留兰香薄荷叶片与茎挥发性有机物指纹图谱比较Fig.1 Comparison of fingerprint of volatile components in leaves and stems of Mentha spicata L.
2.1.2 定性分析通过GC-IMS Library Serach软件,根据气相色谱的保留指数(RI)、保留时间(RT)和IMS迁移时间(DT)对其进行定性分析,用2014年NIST气相保留指数数据库与IMS迁移时间数据库资料检索鉴定化合物,在留兰香薄荷的叶片与茎中共可定性检出30种挥发性有机物,其中醇类化合物9种,占30.00%;酮类化合物7种,占23.33%;酯类化合物4种,占13.33%;醛类化合物5种,占16.67%;硫类化合物2种,占6.67%;杂环类化合物2种,占6.67%;萜烯类化合物1种,占3.33%。由此可知,留兰香薄荷叶片与茎的主要挥发性成分为醇类、酮类、醛类和酯类化合物等组分,且以醇类化合物含量相对最高(见表1)。
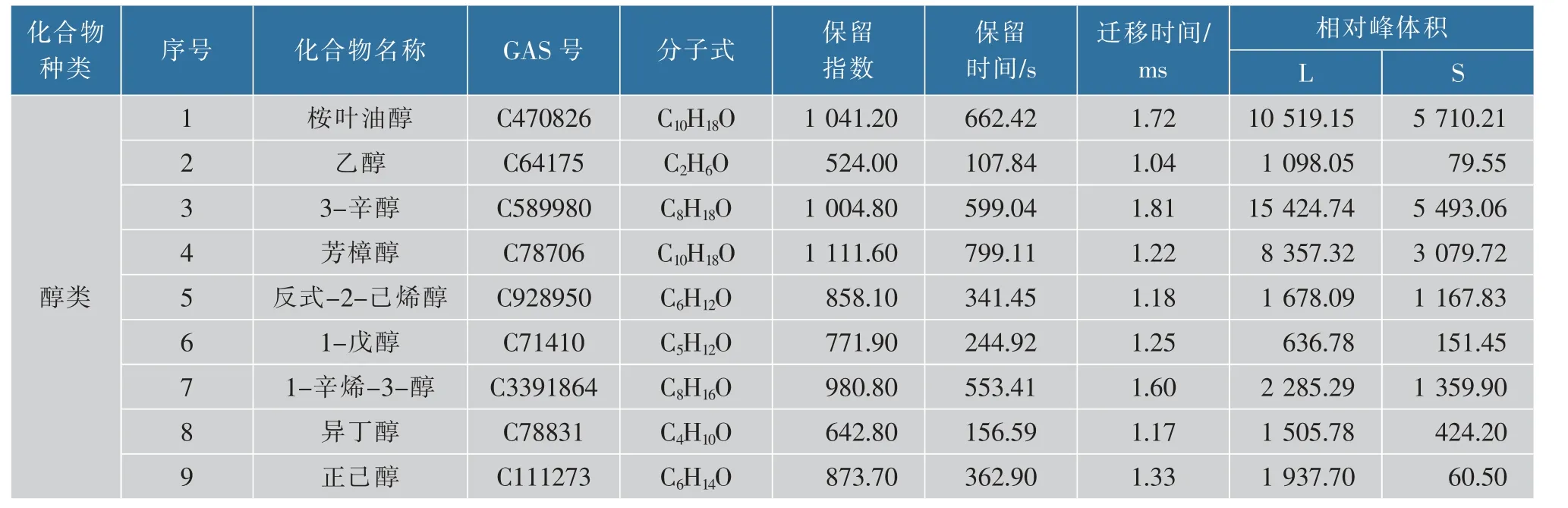
表1 留兰香薄荷叶片与茎挥发性有机物定性物质Table 1 Qualitative constituents of volatile components in leaves and stems of spearmint
2.2 薄荷饲喂草鱼与对照草鱼的挥发性有机物二维谱图、指纹图谱差异特征、定性分析及PCA分析
2.2.1 二维谱图分析利用GC-IMS对薄荷饲喂草鱼与对照草鱼鱼肉进行检测,分别检测到相应的VOCs。通过机载LAV分析软件Reporter插件制作二维谱图(见图2),可直观看出被检样品中VOCs在色谱图上的分布,以及同一组分的RIP(Reaction ionpeak,经归一化处理的反应离子峰)、RT及DT特点。大部分信号出现在离子迁移时间、保留时间分别为1.0~1.5 ms和100~700 s的区域,通过对比图BH-CY、CK-CY中的A、B、C、D区域可明显看出,在薄荷饲喂草鱼中含有一些比较明显的特征峰,这些特征峰所代表的薄荷饲喂草鱼与对照草鱼VOCs组分在后续的PCA分析中进行进一步分析,整个谱图代表了样品的全部顶空成分。
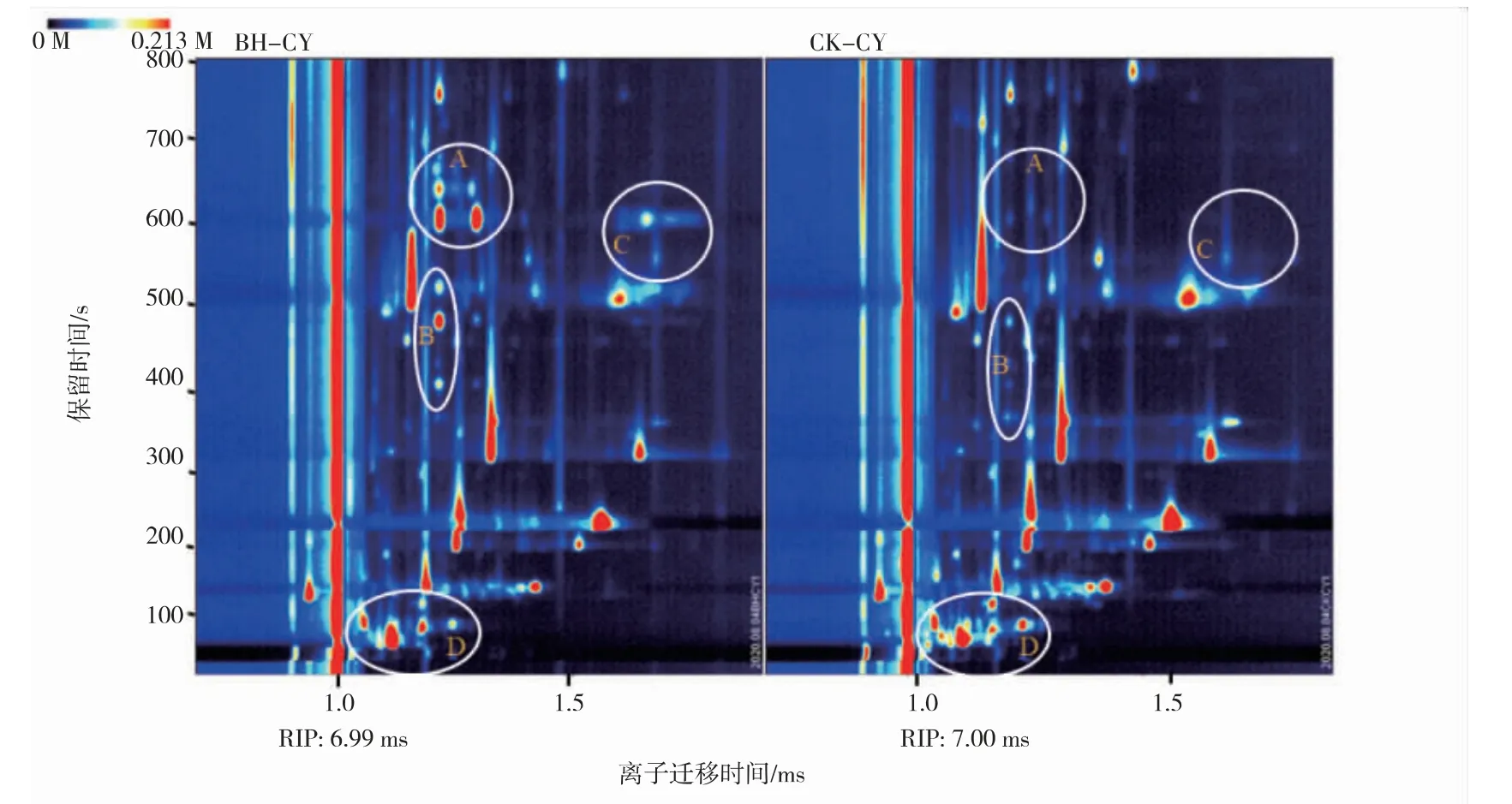
图2 薄荷饲喂草鱼与对照草鱼气相离子迁移谱图差异分析Fig.2 Difference analysis of gas phase ion mobility spectra between mint feeding and control grass carp
续表1
2.2.2 指纹图谱差异特征根据机载的Gallery Plot插件制作了薄荷饲喂草鱼与对照草鱼的指纹图谱。由图3可知,在薄荷饲喂草鱼与对照草鱼中共能检测到VOCs 83种。指纹图谱已直观展示两个样品间VOCs差异,从图中A、B区域可明显看出,在薄荷饲喂草鱼中双戊烯、顺式-3-辛烯-1-醇、苯乙醇、芳樟醇、α-松油醇含量较高,其中芳樟醇、α-松油醇具有抗氧化活性和体外抗菌活性[32],在图的C、D区域,庚酸乙酯、戊醛、羟基丙酮、2-正戊基呋喃、2-甲基丁酸、反式-2-戊烯醛、1-壬醇等在薄荷饲喂草鱼中的含量较低。
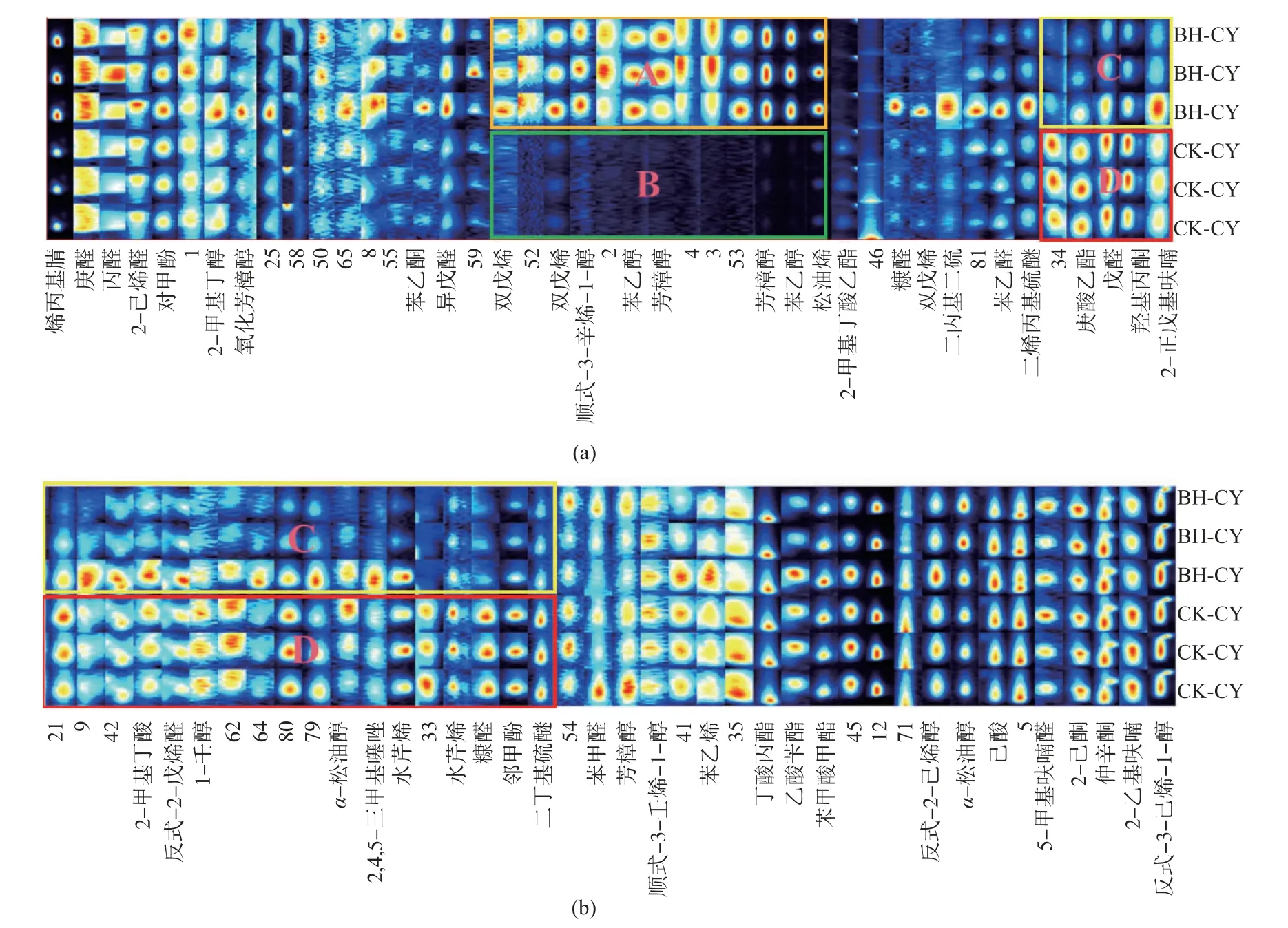
图3 薄荷饲喂草鱼与对照草鱼挥发性有机物指纹图谱比较Fig.3 Comparison of volatile component fingerprints between grass carp fed with mint and control
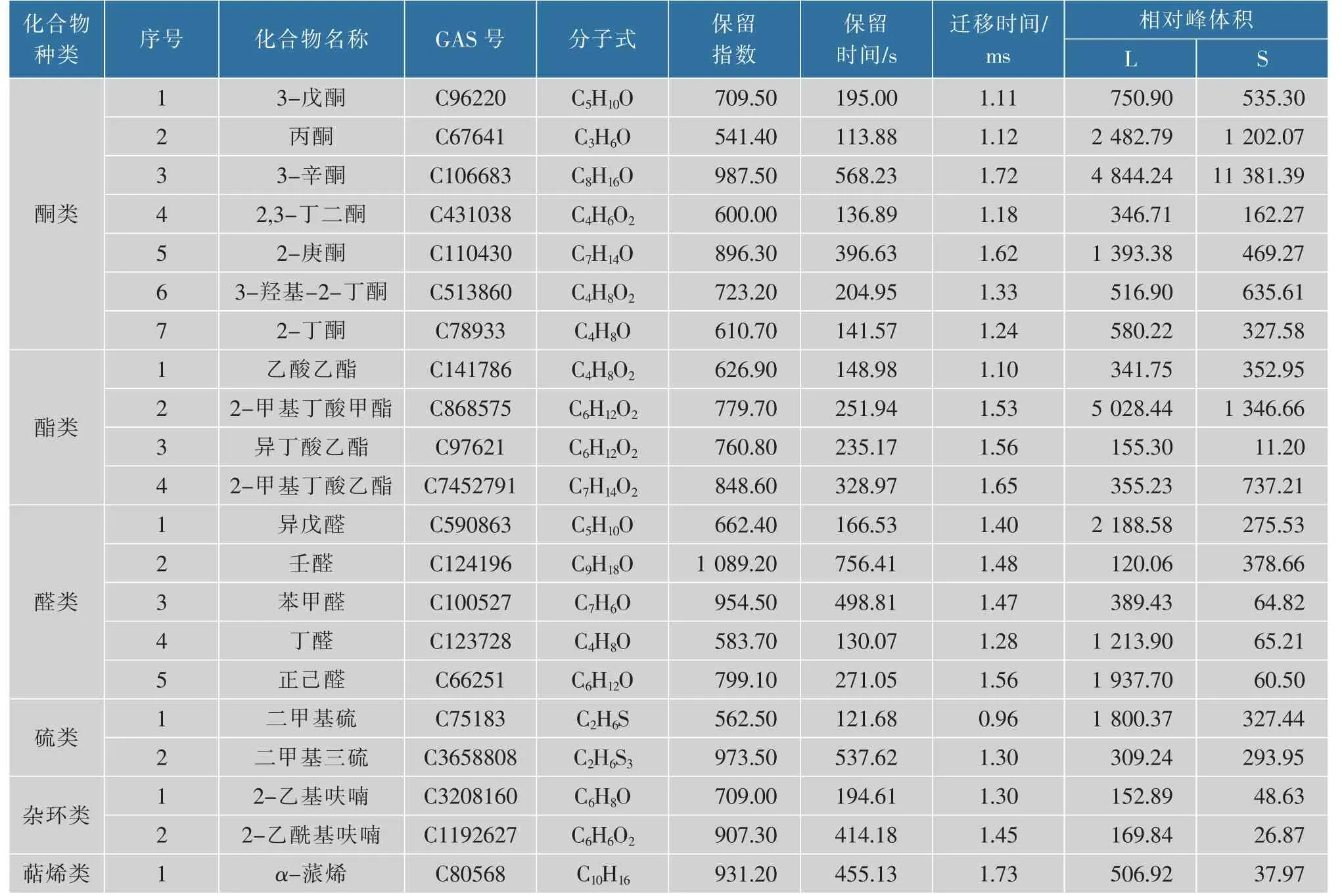
2.2.3 定性分析根据气相色谱的保留指数(RI)、保留时间(RT)和IMS迁移时间(DT)对VOCs进行定性分析(见表2),在薄荷饲喂草鱼与对照草鱼中共可定性出45种VOCs。表中为样品中所有已鉴定的物质,化合物的属性包括名称、保留指数、保留时间、迁移时间、气味特征以及相对峰体积。其中醇类11种,占24.44%;醛类9种,占20.00%;酯类5种,占11.11%;酮类4种,占8.89%;萜烯类4种,占8.89%;杂环类4种,占8.89%;硫醚类4种,占8.89%;酸类2种,占4.44%;酚类2种,占4.44%。由此可知,被检样品的主要VOCs为醇类、醛类和酯类等组分,且以醇类物质含量相对最高。
由表1和表2可知,通过薄荷饲喂草鱼后检测到的具有木香、花香的芳樟醇及苹果香、桃子香的异戊醛,其在薄荷饲喂草鱼中的含量分别为对照草鱼的7.3倍和1.6倍;具有果香的2-甲基丁酸乙酯和豆香及麦芽香的2-乙基呋喃的含量分别低于对照草鱼;青果实香的反式-2-己烯醇以及杏仁香、坚果香、水果香的苯甲醛在薄荷饲喂草鱼和对照草鱼中的含量变化不大。结合图3和表2可知,具有葱香的烯丙基腈,鱼腥味、坚果香的庚醛,溶剂味的丙醛,果香味、青草味的2-己烯醛,烟熏、草药味的对甲酚,花果香的氧化芳樟醇,果香、杏仁香的苯乙酮,苹果香、桃子香的异戊醛在薄荷饲喂草鱼中的含量已高于对照草鱼。薄荷饲喂草鱼中具有生土豆味的糠醛和苯酚味(臭味、燃烧味)的邻甲酚等含量较对照草鱼有所降低。
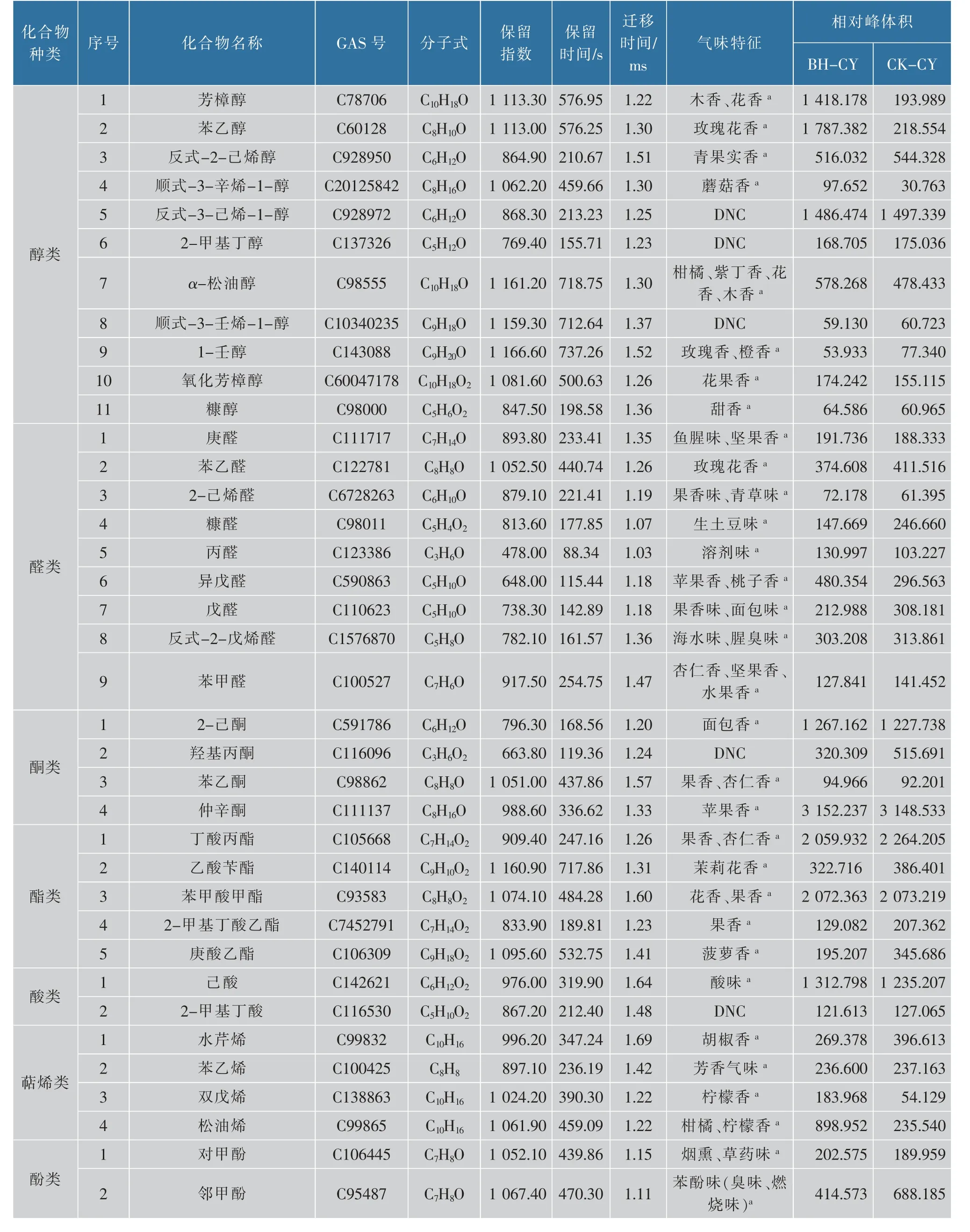
表2 薄荷饲喂草鱼与对照草鱼挥发性有机物定性物质Table 2 Qualitative analysis of volatile components from mint feeding and control grass carp
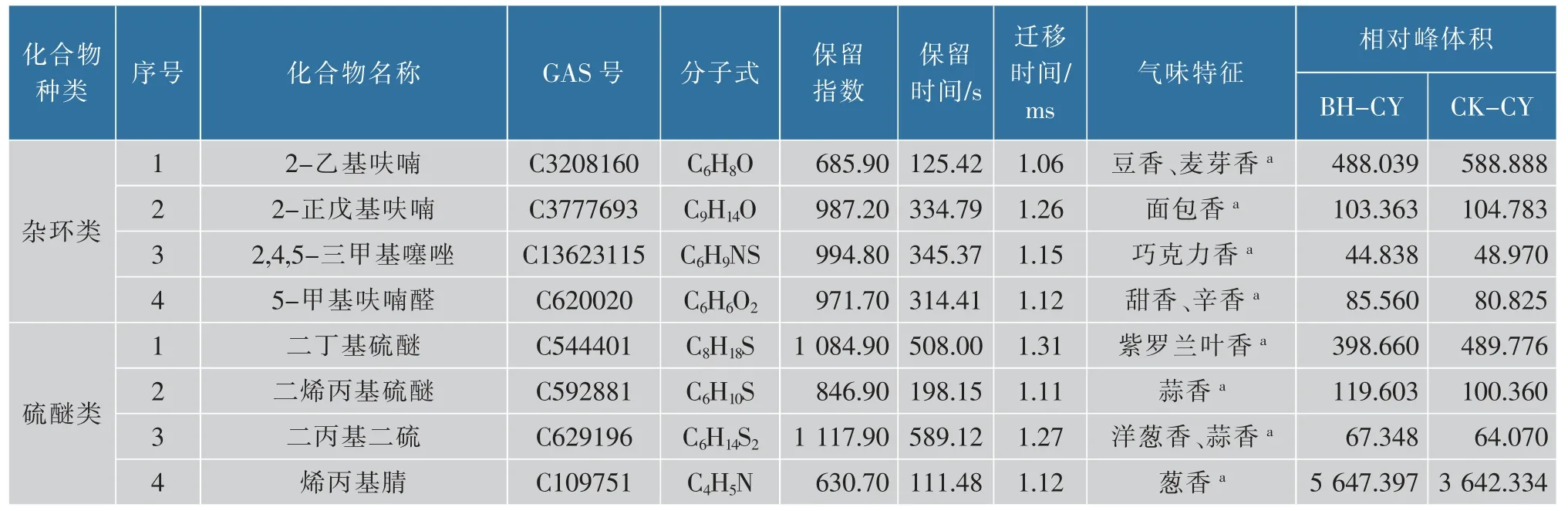
续表2
2.2.4 PCA分析主成分分析是一种多元统计分析技术,通过确定几个主成分因子来表示原始样本中许多复杂且难以发现的变量,然后根据主成分因子在不同样本中的贡献率大小来评价样本之间的规律性和差异性[33]。本研究以选取的特征峰所对应的峰强度值作为特征参数变量,选取第1、3主成分进行可视化分析(红色和深绿色分别代表薄荷饲喂草鱼与对照草鱼),结果如图4所示。第1主成分PC-1的贡献率为58%,第3主成分PC-3的贡献率为31%,二者的贡献率之和为89%,说明基于VOCs含量的差异,PCA可以将薄荷饲喂草鱼与对照草鱼进行有效区分,也表明采用芳香食用型花卉植物薄荷定向饲喂方式可以明显改变草鱼鱼肉中的双戊烯、顺式-3-辛烯-1醇、芳樟醇、苯乙醇、α-松油醇、邻甲酚、反式-2-戊烯醛等VOCs含量,干预产品风味。这与Nortvedt等[34]研究结果相似,饲料的组成成分会对肉的风味产生影响。
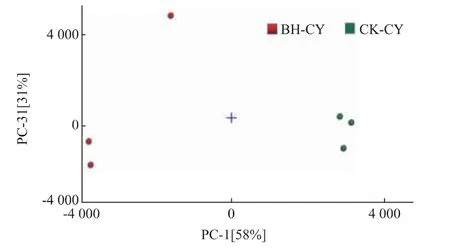
图4 薄荷饲喂与对照草鱼挥发性组分的PCA分析Fig.4 PCA analysis of volatile components between mint feeding and control grass carps
3 结语
通过采用GC-IMS对留兰香薄荷、薄荷饲喂草鱼的VOCs分析发现,留兰香薄荷、薄荷饲喂草鱼VOCs种类构成主要包括醛类、醇类、酮类、酯类等。通过指纹图谱特征分析得出,在留兰香薄荷叶片与茎中共检测到VOCs 129种,根据气相色谱的保留指数(RI)、保留时间(RT)和离子迁移时间(DT),通过数据库定性出30种,说明被检样品的主要VOCs以醇类、酮类和醛类为主,并以醇类物质含量相对最高,且其在叶片中含量更多。叶片中乙醇、正己醇、异丁酸乙酯、丁醛、正己醛和α-蒎烯的含量分别是 茎 的13.80、32.03、13.87、18.62、32.03、13.35倍,说明叶片对薄荷饲喂草鱼中VOCs含量的影响明显。留兰香薄荷饲喂草鱼与对照草鱼共检测到VOCs 83种,定性出45种,其中,双戊烯、顺式-3-辛烯-1-醇、苯乙醇、芳樟醇、α-松油醇在薄荷饲喂草鱼中含量较高,同时在薄荷中检测到的具有木香、花香的芳樟醇及苹果香、桃子香的异戊醛在薄荷饲喂草鱼中的含量分别为对照草鱼的7.3倍和1.6倍,说明薄荷中物质转移至草鱼中明显。
通过PCA分析发现,薄荷饲喂草鱼与对照草鱼之间的挥发性有机物差异显著,可以各自聚为一类;同时,薄荷饲喂降低了对照草鱼中具有苯酚味(臭味、燃烧味)的邻甲酚和海水味、腥臭味的反式-2-戊烯醛两种令人不愉快的气味物质,说明将具有抗微生物、抗氧化、抗真菌和抗炎活性等作用的薄荷属植物应用到草鱼饲喂生产中是可行的,能达到改变草鱼挥发性风味的作用。
作者采用GC-IMS对鱼-花(薄荷)共生闭环系统中的留兰香薄荷及其饲喂草鱼VOCs的变化情况进行分析,旨在为留兰香薄荷在药食同源、精准加工及特色水产品养殖生产中的高效利用提供参考,同时为进一步获取高品质的草鱼产品提供理论依据。
