泮托拉唑对急性肺损伤模型大鼠和人肺微血管内皮细胞损伤的作用及作用机制*
2022-02-17陈庆贤刘立伟吴茂森
陈庆贤,刘立伟,吴茂森
(海南西部中心医院药剂科,海南 儋州 571799)
急性肺损伤(ALI)及急性呼吸窘迫综合征(ARDS)是由各种非心源性原因引起的肺毛细血管内皮和肺泡上皮损伤,血管通透性增高的临床综合征[1]。ALI的临床死亡率高达45%[2],故进一步探索有效治疗ALI的药物具有重要意义。泮托拉唑是一种质子泵抑制剂,是治疗消化不良、胃食管反流病、消化性溃疡等多种胃食管疾病的有效胃酸分泌拮抗剂[3],通过抑制内皮细胞和胃壁细胞核因子−κB(NF−κB)的激活,调节多形核中性粒细胞中的钙离子浓度,抑制中性粒细胞的迁移等不同作用机制,以减轻炎性损伤[4]。雷帕霉素靶蛋白(mTOR)通路在代谢、增殖和自噬诱导过程中起着关键作用,自噬是细胞维持稳态的一种重要机制,脂多糖可诱导小鼠肺上皮和人支气管上皮细胞mTOR磷酸化,并抑制自噬[5]。本研究中探讨了泮托拉唑通过mTOR信号通路调控自噬对大鼠ALI和内皮细胞损伤的影响,为开发新的ALI治疗药物提供参考。现报道如下。
1 材料与方法
1.1 仪器、试药、动物与细胞
仪器:Multiskan FC型酶标仪(赛默飞世尔科技<中国>有限公司);CytoFLEX V2−B4−R2型流式细胞仪(美国贝克曼库尔特有限公司);E200型光学显微镜(日本尼康公司);BIO−RADXR型凝胶成像分析系统(美国伯乐公司)。
试药:泮托拉唑(批号为CC2261),地塞米松(批号为D4902),氯喹(批号为C6628),脂多糖(批号为916374),均购自美国Sigma Aldrich公司;大鼠肿瘤坏死因子−α(TNF−α)、白细胞介素6(IL−6)、白细胞介素1β(IL−1β)酶联免疫吸附(ELISA)检测试剂盒,均购自上海江莱生物科技有限公司;TUNEL凋亡检测试剂盒(德国Roche公司);Annexin V FITC/PI凋亡检测试剂盒(北京索莱宝生物科技有限公司);LC3,Beclin1,mTOR,p−mTOR,甘油醛−3−磷酸脱氢酶(GAPDH)抗体,均购自英国Abcam公司;BeyoECLStar特超敏电化学发光试剂盒(上海碧云天生物技术有限公司)。
动物与细胞:SPF级成年雄性SD大鼠48只,体质量220~250 g,购自海南省实验动物中心,实验动物生产许可证号为SCXK(琼)2020−0007,饲养于(20±2)℃条件下,提供充足饮水及饲料,适应性饲养1周。
细胞:人肺微血管内皮细胞(HPMECs,上海中乔新舟生物科技有限公司,货号为3000)。
1.2 方法
脂多糖诱导ALI大鼠模型分组及给药:将48只SD大鼠随机分为正常对照组,脂多糖组,阳性对照组,泮托拉唑低、高剂量组,泮托拉唑高剂量+氯喹组(氯喹为自噬抑制剂),各8只。除正常对照组外,其余各组大鼠均腹腔注射5 mg/kg脂多糖,以建立ALI大鼠模型。苏木精−伊红(HE)染色见肺微血管内充血及出血,肺泡腔及肺泡隔内有大量中性粒细胞聚集;肺组织湿/干重比值明显升高,血清炎性因子水平明显上升,代表成功构建ALI模型[6]。注射30 min后,阳性对照组大鼠腹腔注射地塞米松2 mg/kg[7],泮托拉唑低、高剂量组大鼠分别腹腔注射26,104 mg/kg泮托拉唑[8],泮托拉唑高剂量+氯喹组大鼠腹腔注射104 mg/kg泮托拉唑和10 mg/kg氯喹[9],正常对照组和脂多糖组注射等体积生理盐水。24 h后进行后续实验。
细胞培养与泮托拉唑给药浓度确定:取HPMECs细胞,用含10%胎牛血清的RPMI 1640培养基,于37℃、5% CO2培养箱中培养。待细胞密度为80%~90%时,0.25%胰酶液消化细胞,取100 µL HPMECs细胞(5×103个/孔)加入96孔板,12 h后分别向细胞中加入不同质量浓度泮托拉唑,即10 µg/mL组、20 µg/mL组、40 µg/mL组、80 µg/mL组、160 µg/mL组,空白组加入等体积生理盐水。37℃、5%CO2条件下培养24 h后,向细胞中加入CCK−8(10µL/孔),37℃条件下孵育3 h。利用Multiskan FC型酶标仪于450 nm波长处测定各孔吸光度值。
HPMECs细胞分组、细胞损伤模型构建与给药:将对数生长期的HPMECs细胞接种于6孔板(5×104个/孔),继续培养24 h,将细胞随机分为正常对照组,脂多糖组,阳性对照组,泮托拉唑低、高剂量组,泮托拉唑高剂量+氯喹组,各3孔。正常对照组和脂多糖组细胞给予等体积生理盐水,其余各组细胞添加100µg/mL脂多糖[10],刺激1 h,收集细胞。检测到炎性因子水平较对照组明显升高,表示成功构建HPMECs细胞损伤模型。脂多糖处理1 h后,阳性对照组添加100 nmol/L地塞米松[7],泮托拉唑低、高剂量组分别添加泮托拉唑40,80 µg/mL,泮托拉唑高剂量+氯喹组添加泮托拉唑80µg/mL和氯喹5µmol/L[11]。继续培养24 h后进行后续实验。
HE染色:给药24 h后,取大鼠肺组织,4%多聚甲醛固定72 h,用乙醇梯度脱水,用二甲苯使之透明。石蜡包埋,切片,脱蜡至水,苏木精染色10 min,0.7%盐酸乙醇分化数秒,流水洗涤,伊红液浸染3 min。用乙醇梯度脱水,用二甲苯使之透明,中性树胶封片。参考文献[12],对肺组织病理学变化进行评分。
肺组织湿/干重比值测定:给药24 h后,麻醉大鼠,取右上肺,去除肺表面水分和血迹,称定质量,即为湿重(W)。65℃恒温箱干燥肺组织,48 h后称定质量,即为干重(D)。计算各组大鼠W/D值。
TUNEL染色检测肺组织凋亡:按HE染色项下方法进行肺组织石蜡切片,常规脱蜡至水,磷酸盐缓冲液(PBS)漂洗,3%H2O2浸洗10 min,加入蛋白酶K工作液,37℃反应20 min,PBS漂洗,滴加TUNEL反应混合液,湿盒中37℃孵育1 h;PBS漂洗,加入转化剂,湿盒中37℃孵育20 min;PBS漂洗,DAB显色;中性树胶封片,于光学显微镜下观察。
肺组织和HPMECs细胞中TNF−α,IL−6,IL−1β水平测定:采集大鼠颈动脉血液标本,4℃条件下以1 000 r/min的转速离心10 min,取血清。收集HPMECs细胞培养上清液,以10 000 r/min的转速离心10 min,去除死细胞及细胞碎片等,吸取上清液,置新的无菌离心管中,分装后冻存,后续实验用。根据ELISA试剂盒说明书检测血清和上清液中TNF−α,IL−6,IL−1β的水平。
流式细胞仪测定HPMECs细胞凋亡率:收集给药处理后的HPMECs细胞,PBS清洗后,Binding Buffer重悬细胞,随后加入Annexin V−FITC室温避光孵育15 min,加入PI室温避光孵育5 min,1 h内利用流式细胞仪检测。
蛋白免疫印迹(Western blot)法测定蛋白表达:将大鼠肺组织剪碎,收集给药继续培养24 h后的HPMECs细胞,RIPA裂解液裂解组织和细胞,以10 000 r/min的转速离心10 min,取上清液,采用蛋白质定量(BCA)法测定蛋白浓度。取30µg蛋白经SDS−PAGE分离,并转至PVDF膜上。10%脱脂奶粉封闭,随后加入LC3(1∶1000)、
Beclin1(1∶1 000)、mTOR(1∶1 000)、p−mTOR(1∶1 000)、GAPDH(1∶2 000)抗体,4℃条件下过夜孵育。加入二抗(1∶5 000),室温孵育1 h后,滴加BeyoECL Star工作液至膜上,用化学发光成像仪检测。
CCK−8检测细胞活性:取对数生长期的HPMECs细胞,按HPMECs细胞损伤模型分组,加入脂多糖诱导并给药处理,在37℃、5%CO2培养箱中培养24 h后,每孔加入20µL CCK−8溶液,2 h后利用酶标仪于450 nm波长处测定吸光度值。细胞活力(%)=[A(加药)−A(空白)]/[A(0加药)−A(空白)]×100%。其中,A(加药),具有细胞、CCK−8溶液和药物溶液孔的吸光度,A(0加药)为具有细胞、CCK−8溶液而无药物溶液孔的吸光度值,A(空白)为没有细胞孔的吸光度值。
1.3 统计学处理
采用SPSS 21.0统计学软件分析。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD−t检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肺组织病理学变化、W/D值、炎性因子水平
结果见图1和表1。与正常对照组比较,脂多糖组大鼠肺组织病理学评分、W/D值及TNF−α,IL−6,IL−1β水平均显著升高(P<0.05);与脂多糖组比较,阳性对照组,泮托拉唑低、高剂量组大鼠肺组织上述指标均显著降低(P<0.05);与泮托拉唑高剂量组比较,泮托拉唑高剂量+氯喹组大鼠肺组织上述指标均显著升高(P<0.05)。
2.2 大鼠细胞凋亡情况
结果见图2和表1。与正常对照组比较,脂多糖组大鼠TUNEL阳性细胞数显著增多(P<0.05);与脂多糖组比较,阳性对照组,泮托拉唑低、高剂量组大鼠TUNEL阳性细胞数均显著减少(P<0.05);与泮托拉唑高剂量组比较,泮托拉唑低高剂量+氯喹组大鼠TUNEL阳性细胞数显著增多(P<0.05)。
表1 大鼠肺组织病理学评分、W/D值、血清炎性因子水平和细胞凋亡情况比较(±s,n=8)Tab.1 Comparison of lung histopathological score,W/D ratio,serum inflammatory factor levels and apoptosis of rats(±s,n=8)
注:与正常对照组比较,*P<0.05;与脂多糖组比较,#P<0.05;与泮托拉唑高剂量组比较,&P<0.05。表3至表4同。Note:Compared with those in the normal control group,*P<0.05(for Tab.1 and Tab.3−4);Compared with those in the LPS group,#P<0.05(for Tab.1 and Tab.3−4);Compared with those in the pantoprazole high−dose group,&P<0.05(for Tab.1 and Tab.3−4).
组别正常对照组脂多糖组阳性对照组泮托拉唑低剂量组泮托拉唑高剂量组泮托拉唑高剂量+氯喹组F值P值给药剂量2 mg/kg 26 mg/kg 104 mg/kg 104 mg/kg+10 mg/kg肺组织病理学评分(分)0.25±0.02 8.13±0.84*2.84±0.51*#5.07±0.65*#3.52±0.44*#5.48±0.61&145.346<0.001 W/D值3.22±0.34 5.63±0.40*3.13±0.28*#4.34±0.31*#3.95±0.24*#5.13±0.30&64.284<0.001血清炎性因子TNF−α 32.16±5.04 312.93±24.41*105.38±12.35*#191.81±28.67*#127.84±15.06*#243.11±24.07&134.475<0.001 IL−6 43.44±4.91 227.18±19.20*98.87±10.18*#163.41±14.61*#114.45±11.01*#186.89±13.18&115.836<0.001 IL−1β 100.34±9.96 290.73±23.19*127.28±13.67*#198.81±20.26*#142.47±13.84*#241.51±19.07&97.743<0.001 TUNEL阳性细胞数(个/每个视野)52.33±5.51 613.67±56.52*238.63±28.18*#483.67±36.53*#274.33±25.54*#552.67±35.02&178.745<0.001

A.正常对照组B.脂多糖组C.阳性对照组D.泮托拉唑低剂量组E.泮托拉唑高剂量组F.泮托拉唑高剂量+氯喹组图1大鼠肺组织病理学变化(×400)A.Normal control group B.LPS group C.Positive control group D.Pantoprazole low−dose group E.Pantoprazole high−dose group F.Pantoprazole high−dose+chloroquine groupFig.1 Pathological changes of lung tissue of rats(×400)

A.正常对照组B.脂多糖组C.阳性对照组D.泮托拉唑低剂量组E.泮托拉唑高剂量组F.泮托拉唑高剂量+氯喹组图2大鼠肺组织细胞凋亡TUNEL染色检测结果(×400)A.Normal control group B.LPS group C.Positive control group D.Pantoprazole low−dose group E.Pantoprazole high−dose group F.Pantoprazole high−dose+chloroquine groupFig.2 TUNEL staining results of apoptosis in lung tissue of rats(×400)
2.3 HPMECs细胞炎性因子水平和细胞凋亡情况
结果见表2、表3和图3。与空白组比较,160µg/mL组细胞活力显著降低(P<0.05),其余组无明显变化。故选取40µg/mL和80µg/mL作为使用浓度。与正常对照组比较,脂多糖组细胞TNF−α,IL−6,IL−1β水平及细胞凋亡率均显著升高(P<0.05);与脂多糖组比较,阳性对照组,泮托拉唑低、高剂量组细胞上述指标水平均显著降低(P<0.05);与泮托拉唑高剂量组比较,泮托拉唑高剂量+氯喹组细胞上述指标水平均显著升高(P<0.05)。
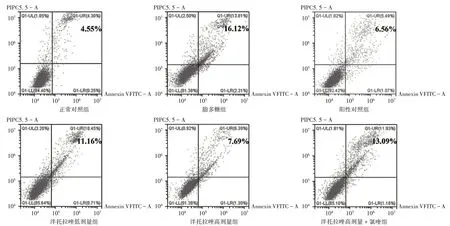
图3 流式细胞仪检测HPMECs细胞凋亡情况Fig.3 Apoptosis of HPMECs detected by the flow cytometry
表2 不同剂量泮托拉唑对HPMECs细胞活力的影响(±s,%,n=3)Tab.2 Effects of different doses of pantoprazole on cell viability of HPMECs(±s,%,n=3)

表2 不同剂量泮托拉唑对HPMECs细胞活力的影响(±s,%,n=3)Tab.2 Effects of different doses of pantoprazole on cell viability of HPMECs(±s,%,n=3)
注:与空白组比较,*P<0.05。Note:Compared with those in the blank group,*P<0.05.
组别空白组10µg/mL组20µg/mL组40µg/mL组细胞活力100.00±5.32 98.37±6.21 97.82±6.98 95.14±5.88组别80µg/mL组160µg/mL组F值P值细胞活力91.29±5.27 80.86±5.92*37.297<0.001
表3 HPMECs细胞TNF-α,IL-6,IL-1β水平及细胞凋亡率比较(±s)Tab.3 Comparison of TNF-α,IL-6 and IL-1β levels and apoptosis of HPMECs(±s)

表3 HPMECs细胞TNF-α,IL-6,IL-1β水平及细胞凋亡率比较(±s)Tab.3 Comparison of TNF-α,IL-6 and IL-1β levels and apoptosis of HPMECs(±s)
组别正常对照组脂多糖组阳性对照组泮托拉唑低剂量组泮托拉唑高剂量组泮托拉唑高剂量+氯喹组F值P值给药剂量10 nmol/L 40µg/mL 80µg/mL 80µg/mL+5µmol/L TNF−α(pg/mL)19.36±2.02 42.85±3.28*21.05±1.87*#33.26±2.19*#25.18±1.93*#38.19±2.57&76.452<0.001 IL−6(pg/mL)11.29±0.96 27.37±2.12*13.28±1.24*#21.84±1.95*#15.72±1.01*#24.83±2.31&87.357<0.001 IL−1β(pg/mL)32.13±2.47 74.75±6.82*35.45±3.23*#51.57±5.48*#38.23±3.11*#62.39±5.84&63.395<0.001细胞凋亡率(%)4.58±0.38 16.24±1.03*6.86±0.57*#11.12±1.07*#7.66±0.63*#13.13±0.83&137.182<0.001
2.4 泮托拉唑激活ALI模型大鼠细胞自噬
结果见图4、图5和表4。与正常对照组比较,脂多糖组大鼠肺组织和HPMECs细胞中LC3Ⅱ/LC3Ⅰ和Beclin1的表达水平均显著降低(P<0.05);与脂多糖组比较,阳性对照组,泮托拉唑低、高剂量组大鼠肺组织和HPMECs细胞中的表达水平均显著升高(P<0.05);与泮托拉唑高剂量组比较,泮托拉唑高剂量+氯喹组大鼠肺组织和HPMECs细胞中上述指标的表达水平均显著降低(P<0.05)。
表4 大鼠肺组织和HPMECs细胞中LC3,Beclin1,p-mTOR/mTOR表达水平比较(±s)Tab.4 Comparison of LC3,Beclin1 and p-mTOR/mTOR expression levels in lung tissue of rats and HPMECs(±s)
组别正常对照组脂多糖组阳性对照组泮托拉唑低剂量组泮托拉唑高剂量组泮托拉唑高剂量+氯喹组F值P值LC3Ⅱ/LC3Ⅰ肺组织(n=8)0.64±0.05 0.12±0.01*1.38±0.13*#0.41±0.03*#1.36±0.14*#0.11±0.01&142.289<0.001 HPMECs细胞(n=3)0.94±0.09 0.21±0.02*0.96±0.11*#0.62±0.07*#0.87±0.09*#0.17±0.02&134.758<0.001 Beclin1肺组织(n=8)0.22±0.03 0.09±0.00*0.64±0.05*#0.26±0.03*#0.53±0.04*#0.35±0.04&115.046<0.001 HPMECs细胞(n=3)0.87±0.09 0.11±0.01*0.84±0.08*#0.20±0.02*#0.65±0.06*#0.13±0.01&117.043<0.001 p−mTOR/mTOR肺组织(n=8)0.11±0.01 0.98±0.11*0.20±0.02*#0.64±0.06*#0.45±0.03*#0.42±0.04&132.246<0.001 HPMECs细胞(n=3)0.13±0.01 1.15±0.12*0.25±0.03*#0.44±0.03*#0.32±0.03*#0.30±0.03&121.035<0.001

1.正常对照组2.脂多糖组3.阳性对照组4.泮托拉唑低剂量组5.泮托拉唑高剂量组6.泮托拉唑高剂量+氯喹组图5 HPMECs细胞LC3和Beclin1表达1.Normal control group 2.LPS group 3.Positive control group 4.Pantoprazole low−dose group 5.Pantoprazole high−dose group 6.Pantoprazole high−dose+chloroquine groupFig.5 Expression of LC3 and Beclin1 in HPMECs
2.5 泮托拉唑抑制mTOR信号通路激活
结果见图6、图7和表4。与正常对照组比较,脂多糖组大鼠肺组织和HPMECs细胞中p−mTOR/mTOR的表达水平均显著升高(P<0.05);与脂多糖组比较,阳性对照组,泮托拉唑低、高剂量组大鼠肺组织和HPMECs细胞中p−mTOR/mTOR的表达水平均显著降低(P<0.05);与泮托拉唑高剂量组比较,泮托拉唑高剂量+氯喹组大鼠肺组织和HPMECs细胞中p−mTOR/mTOR的表达水平均显著升高(P<0.05)。

1.正常对照组2.脂多糖组3.阳性对照组4.泮托拉唑低剂量组5.泮托拉唑高剂量组6.泮托拉唑高剂量+氯喹组图6大鼠肺组织p-mTOR和mTOR表达1.Normal control group 2.LPS group 3.Positive control group 4.Pantoprazole low−dose group 5.Pantoprazole high−dose group 6.Pantoprazole high−dose+chloroquine groupFig.6 Expression of p-mTOR and mTOR in lung tissue of rats

1.正常对照组2.脂多糖组3.阳性对照组4.泮托拉唑低剂量组5.泮托拉唑高剂量组6.泮托拉唑高剂量+氯喹组图7 HPMECs细胞p-mTOR和mTOR表达1.Normal control group 2.LPS group 3.Positive control group 4.Pantoprazole low−dose group 5.Pantoprazole high−dose group 6.Pantoprazole high−dose+chloroquine groupFig.7 Expression of p-mTOR and mTOR in HPMECs
3 讨论
ALI发病机制复杂,目前的治疗方法存在明显局限[13]。泮托拉唑可提高癌细胞对长春新碱的敏感性,诱导癌细胞周期阻滞,抑制迁移和侵袭[14];可有效减轻脓毒症急性肺、肾损伤,抑制肾小管上皮细胞凋亡[8]。本研究结果显示,泮托拉唑干预可减轻ALI模型大鼠和HPMECs模型大鼠肺组织损伤,抑制炎性因子产生及细胞凋亡,发挥保护作用。
细胞自噬是生物体广泛存在的细胞内自主降解过程,自噬不足或过度自噬均可导致ALI,将自噬水平调节至正常范围可减轻ALI[15]。可见,自噬对ALI的发展具有双重作用。研究表明,脂多糖诱导的ALI模型可明显活化mTOR通路,抑制细胞自噬[16],上调自噬水平可改善ALI[17]。本研究结果显示,脂多糖诱导的ALI和HPMECs可明显抑制细胞自噬,泮托拉唑干预可上调自噬水平,自噬抑制剂氯喹可逆转泮托拉唑对ALI和HPMECs的保护作用。
mTOR作为一种保守的丝氨酸/苏氨酸蛋白激酶,是调节细胞生长、增殖、运动、存活、自噬等上游通路的汇合点,抑制mTOR活化可促进细胞自噬[18]。在PM2.5诱导的ALI模型大鼠[19]中,mTOR被激活,导致下游细胞自噬水平受到抑制,黄芪甲苷通过抑制mTOR活化促进自噬,保护PM2.5诱导的ALI。本研究结果显示,脂多糖诱导的ALI和HPMECs均可导致mTOR活化,泮托拉唑干预可抑制其活化,且自噬抑制剂氯喹对其活化无明显影响。
综上所述,泮托拉唑通过mTOR通路调节自噬,在ALI模型大鼠和HPMECs损伤中发挥保护作用。
