龙生蛭胶囊中“桃仁-红花-川芎”药组治疗脑卒中网络药理学研究*
2022-02-17许海燕彭修娟陈衍斌侯敏娜刘艳红
许海燕,王 珊,彭修娟,陈衍斌,侯敏娜,刘艳红,逯 莉,刘 峰,△
(1.陕西国际商贸学院,陕西 咸阳712046;2.陕西步长制药有限公司,陕西 西安 710075)
脑卒中具有发病率高、死亡率高、致残率高、复发率高等特点,是导致人类死亡的第二类原因,与缺血性心脏病、恶性肿瘤构成多数国家的三大致死疾病[1−2]。龙生蛭胶囊由黄芪、水蛭、桃仁、红花、川芎等12味中药材组方,具有补气活血、逐瘀通络功效,临床用于治疗气虚血瘀型中风[3]。方中桃仁味苦、甘,性平,活血化瘀,润肠通便[4];红花味辛,性温,活血通经,祛瘀止痛[5];川芎味辛,性温,活血行气,祛风止痛[6]。桃仁破血力强,红花行血力盛,川芎相须为用,共为臣药行气化瘀,三药配伍,共奏活血破瘀之功,具有活血而不伤血、补血而不留瘀的特点,可祛瘀生新[7]。本研究中基于中医药整合药理学研究平台V2.0(TCMIP V2.0)[8]预测了龙生蛭胶囊中臣药桃仁−红花−川芎药组治疗脑卒中的药效物质基础和作用机制。现报道如下。
1 材料与方法
1.1 药组化学成分来源
在TCMIP V2.0“中药材数据库”项下分别以“桃仁”“红花”“川芎”为关键词进行检索,收集其化学成分,建立“桃仁−红花−川芎”药组化学成分数据库。
1.2 药组候选靶标来源
在TCMIP V2.0“疾病数据库”项下以“Stroke”为关键词进行检索,获得与脑卒中相关的靶点。在“中药(含方剂)靶标预测及功能分析”中,依次添加“桃仁”“红花”“川芎”,对“桃仁−红花−川芎”药组化学成分库中成分的靶标进行预测,选择“相似性分数≥0.8”的成分预测靶标,作为候选靶标。TCMIP V2.0采用二维结构(.mol或.sdf)进行相似性比对,以Tanimoto系数定义的相似度计量方法进行相似性评分,并与美国食品药物管理局(FDA)上市药品的化学结构进行比对[9]。
1.3 蛋白互作网络(PPI)
TCMIP V2.0镶 嵌 了HAPPI,Reactome,molecular interaction database(MINT),online predicted human inter⁃action database(OPHID),database of interacting proteins(DIP)等数据库中的PPI数据,可直接获得“桃仁−红花−川芎”药组的潜在靶标与脑卒中疾病靶标间的PPI[10]。
1.4 中医药关联网络构建与关键网络靶标基因功能挖掘分析
在TCMIP V2.0“中医药关联网络挖掘”项下建立“桃仁−红花−川芎”药组作用的潜在靶标与脑卒中疾病靶标间的PPI,通过计算网络节点连接度、节点介度和节点紧密度,筛选核心节点基因,作为“桃仁−红花−川芎”药组治疗脑卒中的关键靶标网络。根据中药、化学成分、核心靶标、通路、疾病间的关联性,构建中药多维关联网络,筛选“桃仁−红花−川芎”药组关键网络靶标基因显著参与的生物学反应、所行使分子功能及其所在细胞内定位。基于Drugbank,onlinemendelian inheritance in man(OMIM),human phenotype ontology(HPO),gene ontology(GO),therapeutic target database(TTD)及基因相关性数据库(DisGeNET)等数据库对“桃仁−红花−川芎”药组的预测靶标进行基因功能分析和通路富集分析,利用Reactome数据库的Pathway信息,筛选“桃仁−红花−川芎”药组关键网络靶标基因显著参与的分子通路;利用ETCM数据库的疾病和表型数据库,筛选“桃仁−红花−川芎”药组关键网络靶标基因显著相关的疾病和表型。最终构建“中药−活性成分−关键核心靶标−通路”多层次网络关联图[11−12]。
1.5 主要活性物质与靶点的分子对接
采用Sybyl−X7.3软件中的Surflex−Dock程序,将“桃仁−红花−川芎”药组主要活性物质与细胞外信号调节蛋白激酶2(ERK2)、Janus激酶2(JNK2)进行对接,验证此药组治疗脑卒中的药效物质基础。
2 结果
2.1 靶点预测结果
靶标预测及功能分析结果共得到化学成分121种,包括桃仁3种,红花46种,川芎72种,主要为有机酸、甾醇类、黄酮类、糖苷类、挥发油类、生物碱类、酯类等。为保证靶标预测结果的可信度,设定桃仁、红花、川芎中化学成分与FDA上市药物间的相似性分数≥0.8,得到三者的靶标数目分别为90,426,358个。其中,上述3种药材共有靶标14个,包括一氧化氮合酶(NOS)及CSNK2A1,FabZ,NQO2,NR1I2,AKT1,NCOA1,NCOA2,ESR1,ESR2,GLTP,CBR1,SHBG,AHR。
基因功能分析和通路富集分析结果显示,候选靶标基因功能涉及氧化还原过程,离子传输、类固醇激素介导的信号通路、脂质代谢过程,细胞内受体信号通路、神经系统的过程,心肌细胞动作电位参与心肌收缩、类固醇代谢过程,化学突触传递、钙离子传输与导入等生物学过程。中药候选靶标通路富集分析结果显示,涉及通路有核受体转录途径、氨基丁酸(GABA)受体激活、叶酸代谢、胆汁酸和盐的循环利用、胰岛素分泌调节、突触前去极化和钙通道开放、外源性物质等通路。
2.2 核心靶标网络分析
共得到62个与脑卒中及药物相关核心网络靶标,其中27个靶标与药物相关,35个靶标与疾病相关。利用PPI构建核心靶标网络图(见图1),平台设定同时满足大于节点连接度、节点介度、节点紧密度的中位数为卡值。得到关键核心靶标25个,包括HSP90AA1,AR,AKT1,CALM1,NFKB1,ESR1等;已知疾病靶标11个,包括NR3C1,LIMK1,VHL,JAK2,HIF1A,APP,SMAD4,GTF2I,GTF2IRD1,FLNA,NOTCH3;药物与疾病共有靶标2个,包括NR3C1和APP。闫宇翔等[13]从基因整体层面研究发现,NR3C1与心血管疾病危险因素间存在相关性。APP致病变体或重复会导致脑淀粉样血管病的发生,引发原发性非创伤性脑出血。HSP90AA1与抑郁症有关[14],可通过调节HSP90AA1的表达水平来抑制脑卒中后抑郁。AKT1能介导心血管疾病,促进血管内皮生长因子(VEGF)分泌,并介导内皮细胞一氧化氮合酶(eNOS)的磷酸化过程[15]。因此,AKT1可能在许多心血管疾病的发病过程中发挥重要作用。
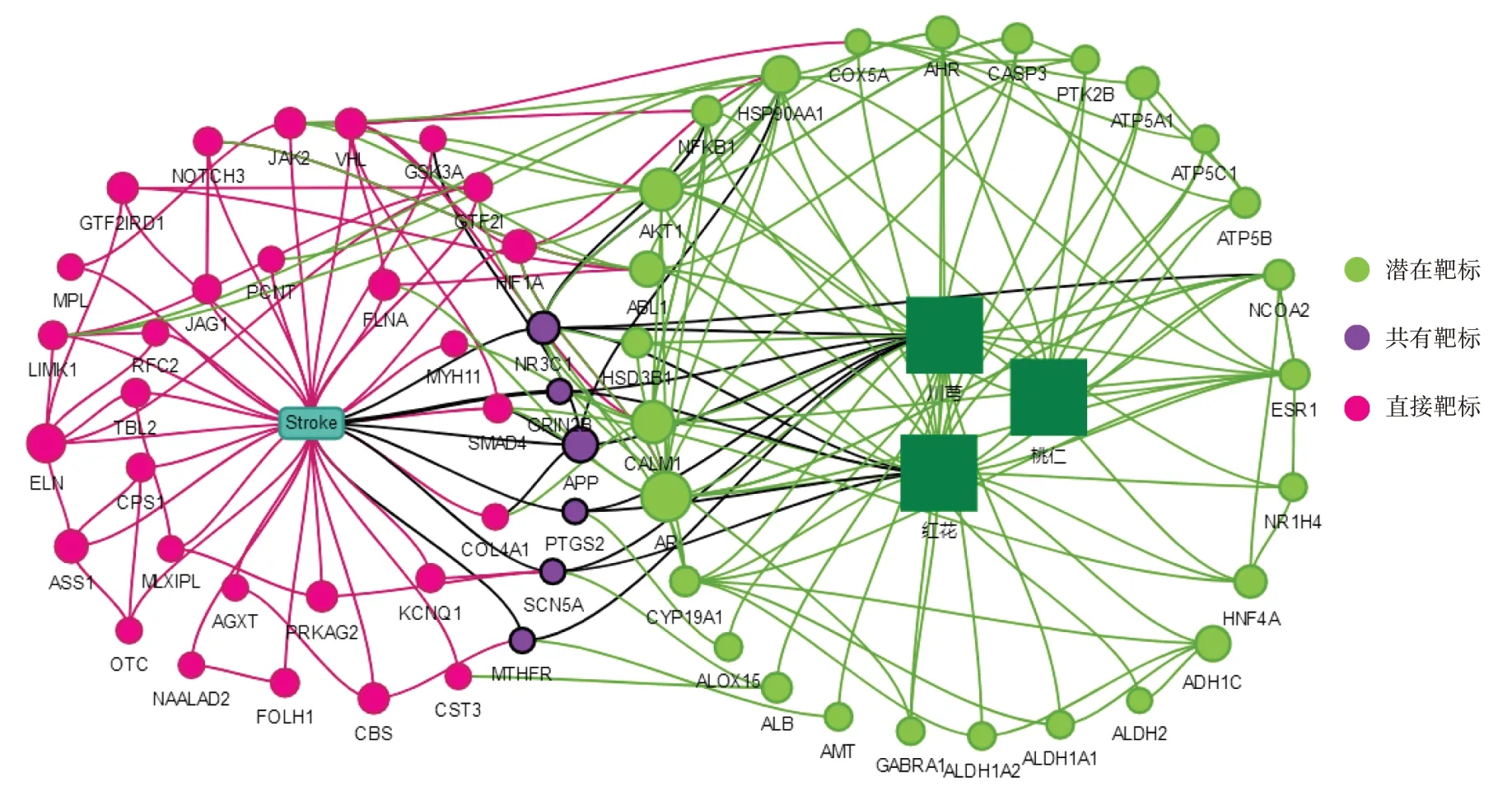
图1 核心靶标网络Fig.1 Network of key targets
2.3 药组治疗脑卒中基因功能及通路信息分析
“桃仁−红花−川芎”药组治疗脑卒中的靶标与疾病靶标基因功能见表1。通过关键靶标功能信息可以推测,“桃仁−红花−川芎”药组主要通过调节NOS活性的正向调控、一氧化氮(NO)生物合成过程的正向调控、RNA聚合酶Ⅱ对转录的正向调控、细胞内受体信号通路、凋亡过程、信号转导和基因表达的调控治疗脑卒中。NOS可调节NO的生成,而NO是脑血管系统中重要的保护因子[16],在缺血再灌注损伤过程中起重要作用[17]。

表1 “桃仁-红花-川芎”药组治疗脑卒中的靶标与疾病靶标基因功能列表Tab.1 List of targets and disease target gene functions of″Persicae Semen-Carthami Flos-Chuanxiong Rhizoma″drug group in the treatment of stroke
“桃仁−红花−川芎”药组治疗脑卒中的分子通路(见表2)主要涉及核受体转录途径、四氢生物蝶呤(BH4)的合成回收和调控、内皮型eNOS激活、细胞内受体的SUMO化、血管内皮细胞生长因子受体2(VEGFR2)介导的血管通透性等条目。如通过BH4的合成、回收及调控,增加eNOS的活性,抑制缺血再灌注引起的损伤[18]。缺血性脑损伤的发生与SUMO化有关[19−20];VEGFR−2可调控血管内皮细胞的增殖、迁移、存活和通透性,促进脑组织缺血区域再灌注[21]。

表2 “桃仁-红花-川芎”药组治疗脑卒中的分子通路列表Tab.2 List of molecular pathways of″Persicae Semen-Carthami Flos-Chuanxiong Rhizoma″drug group in the treatment of stroke
上述靶标功能和分子通路多数与神经系统、循环系统、内分泌系统、免疫系统有关。现代医学研究发现,神经−内分泌−免疫网络系统调节功能的表达异常,导致神经系统、内分泌系统、免疫系统功能异常[22],从而导致脑卒中发生。
2.4 网络可视化图分析
运用整合药理学平台获得了“桃仁−红花−川芎”药组治疗脑卒中的核心靶标,推测“桃仁−红花−川芎”药组可能通过作用于药物与疾病共有靶标而发挥对脑卒中的干预作用,进而发挥药效,并利用核心靶标及其与中药成分和疾病间的关系绘制“中药−活性成分−关键核心靶标−通路”网络可视化图(见图2)。可见,“桃仁−红花−川芎”药组中可作用于脑卒中的活性成分共有19种,主要包括生物碱类、挥发油类、黄酮类、有机酸类等,包括桃仁中的儿茶素,川芎中的川芎嗪、阿魏酸、香草醛、甾醇、川芎萜等,红花中的红花素、新红花苷、亚麻酸、亚油酸等。参考文献[23],在脑卒中急性期治疗的中医用药规律中,桃仁、红花、川芎用药频次排在前10位,在脑卒中急性期及恢复期常用“红花−川芎”药对。证实该药组治疗脑卒中的可靠性及龙生蛭胶囊组方的合理性。活性成分的研究显示,“桃仁−红花−川芎”药组中的儿茶素可通过抑制白细胞的生成来预防血管炎症,也可抑制血小板黏附及血栓形成,扩张血管[24−25]。川芎嗪通过调节凝血、纤溶系统,调控血小板活化、神经活性配体−受体相互作用等信号通路发挥治疗缺血性脑卒中的作用[26];川芎嗪、阿魏酸能保护脑卒中缺血后的急性损伤[27]。红花素可通过抑制H2O2诱导的细胞凋亡通路,减少血小板聚集和黏附,发挥防治心血管疾病的作用[28];何新康等[29]给予脑缺血再灌注模型大鼠腹腔注射不同剂量红花素,结果显示,红花素对脑缺血再灌注损伤具有保护作用。亚麻酸可通过增加缺血区局部的血流量,减轻脑组织缺血坏死的程度,提高脑缺血后的存活率[23,30]。
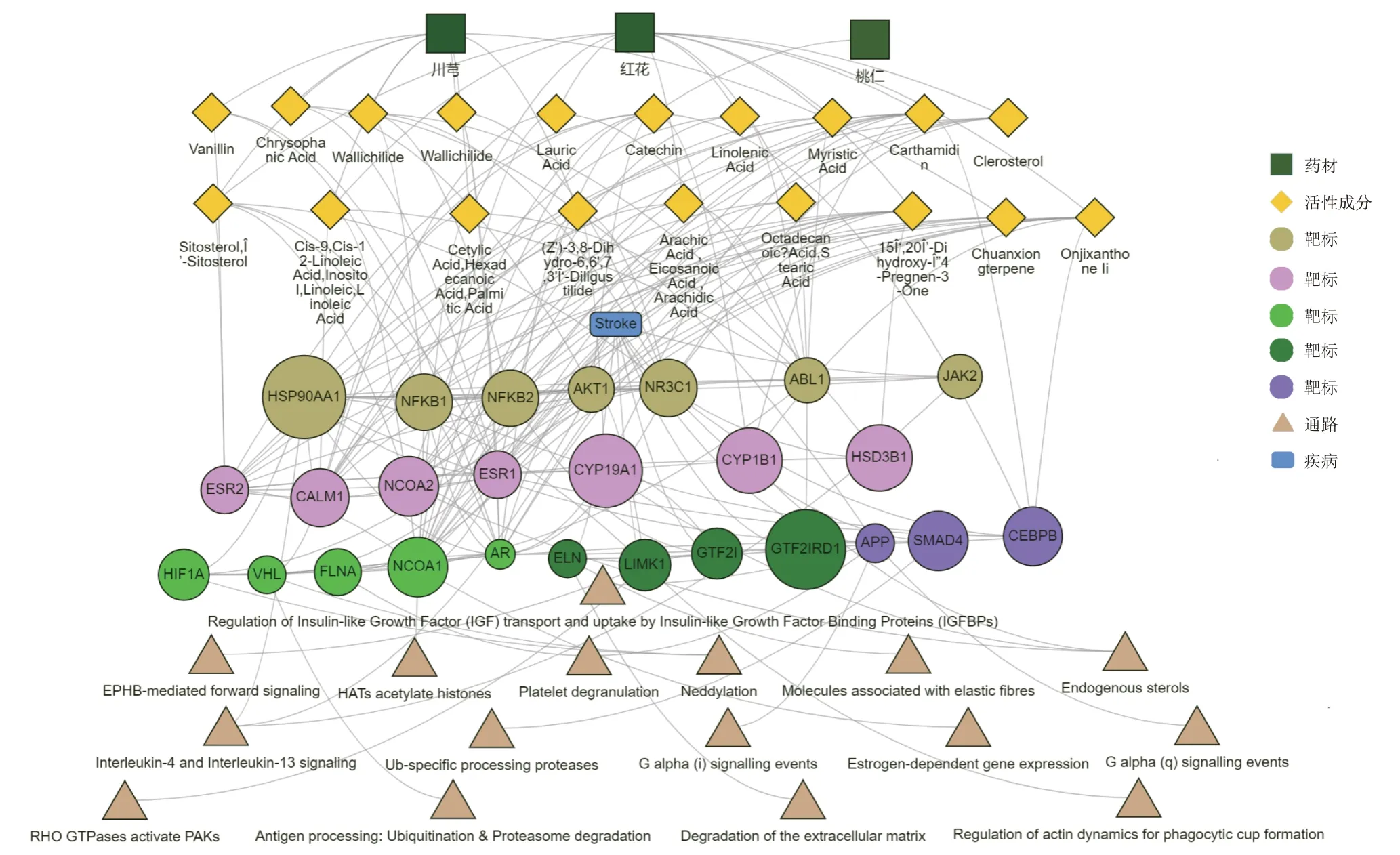
图2 “中药-活性成分-关键核心靶标-通路”多维关联网络Fig.2 Multi-dimensional network of″traditional Chinese medicine-active ingredients-key targets-pathways″
2.5 可能有效成分及调控靶点
从Protein Data Bank(PDB)[31]数据库中下载ERK2和JNK2蛋白晶体结构,分别提取2个靶点蛋白晶体结构的配体,暴露活性位点及除结晶水、加氢和除侧链的残基后;采用AMBER7 FF99力场能量优化;使用Surflex−Dock程序对接分子[32],与筛选得到的“桃仁−红花−川芎”药组中主要活性成分进行对接,得到化合物与核心靶点对接后的均方根偏差值(RMSD)。当RMSD≤2.0Å时[33],说明该对接方法能较好地重现出配体受体原来的结合模式,验证了对接参数设置的合理性。主要活性成分与靶蛋白的对接结果见表3。可知,“桃仁−红花−川芎”药组中主要活性成分儿茶素、川芎嗪、阿魏酸、红花素、亚麻酸与ERK2和JNK2均对接成功,推测“桃仁−红花−川芎”药组确有治疗脑卒中的作用。对其活性成分进行文献验证,发现预测出的活性分子,如儿茶素[24−25]、川芎嗪[26−27]、阿魏酸[27]、红花素[28−29]、亚麻酸[23,30]等活性分子确属治疗脑卒中的有效物质,验证了本研究方法的合理性与可靠性。
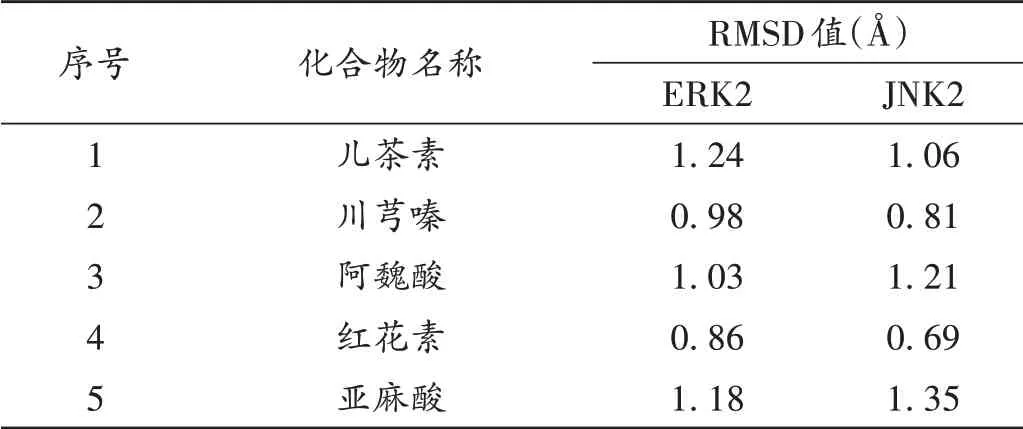
表3 主要活性成分与靶蛋白对接结果Tab.3 Docking results of main active ingredients and target proteins
3 讨论
“桃仁−红花−川芎”作为龙生蛭胶囊中的活血破瘀药组,治疗脑卒中疗效显著[34]。本研究中共预测得到活性成分19个,核心网络靶标62个,其中药物靶标27个,疾病靶标35个,疾病与药物共有靶标2个;其药效物质基础主要为生物碱类、挥发油类、黄酮类、有机酸类等成分。采用分子对接技术进行的虚拟筛选结果表明,“桃仁−红花−川芎”药组中的主要活性成分易与ERK2和JNK2形成较好的对接模式与较高的亲和力,具有治疗脑卒中的活性,也证实了TCMIP V2.0在预测中药及复方作用机制方面的可靠性。
TCMIP V2.0数据源于ETCM中医百科全书数据库,包括中药数据库、中药化学成分数据库、中药靶标数据库、疾病相关分子库等。设置了3种拓扑结构特征值节点连接度、节点介度、节点紧密度,以确定中药矫正疾病失衡网络的候选靶标。通过基因功能分析和通路富集分析,确定靶标基因的生物学功能及其所参与的生物学通路。本研究中借助TCMIP V2.0,以龙生蛭胶囊中的“桃仁−红花−川芎”药组为研究对象,初步阐明了此活血化瘀药组治疗脑卒中的作用机制,为龙生蛭胶囊的进一步深入研究提供了理论及数据支持。但本研究结果是基于网络大数据所做的预测,还需通过进一步研究加以验证。
