EDTA容量法测定铅矿中铅含量的改进研究
2022-02-17刘晓辰韩汝超王莉芃金宇峰
刘晓辰 韩汝超 王莉芃 金宇峰
(中冶北方工程技术有限公司,辽宁 鞍山 114051)
0 引言
铅矿石是指含有铅元素或铅的化合物的矿石,能经过矿物加工工艺而成为含铅元素品位较高的铅精矿或者说是铅矿砂。铅精矿需要经过进一步的冶炼提成,才能成为精铅及铅制品。近年来,我国的铜铅锌产量增幅显著,连续多年居世界第一位[1]。因而,在整个工艺流程的分析检测环节中,发展快速高效的铅含量的分析检测方法技术是十分必要的。
本文介绍的方法是基于成本较低的EDTA容量法,在此基础上加以改进研究,提升效率,缩短实验周期。经反复验证,改进后的方法准确度高,分析成本低,可用于实验室的大批量检测,工作效率显著提高,结果令人满意。
1 实验部分
1.1 研究背景
测定铅矿石中铅含量,现存的化学分析方法较多,中、高含量铅矿石样品可采用容量法;低含量的适合用极谱法或原子吸收光谱法等;对于微量及痕量,特别是多元素同时测定时,普遍采用仪器分析方法,如ICP- AES法、ICP- MS法或XRF法等。对于上述测定方法,国内外已有相应的方法标准。此外,国家标准及行业标准中还介绍有重量法、钼酸盐和铬酸铅以及电解析出二氧化铅的化学分析方法,但是由于这些方法的分析手续过于复杂,检测效率低下,在如今的分析检测工作中已很少应用[2]。
在使用容量法测定矿石中的铅含量时,EDTA容量法应用最广泛,因为其测定铅的特点是干扰因素少,测定成本低,操作上较为简便,易被大多数化学分析实验室接受[2]。然而,现有文献资料介绍EDTA容量法在溶样过程中用硫酸发烟,对发烟的时间温度控制要求较高,如果操作不当,则矿石试样含有的铁、铝、铋等元素易形成难溶硫酸盐,夹杂在硫酸铅沉淀中,影响测定结果;此外,传统方法中,硫酸铅的沉淀过程耗时过长(据查询,有文献中甚至要求放置沉淀过夜),严重影响检测效率。中国是资深的铅生产大国,在全球原生铅的供应上,中国的供应量达70%~80%[1]。铅矿石的选冶规模也日渐扩大,相应的工作效率必须提升。而流程中配套的分析检测便是一个重要的影响因素。因此,在保证不提高成本的前提下,有必要研发一种准确度更高、花费时间更短的测定方法,以适应各级各类实验室对铅矿石及其选冶产品中铅元素的批量检测,提高效率。
本文针对现有分析技术存在的问题,将原有的EDTA容量法测定铅含量的测定方法进行改进研究,保证测定结果的准确性,又显著缩短实验周期。
1.2 方法原理
本文所介绍的方法是采用盐酸-硝酸-高氯酸分解铅矿石样品:随后加入水和酒石酸,再次加热溶解固体,冷却后加硝酸铵固体和丙三醇充分搅拌,溶于水后静置沉淀。沉淀过程中,利用吸热原理和盐类在有机物中溶解性降低的性质,以及低温析出的特性来缩短沉淀时间。在静置沉淀的过程中,利用缓冲溶液保证溶液的酸性环境,监测溶液的pH值。
1.3 试剂和溶液
浓盐酸:市售,ρ1.19 g/mL。
浓硝酸:市售,ρ1.40 g/mL。
高氯酸:市售,含量为70%~72%。
浓硫酸:市售,ρ1.84 g/mL。
氟化铵固体:市售,分析纯。
酒石酸:200 g/L。
硝酸铵固体:市售,分析纯。
丙三醇:市售,分析纯。
乙酸-乙酸钠缓冲溶液(pH为5.5~6.0):称取375g市售分析纯的无水乙酸钠固体,用去离子水溶解后,加入50 mL冰醋酸,再加水稀释至2 500 mL,混匀。
二甲酚橙指示剂(5 g/L):称取0.5 g市售分析纯级别的二甲酚橙固体,溶于100 mL水中(在溶解过程中可以加入3~4滴氨水,以加速溶解)。
标准溶液配制及标定过程:
铅标准溶液:精确称取2.00 g金属铅(分析纯),置于300 mL烧杯中,加入10 mL浓硝酸(ρ1.40 g/mL)及少量蒸馏水,待剧烈反应停止,加热溶解。冷却后转移至1 000 mL容量瓶中,加水稀释至刻度,摇匀。此溶液中的含铅量为2 mg/mL。
EDTA标准滴定溶液;称取3.5 g乙二胺四乙酸二钠固体试剂,置于烧杯中,加水,在电热板上缓慢加热至溶解,冷却后转移至1 000 mL容量瓶中,用水稀释至刻度,混匀。此溶液中,c(EDTA)≈0.009 mol/L。
1.4 实验过程
1.4.1 试样的预处理
首先将铅矿石试样粉碎至100 μm以下的粒度,之后把粉末状的样品装入试料袋,放入烘箱中均匀加热至试样粉末分散。加热条件为100~110 ℃,加热时间为2~3 h。然后将试料袋密封于干燥器中,冷却至室温。
1.4.2 试样溶解
准确称取0.5000 g烘干的铅矿石样品(如果试样是铅精矿,则可减少称样量,称取0.20 g~0.25 g即可),置于300 mL烧杯中,加入0.2 g氟化铵和15 mL盐酸,在电热板上加热溶解。待烧杯中的溶液微沸10 min后,加入5 mL硝酸和5 mL高氯酸,持续加热至杯口冒出浓厚的白烟,取下冷却;稍冷后,用去离子水冲洗烧杯壁(注意此步骤中不能趁热冲洗杯壁,以防烧杯骤冷而炸裂),再加入5 mL浓硫酸,在电热板上继续加热蒸发,直至再次冒浓烟并持续2~3 min,随后取下冷却;此时杯底的固形物呈湿盐状(注意此过程中杯中的液体一定不要全部蒸干,否则不利于下一步溶解,固形物粘在杯底无法溶解完全会导致最终的测定结果偏低)。
向烧杯中加入100 mL水和5 mL酒石酸溶液,置于电热板上缓慢加热溶解固体,煮沸,保持微沸大约5 min后取下冷却。如果能够充分确定矿石样品中不含有锑、铋元素时,此步骤中酒石酸溶液可省略不加。
1.4.3 沉淀处理
在烧杯中加入5 g硝酸铵固体和5 mL丙三醇,充分搅拌,直至固体完全溶解,静置沉淀10 min后,用中速滤纸过滤;再用稀硫酸(5+95)洗涤烧杯和沉淀各5~6次,洗涤完毕,用KSCN溶液检验,如果检验液中残留有红色则需要继续冲洗,直至冲洗至无红色出现后,再将沉淀连同滤纸放回原烧杯中。加入20 mL乙酸-乙酸钠缓冲溶液,在电热板上边加热边搅拌,煮沸5 min后取下冷却,用水稀释至约100 mL。
1.4.4 滴定
向烧杯中加入0.2 g抗坏血酸,充分搅拌,将三价铁离子完全掩蔽;滴加2~3滴二甲酚橙指示剂,用EDTA标准溶液滴定,溶液由酒红色变成亮黄色,即为终点。
1.4.5 空白试验

2 结果与讨论
2.1 滴定度计算
对EDTA标准溶液进行标定,计算其对铅的滴定度。计算公式如式(1):
(1)
式中,FPb—滴定系数,与1.00 mL的EDTA标准溶液相当的铅的质量,g/mL;ρPb—铅标准溶液的质量浓度,g/mL;V—移取铅标准液的体积,mL;V1—滴定铅消耗EDTA标准溶液的体积,mL;V0—滴定标准溶液空白消耗EDTA标准溶液的体积,mL。
2.2 铅含量计算
按式(2)计算铅的质量分数:
(2)
式中,FPb—滴定系数,与1.00mL的EDTA标准溶液相当的铅的质量,g/mL;V2—滴定试液消耗EDTA标准溶液的体积,mL;V0—滴定试料空白消耗EDTA标准溶液的体积。
2.3 铅矿石标准样品测定结果
按照铅含量的多少,有梯度地挑选分析检测实验室常用的3种具有代表性的铅矿石标准样品:GBW07235(Pb%:4.17),GSB04-2192-2008(Pb%:17.93),GBW(E)070173(Pb%:57.44),按照前述实验步骤进行测定,并按照式(2)计算铅的百分含量。通过多次测定结果计算平均值和相对标准偏差。具体结果如表1所示。
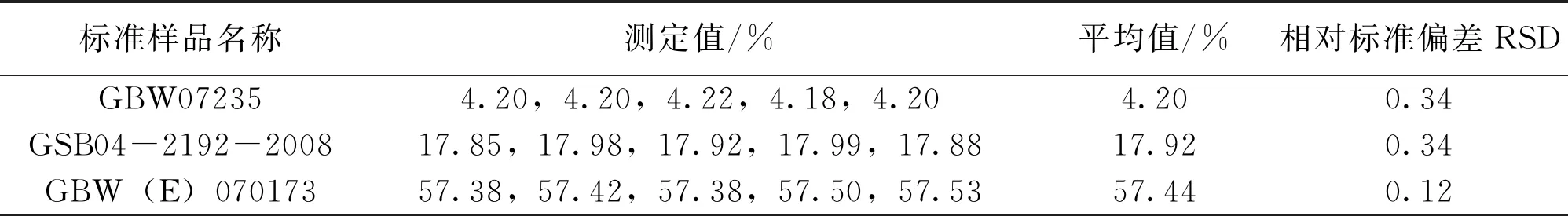
表1 标准样品测定值及方法准确度实验结果
2.4 实验室选矿试验样品实际测定结果
实验样品为内蒙古黑牛王含银铅锌选冶矿样(资料数据铅含量22.76%),按照前述步骤将矿石样品进行预处理:粉碎至100 μm的粒度,在100~110 ℃干燥1~2 h,密封于干燥器中,冷却至室温。之后按照文中介绍的实验步骤进行测定。实测中滴定度为0.0035 g/mL,空白V0为0.10 mL,V为16.40 mL。计算结果:
=22.82%
上述实验结果显示,本测定方法的测定结果偏差小,准确度高,能满足分析要求。
2.5 注意事项
1)硫酸冒烟时温度不宜太高,时间不宜太长,否则铁、铝、铋等元素易生成难溶硫酸盐,夹杂在硫酸铅沉淀中。
2)在滴定过程中,三价铁离子的存在能够封闭二甲酚橙的变色,故在洗涤的过程中必须将其冲洗干净[3]。
3)烧杯中加水后的加热煮沸时间不能太短,应使铁、铝、铋等的无水硫酸盐尽量溶解。
4)对于含锑样品,经硫酸冒烟后,剩余硫酸体积不能少于6 mL,否则,酸度过低锑会出现水解现象,水解的锑会影响硫酸铅的沉淀。
3 结语
经多次验证,本方法测定结果精准,重现性好,特别是沉淀时间明显缩短——原方法需沉淀过夜,即静置10 h以上,改进后的方法利用吸热原理和盐类低温析出的特性,只需1~1.5 h便可将铅离子充分富集。与原有分析手续相比,改进后的测定方法显著地提高了检测效率。该方法操作简单,容易掌握,分析成本低,值得在各级各类实验室中推广应用。
