初发卵巢上皮性癌子宫切除术后的复发形式
2022-02-16PaulSugarbakerDavidChang
Paul H.Sugarbaker David Chang
随着晚期卵巢上皮性癌手术治疗的进展,越来越多的数据表明手术减瘤的彻底性与较好的预后相关。Griffiths 等[1]的回顾性研究显示残留肿瘤病变大小与患者预后负相关。Hoskins 等[2]提出可根据手术后肿瘤残留病灶大小将其分为三类:镜下残留、<2 cm 及>2 cm。上述研究显示患者预后与术后肿瘤残留病变体积呈负相关。Bristow 等[3]的Meta 分析显示术后残留病灶越严重患者生存期越短。由于能够改善预后,根治性减瘤术已经成为晚期卵巢上皮性癌的标准治疗。但是,这一治疗理念并不适合其他腹腔肿瘤如阑尾癌、结直肠癌、胃癌或胰腺癌[4]。本文就子宫切除术治疗原发卵巢上皮性癌后二次手术时,肿瘤进展及复发的不同形式进行研究探讨,旨在罗列和展示高级别卵巢上皮性癌(epithelial ovarian cancer,EOC)复发或进展的特点。
1 材料与方法
1.1 临床资料
前瞻性收集华盛顿癌症研究院近30年20 例复发性卵巢上皮性癌患者的资料,探究卵巢癌患者二次CRS 治疗质量改进项目。纳入标准:1)活检诊断为FIGO ⅢC 期浆液性卵巢上皮性癌。2)初次治疗为子宫及双侧附件切除±淋巴结切除。3)接受顺铂联合紫杉醇辅助±新辅助化疗。4)胸部、腹部及盆腔CT 检查排除腹盆腔外肿瘤复发或进展。5)完全子宫切除术后的切口和脐部完整。本研究获得伦理委员会审核通过及患者知情同意。
1.2 方法
1.2.1 原发性卵巢癌子宫切除术 所有晚期卵巢上皮性癌患者接受标准治疗,即由妇科肿瘤专科医师实施子宫及双侧附件切除术,同时对部分患者实施大网膜切除及淋巴结清扫。对纳入研究的20 例患者,手术目的并不追求切除腹盆腔所有病灶并达到肉眼无瘤。所有患者同时接受全身性新辅助化疗联合术后辅助化疗或单独辅助化疗,化疗方案均为顺铂联合紫杉醇方案。部分患者接受了二线及三线化疗。患者在诊断为复发性卵巢上皮性癌时,通过影像学检查排除腹盆腔外转移。
1.2.2 CRS 所有患者接受了细胞减灭术包括腹膜切除及内脏切除。手术目的为切除所有肉眼可见病变。手术采用耻骨联合至剑突下切口。腹盆腔所有病变在肉眼可视下予以切除。在细胞减灭术时要切除所有肿大淋巴结,进行组织病理学检查。
1.2.3 术中和术后早期腹腔化疗 患者手术结束后接受双向热化疗。顺铂联合阿霉素腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)90 min。异环磷酰胺持续静脉输注90 min。同时美司钠静脉给药3 次。术后早期腹腔化疗(early postoperative intraperitoneal chemotherapy,EPIC)采用紫杉醇腹腔注入,每日1 次,连续5日。
1.2.4 患者术中评估 在CRS 时评价腹膜癌指数(PCI)[5],以评价腹膜病变的范围和程度,由手术医师根据腹盆腔13 个不同分区的病变情况作出判定。
手术医师在完成细胞减灭术后对所有患者进行肿瘤细胞减灭程度(completeness of cytoreduction,CC)评分[5]。CC 0 分表示肉眼无瘤;CC 1 分表示肿瘤结节直径≤2.5 mm;CC 2 分表示肿瘤结节直径2.5 mm ~2.5 cm;CC 3 分表示肿瘤结节直径≥2.5 cm 或腹盆腔内肿瘤结节有相互融合。
对23 个不同解剖部位是否存在肿瘤病变进行判定。对可疑肿瘤病变予以切除并进行病理组织学检查。初次子宫切除术时如果残留病变部位检查阳性定义为肿瘤进展,而肿瘤切除部位检查阳性定义为肿瘤复发。
1.2.5 随访 由经验丰富的肿瘤医师进行门诊随访3年,每3 个月随访1 次。3年内每6 个月复查胸部、腹部及盆腔CT,3年后每年复查胸部、腹部及盆腔CT,持续7年。对复发后二次手术及姑息性全身化疗患者不纳入统计分析。纳入研究的20 例患者中,19例患者获得了总生存期,1 例患者失访。
1.3 统计学分析
采用SAS 9.4 软件进行统计学分析。单变量描述性分析采用非参数检验。总生存分析采用Kaplan-Meier 法,对数似然比检验设为>0.10。以P<0.05 为差异具有统计学意义。
2 结果
2.1 20 例患者临床及生存资料
20 例患者的临床病理特点列见表1,2。实施CRS 时的中位年龄为52(24~73)岁,子宫及双侧附件切除术至肿瘤复发后二次CRS 的中位间隔时间为23(5~77)个月,平均间隔时间为26.9 个月。再次CRS 涉及腹膜切除及内脏切除,平均手术时间为11(5 ~15)h,中位手术时间9.53 h。中位PCI 为15(4~31)。20 例患者中有3 例未达到完全减瘤(15.0%),未能完全减瘤的部位分别位于末端小肠(1 例)、髂血管(1 例)及双侧膈下及盆腔(1 例)。
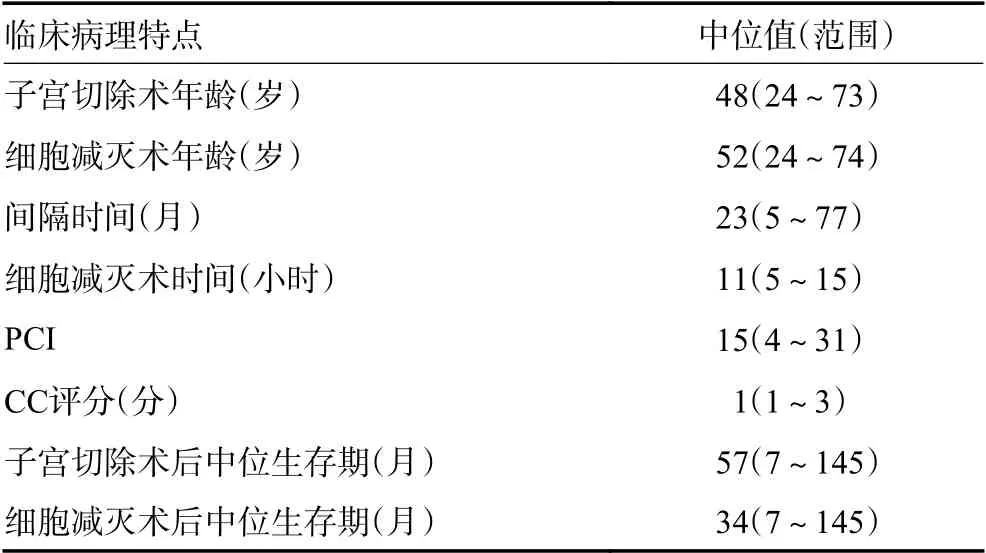
表1 20 例行二次CRS 治疗的复发性卵巢癌患者临床病理特点

表2 20 例二次CRS 治疗复发性卵巢癌患者手术切除部位
8 例患者接受了直肠乙状结肠交界切除及结肠直肠吻合术,1 例接受了腹会阴联合直肠切除术,2 例接受了全结肠切除及末端回肠造口术,4 例患者进行了髂血管、主动脉或腔静脉旁病灶切除。由于无法确定切除标本中的淋巴组织,因此无法判定这4 例患者的肿瘤病变是否为淋巴结转移。
子宫切除术后的中位生存时间为60 个月,二次CRS 后的中位生存时间为34 个月。
2.2 20 例患者23 个不同部位的肿瘤发生率
二次CRS 时通过组织病理证实的肿瘤复发或进展的区域分布情况见表3。子宫切除术时肿瘤残留部位出现新病变定义为肿瘤进展,而肿瘤切除部位出现新的病变定义为肿瘤复发。在23 个有肿瘤的部位中,18(78.3%)个部位肿瘤进展,5(21.7%)个部位肿瘤复发。肿瘤复发或进展最常见部位为右膈下70.0%(14/20),其次为大网膜、直肠乙状结肠交界及直肠65.0%(13/20)。复发部位还见于前腹壁切口55.0%(11/20)、膀胱浆膜面50.0%(10/20)、右侧输尿管远端50%(10/20)、阴道穹隆50%(10/20)及左侧输尿管远端35%(7/20)。
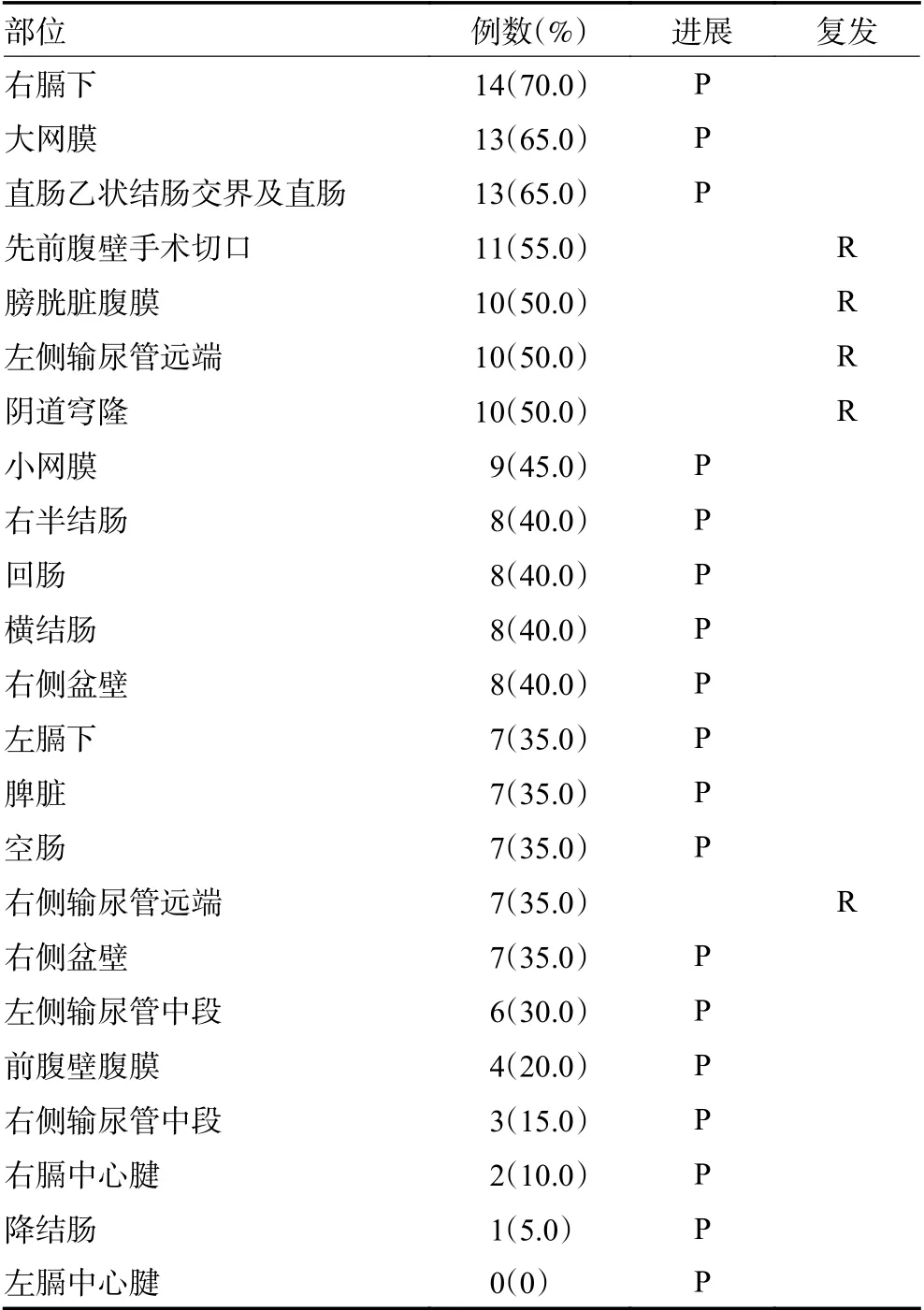
表3 23 个部位的肿瘤发生率
3 讨论
3.1 肿瘤细胞减灭术的手术策略
自1995年首次提出腹膜切除术开始,实施完全CRS 的外科技术已经取得了显著进展[6-7]。随着手术范围扩大,并发症及死亡率均显著增加,患者生存获益并未增加。目前对于采取何种手术策略以达到最佳CRS 尚无定论。通过分析二次CRS 时发现的肿瘤复发或进展形式,可能有助于明确原发性原发性卵巢上皮性癌的最佳手术策略。实施CRS 原则是“最小切缘和体积规则”和“肿瘤细胞包裹理论”。
3.2 最小切缘和体积规则在细胞减灭术中的应用
最小切缘和体积规则限定了初发EOC 腹膜转移病变及子宫切除的范围,指导制定CRS 手术策略。最小切缘和体积规则有助于优化手术策略,保证手术范围足够同时又不过度治疗。例如,在卵巢癌网膜转移病变侵犯胃壁大弯侧时,根据最小切缘规则,CRS 时无需追求根治性盆腔腹膜切除联合直肠乙状结肠切除以达切缘阴性。
最小切缘和体积规则指导不同病变部位的手术范围,具体范围取决于肿瘤体积最大部位能达到的手术彻底程度。对于卵巢癌而言,根据最小切缘和体积规则,如果膈下及脾周有肉眼可见肿瘤病变残留,则盆腔手术无需达到肉眼无瘤。初发卵巢癌的手术切除范围有时仅限于双侧卵巢、输卵管及网膜饼切除,子宫予以保留。同时需行全身化疗以控制膈下及盆腔残留病变。
如果肿瘤体积最大部位能够手术彻底切除,CRS则需达到腹盆腔各部位肉眼无瘤。例如,在膈下及腹腔病灶能够彻底切除情况下,卵巢癌手术治疗可实施“改良后盆腔脏器切除”[8]。
3.3 肿瘤细胞包裹理论
腹膜是防止腹膜转移的第一道防线。手术导致的腹膜损伤或完整性破坏会促进手术部位发生肿瘤转移。腹膜表面损伤部位的肿瘤细胞包裹于血液及纤维蛋白凝块之中。肿瘤细胞黏附定植于损伤部位形成腹膜转移灶并逐步血管化。任何部位的残留肿瘤病变均会产生腹腔游离癌细胞,这些游离癌细胞会在腹膜损伤部位迅速形成克隆。表3 中的数据显示子宫切除术时手术切除部位的肿瘤复发更为严重。先前手术损伤部位肿瘤病变的分层融合显示了肿瘤细胞包裹的大体外观。
3.4 卵巢癌肿瘤细胞包裹理论
FIGO Щ期EOC,子宫、双侧附件联合部分大网膜切除一直是公认的最佳治疗,该策略有助于明确诊断并为肿瘤分期提供信息。然而,子宫切除术在临床中存在一定质疑,子宫切除术会促进盆腔肿瘤病变进展。根治性盆腔手术并不一定延长患者生存,而且可能会因为肿瘤细胞包裹促进重要部位肿瘤复发。本研究表明,约55.0%患者出现腹部切口或腹腔镜戳孔部位复发。在子宫切除术手术部位及盆腔肿瘤复发率较高。肿瘤复发常见部位依次为直肠乙状结肠交界(65.0%)、膀胱、左侧输尿管远端或阴道残端(均50.0%)、左侧盆壁(40.0%)、右侧盆壁(35.0%)及右侧输尿管远端(35.0%)(表1)。本研究所有接受二次CRS 的复发性EOC 患者均在初次子宫切除术时进行了盆腔CRS;但由于肿瘤细胞包裹,大部分患者最终还是出现了盆腔手术部位肿瘤复发。直肠乙状结肠交界、膀胱及输尿管远端等重要结构内或周边肿瘤复发,会引起胃肠道及泌尿功能严重损害,并加速患者死亡。Look 等[9]研究显示有些部位肿瘤复发难以通过手术达到完全切除,从而使患者生存期缩短。手术损伤部位容易发生肿瘤复发也证明了肿瘤细胞包裹理论。
3.5 卵巢癌患者是否均需要实施子宫切除术的探讨
EOC 原发部位在卵巢和输卵管,子宫切除术成为初发卵巢癌患者的标准手术方式的原因,包括:1)输卵管或卵巢淋巴可能通过子宫引流,保留存在隐匿性病灶的子宫则存在术后子宫肿瘤复发风险,但风险较低;2)约50%患者对新辅助化疗有明显疗效并有机会行间歇性CRS,如果能够经膈肌腹膜下、肝胃韧带腹膜下、内脏浆膜下彻底切除肿瘤病灶,则有必要实施子宫切除术、盆腔腹膜切除术及直肠乙状结肠切除,如果膈肌腹膜下及腹腔病灶在新辅助化疗后不能彻底手术切除,则无需行子宫切除;3)部分患者接受新辅助化疗后子宫部位肿瘤仍巨大、对化疗反应欠佳,此类患者有必要行子宫切除术和卵巢切除术。
3.6 同时性子宫内膜癌和卵巢癌患者行子宫切除术的探讨
约10%EOC 患者同时合并侵袭性子宫内膜癌[10],其中一种肿瘤可能为另一种肿瘤的转移病变,而近期研究表明其是两种起源截然不同的肿瘤[11]。此情况多见于围绝经期女性,通常肿瘤体积较大。临床上很少出现跨体腔腹膜转移,这一点与卵巢浆液性癌有所不同。Zaino 等[10]研究显示EOC 合并子宫内膜癌患者预后良好,5年无病生存率85%,10年生存率80%。因此,这种情况需与卵巢子宫内膜样癌所致转移鉴别。对于卵巢内膜样腺癌患者,膈下及腹腔病变常易切除。
Bunting 等[12]报道了卵巢癌并发子宫内膜癌,及子宫切除术在卵巢癌治疗中的应用价值。451 例卵巢癌患者中,同时并发子宫内膜癌者占5%(15 例)。这部分患者子宫表面均无肉眼可见的浆液性病变浸润,均未接受子宫切除术。其中仅3 例患者经阴道超声检查发现异常。该研究建议卵巢子宫内膜样癌患者应常规行盆腔超声检查。如果难以决断是否行子宫切除,可于术中行子宫内膜刮除活检,根据病理结果决定。
3.7 完全CRS 是实施子宫切除术和HIPEC 的指征
实施完全CRS 后游离癌细胞会通过肿瘤细胞包裹发生腹腔种植,HIPEC 可进一步减少腹腔内游离癌细胞数量。van Driel 等[13]研究证实,EOC 患者实施间歇性CRS+HIPEC 较单纯手术生存获益更大。Spiliotis 等[14]研究同样证实CRS+HIPEC 对EOC 的治疗价值。HIPEC 对已形成的种植转移灶有效,上述两项研究所展示的生存获益可能更大。子宫切除术后有必要行HIPEC 以清除肿瘤细胞包裹。
3.8 结语与展望
本文研究了子宫及双侧附件切除术治疗初发EOC 后,腹盆腔不同部位肿瘤复发或进展的特点。主要优点是所有数据为独特的前瞻性数据。尽管二次手术治疗时常发现盆腔肿瘤复发或进展,但不同部位肿瘤病变形式相关研究报道较少。本研究证明了肿瘤细胞包裹理论在EOC 发展中的重要意义。
肿瘤病变的精确定位为区分肿瘤复发或肿瘤进展提供了便利。这使临床医师更易理解EOC 行子宫切除术有时并非必须,而子宫切除有时会带来不良后果。由于肿瘤细胞包裹,手术损伤部位肿瘤复发或进展会更加严重。
本研究的缺点是符合纳入标准的病例数较少。仅20 例患者难以进行统计学分析。此外,本文未尝试报道无病生存期,患者CRS 后在本单位的随访率较低,因此关于无病生存期的数据可靠性不足。关于复发病变的确切数据很难获得,而且较少能够通过组织活检证实。本文对指导EOC 外科治疗具有重要意义。子宫切除术会导致大量肿瘤细胞包裹于手术部位。双侧输卵管及卵巢常需切除。如果切除大网膜有利于最大程度减瘤及减缓恶性腹水发生,则应尽可能切除大网膜及大网膜病损。现代机械止血仪器及高压球形电刀外科技术为实施有限的双侧输卵管卵巢切除术提供了便利条件[9]。如果上腹部有肿瘤病变残留,则盆腔残留同样程度的肿瘤病变并不会影响治疗效果,此时不应行子宫切除术。
子宫切除术治疗卵巢癌具有明确的适应证:1)盆腔病变严重,勉强保留子宫将妨碍完全CRS;2)腹腔内包括双侧膈下病变能够彻底切除,实现肉眼无瘤时。子宫切除术可达到完全CRS,则子宫切除术就是有意义的外科治疗。如果手术不能达到腹腔内肉眼无瘤,那么子宫切除术没有任何意义,反而会因为肿瘤细胞包裹导致不利后果。
