茶树轮斑病生防菌筛选试验
2022-02-16张红岩汤茶琴王润贤
徐 超,刘 敏,张红岩,汤茶琴,王润贤*
(1.江苏农林职业技术学院,江苏句容 212400;2.句容市自然资源和规划局,江苏句容 212400)
茶树是一种具有较强耐酸耐铝毒性,广泛种植于热带亚热带酸性土壤中的植物。土壤是茶园生态系统的重要组成部分,土壤微生物与土壤的化学性质、物质转化、循环利用及污染物的降解等息息相关,对茶树的生长有着重要影响[1]。茶树和土壤构成一个独特的生态系统,土壤肥沃、土质深厚、栽培管理技术科学合理的茶园中土壤微生物较多[2-3]。茶树轮斑病是由茶拟盘多毛孢菌侵染引起的一种茶树病害。近年来,茶树轮斑病的发病情况呈上升趋势,已成为限制各地茶产业发展的重要因素之一。为筛选出对茶树轮斑病有显著防治效果的微生物资源,实现茶园常见病害的有效生物防治,本文对江苏省不同地区茶园土壤中的微生物进行分离和纯化,并分析茶园土壤中的微生物对茶树轮斑病的防治效果。
1 材料与方法
1.1 试验材料
1)土壤样品。2019 年11 月在江苏省不同地区的茶园中采用五点取样法,取每个采样点10 cm 以下的土壤约100 g 作为研究对象,装入自封塑料袋中密封,置于冰盒中带回实验室并进行低温保存,备用[4]。2)茶树轮斑病病原菌,由无锡市茶叶研究所提供。
1.2 试验方法
1.2.1 土壤混悬液制备
称取10 g 土样加入装有90 mL 无菌水的三角瓶中振荡20 min 左右,使土样和水混合均匀,得到10-1稀释液;用无菌吸管吸取土壤混悬液1 mL 加入装有9 mL 无菌水的试管中,适当振荡使土壤混悬液混合均匀,得到10-2稀释液;用无菌吸管吸取10-2稀释液1 mL 加入装有9 mL 的无菌试管中得到 10-3稀释液[5]。
1.2.2 培养基配制
采用200 g 土豆、20 g 葡萄糖、20 g 琼脂、1 000 mL水配制PDA 培养基,并将培养基置于121 ℃灭菌20 min,备用。
1.2.3 微生物的分离与纯化
在无菌平板上分别标注10-1、10-2、10-3,每个浓度重复3 次。用无菌吸管严格按照无菌操作的要求吸取10-3稀释液1 mL 于对应标注的平板中,同样的方法吸取10-2稀释液、10-1稀释液。再用已灭菌过的玻璃棒将菌液均匀涂抹在平板上,每种稀释液要单独使用1 个玻璃棒。将接好的平板放入25 ℃恒温箱中倒置培养3~5 d,并观察记录,获得初分离菌落[5]。用接种环或接种针于初分离菌落的表面挑取少量菌落,并划线接种到新的平板上人工培养3~5 d 后,再次挑取少量菌落并转接。按同种的方法重复操作,直至获得各种微生物的纯培养。将获得纯培养的微生物于4 ℃条件下保存备用。
1.2.4 生防菌室内拮抗效果测定
将分离纯化的微生物与茶树轮斑病病原菌分别接种在同一个平板的两侧,放入培养箱(数显隔水式303As-3)内培养7 d 左右。通过平板对峙实验,根据拮抗效果,分析判断目的微生物的室内抗病性。根据拮抗带的有无或病原菌的生长状况,将平板对峙实验中拮抗效果较显著的微生物作为备选菌株,制备成液体菌剂并保存,用于茶树轮斑病的田间防治试验,将拮抗效果欠佳的菌株直接淘汰。
1.2.5 生防菌田间防治效果测定
在茶树轮斑病的高发季节(7 月),将拮抗效果较显著的备选菌株制成微生物菌剂,于低温条件下进行破碎处理,并按1∶14 的比例加水稀释(每667 m2茶园液体菌剂使用量为1 kg,加水量为14 kg),于傍晚均匀喷施于茶行蓬面。以喷施等量清水(15 kg/667 m2)的茶园作为对照处理。每种处理的茶园面积均为667 m2,设3 组重复。在施用菌剂后的第5 d、10 d、15 d、20 d 分别统计各处理茶园的发病程度,在每个试验重复组内,随机选取500 个叶片,按照公式(1)和公式(2)计算分析茶树轮斑病的感病率、感病指数。

病株病情的分级标准主要是根据叶片正反两面出现病斑的数量及直径,初定分级标准为6 级。1)0 级正常。2)Ⅰ级正反两面有少量病斑。3)Ⅱ级正反两面有病斑,发病面积占叶片总面积1/4 以下。4)Ⅲ级正反两面有病斑,发病面积占叶片总面积的1/4~1/2。5)Ⅳ级正反两面有病斑,发病面积占叶片总面积1/2~3/4。6)Ⅳ级正反两面有病斑,发病面积占叶片总面积3/4 以上。
1.2.6 微生物鉴定
对生防效果较好的微生物送至南京金斯瑞生物科技有限公司进行测序,并结合形态特征进行微生物鉴定。
2 结果与分析
2.1 不同茶园土壤中微生物的差异
如表1 所示,供试茶园土壤中共分离出 64 株细菌、34 种真菌。其中,8-3 样地中的微生物数量最多,细菌占70.1%;7-5 样地中的微生物数量最少,细菌占83.3%。多数茶园分离出的微生物数量在7~10 种,除8-3 样地外,其余样地间的微生物数量差异较小。

表1 不同茶园土壤微生物种类
2.2 茶园土壤微生物的室内拮抗效果
根据室内拮抗实验中拮抗带的有无或病原菌的生长状况,初步确立有效生防菌,并进行后续研究。如图1 所示,对茶树轮斑病拮抗作用较强的细菌有3 种,分别为1 号菌株、2 号菌株、3 号菌株,拮抗菌株和病原菌之间分界线较明显。其中,1 号菌株对病原菌的拮抗效果最好,3 号菌株拮抗效果次之;2 号菌株拮抗效果稍差。对茶树轮斑病拮抗作用较强的真菌有3 种,分别为4 号菌株、5 号菌株、6 号菌株,病原菌的生长均受到抑制;其中,5 号菌株对病原菌的拮抗效果较好,4 号菌株拮抗效果次之,6 号菌株拮抗效果稍差。

图1 土壤微生物对茶园轮斑病的室内拮抗效果
2.3 茶园土壤微生物的田间防治效果
根据茶园土壤微生物室内拮抗实验结果,将平板对峙实验效果较好的6 种菌株作为备选菌株进行田间防治试验,以进一步验证其对茶树轮斑病的田间防治效果。如图2 所示,在3 株供试细菌中,1 号菌株效果最好,在第20 d 时感病率和感病指数分别为35%和12.0,且感病率和感病指数的变化趋势较小;2 号菌株效果次之,在第20 d 时感病率和感病指数分别为48%和16.4;3 号菌株效果最差,在第20 d 时感病率和感病指数分别为65%和20.4。在3 种供试真菌中,5 号真菌效果最好,在第20 d 时感病率和感病指数分别为40%和13.0,且其感病率和感病指数的变化趋势较小;4 号真菌效果次之,在第20 d 时感病率和感病指数分别为55%和16.4;6 号真菌效果最差,在第20 d 时感病率和感病指数分别为60%和19.2。

图2 土壤微生物对茶园轮斑病的田间防治效果
2.4 茶园有效土壤微生物的鉴定
2.4.1 形态特征
对筛选的微生物进行形态学观察,并对其形态特征进行描述(见表2)。

表2 微生物形态观察
2.4.2 分子鉴定
1)生防真菌的分子鉴定。对防治效果较好的5 号真菌进行分子鉴定,ITS 区全序列扩增并进行测序。经比对,该序列与木霉菌序列相似度为100%。结合5号真菌的形态学特征,菌落生长迅速,呈不定型棉絮状或致密丛束状(见图3),表面颜色为绿色,确定该真菌为绿色木霉(Trichoderma virens)。
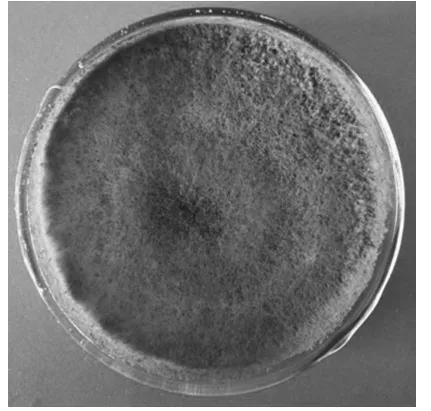
图3 木霉菌
2)生防细菌的分子鉴定。对拮抗效果较好的1号细菌菌株进行分子鉴定。ITS 区全序列扩增并进行测序。经比对,该序列与伯克霍尔德氏菌序列相似度为100%。结合形态学特征,该菌株在PDA 平板上培养,菌落呈淡黄色,菌落隆起,边缘整齐(见图4),革兰氏染色呈阴性,认为该细菌为伯克霍尔德氏菌(Burkholderia cenocepacial)。

图4 伯克霍尔德氏菌
3 结论与讨论
细菌是生物圈中数量最多、分布非常广泛的微生物,占土壤微生物总量的70%~90%[5-6]。有研究表明,1 g 茶园干土中的土壤微生物总数超1 000 万个,最多可达5 800 万个,数量显著多于稻田、林地、旱地土壤,说明茶园土壤更适合微生物生长[7]。当前大量研究集中于土壤微生物,但有关茶园土壤有益微生物的研究相对较少。本文通过对江苏省不同地区茶园土壤中的微生物进行分离和纯化,分析茶园土壤微生物对茶树轮斑病的防治效果,筛选对茶树轮斑病生防效果显著的有益微生物。
试验结果表明,土壤肥沃、土质疏松、管理水平较高的地区微生物数量较多。8-3 样地周围栽培了大量的树木,且土壤表面有机质丰富,茶园整体环境条件较好,适宜土壤微生物的生长繁殖;而7-5 样地此前是荒地,多年无人管理,经开发后成为茶园,因此该茶园中的微生物数量最少。不同地区的茶园由于地理条件、气候条件、土壤肥力等自然因素及人工栽培管理措施的影响,土壤微生物的种类及数量会有显著差异。
有研究表明,木霉菌剂通过产生抗生素、营养竞争、微寄生、细胞壁分解酵素及诱导植物产生抗性等机制,对多种植物病原菌具有拮抗作用,具有保护和治疗双重功效,可有效防治土传性真菌病害,在苗床使用木霉菌剂,可提高育苗与移植成活率,也可用于防治灰霉病[8]。本次试验筛选出的5 号真菌绿色木霉对茶树轮斑病的室内拮抗效果、田间防治效果均较好。伯克霍尔德氏菌是一个复合群体,其中一些菌种具有生物防治、促进植物生长、生物修复等功能[9]。本研究分离的1 号菌株伯克霍尔德氏菌对茶树轮斑病的室内拮抗效果、田间防治效果最好,显著优于其他菌株。近年来,化肥与农药的过度使用导致茶园土壤板结、土质变差等问题,对茶叶的生产及茶叶质量产生不利影响。茶园有益微生物能有效促进茶树生长、改良土壤微环境、控制病害发生等。因此,可将本研究获得的绿色木霉和伯克霍尔德氏菌作为优良的微生物资源,制成微生物菌剂,用于茶树轮斑病的生物防治。
