水分梯度对川西北高原设施栽培巨菌草茎生长的影响
2022-02-16周扬宋思梦周旭陈梁婧张茂娟梁蔡佳王欣然
周扬 宋思梦 周旭 陈梁婧 张茂娟 梁蔡佳 王欣然
(四川民族学院横断山区生态修复与特色产业培育研究中心,四川 康定 626001)
菌草(JUNCAO)是指可作为食、药用菌培养基并具有综合开发利用价值的草本植物[1]。菌草技术是由福建农林大学国家菌草研究中心林占熺团队历经20a余研发而成的集农业、生物、工程于一体的新兴多学科交叉技术。从最初的栽培食药用菌,拓展到菌草饲料、菌草菌物饲料、菌草菌物肥料和生物质能源与材料开发等领域,围绕“植物—菌物—动物”三物循环生产,我国开展了系列的研究与推广应用,建立起菌草综合利用技术与产业发展体系,实现一草多用、综合利用、循环利用[2]。其中,巨菌草(Pennisetum giganteum z.x.lin)是推广应用最广泛的菌草种类之一。巨菌草别称王草、皇竹草、巨象草、甘蔗草,隶属于被子植物门单子叶植物纲禾本科狼尾草属,是一种多年生禾本科直立丛生型植物,具有较强的分蘖能力,适宜在热带、亚热带、温带生长和人工栽培。其生物转化率高,蛋白含量高(种植4周粗蛋白在10.80%以上),年鲜草产量可达200~400t·hm-2,地上部分器官中茎的生物量最大,脆嫩多汁,味甜,适口性好,可用作家畜鲜食饲料或加工成青贮及颗粒饲料,同时茎秆可榨汁制作饮料、提取纤维或精油用于轻工业等[3,4],此外,巨菌草多采用截断“茎秆”来进行大批量无性繁殖[5]。因此,研究巨菌草,尤其是其茎器官的生长发育,对区域生态保护及特色产业培育方面有一定实践价值。
川西北高原地处青藏高原东南缘,是四川省乃至整个长江、黄河流域重要的生态功能区和水源涵养区,且动植物资源(菌类、牦牛、藏系绵羊、藏香猪、藏鸡等)十分丰富[6,7]。但因海拔过高、地势陡峭、高寒干冷,加之道路、水电站、旅游景点开发等人为干扰严重,使得该地区生态环境问题突出,植被退化明显,畜牧业因冬季草地枯萎而发展滞后[8]。引种巨菌草并开发相关生态衍生产业,发挥巨菌草在水土保持、重金属土壤修复、畜牧业饲料、特色药食用菌栽培等方面的生态与经济功能,对川西北高原地区生态保护与重建、区域经济健康发展十分重要。然而,川西北高原的气候较为寒冷,降水稀少,干湿季分明,年蒸发量是年降雨量的2~7倍,干旱程度极高[9],这对巨菌草的健康生长发育与茎秆无性繁殖活力有一定考验。因此,本研究在川西北高原地区,采用设施栽培增温增湿控水的情况下,通过盆栽控制变量实验探讨水分梯度对巨菌草茎器官生长性状的影响,拟为川西北高原巨菌草引种与水分科学管理提供理论依据。
1 材料与方法
1.1 研究地概况
研究地(E102°17′,N30°12′,海拔1400m)地处中国最高一级阶梯向第二级阶梯云贵高原和四川盆地过渡地带,属横断山系北段川西高山高原区,境内地理环境复杂,植被退化明显。境内土壤类型有山地燥褐土、山地燥红土、山地褐土、山地黄棕壤、山地暗棕壤、山地棕壤、山地棕色针叶林土、山地灰化土、山地草甸森林土、高山草甸土、高山寒漠土等。气候属高原型季风气候,平均日照时数1324~2079h·a-1,气温7.0~15.5℃·a-1,年辐射总量超过6000MJ·m-2,无绝对无霜期,大雪、干旱、冰雹、大风等恶劣天气及灾害性天气频繁。降水极少,干湿季分明,降水量69.35~664.4mm·a-1,蒸发量1500~2200mm·a-1,相对湿度50%~70%·a-1。在康定市姑咱镇四川民族学院B校区农学实验楼3楼玻璃温室中进行巨菌草盆栽实验,采用设施栽培的形式控制处理组的温湿度一致,且无降水干扰。
1.2 实验材料
盆栽实验的土壤取自泸定县德威镇德威乡,其土壤质量含水量为83.85g·kg-1,容重为1.43g·cm-3,田间持水量为25.60%,总空隙度、毛管孔隙度、非毛管孔隙度分别为43.71%、28.42%及15.29%,排水能力为17.36mm,见表1。该土壤透气透水能力适中,肥力质量中等,经太阳暴晒消毒后过筛,均匀装入口径40cm、深25cm的聚乙烯圆台形花盆中。盆栽实验的巨菌草种节自福建农林大学国家菌草工程技术研究中心、菌草综合开发利用技术国家地方联合工程研究中心及菌草科学与技术研究院引进,种源纯正,种节为4月龄,茎秆绿化,木质化程度>85%,腋芽饱满,完整健康,无霉烂与病虫害。

表1 所选土壤物理性质背景值
1.3 研究方法
将巨菌草种节留叶鞘,去除叶片和顶端嫩芽,按照15~25cm长度进行砍切(每节保留2~3个芽);将砍好的种节浸泡在3‰尿素溶液中12~24h,清水冲洗后在高温(不超过30℃)高湿(100%)环境中催芽3~5d;选取90根单秆双芽种节及时扦插于90个花盆中(装有16kg德威乡土壤),浇透定根水。按照等距离摆放好花盆,育苗1个月,补充水分,及时清除杂草。
2021年6月16日,巨菌草成苗后,按照控制变量法,选择60盆长势相似的巨菌草幼苗进行水分梯度实验。以每日称重补水法与土壤水分仪相结合的方式,控制保持盆中土壤水分在25%田间持水量为重度干旱胁迫处理组(WHC25),50%田间持水量为轻度干旱胁迫处理组(WHC50),75%田间持水量为正常水分处理组(WHC75),100%田间持水量为水淹胁迫处理组(WHC100)。
1.4 室内实验与监测
花盆中土壤物理性质等背景值采用环刀法测量。室外自然环境因子数据源自当地气象监测站,玻璃温室内环境因子数据源自干湿球温度计每日早、中、晚3次监测均值。6月16日—7月14日实验期内,分别每隔7d对各水分梯度组内4株代表性植株进行连续测量茎器官生长指标(茎粗、节数、节间长、茎秆总长)。其中,茎粗为巨菌草植株第5节处的茎围长,节间长为茎杆总长除以节数。
1.5 数据处理与分析
分别用Excel 2007、SPSS 24.0、Origin 9.0进行数据整理、统计分析、图形制作。运用单因素方差分析(One-way ANOVA)测算不同次测量日前后茎器官形态差值变化及不同水分梯度对茎器官形态特征的影响,Levene's test检验方差齐性时差异程度用Duncan多重比较,Levene's test检验方差不齐时差异程度用T2 Tamhane's test多重比较,显著性水平P=0.05。文中图表数据均为平均值±标准误,WHC25、WHC50、WHC75、WHC100分别代表25%、50%、75%及100%田间持水量处理组。
2 结果与分析
2.1 设施栽培与室外自然环境因子比较
6月16日—7月17日实验监测期内环境因子变化情况见图1,室外自然环境下降雨天数16d,累积降雨量70.30mm,平均日照时间14.00h,平均最高气温24.41℃,平均最低气温15.97℃,平均温度18.83℃,平均相对湿度74.17%。玻璃温室内平均气温29.11℃,比室外高出10.28℃,平均相对湿度71.94%,比室外低2.23%。设施栽培的温湿度更适宜耐高温、耐干旱的巨菌草生长。
2.2 水分梯度对巨菌草茎生长的总体影响
水分梯度显著影响了巨菌草茎生长指标(茎粗、节数、节间长、茎秆总长)(P<0.05)。由表2可知,WHC75组中巨菌草累计节间长增量最大(1.75±1.03cm),WHC100组巨菌草的累计茎粗(0.95±0.22cm)、累计节数(6节)、累计茎秆总长(52.59±3.52cm)增量均最大,而在WHC25中植株死亡。表明随干旱胁迫加剧,巨菌草茎粗、节数、节间长、茎秆总长锐减,各水分梯度中,100%田间持水量(轻度水淹胁迫)巨菌草茎器官生长最好,其次是75%田间持水量组(正常水分梯度),50%田间持水量组(轻度干旱胁迫)巨菌草茎器官长势较弱,25%田间持水量组(重度干旱胁迫)巨菌草无法生产存活。
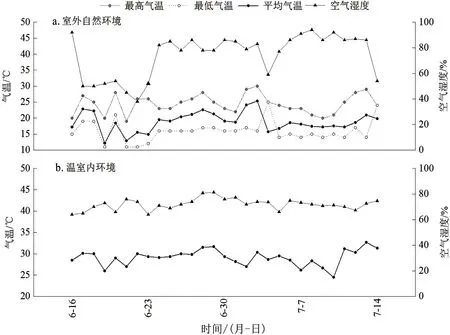
图1 室内外环境因子变化图

表2 不同水分梯度对川西北高原设施栽培巨菌草茎生长指标的总体影响
2.3 水分梯度对巨菌草茎粗的影响
从各水分梯度下巨菌草茎粗增额来看,WHC100组>WHC75组>WHC50组>WHC25组,均有显著性特征。即水淹胁迫状态下巨菌草茎粗增幅最大,其次为正常水分梯度,再者为轻度水分胁迫状态,重度水分胁迫下巨菌草死亡,随盆中土壤水分减少,植株茎粗增幅越小。连续监测不同水分梯度下巨菌草茎粗增幅变化如图2所示,WHC75组巨菌草茎粗增幅随控制实验时长增加不断提升;WHC100组巨菌草茎粗增幅随控制实验时长增加先升高后降低,在6月30日—7月7日有最高值;WHC50组巨菌草茎粗增幅随控制实验时长增加而缓慢降低;WHC25组巨菌草茎粗增幅仅在6月16—23日有变化,6月30日监测时植株已凋萎死亡。
2.4 水分梯度对巨菌草节数的影响
从各水分梯度下巨菌草节数增额来看,WHC100组>WHC75组>WHC50组>WHC25组,均有显著性特征。即水淹胁迫状态下巨菌草节数增幅最大,其次为正常水分梯度,再者为轻度水分胁迫状态,重度水分胁迫下巨菌草死亡,随盆中土壤水分减少,植株节数增幅越小。连续监测不同水分梯度下巨菌草节数增幅变化如图3所示,WHC75组和WHC100组巨菌草节数增幅随控制实验时长增加先升高后降低,在6月30日—7月7日有最高值;WHC50组巨菌草节数增幅随控制实验时长增加而缓慢升高,在6月23—30日间节数无变化(增幅为0),在6月30日—7月7日及7月7—14日间增幅变大但差异不显著;WHC25组巨菌草节数增幅在6月16—23日无变化(增幅为0),6月30日监测时植株已凋萎死亡。
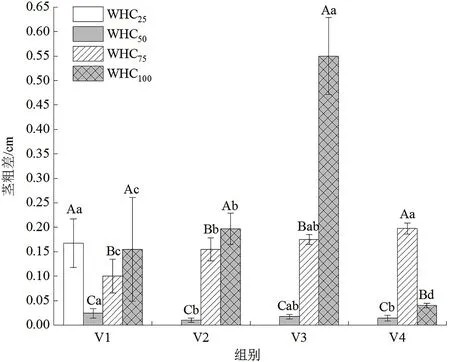
图2 不同水分梯度对川西北高原设施栽培巨菌草茎粗差的影响
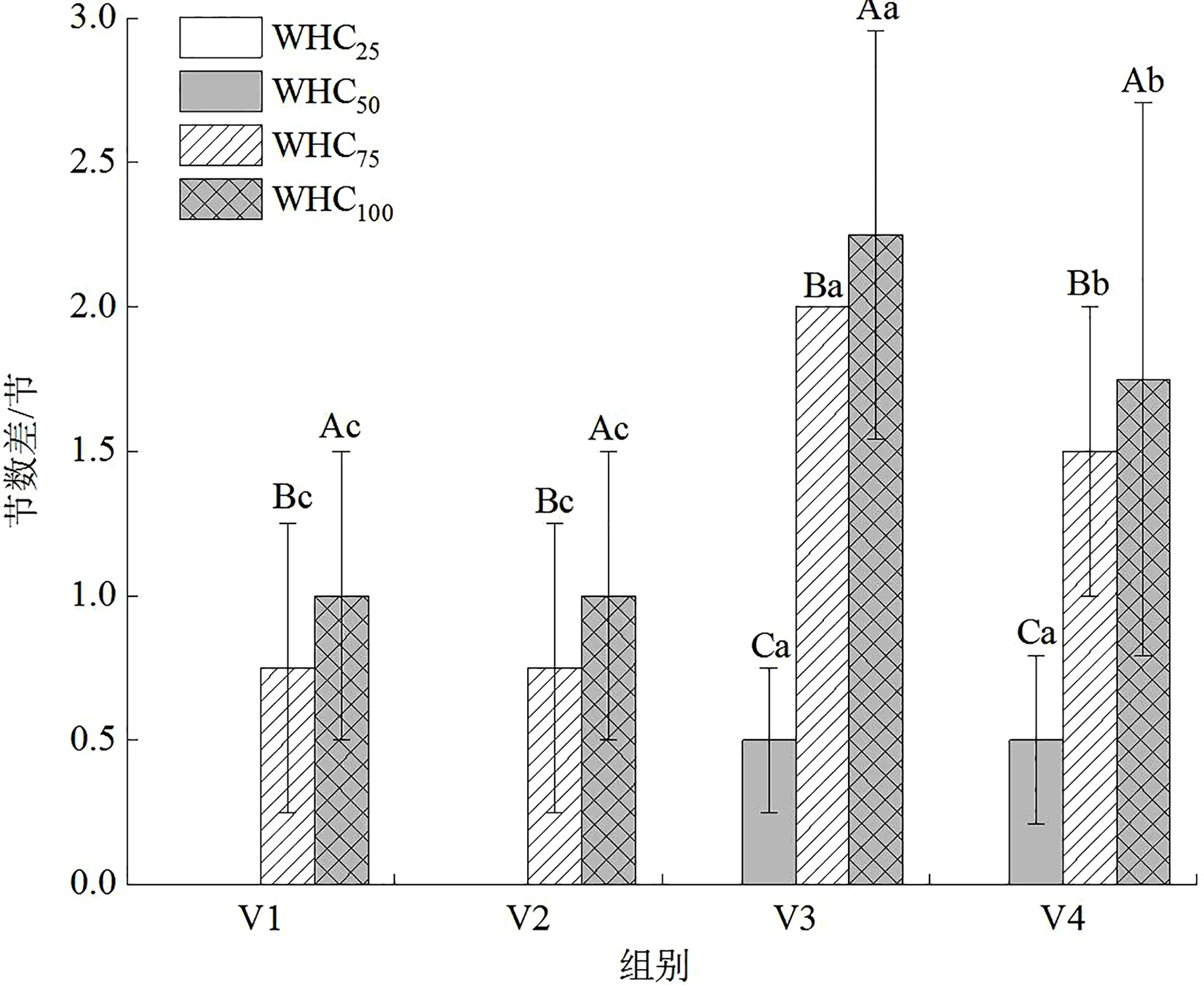
图3 不同水分梯度对川西北高原设施栽培巨菌草节数差的影响
2.5 水分梯度对巨菌草节间长的影响
从各水分梯度下巨菌草节间长增额来看,WHC75组>WHC100组>WHC50组>WHC25组,均有显著性特征。即正常水分状态下巨菌草节间长增幅最大,其次为水淹胁迫状态,再者为轻度水分胁迫状态,重度水分胁迫下巨菌草死亡,随盆中土壤水分减少,植株节间长增幅越小。连续监测不同水分梯度下巨菌草节间长增幅变化如图4所示,WHC75组巨菌草节间长增幅随控制实验时长增加先降低后升高,在6月23—30日间增幅最小,在7月7—14日间增幅最大;WHC100组巨菌草节间长增幅随控制实验时长增加先升高后降低,在6月30日—7月7日有最高值;WHC50组巨菌草节间长增幅随控制实验时长增加先升后降再升再降,无明显规律;WHC25组巨菌草节间长增幅在6月16—23日较大,6月30日监测时植株已凋萎死亡。
2.6 水分梯度对巨菌草茎秆总长的影响
从各水分梯度下巨菌草节间长增额来看,WHC100组>WHC75组>WHC50组>WHC25组,均有显著性特征。即水淹胁迫状态下巨菌草节间长增幅最大,其次为正常水分状态,再者为轻度水分胁迫状态,重度水分胁迫下巨菌草死亡,随盆中土壤水分减少,植株茎秆总长增幅越小。连续监测不同水分梯度下巨菌草茎秆总长增幅变化如图5所示,WHC75组和WHC100组巨菌草茎秆总长增幅随控制实验时长先升后降,WHC75组在6月23—30日间增幅最大,WHC100组在6月30日—7月7日间增幅最大;WHC50组巨菌草茎秆总长增幅随控制实验时长增加先降后升,在6月30日—7月7日间增幅最小;WHC25组巨菌草茎秆总长在6月16—23日间有一定增幅,6月30日监测时植株已凋萎死亡。
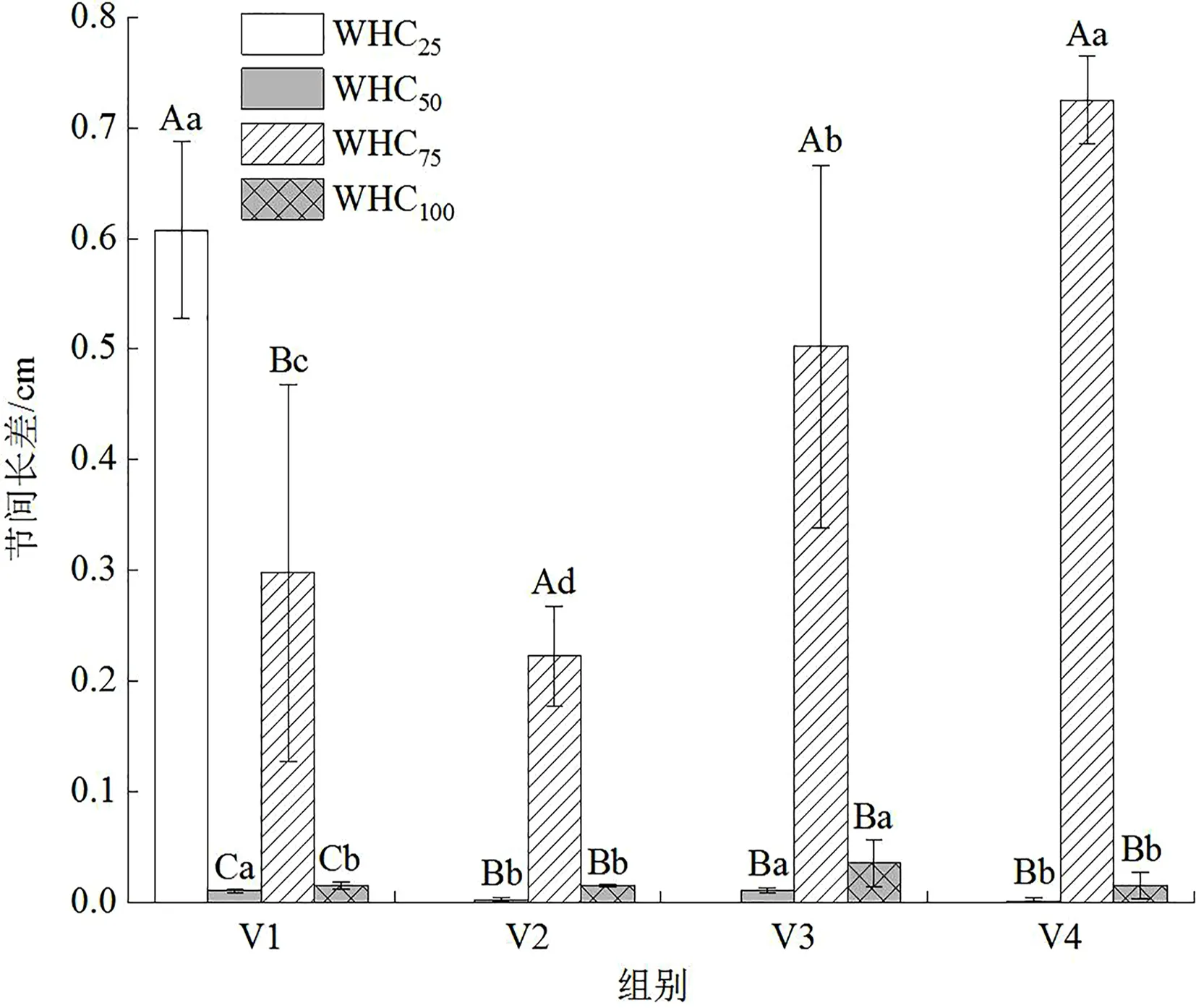
图4 不同水分梯度对川西北高原设施栽培巨菌草节间长差的影响
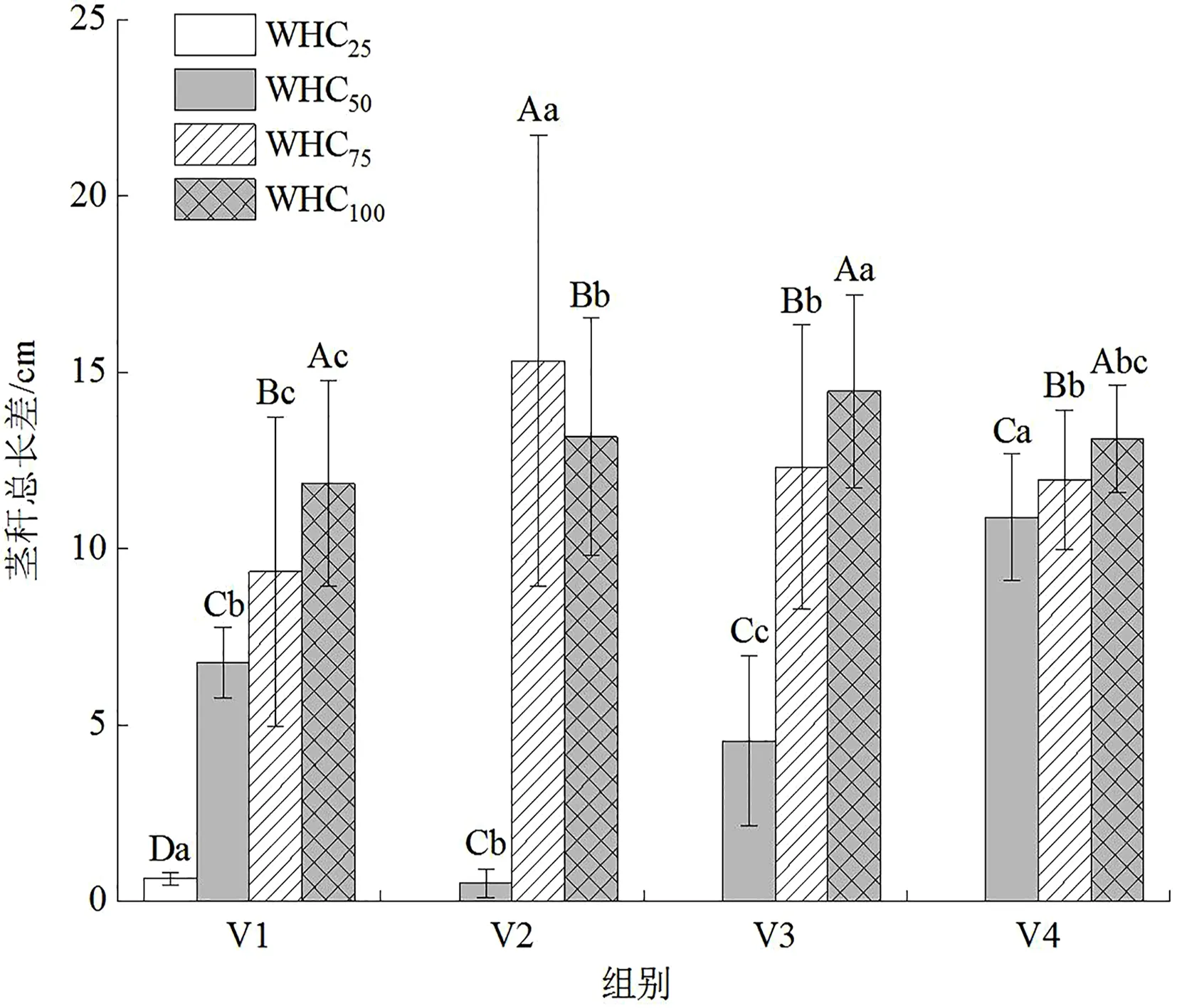
图5 不同水分梯度对川西北高原设施栽培巨菌草茎秆总长差的影响
3 结论与讨论
水分梯度显著影响了川西北高原设施栽培巨菌草茎器官的生长指标(茎粗、节数、节间长、茎秆总长)。轻度水淹胁迫状态下巨菌草累计茎粗、节数、茎秆总长增量最大,其次为正常水分梯度;正常水分状态下巨菌草累计节间长增量最大,其次为轻度水淹梯度;而随干旱胁迫加剧,巨菌草茎粗、节数、节间长、茎秆总长均不断锐减,在轻度干旱胁迫中尚能继续生长,重度干旱胁迫中巨菌草凋萎死亡。因此,川西北高原设施栽培巨菌草在正常水分(75%田间持水量)或轻度水淹(100%田间持水量)状态下茎器官生长旺盛,且在3周后涨幅达到最大值,低于50%田间持水量后长势逐渐变差,达到25%田间持水量后巨菌草无法正常生长。
干旱或水淹带来的水分胁迫作用是限制植物生长发育与形态指标的重要因子,尤其是干旱条件可能会引起膜伤害和膜透性增加及生物自由基积累,而自由基累积会危害植物正常生长,其影响严重性仅次于病虫害等生物胁迫[10]。膨压与光合作用是植物抵抗水分胁迫的首要生理反应[11],本研究表明,巨菌草细胞具有较强的维持膨压能力以帮助其在适度干旱胁迫下维持正常生长。当外界供水减少出现轻度干旱胁迫(50%田间持水量),巨菌草在低渗透压状态下较强的膨压维持能力促使其继续保持气孔开放进行光合作用,保护叶绿素,降低质壁分离,积累有机物,促进茎粗、茎长、节间长、节数等增加;且体内抗氧化物类和小分子物质可以清除部分活性氧自由基抵御不良环境[12]。而当水分下降至25%田间持水量时,膨压维持能力逐渐降低,影响叶片生长,降低光合速率,抑制光反应中的原始光能转换、光合磷酸化、电子传递及暗反应等,叶表面气孔开度减小,CO2吸收量减少,光合作用进一步下降,化学能无法被足够量的CO2进行碳同化,出现光抑制现象,进一步不可逆地破坏了叶绿体超微结构,巨菌草整体出现凋萎死亡。而在正常水分(75%田间持水量)及轻度水淹(100%田间持水量)状态下,巨菌草较强的渗透调节机制持续稳定体内渗压平衡与蛋白质结构稳定性[10,12]。此外,随外界水分条件变化,巨菌草茎生长指标的增幅均在中后期变化更大,这说明巨菌草形态适应对短期内突然的环境变化具有一定缓冲时期。在本研究基础上,后期可进一步增加水分梯度对川西北高原设施栽培巨菌草茎内生理生化指标的影响,进一步加深其对水分胁迫响应的认识。
