孕期应激致子代粪便肠道菌群及靶向代谢组水平的改变
2022-02-15李佳琪马淑琴付有娟姚贵香关素珍
李佳琪,马淑琴,赵 枫,付有娟,姚贵香,关素珍
(1.宁夏医科大学公共卫生与管理学院,银川 750004;2.宁夏环境因素与慢性病控制重点实验室,银川 750004;3.宁夏医科大学总医院,银川 750004)
我国女性劳动参与率较高,女性的职业健康受到了越来越多的关注[1],尤其是女性在妊娠期的特殊生理时期会面临来自工作、生活、社会中各种不良应激事件的心理刺激,不仅对孕妇本身的身体健康产生影响[2],还会导致宫内环境发生改变从而不利于胎儿发育及后期的成长[3]。肠道菌群(gut microbiota)是肠道特有的微生物群落,通过产生微生物及其代谢物进而影响多种代谢和免疫稳态的功能[4]。孕期应激已被证实可对子代的肠道菌群结构产生影响[5],但要深入了解肠道菌群和宿主之间的复杂关系,不仅需要了解其结构和功能,还需要进一步了解肠道菌群与代谢物之间的联系,其中短链脂肪酸作为肠道菌群的代谢物能够反映宿主的代谢情况[6]。因此,本研究通过建立孕期慢性应激大鼠模型,观察孕期应激致仔鼠肠道菌群结构和靶向代谢物短链脂肪酸改变,分析子代肠道菌群与短链脂肪酸的关系,进而为孕期应激对子代发育影响的机制研究提供科学依据。
1 对象和方法
1.1 实验动物及分组
本研究选择健康成年SD大鼠,购自宁夏医科大学实验动物中心[合格证编号:SCXK(宁)2015-0001]。其中雌鼠16只,体质量(200±20)g;雄鼠12只,体质量(200±20)g。适应性饲养1周后,将雌鼠随机分为孕期慢性应激组(模型组)和对照组,每组各8只;将12只雄鼠随机分为模型交配组8只和对照交配组4只。其中模型组雌鼠单笼饲养,对照组雌鼠每笼2只饲养;雄鼠每笼2只饲养。本研究经宁夏医科大学实验动物中心实验动物福利伦理委员会审核(IACUCNYLAC-2019-089)。
1.2 主要仪器与试剂
131I皮质醇放射免疫试剂盒(北京北方生物技术研究所);Illumina Miseq PE300测序平台(上海美吉生物医药科技有限公司);8890B-5977B气相色谱-质谱联用仪(美国Agilent Technologies公司)。
1.3 方法
1.3.1 模型构建 (1)模型选择:选择慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)建立动物模型。应激方式包括:①禁食24 h;②24 h拥挤环境(8只合笼),笼具倾斜30°;③禁水24 h;④24 h潮湿环境(湿度60%~70%);⑤31℃温水游泳1 h;⑥30 min摇晃(1次/s);⑦30 min行为束缚;⑧5 min热应激(42℃);⑨1 min夹尾(距尾尖1 cm处)。模型周期为21 d,期间9种应激方式随机安排,原则上7 d内不出现相同的应激方式。应激①②③④在24 h进行,其余均在当天10:00~12:00进行。应激完成后放回原饲养笼具中。(2)交配过程:模型组在应激第3天(17:00)与模型交配组1∶1合笼饲养,第2天早晨检查雌鼠阴道涂片确认妊娠成功与否,确定妊娠后,将雌雄分笼,模型组继续单笼饲养。孕期每天对模型组实施不同的慢性温和刺激。同期,对照组与对照交配组2∶1合笼饲养,确定妊娠后,对照组每笼2只正常饲养,孕18 d开始单笼饲养。
1.3.2 指标的测定(1)孕期CUMS模型确认:所有雌鼠在应激前1 d,应激第1、7、14、21天行内眦静脉采血,将收集的血浆置于-80℃冰箱冷冻待测。利用131I皮质醇放射免疫试剂盒测定血浆皮质醇浓度,根据公式:C皮质酮=50×C皮质醇,得到本次研究所需皮质酮质量浓度[7]。当模型组大鼠受到应激刺激时,模型组较对照组血浆皮质酮浓度升高(P<0.05),即模型建立成功。(2)仔鼠样本收集:雌鼠分娩后,仔鼠在出生后21 d断乳,每组均随机抽取16只记为对照仔鼠组(16只,雌雄各半)和模型仔鼠组(16只,雌雄各半),并于当天收集两组仔鼠新鲜粪便至无菌冻存管中,并迅速存放于-80℃冰箱中待测。(3)肠道菌群测序及分析:两组均随机抽取6个粪便样品送至上海美吉生物医药科技有限公司进行16S rRNA的测序。采用PCR扩增技术,扩增引物见表1,扩增长度为468 bp。利用Miseq PE300平台进行测序,测定大鼠粪便中微生物16S rRNA V3、V4区序列,使用美吉生物云平台比较分析雌鼠及子代粪便样品中微生物群落结构、组成和差异。α多样性用来反映属水平肠道菌群的多样性,其中Chao、Sobs指数用来表示物种丰度,Simpson指数用来表示物种多样性,Coverage用来表示菌群覆盖度;Venn图反映属水平肠道菌群组成相似性及重叠情况;基于样本群落数据采用组间差异显著性检验观察对照仔鼠组与模型仔鼠组之间物种组成的差异。(4)靶向代谢物测定及关联性分析:精确称取100 mg粪便样本于2 mL研磨管中,加入研磨珠和1 mL研磨液(含0.5%磷酸和50μg·mL-1内标2-乙基丁酸),于冷冻研磨仪50 Hz研磨3 min,研磨2次;冰水浴超声30 min;4℃静置30 min;4℃13 000×g离心15 min;取全部上清液到新的1.5 mL离心管中;加入500μL乙酸乙酯于上清溶液中进行萃取,涡旋混匀,冰水浴超声10 min,4℃13 000×g离心10 min,取上清溶液,利用气相色谱-质谱联用仪(GC-MS)进行上机分析。采用MassHunter定量软件(美国安捷伦公司)默认参数对目标短链脂肪酸各离子碎片进行自动识别和积分,并辅助人工检查。根据计算公式:样品短链脂肪酸含量(μm·mg-1)=(C×V)/M,并结合标准曲线计算各个样品的检测浓度,换算出样品中短链脂肪酸的实际含量。
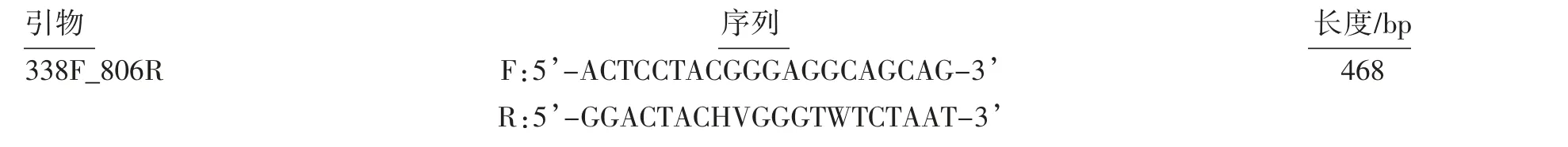
表1 PCR扩增引物
1.4 统计学方法
采用SPSS 25.0统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示,对照组与模型组的血浆皮质酮含量采用重复测量方差分析,通过两独立样本t检验比较对照仔鼠组和模型仔鼠组肠道菌群的α指数多样性;采用单因素方差分析比较子代两组间短链脂肪酸代谢差异;采用冗余分析(redundancy analysis,RDA)和相关性Heatmap图来反映短链脂肪酸与肠道菌群之间的关联性。检验水准α=0.05。
2 结果
2.1 孕期应激对母代血浆皮质酮含量的影响
对母代对照组与模型组的血浆皮质酮含量进行重复测量的方差分析,结果显示两组之间血浆皮质酮浓度差异具有统计学意义(F=7.717,P=0.024)。模型组在应激第7天、14天的血浆皮质酮质量浓度高于同时点的对照组(t=2.341、5.414,P均<0.05),见表2。
表2 孕期应激对母代血浆皮质酮含量的影响(±s,ng·mL-1)

表2 孕期应激对母代血浆皮质酮含量的影响(±s,ng·mL-1)
与同时点对照组比较*P<0.05。
组别 n 应激前1 d 应激后第1天 第7天 第14天 第21天对照组 8 80.44±22.59 95.91±42.74 95.04±14.58 105.48±14.10 96.12±16.92模型组 8 81.14±27.78 92.41±16.47 132.26±16.47* 161.46±18.32* 128.53±42.86
2.2 孕期应激对子代肠道菌群构成的影响
2.2.1 子代属水平肠道菌群α多样性分析 对照仔鼠组的Chao、Sobs、Simpson指数均高于模型仔鼠组(P均<0.05),提示孕期应激降低了仔鼠物种丰度和物种多样性;Coverage指数方面,两组间差异无统计学意义(P>0.05),提示两组仔鼠属水平菌群覆盖度无明显差异,见图1。
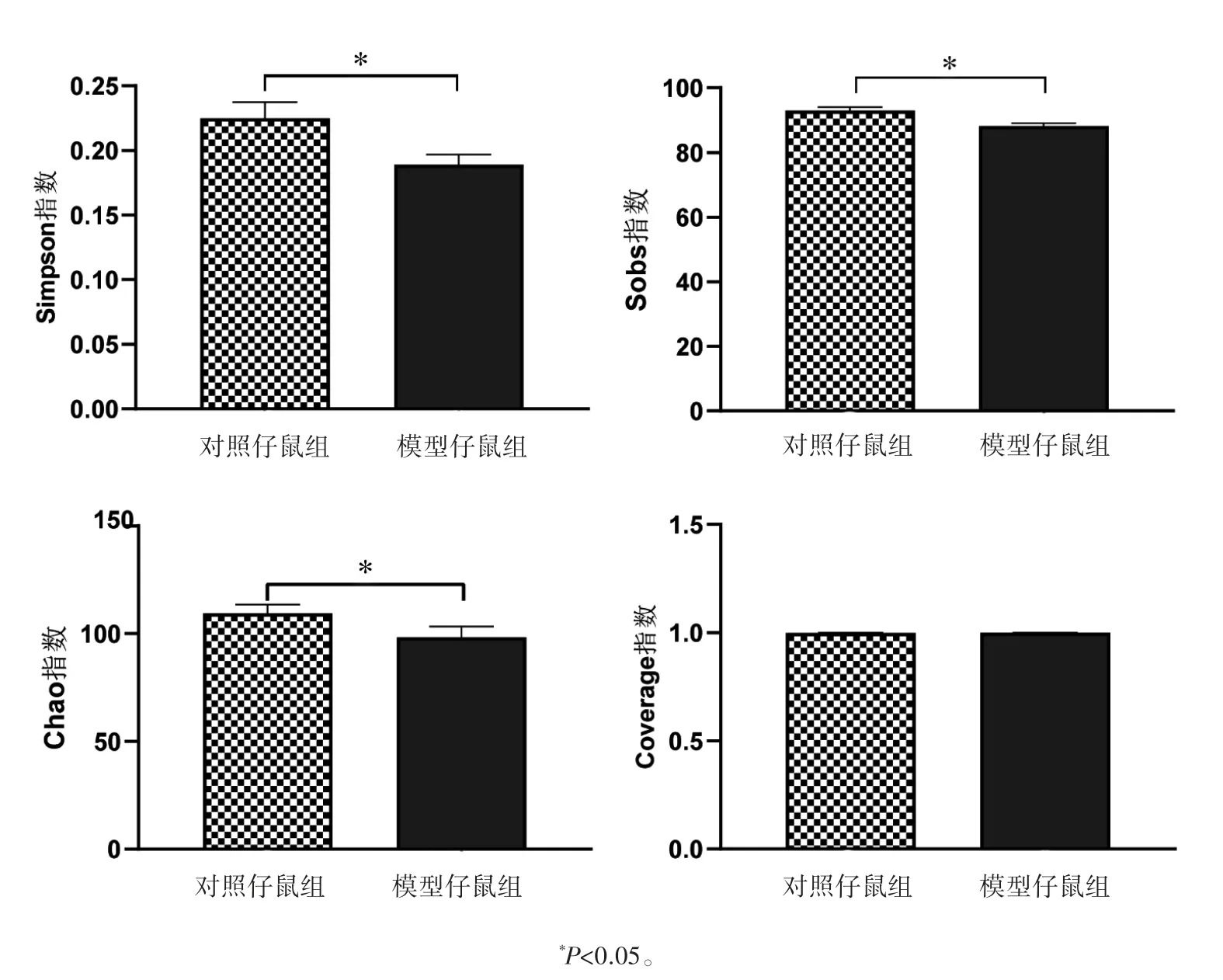
图1 孕期应激仔鼠肠道菌群α多样性分析
2.2.2 子代属水平肠道菌群的物种组成(1)物种组成分析。根据Venn图,对照仔鼠组属水平肠道菌群物种数138种,模型仔鼠组131种,其中两组共有物种数126种,对照仔鼠组独有的物种数为12种,模型仔鼠组5种,模型仔鼠组物种数目少于对照仔鼠组,见图2。(2)群落组成分析。两组属水平肠道菌群构成差异图显示,模型仔鼠组乳酸菌属(Lactobacillus)相对丰度为30.89%,低于对照仔鼠组的35.41%;而模型仔鼠组的norank_f_穆氏杆菌属相对丰度为21.46%,高于对照仔鼠组的19.48%,见图3。
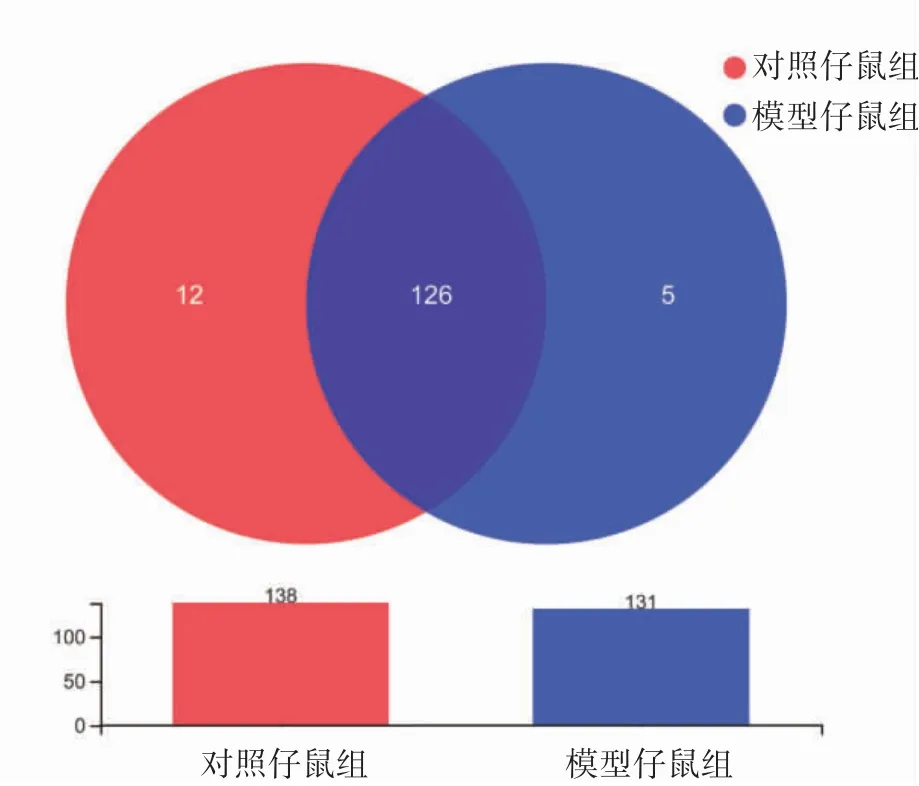
图2 孕期应激子代属水平肠道菌群物种数目及分布Venn图
图3 子代属水平肠道菌群组间构成差异图
2.3 孕期应激对子代短链脂肪酸代谢的影响
模型仔鼠组的粪便代谢物短链脂肪酸中乙酸、丙酸、丁酸、戊酸、异戊酸的含量均高于对照仔鼠组(P均<0.05),见表3。

表3 子代组间短链脂肪酸浓度比较(x±s,μm·mg-1)
2.4 子代肠道菌群与短链脂肪酸含量的相关性
通过RDA解释子代属水平短链脂肪酸与肠道菌群的关系,结果显示,对照组仔鼠组与模型仔鼠组的群落之间有差异,戊酸、异戊酸对肠道菌群的影响相差不大,相比之下,乙酸、丙酸和丁酸对肠道菌群的影响较大。各个短链脂肪酸之间都成锐角提示均呈正相关。通过各样本到箭头的投影点距离看出,不同短链脂肪酸对相同组别不同样本群落分布的影响差别不大。坐标轴中第一排序轴能(RDA1)为84.54%、第二排序轴能(RDA2)为6.23%,表示横、纵轴对肠道菌群变化的解释比例分别为84.54%和6.32%,见图4A。
采用Heatmap图来表示物种丰度前20的肠道菌群与短链脂肪酸之间的相关性,结果显示,Phascolarctobacterium与丁酸呈负相关(r=-0.82,P<0.05),与异戊酸呈负相关(r=-0.82,P<0.05);梭菌属_sensu_stricto_1与丙酸呈正相关(r=0.94,P<0.01),与丁酸呈正相关(r=0.94,P<0.01),与异戊酸呈正相关(r=0.94,P<0.01);普雷沃氏菌属_NK3B31_group与乙酸呈正相关(r=0.81,P<0.05),与戊酸呈正相关(r=0.81,P<0.05),与丁酸呈正相关(r=0.81,P<0.05),与异戊酸呈正相关(r=0.81,P<0.05);双歧杆菌(Bifidobacterium)与丙酸呈正相关(r=0.83,P<0.05),见图4B。
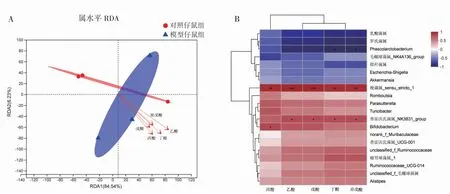
图4 子代肠道菌群与短链脂肪酸含量的相关性
3 讨论
皮质酮是母体孕期应激影响胎儿发育的主要介质,当母体受到应激时,皮质酮浓度升高[8]。本研究结果显示,模型组大鼠第7天、14天测得的血浆皮质酮浓度均高于对照组,表明模型组大鼠处于应激状态,第21天模型组的血浆皮质酮浓度有所下降,可能与孕中、后期下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal,HPA)对应激的适应有关[9]。研究[10]表明,慢性应激开始时,血浆皮质酮水平升高,一段时间后有所降低,与本研究结果相似。
肠道菌群是定植于人体肠道的微生物群落,分为益生菌、致病菌和条件致病菌三类[11]。肠道中菌群分布正常时对维持机体稳态是有益的,一旦菌群失衡,可能会引起机体慢性病的发生[12]。研究[13]表明,孕期应激会改变母代的肠道菌群结构,分娩时羊水中的菌群会定植在婴儿肠道,从而引起子代肠道菌群的改变。本研究通过α多样性分析显示,对照仔鼠组肠道菌群的物种多样性较模型仔鼠组高,模型仔鼠组属水平物种数目要低于对照仔鼠组,物种组成也各不相同,以上均提示孕期CUMS对子代肠道菌群的构成有影响,与王立鹏[14]的研究结果一致。对子代属水平肠道菌群的进一步差异分析显示,模型仔鼠组的乳酸菌属水平下调,而普雷沃氏菌属_NK3B31_group和Akkermansia的水平上调,与冯彦等[15]的研究结果一致。本研究结果显示,普雷沃氏菌属_NK3B31_group与乙酸、异戊酸呈正相关,普雷沃氏菌属的主要发酵物为乙酸、异戊酸等[16],能够解释这一现象,同时也与模型仔鼠组乙酸、异戊酸代谢量升高的结果一致。
短链脂肪酸作为肠道菌群的代谢产物,能够反映宿主与肠道菌群之间的联系[17]。本研究显示,模型仔鼠组的乙酸、丙酸和丁酸的代谢量均增高。产生短链脂肪酸的肠道菌群主要是拟杆菌属、双歧杆菌属、梭菌属和链球菌属[18]。肠道菌群差异分析显示,模型仔鼠组的双歧杆菌属物种丰度高于对照仔鼠组,这可能是导致模型组子代短链脂肪酸代谢量升高的原因。有报道[19]表明,多种环境因子中短链脂肪酸对肠道菌群多样性的影响最大,本研究结果显示,梭菌属_sensu_stricto_1与短链脂肪酸的关联性较强,且均呈正相关,其中乙酸和丁酸与其关联性最强。有研究[20]表明,丁酸主要由梭菌属产生,乙酸有利于产生丁酸的菌群的生长,以上表明肠道菌群与短链脂肪酸有一定的相关性。
综上所述,孕期CUMS会使母鼠的血浆皮质酮含量升高,使其处于应激状态,对子代肠道菌群的物种组成及物种多样性产生影响,从而改变短链脂肪酸的代谢水平。短链脂肪酸作为肠道菌群的代谢产物与肠道菌群存在关联性。
