血清OPG、TNF-α、IL-6水平与糖尿病肾病的关系
2022-02-15张翠平
张翠平
南京中医药大学附属淮安市中医院检验科,江苏淮安 223001
糖尿病肾病(DN)是糖尿病患者主要的微血管并发症之一,随着糖尿病病程的进展,5~10年后有60%~70%的患者会并发DN[1]。DN的发生与糖尿病患者体内生成糖基化终产物、炎症细胞因子聚积、脂质代谢异常及免疫功能异常等因素共同作用有关[2]。骨保护素(OPG)是肿瘤坏死因子(TNF)超家族成员之一,通过结合核因子-κB受体活化因子(RANKL)在成骨细胞分化和吸收中发挥作用。全身和局部的刺激,如炎症因子、激素和细菌产物均会影响OPG/RANKL信号通路。既往研究发现,白细胞介素6(IL-6)是与DN关系密切的炎症因子,OPG与糖尿病心血管事件及DN的发生相关[3-4]。本研究探讨了DN患者血清OPG、TNF-α、IL-6的水平变化及其与DN病程进展的关系。
1 资料与方法
1.1一般资料 选择2016年11月至2018年11月在本院内分泌科住院的2型糖尿病(T2DM)患者123例为研究对象,其中男68例,女55例;年龄35~67岁,中位年龄55岁。纳入标准:T2DM的诊断符合《中国2型糖尿病防治指南(2014年版)》[5]相关标准;无糖尿病急性并发症和急慢性感染。排除标准:合并其他慢性肾脏病、慢性肝病、结缔组织病、肿瘤等。根据尿微量清蛋白(mALB)水平将患者分为糖尿病无肾病组(DM组,mALB<20 μg/min)42例,早期DN组(20 μg/min≤mALB<200 μg/min)40例,临床DN组(mALB≥200 μg/min)41例。另选取30例健康体检者作为对照(NC组)。本研究经本院医学伦理委员会批准,所有研究对象知情同意。
1.2仪器与试剂 OPG、TNF-α、IL-6酶联免疫吸附试验(ELISA)检测试剂盒均购自武汉华美生物工程有限公司,批号分别为CSB-E04692h、CSB-E04740h、CSB-E04638h。iMark 680酶标仪购自美国Bio-Rad公司。SIMENS ADVIA 1200全自动生化分析仪购自德国西门子公司。
1.3方法
1.3.1资料收集 收集各组研究对象的基本临床资料及生化指标,包括性别、年龄、病程、糖化血红蛋白(HbA1c)、三酰甘油(TG)、总胆固醇(TC)、血清肌酐(Scr)、尿素氮(BUN)、尿清蛋白排泄率(UAER)。
1.3.2标本采集 研究对象入院后(健康体检者于体检当日)清晨空腹抽取静脉血5 mL于真空采血管(无抗凝剂)中。室温静置10 min后4 000 r/min离心5 min,吸取上层血清,EP管分装后置于-20 ℃冰箱冻存。
1.3.3OPG、TNF-α、IL-6水平检测 参照试剂盒说明书,采用双抗体夹心法检测血清OPG、TNF-α、IL-6水平。

2 结 果
2.1各组基本临床资料及生化指标比较 各组的性别、年龄比较,差异无统计学意义(P>0.05)。DM组、早期DN、临床DN组的HbA1c、TC、TG、Scr水平均高于NC组,差异有统计学意义(P<0.05)。早期DN组和临床DN组BUN、UAER水平均高于NC组和DM组,早期DN组、临床DN组Scr水平均高于DM组,临床DN组BUN、Scr、UAER水平均高于早期DN组,差异有统计学意义(P<0.05)。早期DN组和临床DN组的病程均长于DM组,差异有统计学意义(P<0.05),见表1。
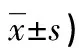
表1 各组基本临床资料及生化指标比较(n/n或
2.2各组血清OPG、TNF-α、IL-6水平比较 早期DN组、临床DN组血清OPG、IL-6水平均高于NC组和DM组,临床DN组血清OPG、IL-6水平均高于早期DN组,差异有统计学意义(P<0.05);临床DN组血清TNF-α水平高于NC组和DM组,差异有统计学意义(P<0.05),见表2。
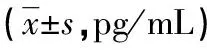
表2 各组血清OPG、TNF-α、IL-6水平比较
2.3血清OPG、TNF-α、IL-6水平间的相关性分析 相关性分析结果显示,血清OPG水平与IL-6水平呈正相关(r=0.597,P=0.02),与TNF-α水平无相关性(r=0.125,P=0.42),血清TNF-α水平与IL-6水平呈正相关(r=0.628,P=0.01)。
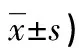
续表1 各组基本临床资料及生化指标比较(n/n或
2.4引起DN发生的危险因素分析 以T2DM患者是否合并DN作为因变量(1为有,0为无),血清OPG、TNF-α、IL-6作为自变量,进行Logistic回归分析,结果显示,血清IL-6、OPG、TNF-α水平升高是引起DN发生的危险因素(P<0.05),见表3。
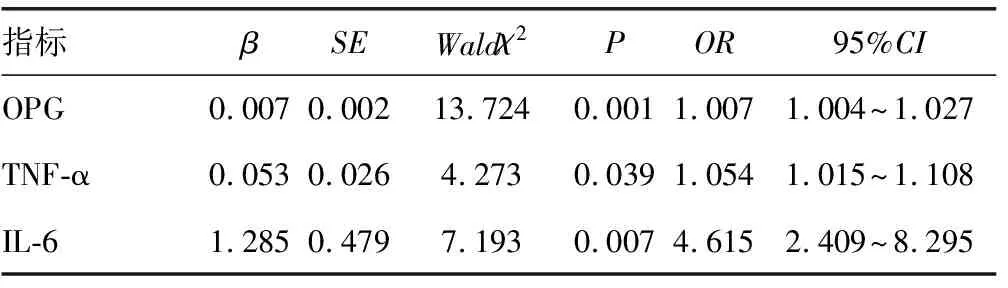
表3 Logistic回归分析结果
3 讨 论
糖尿病患者体内的糖基化终产物可刺激肾脏固有细胞表达和释放TNF-α增多,进而诱导IL-6等炎症因子生成增加,引起肾小球炎症、肾小球系膜细胞增生、肾小球基底膜变厚、肾小球硬化和肾间质纤维化。有研究认为,多种炎症因子与DN的发生、发展关系密切[6]。金徽等[7]发现,金叉石斛可通过抑制糖尿病大鼠肾组织中核因子-κB(NK-κB)的活化,降低IL-6的表达,对糖尿病大鼠肾脏组织起到保护作用。DN患者体内高水平的TNF-α、IL-6与肿瘤坏死因子相关凋亡诱导配体(TRAIL)在患者体内表达增加有关,提示NK-κB介导的炎症信号通路作用于DN的病情发展[8]。有研究发现,DN患者血清IL-6水平升高,且与HbA1c水平呈正相关,参与了DN的发生、发展,其机制可能是肾脏损伤后刺激机体IL-6水平升高,IL-6与相关受体结合后刺激系膜细胞增殖,使肾小球受损加剧,引起肾脏结构和功能异常,IL-6可作为DN患者病情严重程度评估的参考指标[9-10]。动物实验证实,消渴平合剂可能通过抑制肾脏NK-κB、p65、IL-6基因和蛋白表达,从而降低db/db小鼠糖化血清蛋白及血脂水平[11]。本研究中,早期DN组、临床DN组血清IL-6水平高于DM组、NC组,临床DN组血清IL-6水平高于早期DN组,差异有统计学意义(P<0.05),提示血清IL-6水平随着DN病情进展逐渐升高,与DN的发生、发展有关,与上述研究结果类似。
OPG是由动脉血管平滑肌细胞和内皮细胞产生的可溶性分泌糖蛋白,在骨代谢调节中起重要作用。OPG还是血管钙化的一个重要调节因子,对血管钙化和内皮细胞的存活起保护作用。血清OPG水平升高与1型糖尿病患者冠状动脉病变和肾脏损伤相关[12]。DN患者血清OPG水平升高可能是一种代偿性的防御机制,通过促进肾脏毛细血管内皮细胞的增殖,减少凋亡,避免内皮细胞的进一步受损,起到血管保护作用。本研究中,早期DN组、临床DN组血清OPG水平高于DM组、NC组,临床DN组血清OPG水平高于早期DN组,差异有统计学意义(P<0.05),提示血清OPG水平随着DN病情进展逐渐升高,与DN的发生、发展有关。
本研究中,血清TNF-α对肾损伤的严重程度反应较为不敏感,仅是临床DN组血清TNF-α水平与DM组、NC组比较,差异有统计学意义(P<0.05),而早期DN组与DM组血清TNF-α水平比较,差异无统计学意义(P>0.05)。本研究相关性分析结果显示,血清OPG、TNF-α水平均与IL-6水平呈正相关。 PACIFICO等[13]研究发现,OPG有强大的抗炎能力,与炎症因子TNF-α、IL-6的表达呈正相关,与本研究结果类似。Logistic回归分析结果显示,血清IL-6、OPG、TNF-α水平升高是引起DN发生的危险因素(P<0.05),进一步提示上述3项指标与DN的发生有关。本研究存在一定的不足之处,纳入的样本量较少,且未对3项指标对DN的预测价值、预后评估价值等进行分析,后期将进行大样本量的临床研究进一步验证。
