肿瘤免疫治疗相关的继发性噬血细胞综合征1例诊治分析
2022-02-15单锦露
杜 佳,李 钱,李 娟,单锦露
陆军特色医学中心肿瘤科,重庆 400042
噬血细胞综合征(HPS)又称噬血细胞性淋巴组织细胞增多症(HLH),是一组由细胞因子风暴引起的淋巴细胞、单核细胞和巨噬细胞增生和活化,伴随吞噬血细胞现象的过度全身炎症反应综合征[1-3]。根据病因可分为原发性HPS和继发性HPS,原发性HPS通常通过常染色体隐性遗传,继发性HPS可能与感染、恶性肿瘤、自身免疫性疾病或药物使用有关[2-6]。HPS在临床上较为少见,病死率高。本文报道了1例肿瘤免疫治疗相关的继发性HPS,以期为临床诊疗提供参考。
1 临床资料
1.1基本情况 患者男性,69岁,因“肺腺癌伴胸腰椎转移第2次免疫治疗后35 d”于2019年10月8日入院。既往高血压30年余,血压控制可;吸烟指数1 000。2019年6月15日患者因腰部持续胀痛行脊椎MRI示:T4、T5、T11及L2椎体转移癌。胸部CT示右肺上叶包块,纵隔多发淋巴结肿大。2019年6月20日行T11、L2椎体活检及椎体成形术,术后病理示:T11、L2椎体转移性腺癌,表皮生长因子受体(EGFR)野生型。2019年7月15日行胸部增强CT 示:右肺上叶后段占位(3.0 cm×2.4 cm);右侧锁骨上窝、肺门、纵隔淋巴结转移;多发骨转移、双侧肾上腺转移。头颅MRI示:多发腔隙性脑梗死,脑萎缩。病理检查:T11、L2椎体转移性低分化腺癌,细胞程序性死亡配体1(PD-L1) 80%阳性。结合美国国立综合癌症网络(NCCN)指南,建议行免疫治疗,但患者因家庭条件困难拒绝免疫治疗而选择全身化疗。2019年7月18日予第1周期化疗(培美曲赛二钠+卡铂),化疗后胃肠道反应AE3级,贫血AE2级。因化疗不良反应明显,患者拒绝化疗。随后于2019年8月12日及9月3日予免疫治疗(信迪利单抗注射液200 mg),9月5日行椎体转移病灶放疗(3GY/10F)后腰部疼痛缓解。入院诊断:右肺上叶后段周围型腺癌(cT1cN3M1c ⅣB期、EGFR野生型、PD-L1 80%阳性);多发骨转移癌;双侧肾上腺转移癌。
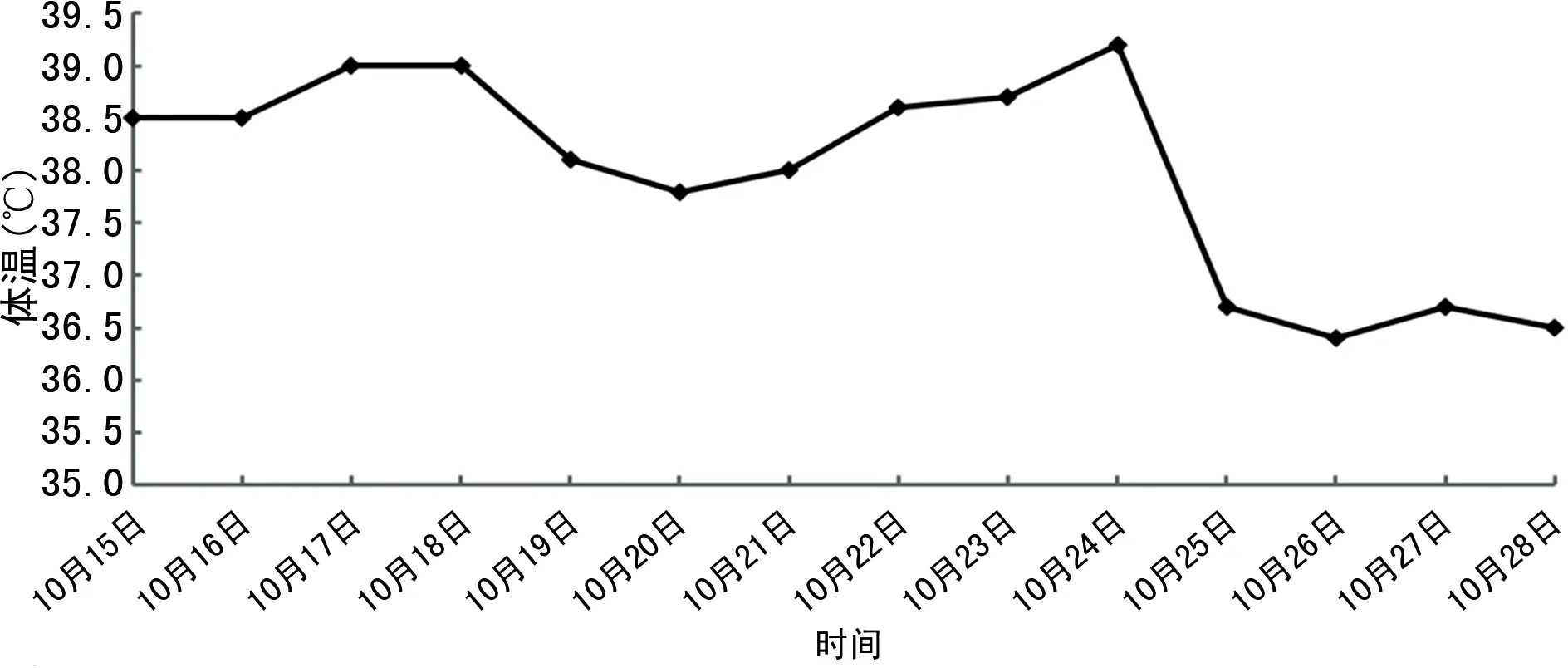
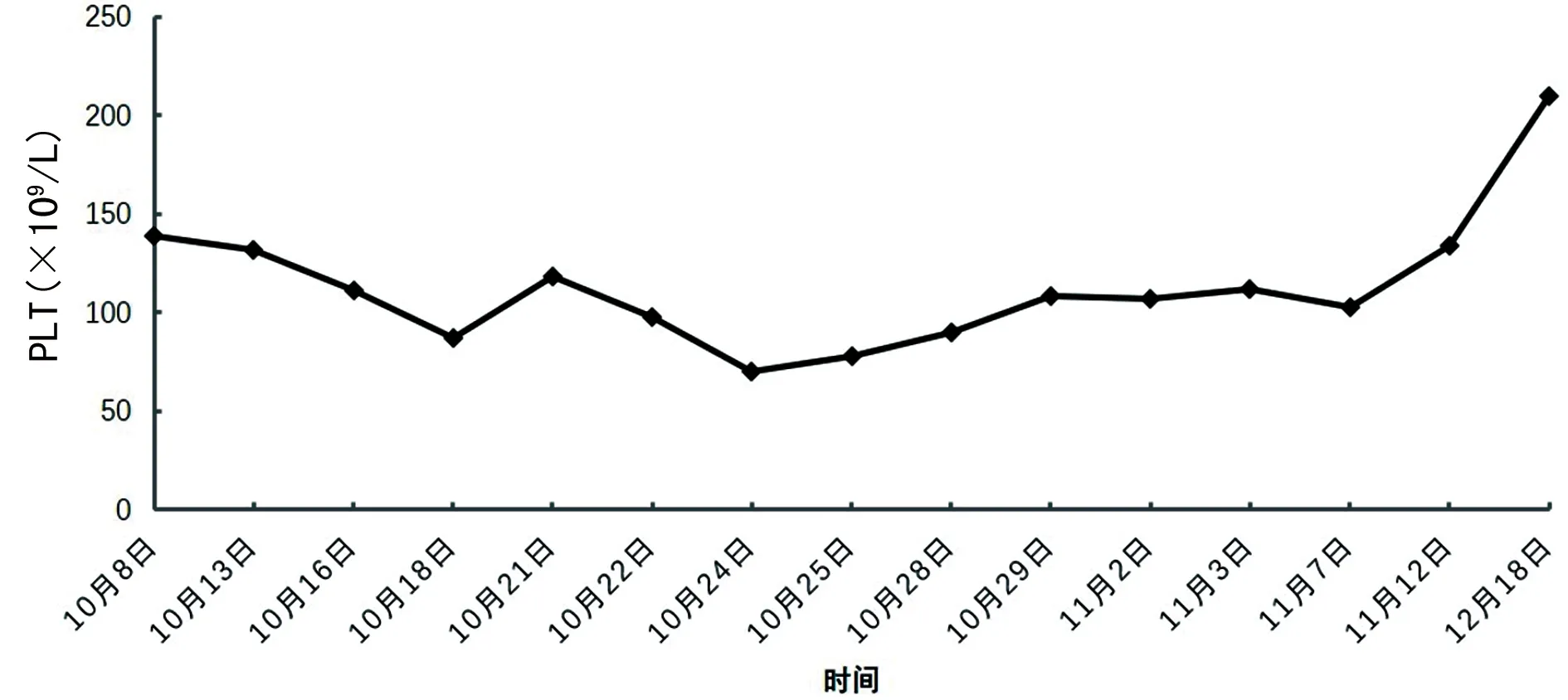
1.2病情变化 患者入院第2天晨间突发短暂意识丧失,随后出现反应迟钝及认知功能差。头颅MRI示腔隙性脑梗死灶增多;动态心电图提示窦性心律、频发房性早搏,按神经内科及心内科会诊意见对症处理后反应迟钝及认知功能差未改善。于2019年10月15日开始持续发热(图1),最高体温39.2 ℃,血常规示白细胞计数及中性粒细胞百分比在正常范围内,白细胞介素(IL)-6为61.26 pg/mL,降钙素原水平正常。胸部增强CT示:双肺慢性炎症,肺部肿瘤病灶较前缩小,肿瘤评估为部分缓解(PR),见图2。给予抗菌药物治疗后患者发热未能有效控制,同时血红蛋白(Hb)水平呈逐渐下降趋势,最低降至39 g/L(图3,国际组织细胞协会HLH-1994方案治疗前)。查溶血全套均为阴性,特异性抗体筛查抗-P1阳性,请输血科会诊,予输注经抗-P1处理后的红细胞悬液,但患者贫血未改善。血小板计数(PLT)也呈逐渐下降趋势(图4,HLH-1994方案治疗前),升血小板药物治疗无效。此外,患者全身皮肤及巩膜逐渐黄染,并持续加重,小便呈茶色;总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)水平升高,清蛋白(ALB)水平下降(表1,HLH-1994方案治疗前);尿常规示隐血试验阳性,尿蛋白阳性。请消化科会诊,予保肝、退黄治疗后皮肤黄染未改善,肝功能相关指标水平持续高于正常。
注:10月24日开始采用HLH-1994方案治疗。
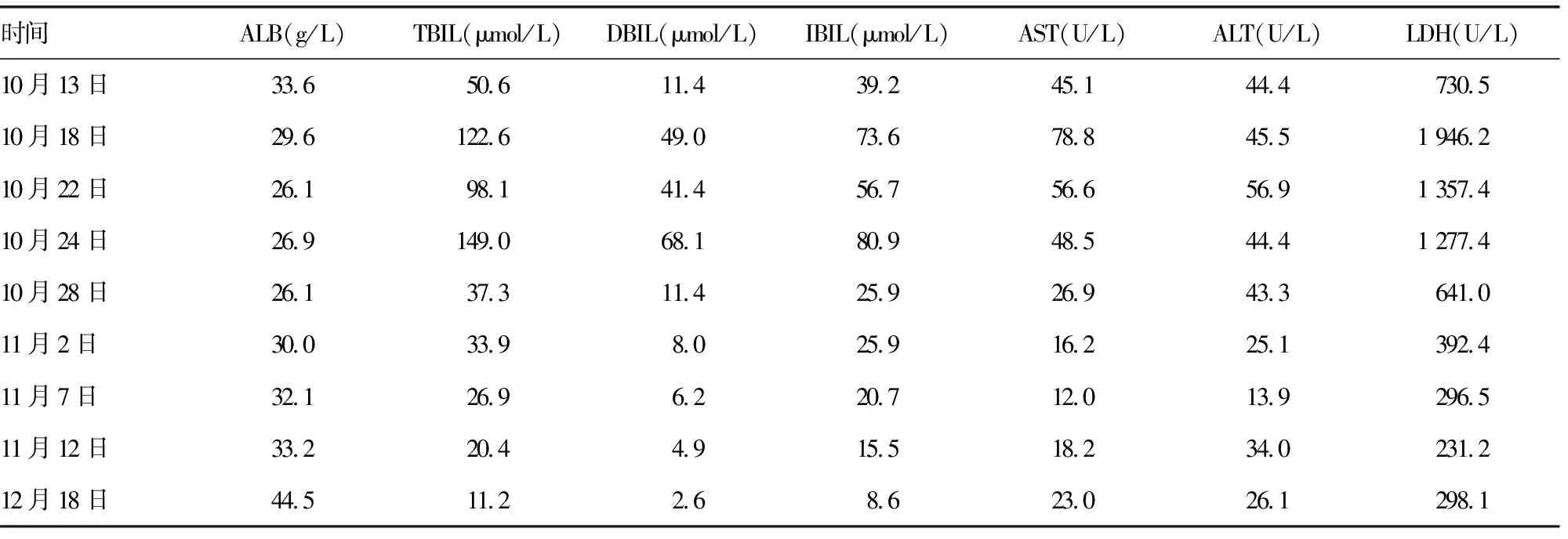
表1 肝功能指标水平变化趋势
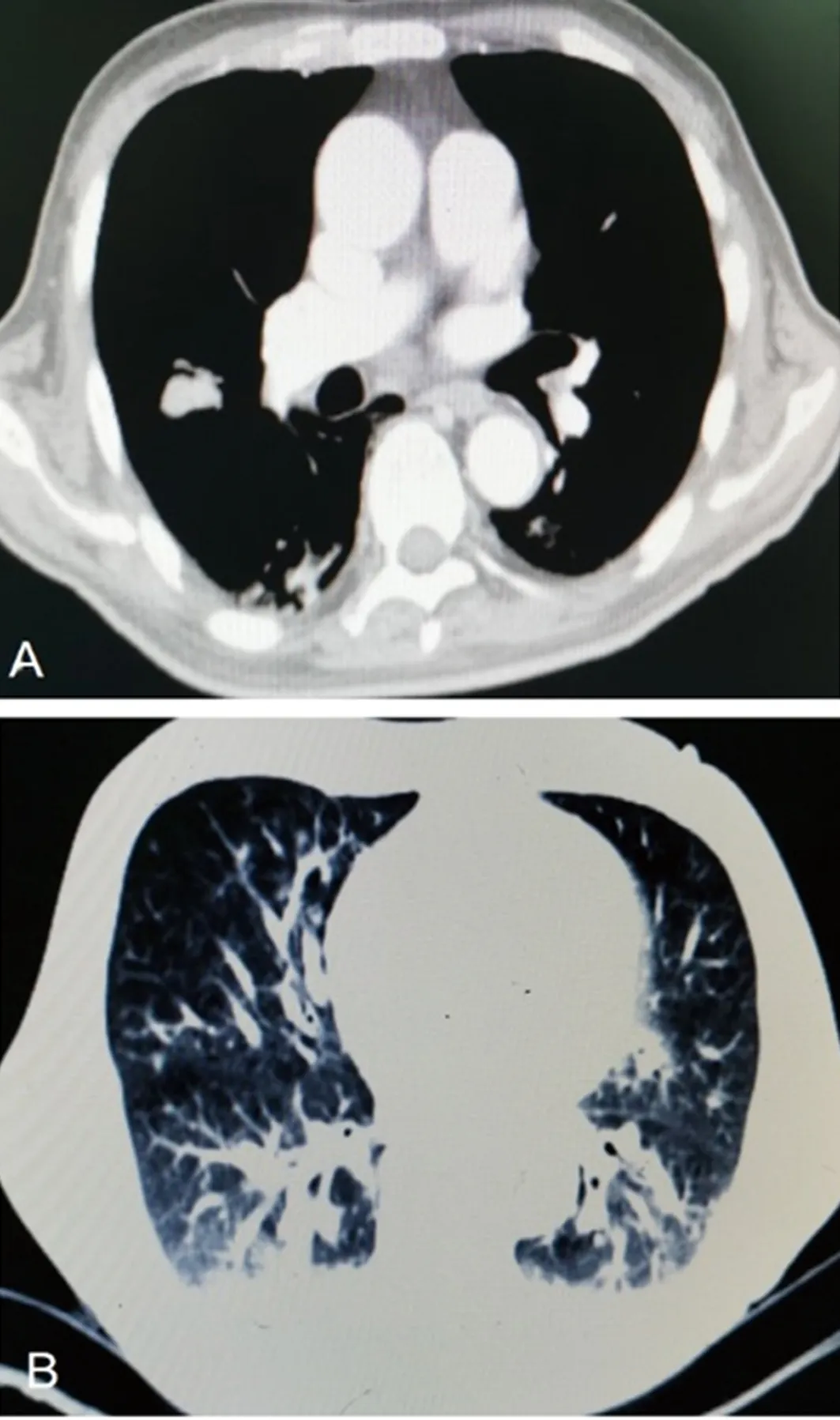
注:A为纵隔窗;B为肺窗。

注:10月24日开始采用HLH-1994方案治疗。
1.3诊断 2019年10月22日行骨髓穿刺细胞学检查,结果示:增生性贫血骨髓象,可见噬血细胞,见图5A。IL-2受体1 636 U/mL,铁蛋白>1 500 ng/mL。结合HLH-2004方案相关诊断标准[6],诊断为继发性HPS。
1.4治疗 于2019年10月24日予HLH-1994方案治疗[VP-16:第1、2周150 mg/m2,2次/周,第3~8周150 mg/m2,1次/周;地塞米松:第1、2周10 mg/(m2·d),第3、4周5 mg/(m2·d),第5、6周2.5 mg/(m2·d),第7周1.25 mg/(m2·d),第8周减量至停药]。
注:10月24日开始采用HLH-1994方案治疗。

注:A为治疗前;B为治疗后。
1.5疗效评价 经HLH-1994方案治疗后,患者认知功能恢复,体温逐渐降至正常(图1),皮肤及巩膜黄染消失,异常指标逐渐恢复正常。治疗结束后于2019年12月18日再次行骨髓穿刺细胞学检查,未见噬血细胞(图5B)。治疗后,Hb水平及PLT逐渐恢复正常(图3、4),ALB、TBIL、DBIL、IBIL、ALT、AST、LDH(表1)及IL-2受体水平逐渐恢复正常(图6)。胸部增强CT提示肺部病灶进一步缩小(图7),疗效评估为PR。
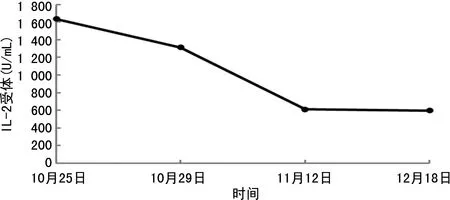
图6 IL-2受体水平变化趋势图
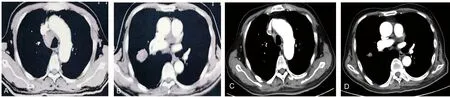
注:A、B为2019年7月15日检查结果;C、D为2019年12月18日检查结果。
2 讨 论
HPS是由失控的免疫反应过度激活引起的疾病,临床以持续高热、肝脾大、全血细胞减少及在骨髓、肝脾、淋巴组织中发现噬血现象为主要特征[7]。原发性HPS 70%发生于1岁以内婴幼儿,甚至可在出生前发病,出生时即有临床表现。继发性HPS以成人多见,与感染、肿瘤、风湿免疫性疾病、免疫治疗、妊娠、器官和造血干细胞移植、代谢性疾病等因素有关[8-9]。HLH-2004方案中的诊断诊断是目前国际上广泛采用的HPS诊断标准[6],满足以下2条中的任意一条可诊断为HPS:(1)发现HPS相关的分子遗传学异常(PRF1、UNC13D、STXBP2、RAB27A、STX11、SH2D1A、XIAP);(2)符合下列8项临床标准中的5项,①发热超过1周,高峰值在38.5 ℃以上;②脾大;③两系或三系血细胞减少(Hb<90 g/L,PLT<100×109/L,中性粒细胞计数<1.0×109/L);④三酰甘油水平升高(≥3.0 mmol/L)和(或)纤维蛋白原水平下降(≤1.5 g/L);⑤血清铁蛋白水平升高(≥500 μg/L);⑥IL-2受体水平升高;⑦自然杀伤(NK)细胞活性下降或缺乏;⑧骨髓、脾、脑脊液或淋巴结活检发现噬血细胞,未见恶性肿瘤细胞。此外,出现黄疸、转氨酶增高、低蛋白血症、LDH水平升高亦支持HPS的诊断。本例患者存在发热,体温>38.5 ℃持续超过7 d,骨髓中查见噬血细胞,Hb水平及PLT下降,铁蛋白及IL-2受体水平升高;其他异常临床表现包括皮肤、巩膜黄染,转氨酶及LDH水平升高,低蛋白血症,血尿及尿蛋白阳性等。经多学科会诊,排除颅内器质性病变、消化道疾病、感染性及溶血性疾病、肿瘤进展等因素,最终诊断为继发性HPS。
免疫检查点抑制剂成为治疗各晚期肿瘤的新方法,但其引起的不良反应亦不容忽视。TAKESHITA等[10]报道了1例63岁鳞状非小细胞肺癌晚期患者在三线化疗后病情进展,予以纳武利尤单抗治疗后出现HPS、间质性肺炎和疑似Stevens-Johnson综合征。SATZGER等[11]报道了1例26岁转移性黑色素瘤患者在使用纳武利尤单抗加伊匹单抗治疗期间出现HPS。MASOOD等[12]报道了1例58岁转移性黑色素瘤患者在接受帕博利珠单抗治疗后出现发热、贫血、血小板减少、高三酰甘油血症、高铁蛋白血症、NK细胞活性降低,最后诊断为继发性HPS。本例患者既往无风湿免疫性疾病、器官和造血干细胞移植、代谢性疾病等病史,肿瘤评估为PR,有细胞程序性死亡受体1抑制剂治疗史,考虑该例继发性HPS与免疫治疗相关。因此,当免疫治疗后出现血液学异常时,应将HPS纳入进行鉴别诊断。
HPS最初症状可能不典型,进展快,病死率高,及时开始适当的治疗对提高患者的生存率至关重要。根据HLH-1994和HLH-2004方案的前瞻性临床研究结果和国际组织细胞协会的最新意见[6],推荐诱导治疗期使用HLH-1994方案。HLH-1994方案治疗1周后患者发热、反应迟钝、皮肤及巩膜黄染等临床症状逐渐改善。治疗结束后复查骨髓细胞学未见噬血细胞,血常规、IL-2受体水平及肝功能等恢复正常,临床疗效评估为PR。
HPS是一种免疫介导的危及患者生命的疾病,在恶性肿瘤或免疫治疗的患者中,当出现持续发热、外周血两系或者三系减低、高铁蛋白血症、IL-2受体水平升高、抗菌药物治疗无效的情况时,需警惕HPS。免疫治疗虽然给肿瘤患者带来了很大的生存获益,但对其免疫毒性的认识及管理仍需临床加以重视。
