MMP-2促进肌源性间充质干细胞成骨分化的实验研究
2022-02-15朱忠胜殷诺张东肖海军薛锋
朱忠胜,殷诺,张东,肖海军,薛锋
(上海市奉贤区中心医院骨科,上海 201406)
多年来,临床上治疗大段骨缺损缺少理想的方法。而纳米生物材料、3D打印生物材料、基因治疗、外泌体组织工程等新型骨组织工程学的快速发展为大段骨缺损治疗带来了新的希望[1-4]。基质金属蛋白酶(matrix metalloproteinase,MMP)是一组锌与钙离子依赖性的肽链内切酶家族,在干细胞迁移和肿瘤转移行为过程中发挥重要的调节作用[5-8],但其在干细胞成骨分化中的作用尚不明确。本课题组前期研究结果提示肌源性间充质干细胞具有良好的成骨分化能力和促进骨修复的作用[9],同时发现MMP-2在肌肉异位骨化中高表达,在肌源性间充质干细胞抗凋亡实验中发现了MMP-2存在显著的表达变化,并且抑制MMP-2表达后肌源性间充质干细胞的细胞活力明显降低,提示MMP-2在肌源性间充质干细胞成骨及骨修复过程中可能具有重要的调控作用。本研究采用大鼠肌肉原代分离出的肌源性间质干细胞,通过构建MMP-2过表达及干扰载体,观察MMP-2对肌源性间充质干细胞成骨分化及钙结节形成的影响。
1 资料与方法
1.1 材料 I型胶原酶(YEASEN),胰蛋白酶(北京中杉金桥),青-链霉素(杭州吉诺),Dulbecco氏培养基(Dulbecoo's modified eagle medium,DMEM)/F12培养液(GIBICO),胎牛血清(GIBICO),磷酸盐缓冲液(phosphate buffered saline,PBS)(北京天根),多聚赖氨酸(碧云天),CD44/90/29/105抗体(Abcam),CD106/45抗体(Abcam),Runt相关转录因子2(Runt related transcription factor 2,RUNX2)抗体(Abcam)、碱性磷酸酶(alkaline phosphatase,ALP)抗体(Santacruz),骨钙素(osteocalcin,OCN)抗体(Abcam),β-actin抗体(Abcam公司),逆转录聚合酶链式反应(reverse transcriotion-polymerase chain reaction,RT-PCR)试剂盒(TAKARA),RNA提取试剂Trizol(Ambion),逆转录试剂盒(TAKARA),质粒DNA提取试剂盒(北京天根),限制性内切酶(Thermo Fisher),茜素红染色试剂盒(Sigma),成骨诱导液(Thermo Fisher)。流式细胞仪(BD),倒置显微镜(Olympus)。
1.2 方法
1.2.1 肌源性间充质干细胞的原代分离培养及鉴定 (1)取4周雄性SD大鼠脱颈处死;(2)消毒后切取右后肢股四头肌约2 g,剪成肉糜状;(3)PBS液冲洗3次去除上清;加入2~3倍体积0.10% Ⅰ型胶原酶,置入37℃水浴消化40 min(其间吹打数次);(4)离心,吸除上清,加入2~3倍体积的0.25%胰蛋白酶-乙二胺四乙酸(ethylene diaminetetraacetic acid,EDTA),37℃水浴消化20 min(其间吹打数次);(5)加入含20%胎牛血清(fetal bovine serum,FBS)的DMEM/F12培养液2~3 mL终止消化,同上法离心5 min;(6)吸除上清,加入含20% FBS的DMEM/F12培养液重悬细胞,所得细胞悬液用100、200、400目滤网依次过滤,将滤液置入未经多聚赖氨酸处理的培养瓶中,使之贴壁;(7)1 h后将未贴壁的细胞转入新的经多聚赖氨酸包被的培养皿中,继续培养。4 d后首次换液,以后2~3 d换液1次;(8)待细胞生长达70%融合后,用0.25% 胰蛋白酶消化,按1︰2比例进行传代;(9)取传达2代后培养的细胞进行流式检测:CD90(+)、CD105(+)、CD44(-)、CD45(-),检测确定后进行传代培养。
1.2.2 MMP-2过表达及干扰载体的构建 (1)过表达载体Plvx-IRES-ZsGreen1-MMP-2的构建:根据美国国家生物技术信息中心数据库中MMP-2 (NM_031054.2)序列信息设计并合成PCR引物,上游为AATTCCTCGAGACTAGTTATGGAGGCACGATTGGTCTG,下游为ATCCGCGGCCGCTCTAGTCAGCAGCCCAGCCAGTC。以含目的基因MMP-2的cDNA为模板,进行PCR扩增MMP-2基因,再以目的基因PCR产物和Plvx-IRES-ZsGreen1载体进行酶切及回收,并进行质粒验证;(2)干扰质粒Plvx-shRNA2-sh-MMP-2的构建:设计并合成引物,合成单链 DNA oligo,把片段1、片段2干粉溶解于退火缓冲液中(100 μL),90℃,5 min,然后自然冷却至室温,使其复性成双链。Plvx-shRNA2载体BamHI和EcoRI双酶切及回收、连接转化、质粒抽提,最后测序鉴定。
1.2.3 免疫蛋白印迹(western blot,WB) 检测上调和下调MMP-2表达后肌源性间充质干细胞成骨分化标志蛋白(RUNX2、OCN、ALP)表达的影响。分别于第1天、第7天、第14天收集肌源性间充质干细胞,加入细胞裂解液,12 000 rpm,4℃离心5 min,提取上清液。常规电泳、转膜,封闭,分别加入一抗RUNX2、OCN、ALP (1︰1 000)杂交。以β-actin为内参。
1.2.4 茜素红染色 (1)收集经过质粒转染的对数生长期的肌源性间充质干细胞,用胰酶消化1~2 min,在倒置显微镜下观察消化后细胞的形态变化,当有少量细胞悬浮时弃掉消化液,加入2~4 mL培养液终止消化,吹打分散细胞;(2)用血球计数板计数,24孔板加入爬片,每孔2×104个细胞,设3个重复,根据实验需要培养加入成骨诱导液第7天、第14天时进行染色;(3)在每个时间点先轻轻弃除培养液,PBS冲洗3次。加入95%酒精固定30 min;(4)将茜素红染液用0.22 μm滤纸过滤,加入染液覆盖住底孔,室温染色放置5 min;(5)PBS漂洗3次。风干,甘油明胶封片;(6)显微镜观察拍照。
1.3 统计学分析 应用SPSS 22.0统计学软件对数据进行分析。计量资料组间比较采用独立t检验或者方差分析,计数资料组间比较用Fisher确切概率法检验,P<0.05为差异有统计学意义。
2 结 果
2.1 肌源性间充质干细胞原代分离培养及鉴定 肌源性间充质干细胞的形态学观察:取原代培养的细胞接种于培养皿后,分别于培养0 d、1 d、7 d镜下观察,镜下可见大量大小不一的圆形细胞悬浮于培养液中。培养1d后开始有细胞贴壁生长,呈多边形、梭形,分散在培养皿贴壁生长;培养7 d后细胞排列较整齐,融合成片生长,形态一致,呈长梭形,融合率达70%(见图1)。肌源性间充质干细胞表面标记物检测:流式细胞仪检测结果显示,第3代大鼠肌源性间充质干细胞表面标记物CD90、CD105阳性率均高于90%,而CD44、CD45阳性率均低于1%,这提示我们所分离得到的细胞即为具有干细胞特征的大鼠肌源性间充质干细胞(见图2)。

图1 培养0 d、1 d、7 d后肌源性间充质干细胞的形态特征(×100)

图2 肌源性间充质干细胞原代分离培养的流式细胞鉴定
2.2 MMP-2过表达及干扰载体的构建及转染成功的肌源性间充质干细胞 根据MMP-2的全长序列,设计3条相应的shRNA序列及相应的对照序列,分别为sh-MMP-2-1、sh-MMP-2-2和sh-MMP-2-3。WB实验检测结果提示sh-MMP-2-2对于MMP-2的表达干扰作用最好(见图3a),被选作为后续实验中干扰MMP-2的shRNA序列;同时相较于对照组,MMP-2的过表达质粒转染细胞后结果提示MMP-2的表达明显上调,这对于后续研究MMP-2影响肌源性干细胞成骨分化及相关蛋白表达奠定了基础(见图3b)。
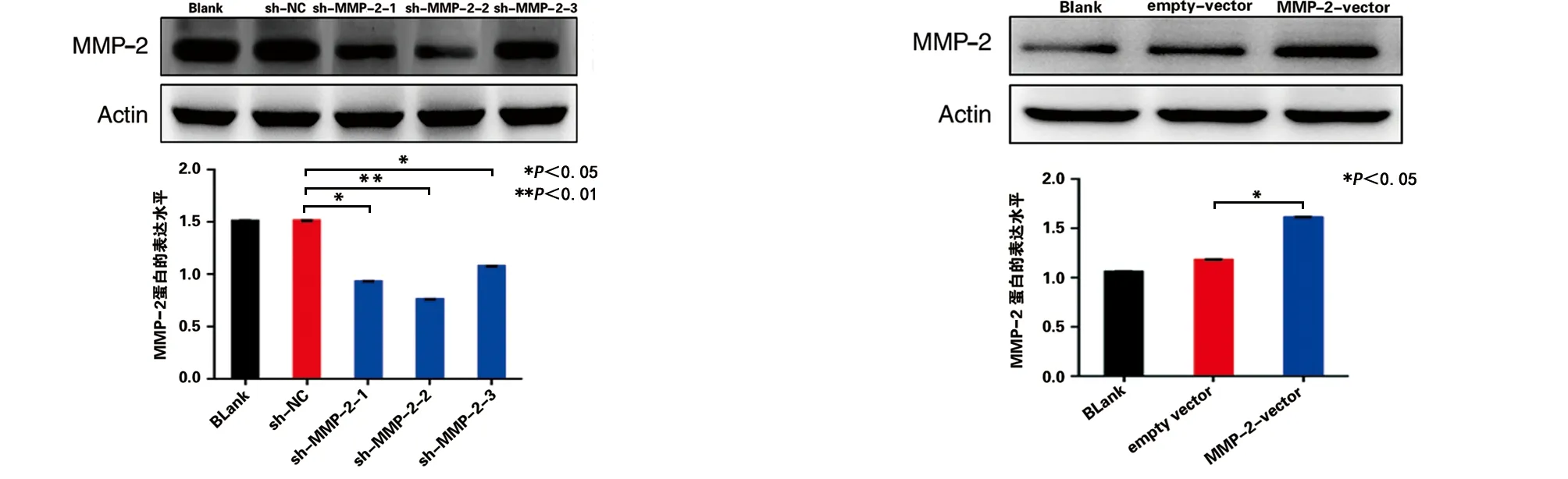
a sh-MMP-2明显下调细胞中MMP-2的表达水平 b 过表达质粒明显上调MMP-2的表达
2.3 MMP-2促进肌源性间充质干细胞的成骨基因的表达 WB检测各时相肌源性间充质干细胞中成骨因子表达水平:转染shRNA或者MMP-2的过表达质粒,干预肌源性间充质干细胞中MMP-2的表达后,继续培养细胞,分别在第1天、第7天、第14天采用WB检测细胞中成骨基因RUNX2、OCN、ALP的表达水平。结果与阴性对照组相比较,干扰MMP-2的表达后在第1天、第7天、第14天,RUNX2、OCN、ALP的表达明显下调(P值分别为0.037、0.038、0.033,均<0.05),而过表达MMP-2后RUNX2、OCN、ALP的表达随之明显上调(P值分别为0.02、0.03、0.01,均<0.05),这提示MMP-2可能通过促进成骨分化相关蛋白RUNX2、OCN、ALP的表达促进肌源性间充质干细胞的成骨过程,具体分子机制有待进一步阐明(见图4)。

a 培养1 d b 培养7 d c 培养14 d
2.4 MMP-2促进肌源性间充质干细胞钙结节的形成 对肌源性间充质干细胞分别转染MMP-2过表达质粒或shRNA后,于第7天和第14天进行茜素红染色,结果显示对照组、过表达组、干扰组细胞在培养第7天时组间茜素红染色差异不大(P>0.05);但是,在培养14 d时过表达组的茜素红染色钙结节最多,干扰组最少,组间比较差异具有统计学意义(P<0.05,见图5)。

图5 茜素红染色检测钙结节形成情况(茜素红染色,×100)
3 讨 论
3.1 肌源性间充质干细胞的作用 肌源性间充质干细胞具有一般干细胞的特点,可以自我更新、繁殖产生更多的干细胞,同时也可以分化成各种各样的具有特定功能的细胞,既可以向成肌细胞方向分化,也可向成骨细胞方向分化[10]。肌源性间充质干细胞作为组织工程的种子细胞,来源广,易获取,既没有胚胎干细胞的伦理问题,也没有骨髓间充质干细胞(bone marrow-mesenchymal stem cells,BM-MSCs)的来源受限问题,因为成年人肌肉组织约占体重的35%~45%[11-12]。众多的研究表明,肌源性干细胞能够分化成软骨和骨,可以直接参与骨折愈合。肌源性干细胞在与骨膜损伤更严重的骨折中的作用尤为重要[13-16]。研究指出肌源性间充质干细胞不仅能直接参与骨组织的修复,同样也可以通过BM-MSCs类似的作用促使旁分泌因子的分泌影响骨修复[17]。
3.2 MMP的作用 MMP是一组锌与钙离子依赖性的肽链内切酶家族。家族所有成员具有一些共同的氨基酸序列和结构域,通过其某个区的增减修饰而形成不同的MMP。根据其结构和作用底物不同可分为6大类:胶原酶、明胶酶、溶基质素、溶间质素、膜型MMP和其他MMPs[5]。它们的生物学功能主要是降解细胞外基质蛋白质。在多种组织和细胞中均有表达,肿瘤细胞、上皮细胞、内皮细胞、角质细胞、骨骼肌细胞、神经细胞、成纤维细胞等都表达不同类别的MMPs。在许多正常的生理过程,如胚胎发育、形态形成、再生与组织愈合,它们都发挥着重要的功能[6-7]。它们也参与许多病理过程,如关节炎、癌症以及心血管疾病等[18-20]。
已有研究报道多种MMPs在人BM-MSCs中表达,干细胞MMPs的表达变化影响干细胞微环境,在干细胞迁移和多种分化行为过程中起着重要调节作用[21]。BM-MSCs向成骨分化过程中表达包括MMP-2、细胞膜型1-MMP(membrane type 1 metalloprotease,MT1-MMP)在内的多种MMPs。Schneider等[22]证明脐带来源的间充质干细胞在分化为成骨细胞的过程中表达MMP-1和MMP-2,这些MMPs在骨代谢和骨形成过程中可能起重要作用。
3.3 MMP-2促进成骨的作用及意义 本实验采用原代培养方法分离出肌源性间充质干细胞,通过构建MMP-2过表达和干扰载体,上调和下调肌源性间充质干细胞中的MMP-2表达,进而检测肌源性间充质干细胞成骨相关基因的表达变化及其对成骨分化的影响。研究发现MMP-2能够促进肌源性间充质干细胞的成骨分化,同时能够促进钙结节的形成,从一定程度上提示MMP-2在干细胞成骨分化中可能发挥重要作用。骨骼肌来源的细胞应用于骨和软骨组织修复和再生的研究已经取得了长足的进展,由于骨骼肌获得方便及实用性,将有助于骨折及大段骨缺损修复的临床研究[23],但其具体分子调控机制有待进一步研究。伴随着骨组织工程技术的不断成熟,可能为其广泛的临床应用提供一定的理论支撑。
