帕金森病病人血清瘦素水平与抑郁症的相关性
2022-02-15牛晓露朱岩岩李合华
牛晓露,刘 丽,常 利,朱岩岩,李合华
帕金森病(Parkinson′s disease,PD)是一种神经系统变性疾病,个体的遗传易感性、环境及免疫等多种因素共同介导PD的发病,但具体发病机制尚不清楚[1-2]。瘦素是机体脂肪组织中合成的一种相对分子量为16 kDa的蛋白质,可穿过血脑屏障并广泛分布于中枢神经系统[3],可通过活化多种信号途径抑制多巴胺能神经元的退行性改变,进而降低PD的发病风险[4]。有研究证实,瘦素和抑郁症也具有一定相关性,低水平的瘦素可能会促进抑郁症的发生[5-6]。本课题组前期研究结果证实,PD病人血清瘦素水平明显低于健康对照者[7]。目前,关于PD合并抑郁症和瘦素的相关性研究报道较少,本研究在前期研究的基础上,进一步扩大样本量来探讨两者之间的相关性。现报道如下。
1 资料与方法
1.1 临床资料 回顾性纳入2015年1月—2019年6月于新乡医学院第一附属医院神经内科住院的PD病人263例作为PD组,74例PD合并抑郁症病人作为PD合并抑郁症组(PDD组),45名体检健康者作为对照组。PD组纳入标准参考2016年中华医学会神经病学分会帕金森病及运动障碍学组制定的诊断标准[8]。
PD合并抑郁症诊断符合美国精神障碍诊断与统计手册第4版(DSM-Ⅳ)轴Ⅰ障碍定式临床检查(SCID/I)中关于抑郁症的诊断标准,且至少2周内未服用过任何抗抑郁药,入院时均由专人根据病史、临床表现及汉密尔顿抑郁量表(HAMD-24项)进行抑郁症诊断。PD组,男130例,女133例,年龄(63.25±14.49)岁;PDD组,男39例,女35例,年龄(60.73±7.46)岁;对照组,男20名,女25名,年龄(59.46±8.74)岁。3组年龄、性别比较差异均无统计学意义(P>0.05)。研究对象均对本研究知情同意且签署知情同意书。
1.2 研究方法 抽取所有研究对象清晨空腹外周静脉血5 mL于抗凝管中,常温下离心并收集上层血清置于-80 ℃保存。血清瘦素水平通过酶联免疫吸附试验(ELISA)试剂盒(上海碧云天生物技术有限公司生产,批号20195863)检测,具体步骤参考试剂盒中说明书进行。263例病人的年龄、性别、体质指数(BMI)、PD病程、PD病情严重程度、PD分型、抑郁症病情严重程度及病程、合并高血压、糖尿病及血脂异常等均从住院病历系统中获得。PD病情严重程度采用 Honehn-Yahr分级评估[9],Ⅰ级、Ⅱ级为早期(轻度);Ⅲ级为中期(中度),Ⅳ级、Ⅴ级为晚期(重度)。抑郁症病情严重程度采用HAMD-24项进行评估[10],评分<8分、8~<20 分、20~<35分、≥35分依次表示正常、轻度抑郁、中度抑郁、重度抑郁。

2 结 果
2.1 对照组、PD组和PDD组血清瘦素水平比较 对照组血清瘦素水平为(15.63±2.54)μg/L,明显高于PD组[(8.58±1.24)μg/L]和PDD组[(4.54±0.18)μg/L],差异均有统计学意义(t值分别为29.172,27.244;P均<0.01);PD组血清瘦素水平明显高于PDD组,差异有统计学意义(t=27.915,P<0.01)。
2.2 PD组和PDD组临床特征比较 PD组与PDD组PD病程、PD病情严重程度、HAMD-24项评分比较差异均有统计学意义(P<0.05)。详见表1。

表1 PD组和PDD组临床特征比较
2.3 PDD组血清瘦素水平的影响因素 Logistic回归分析结果显示,PD病程、PD病情严重程度和HAMD-24项评分是PDD组血清瘦素水平的影响因素。详见表2。
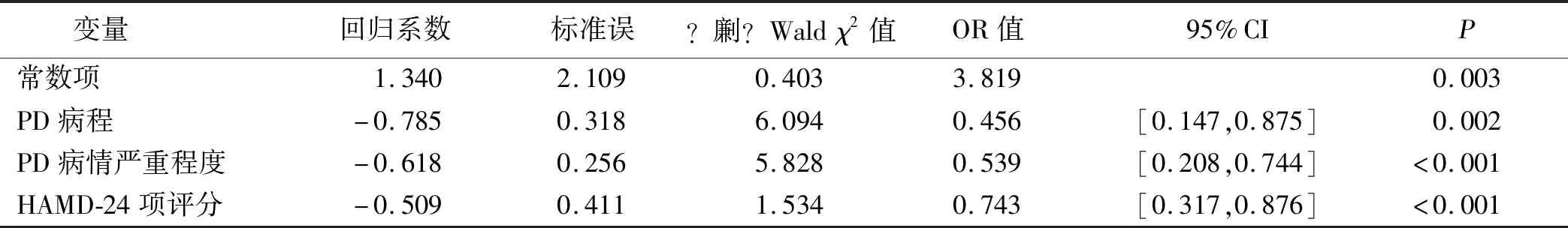
表2 PDD组血清瘦素水平的影响因素分析
2.4 PDD组血清瘦素水平与抑郁症病情严重程度的相关性分析 根据HAMD-24项评分将74例PD合并抑郁症病人分为轻度抑郁组(19例)、中度抑郁组(34例)和重度抑郁组(21例)。轻度抑郁组、中度抑郁组和重度抑郁组血清瘦素水平分别为(6.47±1.32)μg/L、(4.18±0.55)μg/L和(2.43±0.41)μg/L,轻度抑郁组血清瘦素水平明显高于中度抑郁组和重度抑郁组,中度抑郁组血清瘦素水平明显高于重度抑郁组,差异均有统计学意义(P<0.05)。PDD组HAMD-24项评分与血清瘦素水平呈负相关(r=-0.738,P<0.001)。
2.5 血清瘦素水平诊断PD病人发生抑郁症的临床效能 将PD合并抑郁症病人血清瘦素水平作为检验变量,ROC结果显示,瘦素水平诊断PD合并抑郁症的曲线下面积为0.923[95%CI(0.869,0.976)],当截断值为4.17 μg/L时,灵敏度和特异度分别为 95.79%和93.18%。详见图1。
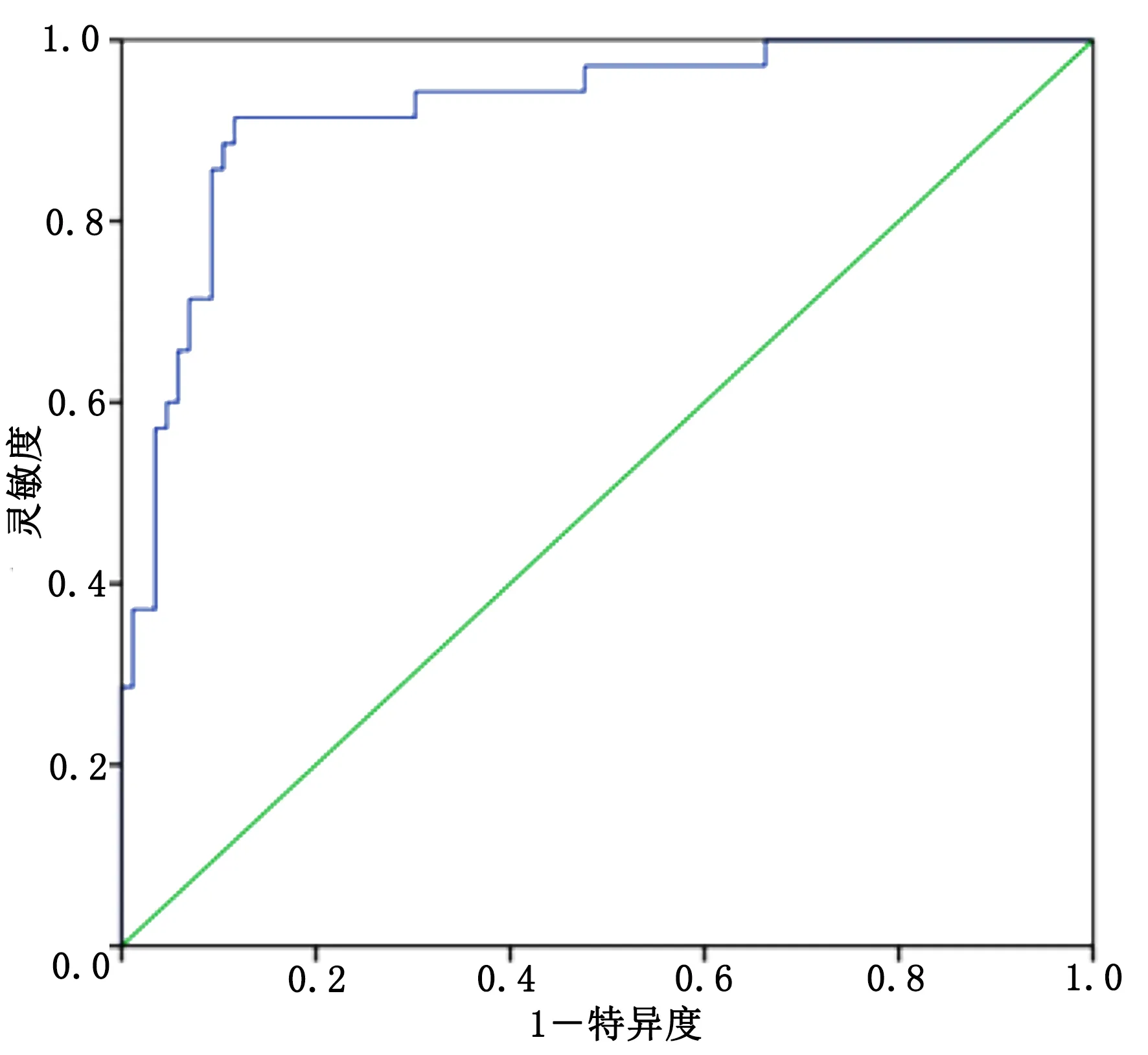
图1 血清瘦素水平诊断PD病人发生抑郁症的临床效能
3 讨 论
PD为一种慢性神经系统退行性疾病,临床症状分为运动症状和非运动症状,运动症状主要表现为静止震颤和运动迟缓等,而非运动症状则以抑郁、睡眠认知障碍及自主神经功能异常等为主[2]。PD病人非运动症状往往早于运动症状之前出现,而抑郁是PD病人较为常见的一种非运动症状,Cui等[11]对403例我国PD病人开展的横断面研究调查结果显示,PD病人抑郁症发生率达11.7%。传统观点认为,PD病人由于各种运动障碍及生活自理能力下降等诱发负性心理反应,最终导致抑郁症的发生,但最新研究发现,PD病人脂肪细胞因子(如瘦素)可能参与抑郁症的发病[12]。
汪卫华等[13]采用小剂量氯胺酮治疗39例重度抑郁症病人7 d后发现,抑郁症病人HAMD评分较治疗前明显降低,血清5-羟色胺(5-HT)水平治疗前后无明显变化,而血清瘦素水平较治疗前明显升高,认为氯胺酮的抗抑郁疗效可能与升高瘦素水平有关。也有研究发现,抗抑郁治疗后,血清瘦素水平较治疗前明显升高,说明抑郁症的发病可能与瘦素的低表达具有一定关联性。前期研究发现,PD病人血清瘦素水平较健康者明显降低[7]。本研究分析得出,PD合并抑郁症病人血清瘦素水平较PD病人明显降低,且瘦素水平与抑郁症病情严重程度呈负相关,提示血清瘦素水平在一定程度上可反映PD合并抑郁症病人病情严重程度,通过Logistic回归分析得出PDD组病人病程长、病情程度严重及HAMD-24项评分高均是瘦素水平降低的独立危险因素,说明瘦素在一定程度上可能参与了PD合并抑郁症的病情进展。
刘红旗等[14]研究证实世界卫生组织幸福指数量表(WHO-5)与贝克抑郁量表诊断PD合并抑郁症的临床效能较好,敏感度和特异度均达到85%以上,但其研究也存在样本量小及量表评分的主观性较大等缺陷,目前,关于诊断PD合并抑郁症的临床血清学标志物的研究报道较少,本研究采用ROC曲线证实瘦素诊断PD合并抑郁症的临床效能较好,AUC达0.923,当截断值为4.17 μg/L时,最佳灵敏度和特异度分别为 95.79%和93.18%,本研究结果提示瘦素可以作为PD合并抑郁症的一项血清学标志物。
综上所述,瘦素和PD合并抑郁症具有相关性,低水平的瘦素可能增加PD病人抑郁症的发病风险,同时本研究也存在不足之处,需要更大样本量的临床队列研究结果支持本研究结论,未来针对靶向拮抗瘦素的生物制剂治疗PD合并抑郁症也值得进一步探讨。
