LncRNA SNHG7对小鼠心肌梗死后心肌细胞损伤的保护作用
2022-02-15赵瑞彪单会艳俞艳华
赵瑞彪,单会艳,俞艳华
心肌梗死是临床常见的心血管疾病,近年来,心肌梗死发病率与死亡率逐年上升,已严重影响人们生活质量,非编码RNA属于组织特异性的RNA分子,其具有高度保守性,并可调控细胞增殖及凋亡等过程从而参与心血管疾病发生、发展过程,其中,微小RNA(miRNA)与长链非编码RNA(LncRNA)在心血管疾病中表达异常,并可能作为减轻心肌细胞损伤的治疗靶点[1-5]。长链非编码RNA SNHG7(LncRNA SNHG7)在骨关节炎中表达水平降低,上调其表达可抑制软骨细胞凋亡及促进细胞增殖[6]。但SNHG7在小鼠心肌梗死后心肌细胞损伤中的作用机制尚未阐明。本研究旨在探讨SNHG7过表达对小鼠心肌梗死后心肌细胞凋亡及炎症损伤的影响及其可能作用机制。
1 材料与方法
1.1 材料与试剂 40只无特定病原体(SPF)级C57BL/6雄性小鼠购自北京维通利华实验动物技术有限公司,12周龄,死亡4只,剩余36只,动物许可证号SXCK(京):2016-0008。大鼠心肌细胞H9C2购自美国ATCC细胞库;Lipofectamine2000购自美国Invitrogen公司;miR-223 mimics、miR-NC、si-NC、si-SNHG7购自上海吉玛制药技术有限公司;Trizol、cDNA合成、荧光定量购自美国Thermo Fisher公司;缺口末端标记法(TUNEL)染色试剂盒购自北京索莱宝科技有限公司;兔抗鼠脂肪酸合成酶(Fas)、Cleaved Caspase-3抗体购自美国Santa Cruz公司;辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自武汉艾美捷科技有限公司。
1.2 方法
1.2.1 建立小鼠心肌梗死模型 采用2%水合氯醛(100 mg/kg)麻醉小鼠,切开气管,使用呼吸机辅助呼吸(7~8 mL),120次/min,呼吸比1∶2,在第4肋间入胸,识别前降支走行范围,采用滑线(7/0)结扎前降支,同时进行苏木素-伊红(HE)染色与Masson染色,观察小鼠心电图示波,若左心室前壁部分颜色转为苍白且具有心肌梗死的临床表现时则视为模型制作成功[7]。1.2.2 实验分组 采用慢病毒方法构建携带SNHG7过表达的慢病毒与携带绿色荧光蛋白(GFP)的慢病毒空载体[8]。36只小鼠随机选取9只作为假手术组(小鼠仅开胸,不结扎冠状动脉),其余27只小鼠均进行造模,随机分为模型组、空载组与SNHG7过表达组,每组9只。空载组携带GFP的慢病毒空载体(4×107TU)进行心肌组织局部注射转染,SNHG7过表达组携带SNHG7过表达的慢病毒(4×107TU)进行心肌组织局部注射转染。各组培养24 h后,采用10%水合氯醛麻醉小鼠,切取远端缺血心肌组织,置于-80 ℃超低温冰箱内保存。
1.2.3 缺氧/缺血诱导H9C2细胞建立细胞损伤模型 H9C2细胞正常培养,置于培养箱培养24 h,将培养液更换为不含血清的培养基,首先置于缺氧罐内,同时在其中放置Genbox厌氧产气包,制备缺血/缺氧模型,将缺氧罐置于恒温培养箱培养48 h,收集细胞进行后续实验研究[9]。将正常培养的心肌细胞作为Con组,将缺氧缺血处理的心肌细胞作为缺氧组。
1.2.4 实时荧光定量聚合酶链式反应(qRT-PCR)检测SNHG7、miR-223与肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β) mRNA的表达水平 采用Trizol法提取总RNA,反转录得到cDNA,以cDNA为模板进行qRT-PCR扩增检测SNHG7、miR-223与TNF-α、IL-6、IL-1β mRNA相对表达量。引物序列见表1。

表1 引物序列
1.2.5 TUNEL法检测细胞凋亡 取心肌组织,常规脱蜡处理制备石蜡切片(5 μm),经过不同浓度的乙醇浸洗,滴加蛋白酶K溶液,室温孵育,磷酸盐缓冲液(PBS)洗涤,滴加50 μL TUNEL反应液,室温孵育1 h,PBS洗涤,滴加过氧化氢10 min,PBS洗涤,滴加底物二氨基联苯胺(DAB)底物溶液(50 μL),室温孵育10 min,PBS洗涤,加入DIPA,采用抗荧光淬灭剂封片,应用荧光显微镜观察与蓝色细胞核重叠的绿色荧光为凋亡细胞,凋亡指数=凋亡细胞核数/总细胞核数。
1.2.6 双荧光素酶报告基因检测SNHG7与miR-223的靶向关系 LncBase v.2预测显示SNHG7与miR-223存在结合位点,分别构建野生型载体WT-SNHG7与突变型载体MUT-SNHG7,分别将miR-NC、miR-223 mimics与WT-SNHG7、MUT-SNHG7共转染至心肌细胞,置于培养箱继续培养24 h,收集细胞,检测各组相对荧光素酶活性。分别将pcDNA、pcDNA-SNHG7、si-NC、si-SNHG7转染至心肌细胞,采用qRT-PCR检测miR-223的表达量。
1.2.7 蛋白免疫印迹法(Western Blot)检测Fas、Cleaved Caspase-3蛋白表达 心肌组织加入500 μL RIPA裂解液提取总蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转膜、封闭2 h,孵育一抗稀释液与二抗稀释液,化学发光加强法(ECL)显影,应用Image J软件分析各条带灰度值。Fas、Cleaved Caspase-3一抗稀释比为1∶1 000,二抗稀释比为1∶2 000,Fas、Cleaved Caspase-3以甘油醛-3-磷酸脱氢酶(GAPDH)为内参计算Fas、Cleaved Caspase-3蛋白相对表达量。

2 结 果
2.1 HE染色与Masson染色结果 HE染色结果显示,模型组大鼠心肌细胞肥大,排列紊乱,血管增生,细胞间质增宽;Masson染色结果显示,模型组大鼠出现组织纤维化,不定性胶原纤维组织增生。详见图1。
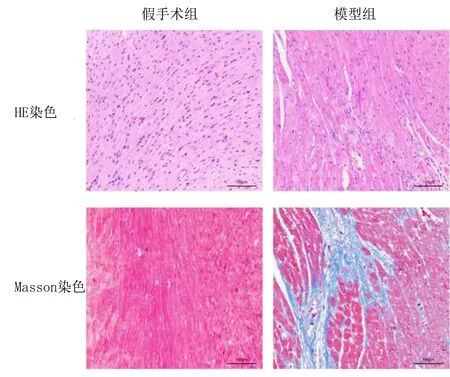
图1 HE染色与Masson染色结果
2.2 各组大鼠SNHG7表达水平比较 与假手术组比较,模型组SNHG7表达水平明显降低(P<0.05);与模型组、空载组比较,SNHG7过表达组SNHG7表达水平明显升高(P<0.05)。详见表2。

表2 各组大鼠SNHG7表达水平比较(±s)
2.3 SNHG7过表达对大鼠心肌梗死后心肌细胞凋亡及Fas、Cleaved Caspase-3蛋白表达的影响 与假手术组比较,模型组凋亡指数及Fas、Cleaved Caspase-3蛋白水平明显升高(P<0.05);与模型组、空载组比较,SNHG7过表达组凋亡指数及Fas、Cleaved Caspase-3蛋白水平明显降低(P<0.05)。详见图2、表3。
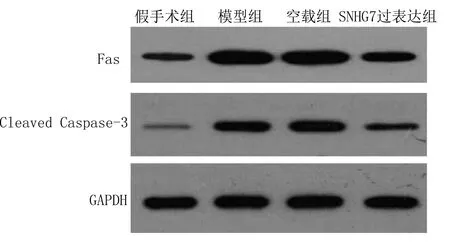
图2 Western Blot法检测Fas、Cleaved Caspase-3蛋白表达电泳图

表3 SNHG7过表达对大鼠心肌梗死后心肌细胞凋亡及Fas、Cleaved Caspase-3蛋白表达的影响 (±s)
2.4 SNHG7过表达对大鼠心肌梗死后心肌细胞炎性因子mRNA表达的影响 与假手术组比较,模型组TNF-α、IL-6、IL-1β mRNA表达水平明显升高(P<0.05);与模型组、空载组比较,SNHG7过表达组TNF-α、IL-6、IL-1β mRNA表达水平明显降低(P<0.05)。详见表4。

表4 SNHG7过表达对大鼠心肌梗死后心肌细胞炎性因子mRNA表达的影响 (±s)
2.5 缺氧/缺血诱导的H9C2细胞中SNHG7与miR-223的表达水平 与Con组比较,缺氧组SNHG7表达水平明显降低(P<0.05),miR-223表达水平明显升高(P<0.05)。详见表5。

表5 缺氧/缺血诱导的H9C2细胞中SNHG7与miR-223的表达水平 (±s)
2.6 SNHG7靶向调控miR-223 LncBase v.2预测显示,SNHG7与miR-223存在结合位点,详见图3。双荧光素酶报告实验结果显示,miR-223过表达可抑制野生型WT-SNHG7转染细胞的荧光素酶活性(P<0.05),但其对突变型MUT-SNHG7转染细胞的荧光素酶活性无明显影响(P>0.05),详见表6。与pcDNA组比较,pcDNA-SNHG7组miR-223表达水平明显降低(P<0.05);与si-NC组比较,si-SNHG7组miR-223表达水平明显升高(P<0.05)。详见表7。

图3 SNHG7的序列中含有与miR-223p互补的核苷酸序列

表6 双荧光素酶报告实验(±s)

表7 SNHG7靶向调控miR-223的表达(±s)
3 讨 论
LncRNA可参与心肌梗死等心血管疾病发生、发展过程,调控细胞增殖及凋亡等生物学过程,并可通过竞争性结合miRNA而负向调控其表达从而参与细胞凋亡等过程[10-12]。但仍有部分LncRNA在心肌梗死后心肌细胞损伤中的作用机制尚未阐明。
SNHG7在神经胶质瘤、卵巢癌、宫颈癌等肿瘤中表达水平升高,并可促进肿瘤发生及发展[13-15]。但SNHG7在心肌梗死中的表达及其可能作用机制尚未阐明。本研究结果显示,心肌梗死模型组小鼠心肌组织中SNHG7的表达水平降低,而SNHG7过表达组SNHG7的表达水平明显升高,提示SNHG7在心肌梗死发生、发展过程中发挥重要作用。心肌梗死发生后可加重心肌损伤,其中,心肌细胞凋亡是加重心肌损伤的重要原因,因此,减少心肌细胞凋亡成为减轻心肌损伤的重要措施,细胞凋亡过程与 Caspase级联反应密切相关,Caspase-3属于凋亡执行因子,凋亡过程中Caspase-3被激活形成Cleaved Caspase-3,Cleaved Caspase-3的表达水平可反映细胞凋亡情况,而Fas基因被活性氧激活后可启动凋亡程序而激活Caspase-8、Caspase-3,从而促进细胞凋亡[16]。本研究结果显示,模型组凋亡指数及Fas、Cleaved Caspase-3蛋白水平明显升高,而SNHG7过表达后凋亡指数及Fas、Cleaved Caspase-3蛋白水平明显降低,提示SNHG7过表达可抑制心肌梗死后心肌细胞凋亡。心肌梗死后炎症也可参与心肌缺血性损伤,心肌炎症反应在心功能障碍中发挥重要作用,减轻炎症反应可减轻心肌损伤,其中,炎性因子TNF-α、IL-6、IL-1β可能是心肌缺血后心功能障碍的重要刺激因子,并可能是促进细胞凋亡的重要影响因素[17]。本研究结果显示,心肌梗死后小鼠心肌组织中TNF-α、IL-6、IL-1β mRNA的表达水平明显升高,而SNHG7过表达后TNF-α、IL-6、IL-1β mRNA的表达水平明显降低,提示SNHG7过表达可通过抑制TNF-α、IL-6、IL-1β的表达从而减轻心肌炎性反应。
miR-223属于髓系特异性miRNA,其在心血管疾病中表达异常,并可能通过调控内皮细胞的多种基因表达参与动脉粥样硬化、心肌代谢等多种疾病发生、发展过程[18]。miR-223在心肌梗死病人血清中的表达水平明显升高,并可能作为预测心肌梗死的辅助指标,同时通过体外细胞实验证实miR-223可促进心肌细胞凋亡[19]。大黄素通过下调miR-223的表达而减轻脂多糖诱导的心肌细胞损伤[20]。与上述研究结果相似,本研究通过体外细胞实验证实缺氧/缺血诱导的心肌细胞中SNHG7的表达水平明显降低,miR-223的表达水平明显升高。本研究证实SNHG7可靶向结合miR-223,并可负向调控miR-223的表达及活性。提示SNHG7可能通过下调miR-223的表达从而对心肌细胞发挥保护作用。
综上所述,SNHG7过表达可抑制小鼠心肌梗死后心肌细胞凋亡及炎症反应,其作用机制可能与靶向调控miR-223的表达有关,SNHG7可能作为心肌梗死等心血管疾病诊断及治疗的潜在靶点,但关于心肌细胞损伤过程中SNHG7如何调控miR-223表达及其下游靶基因表达尚不清楚,其具体作用机制仍需进一步探讨。
