多巴脱羧酶对异色瓢虫生殖力的调控机制
2022-02-15田仁斌徐庆宣臧连生
陈 旭, 田仁斌, 徐庆宣, 李 姝, 王 甦, 臧连生, 肖 达,*
(1.北京市农林科学院植物保护环境保护研究所, 北京 100097;2.贵州大学, 绿色农药与农业生物工程教育部重点实验室, 贵阳 550025)
异色瓢虫Harmoniaaxyridis属于鞘翅目(Coleoptera)瓢虫科(Coccinellinae),是农业和林业上一种重要的捕食性天敌昆虫,对蚜虫、叶螨、介壳虫等重要害虫具有很强的捕食能力(Koch,2003; 王甦等, 2007; 唐斌等, 2014)。异色瓢虫也是典型的多型性物种,其成虫鞘翅表型变化丰富,由黑色[黑底型(melanic)]或淡黄色[黄底型(succinic)]作为底色,镶嵌以红色或黑色圆点状色块(Bezzeridesetal., 2007)。据不完全统计,异色瓢虫鞘翅色斑有200多种(Andoetal., 2018)。近年来,围绕异色瓢虫色型多样性形成机制的研究逐渐增多,谈家桢先生认为异色瓢虫鞘翅表型的变异是黑色素与非黑色素(类胡萝卜素衍生物)的分布范围与布局的更动引起的,这与其鞘翅黑化过程中鞘翅内部体液中的酶有相关性(庚镇城和谈家桢, 1980);True(2003)研究认为异色瓢虫鞘翅颜色的变异可能是昆虫表皮的黑化现象;Chen等(2019)研究证明多巴胺黑色素是异色瓢虫鞘翅黑色素的主要成分,且在实验中发现干扰了编码黑色素合成过程中的关键酶——多巴脱羧酶(DOPA decarboxylase, DDC, EC 4.1.1.28)的基因表达后,异色瓢虫雌虫的生殖力明显下降。但目前,多巴脱羧酶对于异色瓢虫生殖的具体调控机制还未见报道。
多巴脱羧酶(DDC)是黑色素合成过程中关键转化酶(Hiruma and Riddiford, 2009),除了参与昆虫表皮的黑色素合成过程,还与昆虫胚胎发育、幼虫蜕皮、表皮骨化等有关(Arakaneetal., 2009; Wang Setal., 2013; Sterkeletal., 2019)。多巴脱羧酶主要存在于昆虫的表皮、神经系统和卵巢细胞中(Wang MXetal., 2013),催化多巴(dihydroxyphenylalanine, DOPA)生成多巴胺(dopamine, DA),而多巴胺是生物体内重要的神经递质,参与昆虫的各种生命活动,它也是昆虫生长发育过程中不可或缺的生物胺之一(Hodgetts and O′Keefe, 2006)。多巴胺可以参与调节昆虫的求偶行为和生殖行为(姜宏健等, 2020),还可以与其他生物胺和激素协同互作,调节社会性昆虫的生殖行为及性别转化(Haranoetal., 2005, 2008)。目前,多巴胺对于昆虫生殖的调控机制在果蝇Drosophila中的研究较为透彻。多巴胺与蜕皮激素(molting hormone, MH)、保幼激素(juvenile hormone, JH)和章鱼胺(octopamine, OA)之间的互作,不仅可以调节昆虫的生殖行为,还可以调节卵细胞的发育(姜宏健等, 2020)。而这种互作的实现,通常依赖于调节关联基因表达和酶的活性。
本实验利用基因RNA干扰技术(RNA interference, RNAi)对异色瓢虫的多巴脱羧酶基因进行表达干扰,统计分析成虫产卵量和子代卵的孵化率,并对卵巢进行解剖,对卵巢组织形态及卵巢管的发育进行研究。以期为阐明多巴脱羧酶对异色瓢虫生殖力的调控机制提供理论基础。
1 材料与方法
1.1 供试昆虫
异色瓢虫为北京市农林科学院植物保护环境保护研究所室内定殖种群。提供蚕豆蚜Aphiscurviness为食物对异色瓢虫试验种群进行扩繁。具体流程如下:种植蚕豆苗,对豆蚜进行扩繁,待豆蚜种群扩繁到适宜的密度时将其放入养虫笼中,随后接入异色瓢虫的初孵幼虫。放置于温度25±1℃,相对湿度70%±5%,光周期16L∶8D条件下饲养(Chenetal., 2019)。
1.2 试验器材
冰箱、温湿度计、透明养虫盒(长×宽×高=13 cm×13 cm×8.0 cm)、培养皿(直径:5.0 cm)、小型养虫盒(直径:6.0 cm,高:2.5 cm)、养虫笼(长×宽×高=50 cm×45 cm×45 cm,尼龙网:120目)、玻璃研磨器(5 mL)、显微注射系统Nanoject Ⅱ(World Presion Instruments)、MJ Research PTC-100 PCR仪(MJ Research Inc.)、Kodak电泳凝胶成像仪、高速冷冻离心机、Power/PAC 3000型电泳仪、NanoDrop One超微量紫外分光光度计等。
1.3 主要试剂
Trizol试剂为Invitrogen公司产品。cDNA合成试剂盒为TaKaRa公司产品。QIAEX Ⅱ Gel Extraction Kit 切胶回收试剂盒和QIAquick PCR产物纯化试剂盒为QIAGEN公司产品。MEGAscript®RNAi试剂盒为Ambion公司产品。氯仿、吖啶橙、1×PBS缓冲液、异丙醇、75%乙醇(用RNase-free水配制)均购自Sigma公司。
1.4 双链RNA的合成
1.4.1引物设计:根据NCBI 中提供的异色瓢虫多巴脱羧酶基因(HaDDC)(GenBank登录号: KU820948)和绿色荧光蛋白基因(GFP)的序列信息,利用在线引物设计网站E-RNAi(http:∥www.dkfz.de/signaling/e-rnai3/idseq.php)设计引物。具体引物信息如表1所示。

表1 dsRNA合成所用引物序列
1.4.2总RNA提取与cDNA第1链的合成:将异色瓢虫4龄幼虫单头放入玻璃匀浆器中,加入1 mL TRIzol试剂。室温下放置5 min后,将其充分匀浆。按照Trizol试剂说明书提取总RNA,然后使用NanoDrop One分光光度计检测RNA浓度和纯度(ng/μL)。根据PrimeScriptTMRT Master Mix试剂盒说明书进行反转录合成cDNA,产物于-20℃冰箱保存备用。
1.4.3含T7启动子序列的双链RNA(dsRNA)合成模板的制备:以异色瓢虫cDNA为模板,利用含有T7启动子序列的引物进行双链RNA(dsRNA)模板的扩增。PCR反应程序: 95℃ 1 min; 94℃ 30 s, 70-60℃ 30 s, 72℃ 30 s, 11个循环; 94℃ 30 s, 65℃ 30 s, 72℃ 30 s, 30个循环; 72℃ 10 min。利用琼脂糖凝胶电泳检测PCR产物,利用QIAEX Ⅱ Gel Extraction Kit试剂盒进行切胶回收目的片段产物,然后以回收产物为模板,继续扩增目的片段,PCR反应程序: 94℃ 3 min; 94℃ 30 s, 65℃ 30 s, 72℃ 45 s, 35个循环; 72℃ 10 min。确认目的条带大小正确,无特异性扩增。采用QIAquick PCR产物纯化试剂盒进行PCR产物的纯化,NanoDrop One分光光度计进行浓度检测。
1.4.4dsRNA的制备:根据MEGAscript®RNAi试剂盒的说明书,以1.4.3节所得的模板DNA为模板,在体外转录合成GFP和HaDDC的双链RNA。利用NanoDrop One检测dsRNA浓度,放置于-80℃冰箱保存备用。
1.5 显微注射
收集异色瓢虫4龄幼虫,将其放入玻璃培养皿中并加入灭菌水浸泡。10 min后取出幼虫进行显微注射dsGFP(对照组)和dsHaDDC(处理组),注射量为300 ng/头。注射部位为幼虫背部倒数第1或第2个节间膜处。每个处理注射幼虫40头,3个生物学重复。已经注射的幼虫放入干净的培养皿中,放置于标准的饲养条件下饲养。
1.6 生殖力检测
待幼虫羽化为成虫后,根据表型选取黑底四窗型异色瓢虫成虫进行交配,具体操作如下(图1):
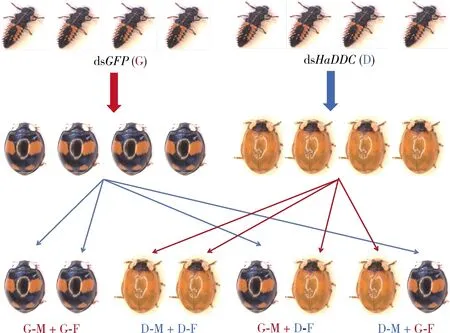
图1 HaDDC被RNAi后异色瓢虫生殖力检测
(1)注射dsGFP雄虫×注射dsGFP雌虫(G-M+G-F);
(2)注射dsHaDDC雄虫×注射dsHaDDC雌虫(D-M+D-F);
(3)注射dsGFP雄虫×注射dsHaDDC雌虫(G-M+D-F);
(4)注射dsHaDDC雄虫×注射dsGFP雌虫(D-M+G-F)。
每个处理有3对瓢虫,3个生物学重复。从羽化第8天后收集并开始记录产卵量,统计20 d内累计产卵量,产卵后第3天统计子代卵孵化率。
1.7 异色瓢虫卵巢组织解剖与染色
待注射了dsHaDDC和dsGFP的4龄幼虫羽化为成虫后,按照雌雄1∶1的比例分别放入养虫盒中,每个养虫盒中共30头成虫。分别在羽化第8, 14 和20天时进行解剖。将异色瓢虫雌成虫放置于琼脂糖凝胶培养皿中,腹部朝上并用标本针插入胸部第2节将其固定,随后加入1×PBS缓冲液,用镊子将腹部延中间小心剖开,分离卵巢组织,然后用1×PBS 缓冲液冲洗卵巢上的脂肪体。将冲洗完毕的卵巢放到新的载玻片上,然后加入一滴吖啶橙染料(0.02 mg/mL),将其浸没。将载玻片放入培养箱中,37℃避光染色15 min。染色结束后,将卵巢组织用1×PBS缓冲液冲洗2次,然后将冲洗完毕的卵巢组织放入新的载玻片上,加入1×PBS缓冲液。用荧光显微镜观察卵巢的形态和卵巢管的发育情况,统计卵巢管数量并拍照记录。
1.8 数据分析
利用Excel软件对各试验所得观测值进行统计分析,获得平均值和标准误。利用SigmaPlot进行作图。数据统计分析采用单因素方差分析(SPSS V22)。
2 结果
2.1 抑制HaDDC表达对异色瓢虫产卵量的影响
异色瓢虫具有非常敏感的RNAi效应(Xiaoetal., 2020)。将注射了dsGFP和dsHaDDC的4龄幼虫在标准条件下饲养,成虫羽化后第1天根据表型进行配对,第8天开始记录产卵量,结果如图2所示: 注射dsGFP雄虫与注射dsGFP雌虫(G-M+G-F)交配后,20 d内累计产卵量达到371.33±84.31粒。相比之下,注射dsHaDDC雄虫与注射dsHaDDC雌虫(D-M+D-F)交配后,20 d内累计产卵量仅为38.67±7.80粒,显著低于对照组(P<0.05)。注射dsGFP雄虫与注射dsHaDDC雌虫(G-M+D-F)交配后,20 d内累计产卵量为135.50±28.38粒,与对照组差异显著(P<0.05)。注射dsHaDDC雄虫与注射dsGFP雌虫(D-M+G-F)交配后,20 d内累计产卵量为76.00±14.00粒,与对照组差异显著(P<0.05)。除此之外,我们在试验过程中还观察到对照组(G-M+G-F)所产的卵是聚集在一起的卵块,而雌雄虫均注射dsHaDDC的处理组(D-M+D-F)的卵,不聚集成卵块,而是散落在实验容器中。
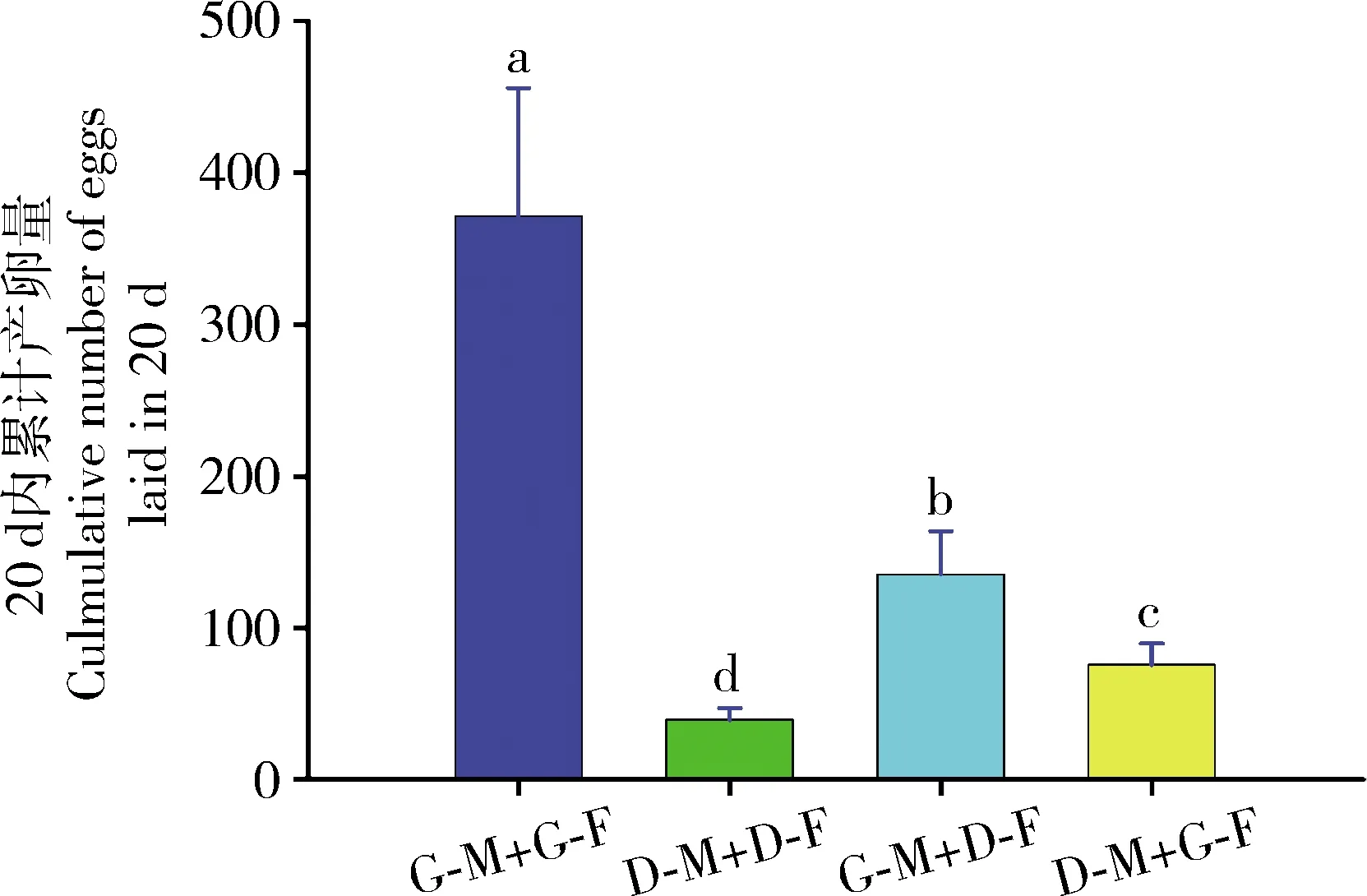
图2 RNAi介导的基因沉默抑制异色瓢虫4龄幼虫HaDDC表达对成虫产卵量的影响
2.2 抑制HaDDC表达对异色瓢虫子代卵孵化率的影响
对2.1节成虫所产的卵3 d后统计记录其孵化率,结果如图3所示:对照组注射dsGFP雄虫与注射dsGFP雌虫(G-M+G-F)交配后, 子代卵孵化率达72.80%±1.38%;雌雄虫均注射dsHaDDC(D-M+D-F)交配后,所产的卵均未孵化;注射dsGFP雄虫与注射dsHaDDC雌虫(G-M+D-F)交配后,子代卵孵化率为33.89%±2.38%,显著低于对照组(P<0.05);注射dsHaDDC雄虫与注射dsGFP雌虫(D-M+G-F)交配后, 子代卵孵化率仅为2.91%±0.56%,显著低于对照组(P<0.05)。

图3 RNAi介导的基因沉默抑制异色瓢虫4龄幼虫HaDDC的表达对子代卵孵化率的影响
2.3 抑制HaDDC表达对异色瓢虫卵巢组织形态的影响
选取异色瓢虫4龄幼虫,分别注射dsGFP和dsHaDDC后放入养虫室中饲养,在其羽化后第8天对雌成虫卵巢进行解剖并拍照记录。结果如图4所示:注射dsHaDDC的雌成虫卵巢形态和大小与注射dsGFP的对照组相比无明显差异。

图4 RNAi介导的基因沉默抑制异色瓢虫4龄幼虫HaDDC的表达对雌成虫卵巢发育的影响
在上述同批的实验试虫中选取羽化后第8天的雌成虫对其卵巢组织进行解剖,统计双侧卵巢中卵巢管的数量,结果如图5所示:注射dsGFP的对照组雌成虫卵巢管数量为63.95±9.22根,注射dsHaDDC的处理组雌成虫卵巢管数量为59.19±9.65根,两者无显著差异(P>0.05)。
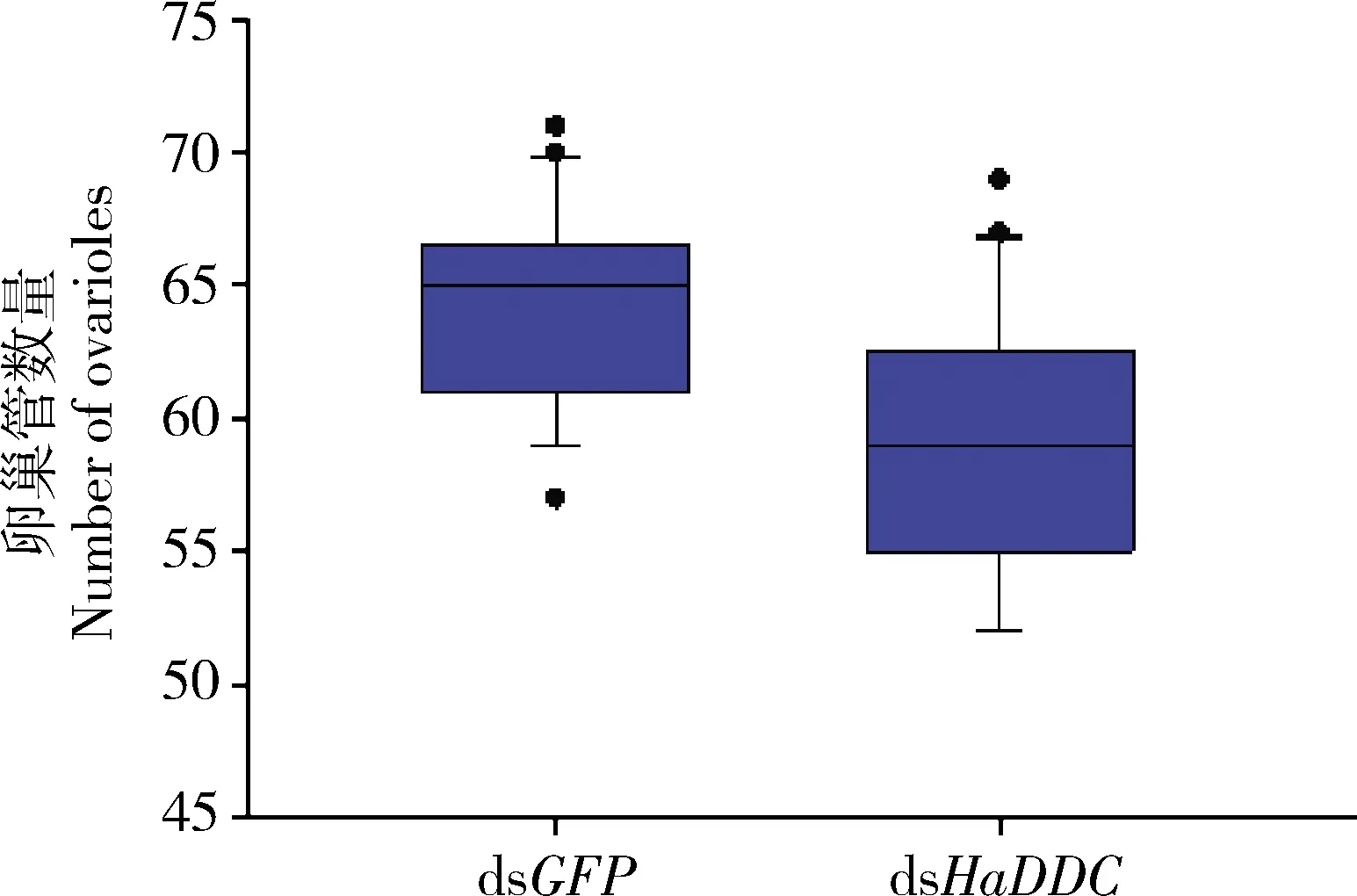
图5 RNAi介导的基因沉默抑制异色瓢虫4龄幼虫HaDDC的表达对雌成虫双侧卵巢管数量的影响
2.4 抑制HaDDC表达对异色瓢虫卵发育的影响
异色瓢虫在羽化后15 d左右开始产卵,我们选择羽化后第14天雌成虫对其卵巢进行解剖,结果发现:注射dsGFP的对照组雌成虫卵巢形态饱满,双侧卵巢管中均有卵母细胞发育,其中可见2粒成熟的卵粒(图6: A),除此之外,我们在解剖卵巢过程中还观察到有散落的成熟卵粒;注射dsHaDDC的处理组雌成虫卵巢形态也比较饱满,双侧卵巢管中也有卵母细胞发育,但是未见已经明显成熟的卵粒(图6: B)。
异色瓢虫羽化后20 d左右进入产卵高峰期,我们选择羽化后第20天雌成虫对其卵巢进行解剖,结果表明:注射dsGFP的对照组雌成虫卵巢形态饱满,卵巢管中可见大量卵母细胞发育(图6: C);注射dsHaDDC的处理组雌成虫卵巢形态较为饱满,卵巢管中仅见少量卵母细胞发育(图6: D)。

图6 RNAi介导的基因沉默抑制异色瓢虫4龄幼虫HaDDC的表达对卵发育的影响
3 讨论
昆虫高效的繁殖能力不仅是害虫暴发成灾的原因,也是益虫人工饲养和利用的基础。研究表明昆虫的生殖能力主要受内部因素如激素(郭郛, 1963)和生物胺(熊佳新等, 2019)等以及外部因素如营养(苏天运, 1986)、温度(蒋丰泽等, 2015)、湿度(周睿琦等, 2013)等的影响。生物胺是影响昆虫生殖状态的一种微量物质,主要包括:多巴胺、酪胺、章鱼胺、色胺和组胺(申王尚等, 2018)。多巴胺是昆虫表皮鞣化过程的产物,由酪氨酸代谢而来,酪氨酸羟化酶(tyrosine hydroxylase)和多巴脱羧酶是多巴胺合成过程中重要的限速酶。本研究以多巴脱羧酶为切入点,利用基因沉默技术从表观遗传学角度揭示其对异色瓢虫生殖力的调控作用。
前期研究结果表明,异色瓢虫具有非常敏感的基因沉默效应。将多巴脱羧酶基因双链RNA(dsHaDDC)注射到异色瓢虫4龄幼虫体内,会引起其表达量显著降低,同时出现明显的黑色素缺失的表现型(Xiaoetal., 2020)。生殖力检测结果表明,异色瓢虫雌虫的HaDDC基因被抑制表达后其产卵量显著降低(图2)。异色瓢虫HaDDC基因被抑制表达后,其子代卵的孵化率也显著降低(图3)。在长红猎蝽Rhodniusprolixus研究中同样发现多巴脱羧酶抑制表达后,可以延迟产卵期并降低卵的孵化率(Sterkel and Oliveira, 2017; Sterkeletal., 2019)。综上分析所述,我们可以推断多巴脱羧酶可以调控异色瓢虫的生殖力。目前对于多巴脱羧酶调控昆虫生殖力的研究主要以其下游产物多巴胺为切入点进行(Sasaki and Nagao, 2001; Liuetal., 2008; 姜宏健等, 2020)。有研究表明多巴胺对于昆虫生殖调控的机制是由其作为神经递质对下游受体进行激活进而产生一系列与生殖相关的级联反应(Gruntenko and Rauschenbach, 2008)。
前期研究发现,多巴脱羧酶的下游产物多巴胺与昆虫卵巢发育的关系十分密切,例如在蚂蚁Diacammasp.和黑腹果蝇Drosophilamelanogaster中雌性个体脑内多巴胺含量越高,其卵巢发育越好(Shimojietal., 2017)。我们研究中发现多巴脱羧酶被抑制表达后,异色瓢虫的产卵量及其子代卵孵化率均显著降低(图2和3)。为探究产生这种影响的原因是否是由于多巴脱羧酶表达量降低导致了其产物多巴胺含量减少进而影响了异色瓢虫卵巢的发育及功能,我们解剖了异色瓢虫的卵巢组织,结果显示HaDDC基因被抑制表达后不影响卵巢组织的形态发育(图4: A, B)。有研究报道,瓢虫卵巢管的数量与卵的数量密切相关(刘志伟等, 2016),异色瓢虫每侧卵巢管数为28~33根(陈洁等, 2015)。我们又继续探究了异色瓢虫卵巢管的数量,研究发现多巴脱羧酶被抑制表达后卵巢管的数量降低,但与对照组无显著差异(图5)。因此,我们推断多巴脱羧酶与异色瓢虫卵巢管的发育进程无关,推测其可能参与了异色瓢虫生殖过程的其他方面。综上分析所述,多巴脱羧酶与异色瓢虫卵巢发育无直接关系。
多巴脱羧酶产物多巴胺不仅影响昆虫生殖系统形态发生, 也影响昆虫的交配行为。Neckameyer(1998)发现雄性果蝇体内多巴胺含量降低所引起的同性求偶、交配紊乱。但本研究中,我们观察发现异色瓢虫多巴脱羧酶被抑制表达后,雌虫和雄虫之间可以正常交配。在黑须伊蚊Aedesatropalpus、双斑蟋蟀Gryllusbimaculatus和黑腹果蝇D.melanogaster等昆虫中研究发现多巴脱羧酶的产物多巴胺也能通过调控保幼激素作用于脂肪体,进而调节卵黄原蛋白的合成最终影响卵母细胞的发育(孙建新和谭璟宪, 1990; Woodring and Hoffmann, 1994; Gruntenko and Rauschenbach, 2008)。我们在异色瓢虫产卵初期及产卵高峰期对其卵巢组织进行解剖,结果表明HaDDC基因被抑制表达后,卵巢组织中发育的卵母细胞个数及成熟的卵粒数均明显少于对照组(图6: B, D)。因此,我们推断多巴脱羧酶可以调控异色瓢虫卵母细胞到成熟卵粒的发育过程,进而参与对生殖力的调控。此外,有研究表明多巴脱羧酶参与卵壳表皮和绒毛膜硬化和变暗(Schlaeger and Fuchs, 1974)。本研究中,我们发现多巴脱羧酶被抑制表达后,子代卵的孵化率显著降低,我们推断可能是由于多巴脱羧酶被抑制表达后,影响卵壳的硬化过程,导致卵失水进而影响孵化。
综上,本研究对异色瓢虫多巴脱羧酶调控生殖力的机制进行解析,利用RNAi技术结合组织解剖证明多巴脱羧酶参与异色瓢虫卵母细胞到成熟卵粒的发育过程,进而调控生殖力。本研究结果为利用RNAi机制为核心的害虫防控技术提供备选基因。然而,对于多巴脱羧酶对异色瓢虫卵母细胞发育的分子调控机制还有待进一步研究。
