GeneXpert MTB/RIF Ultra检测手术组织对结核病的诊断价值
2022-02-15雷静邬霞谈小文李爱芳崔晓利康磊庞健健任斐吴守振杨翰
雷静 邬霞 谈小文 李爱芳 崔晓利 康磊 庞健健 任斐 吴守振 杨翰
结核分枝杆菌检测阳性(包括细菌学和分子生物学)是结核病诊断的重要依据[1]。随着分子生物学技术的飞速发展,用于结核病病原学检测的分子生物学技术也日益增多,而新一代的GeneXpert MTB/RIF Ultra(简称“Xpert Ultra”)在结核病的诊断中表现出更高的敏感度,明显优于GeneXpert MTB/RIF(简称“Xpert”)检测[2-3]。但Xpert Ultra技术检测手术标本(组织和脓液)的研究还鲜有报道。鉴于此,笔者应用Xpert Ultra检测疑似结核病患者组织及脓液标本,并与其他常用方法检测结果进行对比,同时分析其检测同一病灶不同标本的病原学阳性检出率,以评价Xpert Ultra检测手术标本对结核病的诊断价值。
材料和方法
一、研究材料
采用前瞻性研究的方法,采集2021年1—9月西安市胸科医院297例疑似结核病患者同一病灶手术组织和(或)脓液标本,获取组织标本227份,脓液标本106份,剔除不能满足组织和脓液标本检测量的标本后获得合格的手术组织标本49份,脓液标本36份。其中,来自于肺组织及其病灶旁脓液标本34份和21份,淋巴组织及其病灶旁脓液标本15份和11份,余4份脓液标本为单一标本。研究对象中,男性28例,女性21例;对术前32例有临床症状、体征等可疑结核病患者行规范抗结核药物治疗1个月,另17例疑似结核病患者视病情发展均在1周内择机手术。本研究已通过西安市胸科医院伦理委员会审批(S2021-0013)。
二、研究方法
分别对上述纳入的组织标本和脓液标本行Xpert Ultra、Xpert、BACTEC MGIT 960液体培养(简称“MGIT 960培养”)、DNA实时荧光定量核酸扩增检测(FQ-PCR)、结核分枝杆菌RNA实时荧光恒温扩增(SAT-RNA)、DNA实时荧光恒温扩增(恒温扩增法)。
1.仪器与试剂:全自动医用PCR分析系统GeneXpert DxSystem、Xpert Ultra检测试剂盒和Xpert检测试剂盒(美国赛沛公司),ABI 7500荧光定量PCR仪(美国应用生物系统公司),MGIT 960液体培养试剂盒及全自动分枝杆菌检测系统(美国BD公司),Deaou-308C恒温荧光PCR快速检测系统和结核分枝杆菌复合群恒温扩增核酸检测试剂盒(广州迪澳生物科技有限公司),细胞超声破碎仪FZP-1和RNA恒温扩增-TB-SAT结核分枝杆菌核酸检测试剂盒(上海仁度生物科技有限公司),PCR-荧光探针法-分枝杆菌核酸检测试剂盒(北京博奥晶典生物科技有限公司)。
2.Xpert Ultra和Xpert检测:组织标本使用玻璃珠进行匀浆处理,生理盐水重悬。脓液标本加入生理盐水重悬后,使用细胞超声破碎仪40 Hz 15 min。分别静置上述处理后标本5 min,吸取上清液1.5 ml加入试剂盒上机测试。仪器自动判读阳性[高、中、低、极低、trace(Xpert Ultra)]和阴性结果。若出现检测失败则重新检测。
3.FQ-PCR法:分别将制备好的组织匀浆标本、脓液标本与4% NaOH溶液以1∶1~1∶2 混合液化,取1 ml液化后标本加入1.5 ml离心管中,15 000×g离心6 min,弃上清,加入1 ml生理盐水涡旋振荡后,15 000×g离心6 min,弃上清,向沉淀中加入50 μl核酸提取液并转入带磁珠的核酸提取管中,振荡仪快速振荡10 min,95 ℃金属浴加热5 min。15 000×g离心2 min,上清即为核酸标本。取2 μl提取好的核酸溶液加入18 μl PCR扩增试剂微量反应管中,上机检测。扩增程序:37 ℃ 300 s,1个循环;94 ℃ 180 s,1个循环;94 ℃ 15 s,40个循环;60 ℃ 30 s,40个循环;50 ℃ 10 s,1个循环;荧光采集点选择60 ℃ 30 s。结果判读:循环阈值(Ct值;样本曲线与阈值线交点的横坐标读数)<40为阳性,Ct值≥40或无数值为阴性,若出现检测失败则重新检测。
4.SAT-RNA法:分别将制备好的组织匀浆标本、脓液标本与4% NaOH溶液以1∶1~1∶2混合液化,取1 ml经液化后标本加入1.5 ml离心管中,15 000×g离心6 min,弃上清,加入1 ml生理盐水涡旋振荡后,15 000×g离心6 min,弃上清,加入50 μl稀释液,旋涡振荡混匀,置于超声破碎仪中40 Hz 15 min,15 000×g离心2 min。吸取2 μl提取后RNA加入30 μl扩增试剂微量反应管中,放置于恒温干浴器内,60 ℃ 10 min,42 ℃ 5 min,加入 SAT酶,上机检测。扩增程序:42 ℃ 1 min,40个循环,每分钟采集1次荧光。结果判读:根据分析后图像调整基线和阈值线,Ct值<40为阳性,Ct值≥40或无数值为阴性,若检测失败需重新检测。
5.MGIT 960培养:分别吸取制备好的组织匀浆、脓液标本各2 ml与4% NaOH溶液以1∶1~1∶2 混合(混合后NaOH终浓度为3%~4%),加入50 ml无菌离心管中漩涡振荡混匀,室温静置15 min,加入0.1 mol/L磷酸盐缓冲溶液(PBS)至45 ml,3000×g离心20 min,弃上清,加入1 ml PBS溶液后混匀,室温静置10 min后,吸取0.5 ml至 MGIT 960培养管中,置于MGIT 960培养箱中培养42 d。结果判读:MGIT 960系统报阳后,抗酸染色及分枝杆菌菌种鉴定(基因芯片法)为结核分枝杆菌者为阳性,反之为阴性。
6.恒温扩增法:分别将制备好的组织匀浆标本、脓液标本与4% NaOH溶液以1∶1~1∶2混合液化,用一次性吸管吸取200 μl液化后的标本加入到样品管中,混匀。100 ℃恒温处理10 min,取出样品管,冷却至室温。取下吸附管管帽,将样品管顺时针旋入吸附管,充分混匀液化液和吸附剂,平放静置1 min。挤压吸附管将液滴挤入离心管中备用。将模板DNA加入到恒温扩增核酸检测试剂盒中对应反应管中,瞬时(5 s)离心混匀以上试剂,上机扩增。仪器自动判读阳性或阴性结果。若检测失败则重新检测。
7.样本阳性结果判读:每种方法均分别检测1或 2种标本,将任一标本检测阳性结果判定为阳性。
三、统计学处理
采用SPSS 18.0软件进行数据的统计分析,并绘制ROC曲线。计数资料采用“例(率,%)”描述,两组间差异的比较采用χ2检验或Fisher精确概率法,检验水准为α=0.05。以临床诊断为参考标准,分析6种技术检测结核病的敏感度、特异度、阳性预测值、阴性预测值、符合率、Kappa值、受试者工作特征曲线(ROC曲线)下面积。本研究考虑组织标本较脓液标本普遍易得,且合格标本也较多,故仅对组织标本的检测效能进行分析。其中,Kappa值在0.00~0.20为极低一致性、0.21~0.40为一般一致性、0.41~0.60为中等一致性、0.61~0.80为高度一致性、0.81~1.00为几乎完全一致。同时评价不同方法检测确诊结核病患者同一病灶不同类型标本(组织及脓液样本)阳性率的差异。
结 果
一、临床诊断及检测阳性率
49例研究对象中,病原学诊断结核病32例,包括肺结核21例,淋巴结结核11例;其他疾病17例,包括肺恶性肿瘤12例,淋巴结增大2例,胸膜炎2例,胸腔积液1例。Xpert Ultra在疑似结核病组织标本检测中总阳性率为49.0%(24/49),对确诊结核病的组织标本检测阳性率为75.0%(24/32),对确诊结核病脓液标本检测中阳性率为71.4%(20/28)。
二、不同方法对组织标本的检测效能
考虑组织标本阳性率高于脓液标本,且组织标本普遍易得,合格标本也较多,故仅对组织标本的检测效能进行分析。
以临床诊断结果为参考标准,6种方法对组织标本的检测效能见表1。Xpert Ultra检测的敏感度(75.0%)明显高于Xpert、FQ-PCR、SAT-RNA、恒温扩增法及MGIT 960培养,差异均有统计学意义(χ2=32.919,P<0.001;χ2=21.866,P<0.001;χ2=5.418,P=0.020;χ2=15.228,P<0.001;χ2=11.574,P=0.001)。一致性分析显示:Xpert Ultra与临床确诊高度一致,Xpert和FQ-PCR为中等一致,MGIT 960培养为一般一致,SAT-RNA和恒温扩增法为极低一致。Xpert Ultra的ROC曲线下面积最大(0.875),诊断效能最高,其后依次为Xpert(0.828)、FQ-PCR(0.766)、MGIT 960培养(0.688)、SAT-RNA(0.625)、恒温扩增法(0.531),见图1。
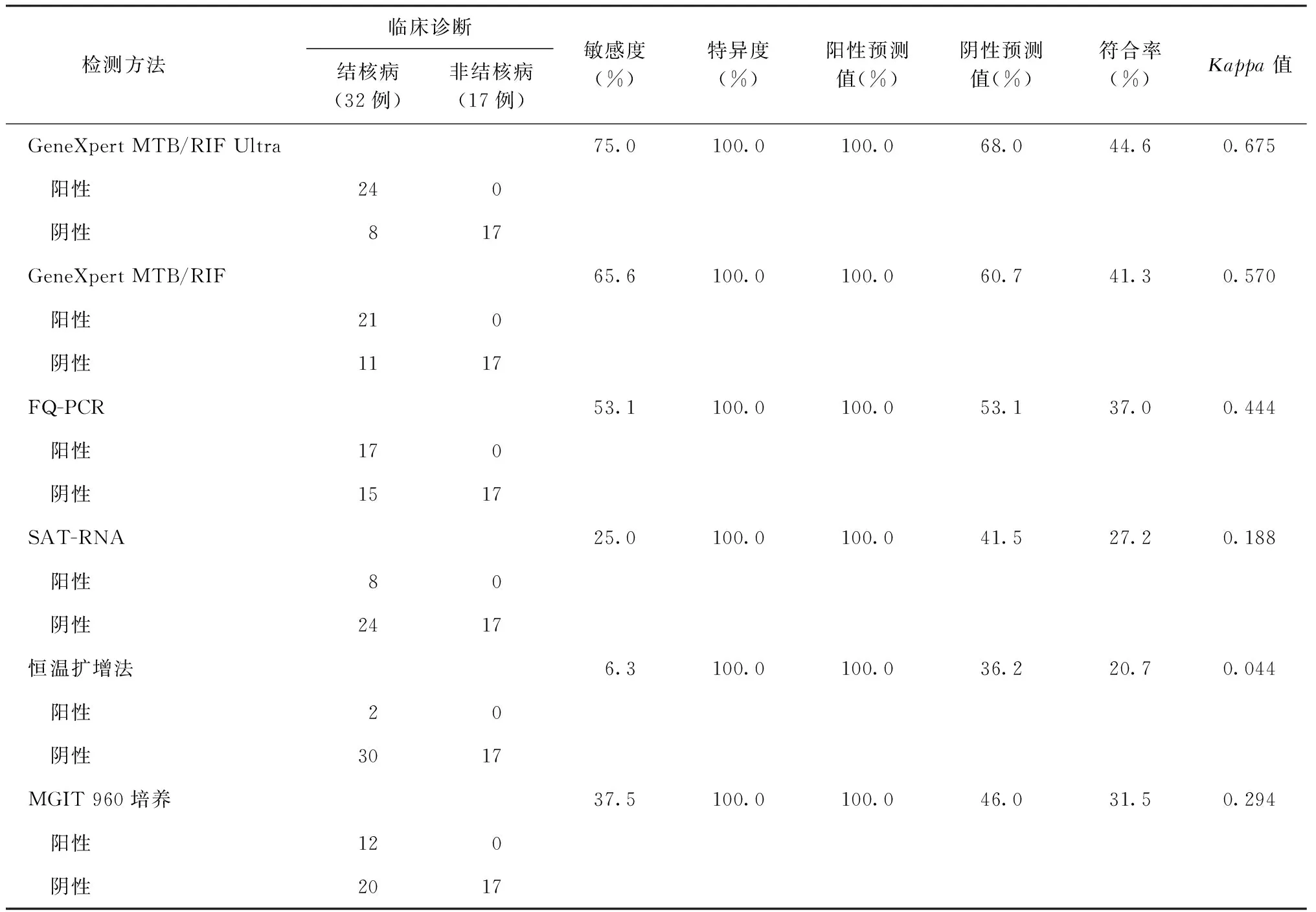
表1 6种检测方法以临床确诊结果为参照对结核病的的检测效能
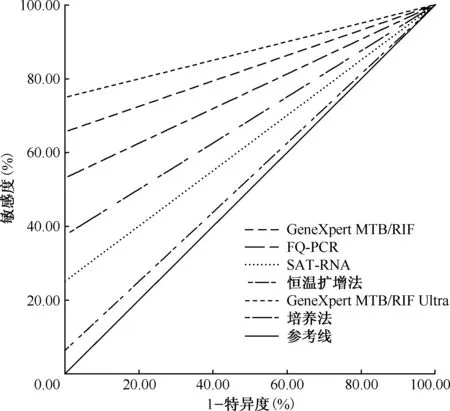
注 培养法:BACTEC MGIT 960液体培养,FQ-PCR:DNA实时荧光定量核酸扩增检测,SAT-RNA:结核分枝杆菌RNA实时荧光恒温扩增,恒温扩增法:DNA实时荧光恒温扩增图1 6种检测方法以临床诊断结果为参照诊断结核病的ROC曲线
三、不同方法对结核病患者组织和脓液标本的检测情况
对28份确诊结核病患者同一病灶的组织与脓液标本检测结果进行比较,发现同一种检测方法对同一病灶的组织与脓液标本检测阳性率的差异均无统计学意义,见表2。
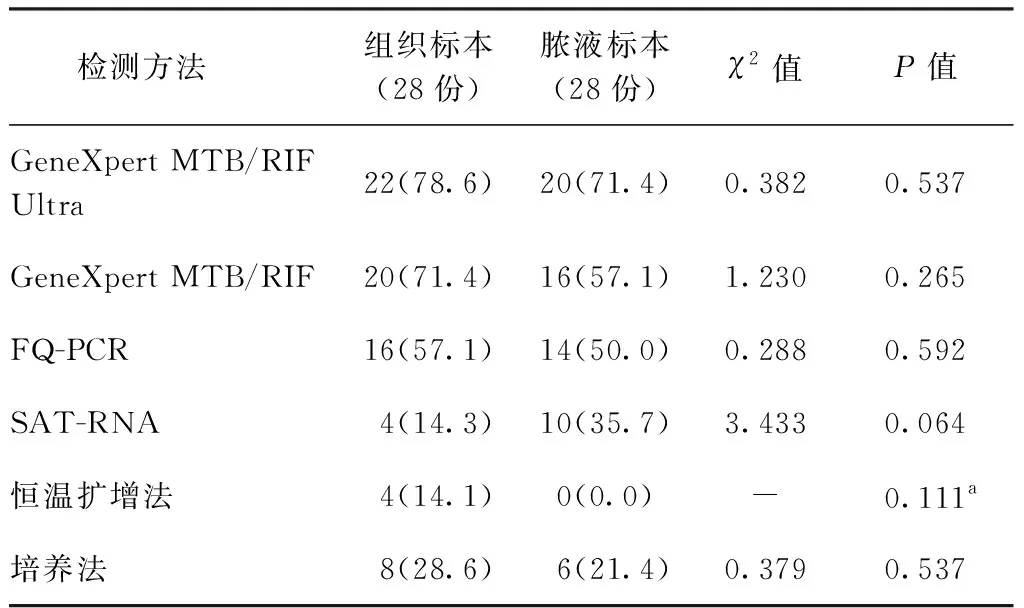
表2 6种检测方法对28例结核病患者同一病灶脓液与组织标本检测阳性率比较 [份(阳性率,%)]
讨 论
随着分子生物学检测技术的飞速发展,Xpert、FQ-PCR、SAT-RNA等常用分子生物学检测方法已被广泛应用于临床检验。Xpert检测系统因其操作方便快捷、敏感度高、报告时间短而受到青睐[4];而FQ-PCR法采用结核分枝杆菌的保守序列设计探针,但因提取临床标本中模板DNA的过程多为人工操作,受影响因素较多,可能降低了FQ-PCR对结核分枝杆菌核酸的检测效率。SAT-RNA法是以结核分枝杆菌RNA为模板,受RNA易降解的特性使其敏感度极大降低。而Xpert Ultra是在原有Xpert系统上进行了优化,检测原理由半定量半巢式循环阈值的比较变为半定量巢式PCR,并采用了高分辨率熔解曲线技术,弥补了Xpert对菌量较少样本检测敏感度较低的缺点,使该试剂盒的PCR扩增体系由原来的25 μl提升至50 μl,对结核分枝杆菌的检出下限由原来的112.6 CFU/ml下降为15.6 CFU/ml,敏感度提高了7倍,并在检测单个ropB目的基因的基础上增加2个多拷贝序列,即IS6110和IS1081[3, 5-7]。目前,Xpert Ultra方法已经在痰液、脑脊液、胃液等标本的检测中表现出了较高的敏感度,但由于手术样本取材困难,且无法重复获得,Xpert Ultra方法检测这些标本的研究还欠缺。
本研究显示,以临床诊断结果为标准,Xpert Ultra检测的一致性最高,且敏感度明显高于Xpert等其他5种检测方法,与2020年Cresswell等[8]采用前瞻性队列研究检测51例结核性脑膜炎患者脑脊液标本的结果一致。另有研究发现,Xpert Ultra检测痰液、支气管肺泡灌洗液、胃液等标本在诊断成人肺结核、儿童肺结核的敏感度也均高于Xpert[9-10],检测儿童胃液与临床诊断儿童肺结核有较高的一致性[11]。
本研究发现,Xpert Ultra、Xpert和FQ-PCR检测的敏感度均高于SAT-RNA和培养法,认为是前3种检测手段的靶基因均为DNA,可以检测到样本中的死菌和活菌,增加了检测敏感度;而SAT-RNA、培养法只能检测到样本中的活菌,并且,为降低因手术可能导致的感染播散风险,本研究纳入的32例临床诊断结核病患者均于术前进行了1个月的规范抗结核药物治疗,可能导致术后样本活菌载量的减少,降低这两种方法的检测敏感度。同时,恒温扩增法检测的敏感度也较低,可能与其试剂盒虽适用于DNA检测,但其配置的核酸提取装置主要针对痰液标本设计,并不适用于组织和脓液样本的检测有关。
本研究进一步了解了各种方法对同一病灶的组织标本及脓液标本检出阳性率的差异,结果发现,同一检测方法对组织及脓液两种标本检出阳性率的差异均无统计学意义,提示无需采用同一方法检测同一病灶不同标本,但考虑脓液标本检测的有效性,建议优先选取组织标本。但这一结果与本研究团队之前的研究结论“Xpert及培养法检测组织标本阳性率优于脓液标本”[12]不符,可能与本次研究对标本前处理的改进有关。本研究对组织标本的前处理使用了玻璃珠对预先处理好的小块组织进行研磨,研磨效果好、成本低。而传统研磨方法,如普通玻璃研磨器为一次性使用,虽避免了污染,但成本过高,重复使用又容易造成核酸污染;而高速研磨器,又因转速过高而产生大量气溶胶,易造成生物危害及环境污染。另外,本研究对脓液标本使用了细胞超声破碎仪。该破碎仪可将黏稠的脓液标本分散完全,同时可将白细胞吞噬的结核分枝杆菌充分释放,使得上清液中的核酸量大幅提高,最大程度地提高试剂的使用效率和检测阳性率;而未经超声破碎的脓液标本,在进行Xpert Ultra和Xpert检测吸取上清液时,由于大量游离的及白细胞吞噬的结核分枝杆菌沉积于底部,上清液检测容易造成实验的假阴性,底部沉淀的检测又容易造成试剂盒堵塞,导致检测失败及成本增加。
综上所述,Xpert Ultra在检测术后组织及脓液标本的优势明显,具有较高的结核病快速诊断价值,优化样本前处理方式可进一步提高其检测阳性率,且无需采用同一方法检测同一病灶不同标本类型;但考虑采样的可及性和合格率,应优先选择组织标本。本研究也存在一定不足,因手术组织和脓液标本采集的特殊性,获取的合格样本有限,可能造成结果的偏倚。
